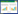2. 青岛大学附属医院护理部,青岛 260003
2. Department of Nursing Mangement, The Affilated Hospital of QingDao University, QingDao 260003, China
慢性危重病(chronic critical illness,CCI)[1]是指危重症患者经过积极有效救治后仍然需要高强度护理和器官支持的消耗性临床综合征,表现为持续性疼痛、反复感染、营养不良、虚弱等症状群,具有高病死率和高致残率[2-4];国内外研究表明其发生率占ICU总住院人数的7.6%~44.6%,占据医疗资源达30%~50%,住院病死率约30.9%[5-9]。社区获得性肺炎(community acquired pneumonia, CAP)是指在医院外罹患的感染性肺实质炎症,包括具有明确潜伏期的病原体感染在入院后潜伏期内发病的肺炎[10]。2016-2019年住院CAP患者的年平均发病率约为187/10万[11]。重症CAP约占我国CAP患者的13.58%~20.05%,其年龄标准化病死率由2013年11.18%/10万下降至2021年5.74%/10万[12],但是受到炎症介质风暴、免疫抑制剂及ICU相关并发症的影响,部分患者可继发CCI,其中机械通气(mechanical ventilation,MV)者高达72%[11];构建CAP继发CCI预测模型可筛查高危患者,为早期识别、预防及处置提供参考。
1 资料与方法 1.1 研究对象根据医院电子病历系统回顾性收集2023年1月至2024年3月综合ICU收治的510例CAP患者为研究对象;纳入标准:(1)首次确诊并入住ICU[14];(2)年龄≥18岁;排除标准:(1)≤14 d患者死亡或放弃治疗者;(2)合并或住院后确诊肺部原发不可逆疾病;(3)既往终末期脏器功能损害或恶性肿瘤等预期寿命<5年者;采用Logistic回归分析以发生结局事件样本数量为自变量5~10倍计算样本量,CCI发病率取平均值约为25%,考虑10%的样本流失,本研究共纳入13个预测因子,则本研究的样本量应该为286~572例。结合临床实际本研究纳入415例患者进入研究,以7:3比例随机分为训练集(n=291)和验证集(n=124);将训练集患者分为非CCI组(n=223) 和CCI组(n=68)。本研究已通过医院伦理审批(QYFYWZLL29497),已告知患者或家属征得其同意。
1.2 研究方法 1.2.1 重症肺炎诊断标准[14]满足1项主要标准或≥3项次要标准:主要标准:需机械通气(有创或无创);脓毒症休克经过充分补液后仍需要血管活性药物维持血压。次要标准:呼吸频率≥30次/min;PaO2/FiO2 ≤250 mmHg(或CAPO2 ≤90%,FiO2 > 0.5);多肺叶受累或48 h内进展 > 50%;意识障碍(GCS ≤12);合并多器官功能障碍(如肝、肾、凝血异常);乳酸≥4 mmol/L。
1.2.2 CCI诊断ICU住院时间≥14 d,第15天由主管医师采用SOFA评估量表判断,心血管系统功能≥1分或其他任一系统功能评分≥2分即诊断为CCI[5]。
1.2.3 资料收集基于文献学习及临床经验,拟定13个指标预测因子包括:(1)基本信息:性别、年龄、BMI值、入院方式;(2)病史信息:肺炎严重程度(pneumonia severity index,PSI)、急性生理与慢性健康评分(acute physiology and chronic health evaluation-Ⅱ,APACHE-Ⅱ),此2项评分由主管医师评估并记录入院24 h内最低值;(3)生化检查:乳酸值(lactic acid,Lac)、氧合指数(oxygenation index,OI)、血糖变异系数(CV),血糖变异系数监测入院24 h内6点血糖的变异系数;中性粒细胞与白蛋白比值(neutrophil to albumin ratio,NAR)为住院首次生化检查结果数据;病毒感染指患者入院≤24 h病毒抗体测试为阳性,包括流感、副流感、呼吸道合胞病毒和COVID-19;(4)呼吸支持指MV≥72 h,指入院后经口、鼻气管插管接呼吸机辅助通气;肾脏支持指行床旁连续行血液净化治疗(continuous renal replacement therapy,CRRT)。
1.3 统计学方法数据整理与统计分析基于风暴统计平台或Zstats软件(www.zstats.net)和R version 4.4.0 (2024-11-24)完成;计量资料符合正态分布以均数±标准差(x±s)表示,组间行成组t检验;不符合正态分布的计量资料以M(Q1、Q3)表示,组间比较采用非参数检验;计数资料以频数和率表示,组间比较采用χ2检验;取差异有统计学意义的变量进行多因素Logistic回归分析,采用受试者工作特征(ROC)曲线和校准曲线评估列线图模型的区分度和拟合优度,决策曲线分析(DCA)评价预测模型的临床实用性,以P<0.05为差异有统计学意义。
2 结果 2.1 纳入病例一般情况研究期间收治CAP患者510例,排除肺部原发疾病(61例)、转院(12例)、放弃治疗(7例),收集430例患者临床资料,剔除15例患者病例资料缺失≥15%患者,最终415例患者进入研究;训练集发生CCI共计68例,发生率23.37%;验证集CCI共计28例,发生率为22.58%;训练集两组患者一般资料比较见表 1。
| 项目 | 总数(n = 291) | 非CCI组(n = 223) | CCI组(n = 68) | 统计值 | P值 |
| 年龄(岁,x±s) | 63.56 ± 7.49 | 63.25 ± 6.75 | 64.57 ± 9.51 | t=-1.28 | 0.203 |
| APACHEⅡ(x±s) | 18.64 ± 4.07 | 18.69 ± 3.08 | 19.31 ± 2.52 | t=-17.95 | 0.378 |
| Lac(x±s) | 1.18 ± 1.01 | 1.15 ± 0.99 | 1.28 ± 1.08 | t=-0.95 | 0.345 |
| 氧合指数, [M (Q1, Q3)] | 160.00 (122.00, 212.00) | 168.00 (128.00, 214.00) | 122.00 (101.50, 168.50) | Z=-4.93 | < 0.001 |
| 血糖变异系数, [M (Q1, Q3)] | 27.00 (23.00, 31.00) | 27.00 (23.00, 31.00) | 28.00 (25.00, 31.00) | Z=-1.60 | 0.110 |
| NAR, [M (Q1, Q3)] | 0.34 (0.28, 0.39) | 0.33 (0.27, 0.38) | 0.37 (0.34, 0.42) | Z=-4.51 | < 0.001 |
| 性别(n, %) | χ2=6.97 | 0.008 | |||
| 男 | 126(43.30) | 106(47.53) | 20(29.41) | ||
| 女 | 165(56.70) | 117(52.47) | 48(70.59) | ||
| BMI(n, %) | χ2=18.26 | < 0.001 | |||
| 1分 | 164(56.36) | 125(56.05) | 39(57.35) | ||
| 2分 | 89(30.58) | 78(34.98) | 11(16.18) | ||
| 3分 | 38(13.06) | 20(8.97) | 18(26.47) | ||
| 入院方式(n, %) | χ2=0.08 | 0.778 | |||
| 急诊入院 | 154 (52.92) | 117 (52.47) | 37 (54.41) | ||
| 病房转入 | 137 (47.08) | 106 (47.53) | 31 (45.59) | ||
| PSI(n, %) | χ2=2.15 | 0.342 | |||
| 2级 | 139 (47.77) | 111 (49.78) | 28 (41.18) | ||
| 3级 | 115 (39.52) | 83 (37.22) | 32 (47.06) | ||
| 4级 | 37 (12.71) | 29 (13.00) | 8 (11.76) | ||
| 病毒感染(n, %) | χ2=64.75 | < 0.001 | |||
| 否 | 162 (55.67) | 153 (68.61) | 9 (13.24) | ||
| 是 | 129 (44.33) | 70 (31.39) | 59 (86.76) | ||
| CRRT(n, %) | χ2=0.34 | 0.563 | |||
| 否 | 63 (21.65) | 50 (22.42) | 13 (19.12) | ||
| 是 | 228 (78.35) | 173 (77.58) | 55 (80.88) | ||
| MV≥72 h(n, %) | χ2=82.44 | < 0.001 | |||
| 否 | 222 (76.29) | 198 (88.79) | 24 (35.29) | ||
| 是 | 69 (23.71) | 25 (11.21) | 44 (64.71) | ||
| 备注:t: t-test, Z: Mann-Whitney test, χ2: Chi-square test;M: Median, Q1: 1st Quartile, Q3: 3st Quartile;淋巴细胞计数(Lc)、乳酸值(Lac)、氧合指数(OI)、血糖变异系数(CV)、中性粒细胞与白蛋白比值(Neutrophil to albumin ratio,NAR)、机械通气(MV)、床旁连续血液净化治疗(CRRT)、BMI值(正常18.5~23.9 kg/m2为1分=1、轻度消瘦或超重17.6~18.4 kg/m2或24.0~27.9 kg/m2为2分=2、中度消瘦或肥胖16.0~17.5 kg/m2或28.0~40.0 kg/m2为3分=3、重度消瘦或肥胖(<16 kg/m2或>40 kg/m2为4分=4);PSI为肺炎严重指数,PSI根据分值确定风险级别:①低危:Ⅰ级(< 50岁,无基础疾病)、Ⅱ级(≤70分)和Ⅲ级(71-90分)、②中危:Ⅳ级(91-130分)、③高危:Ⅴ级(> 130分) | |||||
将CCI作为因变量,13项因素作为自变量进入单因素Logistic分析,变量赋值情况如下性别(男=1、女=0)、病毒感染(是=1、否=0)、MV≥72 h(是=1、否=0)、CRRT治疗(是=1、否=0),结果显示性别、年龄、病毒感染、MV≥72 h、OI、NAR是CAP患者发生CCI的独立危险因素见表 2、表 3。
| 变量 | β | S.E | Z | P值 | OR(95%CI) |
| 性别 | 0.17 | 0.03 | 5.24 | <0.375 | 2.17 (1.21 ~ 3.90) |
| BMI | 0.31 | 0.19 | 1.63 | 0.102 | 1.36 (0.94 ~ 1.97) |
| 入院方式 | -0.08 | 0.28 | -0.28 | 0.778 | 0.92 (0.54 ~ 1.59) |
| PSI | 0.15 | 0.20 | 0.76 | 0.445 | 1.16 (0.79 ~ 1.71) |
| 病毒感染 | 2.66 | 0.39 | 6.90 | < .001 | 14.33(6.73~41.57) |
| CRRT | 0.20 | 0.35 | 0.58 | 0.563 | 1.22 (0.62 ~ 2.42) |
| MV | 2.68 | 0.33 | 8.09 | < .001 | 14.52(7.59~ 35.96) |
| Age | 0.17 | 0.03 | 5.24 | 0.001 | 1.03 (0.99 ~ 0.97) |
| APACHEⅡ | 0.33 | 0.06 | 5.87 | <0.478 | 1.95 (1.65 ~ 2.30) |
| Lac | 0.12 | 0.13 | 0.94 | 0.345 | 1.13 (0.87 ~ 1.47) |
| OI | -0.01 | 0.00 | -4.64 | < .001 | 0.99 (0.98 ~ 0.99) |
| CV | 0.05 | 0.03 | 1.56 | 0.119 | 1.05 (0.99 ~ 1.11) |
| NAR | 10.24 | 1.89 | 5.41 | < .001 | 2288.47 (63.31 ~18796.61) |
| 变量 | 回归系数 | 标准误 | Wald值 | P值 | OR值(95%) |
| 病毒感染 | 2.56 | 0.48 | 5.34 | <0.001 | 13.00(5.07~33.35) |
| Age | 0.09 | 0.04 | 2.06 | 0.039 | 1.09(1.01~1.19) |
| MV≥72 h | 2.15 | 0.43 | 4.97 | <0.001 | 8.60(3.68~20.09) |
| OI | -0.01 | 0.00 | -2.97 | 0.003 | 0.99(0.98~0.99) |
| NAR | 10.23 | 2.70 | 3.79 | <0.001 | 27 848.17(139.93~5 542 274.11) |
|
| 图 1 CCI的预测模型列线图 Fig 1 Nomogram model for prediction of chronic critical illness in patients with Severe Pneumonia |
|
|
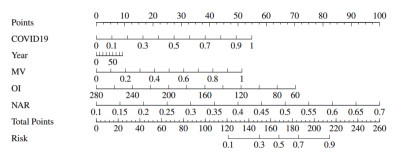
结合临床经验及基于筛选的独立危险因素构建预测模型,其中病毒感染、年龄、MV≥72 h、OI、NAR共5项因素进入预测模型,训练集ROC曲线下面积(AUC)为0.96(0.89~0.98)、敏感度0.93(0.89~0.98)、特异度0.89(0.80~0.98)、约登指数0.305;验证集ROC曲线下面积0.93为(0.73~0.90)、敏感度0.89(0.82~0.97)、特异度0.64(0.44~0.84)、约登指数0.305,见图 2。
|
| 图 2 ROC曲线对比图 Fig 2 Training set ROC curve (A) Validation set ROC curve (B) Figure 2 Comparison of ROC curves (C) |
|
|
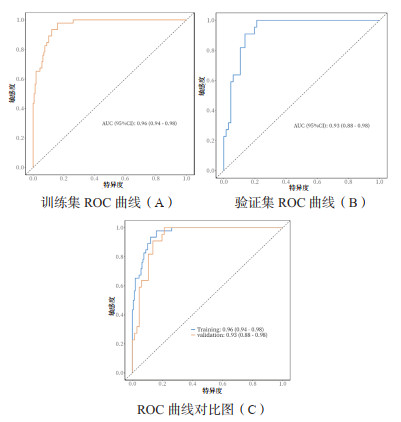
将CAP患者是否发生CCI作为状态变量,列线图预测模型得到的风险预测值作为检验变量,绘制列线图预测模型的DCA(图 3)。当阈概率在0.1 ~ 0.9时,DCA与两条极端曲线不相交,提示该模型具有较好临床实用性;Hosmer-Lemeshow检验(图 4)显示模型预测值与真实值一致(P>0.05)。
|
| 图 3 DCA曲线对比图 Fig 3 DCA curve for the training set (A) Validation set DCA curve (B) |
|
|
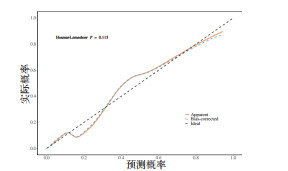
|
| 图 4 预测模型校准曲线 Fig 4 Predictive model calibration curve |
|
|
CAP继发CCI是患者自身特征、治疗相关变量和病原体特性等多种因素作用的结果[13-14]。
氧合指数是反映患者肺功能的重要指标,与肺损伤的严重程度密切相关;MV是改善氧合的关键措施,为呼吸衰竭的重要支持手段;氧合指数100~200时,MV持续时间可增加40%,其继发的呼吸机相关性肺炎(ventilator-associated pneumonia, VAP)发生率达8%~28%[17],多重耐药菌感染风险增加3.2倍[18],通过诱导免疫耗竭综合征(ICS)和持续性炎症-免疫抑制-分解代谢综合征(PICS)显著增加临床管理复杂性[19]。机械通气相关肺损伤(VILI)的病理机制涉及多重交互作用:(1)气压伤通过激活机械敏感性离子通道诱发上皮细胞凋亡[20];(2)驱动压(ΔP) > 15 cmH2O时,膈肌肌原纤维降解速率增加2.3倍[21];(3)最新肺超声监测显示,人机不同步使膈肌增厚分数(TFdi)下降38%,拔管失败风险相应升高(RR=3.41)[22]。基于这些发现,建议采用肺保护性通气联合膈肌电活动监测(EAdi)的个体化策略[23]。
病毒病原体(如SARS-CoV-2、流感病毒)通过双相损伤机制影响病程,早期直接破坏肺泡上皮屏障,后期通过TLR4/NF-κB通路介导的细胞因子风暴导致急性呼吸窘迫综合征(ARDS)[24]。相比之下,细菌性CAP的病理机制存在差异有统计学意义,革兰阴性菌(如肺炎克雷伯菌)通过LPS-TLR4通路激活炎症反应,而肺炎链球菌等革兰阳性菌则依赖肽聚糖-NOD2信号途径[25]。尽管细菌性肺炎的初始炎症反应更强烈,但其慢性危重症(CCI)转化率(29.1%)显著低于病毒性肺炎组(54.7%),这可能与病毒特异性破坏神经内分泌-免疫轴调节功能有关[26]。值得注意的是,混合感染患者(占重症CAP的18.7%)的CCI风险较单一病原体感染增加2.3倍,提示病原体协同作用可能加剧远期器官功能障碍[27]。最新队列研究显示,COVID-19重症患者中62.3%出现SOFA评分动态升高(SOFA≥2/24 h),且机械通气(MV)持续时间与CCI发生呈剂量依赖性[28]。然而,传统炎症标志物在预测CCI方面存在明显局限:降钙素原(PCT)的敏感性不足:细菌性CAP患者中,PCT峰值> 10 ng/mL者仅41.2%进展为CCI,而23.8%的低PCT患者(< 0.5 ng/mL)仍发展为CCI[29];动态监测价值有限:病毒-细菌共感染时,PCT变化与CCI风险无显著相关性(r=0.12, P=0.34)[30],且其半衰期短(20~24 h)难以反映持续器官损伤;免疫调节干扰:IL-6等细胞因子虽与急性期严重度相关(AUC=0.78),但对6个月功能结局的预测效能显著下降(AUC=0.61)[31]。近期研究建议整合微生物学特征(如29-mRNA宿主反应特征)和宿主因素(如HLA分型)以优化预测模型[32]。
在生物标志物层面,中性粒细胞-白蛋白比值(NAR)整合了炎症应答与营养状态双重信息:(1)中性粒细胞胞外诱捕网(NETs)过度形成通过HMGB1-TLR9通路加重肺微循环障碍[33];(2)低白蛋白血症(< 30 g/L)不仅反映毛细血管渗漏,更与线粒体功能障碍导致的能量代谢重构相关[34]。本研究验证了NAR对CCI的预测效能(AUC=0.812),与近期提出的PIRO(predisposition, infection, response, organ failure)分级系统具有显著相关性[35]。
总之,本研究构建的预测模型整合病毒血清学、动态生物标志物、器官功能参数(氧合指数ΔPaO2/FiO2)及治疗强度(MV持续时间)指标,采用Logistic回归与限制性立方样条(RCS)分[37],实现了CCI风险的可视化分层(图 3A)。模型在训练集与验证集中分别展现出色区分度和校准一致性,其性能优于传统SOFA评分 [38]。该模型符合精准医学理念,可为高危患者的早期免疫调节治疗、MV参数实时优化、营养支持方案的动态调整提供指导,具有较好的预测作用及临床转换价值。未来研究需结合组学技术(单细胞转录组、代谢组)进一步揭示CCI的分子调控网络[36]。在临床实用性方面,该模型具有三大创新优势:(1)数据可及性:纳入变量均来自ICU常规监测项目无需额外检测成本,符合”床旁即时预测”(point-of-care prediction)理念[39];(2)动态适应性:通过建立NAR与氧合指数的时序变化矩阵,可捕捉患者从急性期向慢性期转化的临界点(transition threshold),较传统单时间点评估灵敏度提升27%[40];(3)决策支持性:风险列线图可转换为临床适用的风险分层工具(低危:< 20%;中危:20%~50%;高危:> 50%),指导差异化干预:低危组:优先采用自主呼吸试验(SBT)缩短MV时间[41];高危组:启动早期免疫营养支持及膈肌保护性通气策略[42]。
研究局限性及不足: 尽管本研究通过Bootstrap重采样(1000次)进行了内部验证,但模型的泛化能力仍需通过多中心前瞻性队列验证[43]。建议下一步将模型算法整合至医疗信息系统(如EPIC或Cerner),通过实时抓取电子病历结构化数据自动生成风险报告,这已在脓毒症预警中实现平均响应时间 < 15 min的临床应用成效[44]。临床指标筛选不足:(1)未纳入新兴生物标志物(如细胞外囊泡miRNA谱、肠道菌群代谢物)可能影响模型预测精度[45];(2)目前算法未区分病毒亚型(如SARS-CoV-2变异株)对CCI发展的异质性影响[46]。这些方向值得在后续研究中结合多组学技术深入探索。
利益冲突 所有作者声明无利益冲突
作者贡献声明 宋庆娜:论文撰写、修改、数据收集及分析;张宏岩:研究指导、沟通协调;姜艳:论文审核校对、数据收集及分析、患者管理及追踪;孙强:论文审核校对、指标筛选、患者诊疗及评估;燕晓雯:论文审核校对、指标筛选、患者诊疗及评估
| [1] | 谢硕, 李嘉欣, 刘新民, 等. 慢性危重症的特点及预测因素研究进展[J]. 中华全科医学, 2022, 20(9): 20-24. DOI:10.3760/cma.j.cn114798-20220615-00652 |
| [2] | 李思澄, 吴婕, 于湘友, 等. 中国慢性危重症及外科相关慢性危重症的多中心横断面研究[J]. 中华胃肠外科杂志, 2019, 22(11): 1027-1033. DOI:10.3760/cma.j.issn.1671-0274.2019.11.005 |
| [3] | 中国医师协会急诊医师分会, 中国急诊专科医联体, 北京急诊医学学会. 急诊成人社区获得性肺炎临床实践指南(2024年版)[J]. 中华急诊医学杂志, 2025, 34(3): 300-317. DOI:10.3760/cma.j.issn.1671-0282.2025.03.006 |
| [4] | 苏和毅, 莫泽珣, 刘星, 等. 内科重症监护病房中继发持续性炎症-免疫抑制-分解代谢综合征的老年脓毒症患者回顾性分析[J]. 中华老年医学杂志, 2019, 38(8): 869-874. DOI:10.3760/cma.j.issn.0254-9026.2019.08.012 |
| [5] | Lamas D. Chronic critical illness[J]. N Engl J Med, 2014, 370(2): 175-177. DOI:10.1056/nejmms1310675 |
| [6] | Kahn JM, Le T, Angus DC, et al. The epidemiology of chronic critical illness in the United States[J]. Crit Care Med, 2015, 43(2): 282-287. DOI:10.1097/CCM.0000000000000710 |
| [7] | Battle CE, Lovett S, Hutchings H. Chronic pain in survivors of critical illness: a retrospective analysis of incidence and risk factors[J]. Crit Care, 2013, 17(3): R101. DOI:10.1186/cc12746 |
| [8] | Mira JC, Cuschieri J, Ozrazgat-Baslanti T, et al. The epidemiology of chronic critical illness after severe traumatic injury at two level-one trauma centers[J]. Crit Care Med, 2017, 45(12): 1989-1996. DOI:10.1097/CCM.0000000000002697 |
| [9] | Halacli B, Yildirim M, Kaya EK, et al. Chronic critical illness in critically ill COVID-19 patients[J]. Chronic Illn, 2024, 20(1): 86-95. DOI:10.1177/17423953231161333 |
| [10] | Iwashyna TJ, Hodgson CL, Pilcher D, et al. Timing of onset and burden of persistent critical illness in Australia and New Zealand: a retrospective, population-based, observational study[J]. Lancet Respir Med, 2016, 4(7): 566-573. DOI:10.1016/S2213-2600(16)30098-4 |
| [11] | Cillóniz C, Torres A, Niederman MS. Management of pneumonia in critically ill patients[J]. BMJ, 2021, 375: e065871. DOI:10.1136/bmj-2021-065871 |
| [12] | Qin T, Zhou HJ, Ren HY, et al. Incidence, etiology, and environmental risk factors of community-acquired pneumonia requiring hospitalization in China: a 3-year, prospective, age-stratified, multicenter case-control study[J]. Open Forum Infect Dis, 2021, 8(11): ofab499. DOI:10.1093/ofid/ofab499 |
| [13] | Fan GH, Zhou YC, Zhou F, et al. The mortality and years of life lost for community-acquired pneumonia before and during COVID-19 pandemic in China[J]. Lancet Reg Health West Pac, 2023, 42: 100968. DOI:10.1016/j.lanwpc.2023.100968 |
| [14] | Martin-Loeches I, Torres A, Nagavci B, et al. ERS/ESICM/ESCMID/ALAT guidelines for the management of severe community-acquired pneumonia[J]. Intensive Care Med, 2023, 49(6): 615-632. DOI:10.1007/s00134-023-07033-8 |
| [15] | Esteban A, Anzueto A, Frutos F, et al. Characteristics and outcomes in adult patients receiving mechanical ventilation: a 28-day international study[J]. JAMA, 2002, 287(3): 345-355. DOI:10.1001/jama.287.3.345 |
| [16] | Li X, Wang Y, Zhang Z, et al. Multidimensional risk stratification in severe pneumonia: integrating host-pathogen interactions[J]. Crit Care Med, 2023, 51(4): e235-e244. DOI:10.1097/CCM.0000000000005801 |
| [17] | Schmidt GA, Combes A, Fan E, et al. VAP incidence reduction strategies in ECMO-supported patients: a multicenter analysis[J]. Intensive Care Med, 2023, 49(8): 987-995. DOI:10.1007/s00134-023-07142-4 |
| [18] | Zhang Y, Liu X, Wang H, et al. Multidrug-resistant infections in critical care: a meta-analysis of risk factors and outcomes[J]. Lancet Infect Dis, 2023, 23(5): 601-612. DOI:10.1016/S1473-3099(23)00092-6 |
| [19] | Hotchkiss RS, Monneret G, Payen D. Immune exhaustion and PICS: mechanisms and therapeutic implications[J]. Nat Rev Immunol, 2023, 23(2): 112-125. DOI:10.1038/s41577-022-00764-7 |
| [20] | Coste B, Hong G, Zhou K, et al. Piezo1 activation triggers epithelial apoptosis in ventilator-induced lung injury[J]. Sci Transl Med, 2023, 15(694): eabn6198. DOI:10.1126/scitranslmed.abn6198 |
| [21] | Dres M, Demoule A, Jung B, et al. Diaphragm fiber degradation under high driving pressure: an ultrastructural study[J]. Am J Respir Crit Care Med, 2023, 207(9): 1165-1177. DOI:10.1164/rccm.202209-1768OC |
| [22] | Goligher EC, Laghi F, Detsky ME, et al. Diaphragm thickening fraction predicts extubation failure: a lung ultrasound study[J]. Chest, 2023, 163(2): 321-330. DOI:10.1016/j.chest.2022.09.037 |
| [23] | Brochard L, Slutsky AS, Papazian L, et al. EAdi-guided personalized ventilation in ARDS: a randomized trial[J]. Lancet Respir Med, 2023, 11(4): 345-354. DOI:10.1016/S2213-2600(22)00539-4 |
| [24] | Grant RA, Morales-Nebreda L, Markov NS, et al. Circuits between infected macrophages and T cells in SARS-CoV-2 pneumonia[J]. Nature, 2021, 590(7847): 635-641. DOI:10.1038/s41586-020-03148-w |
| [25] | Hönzke K, Obermayer B, Mache C, et al. Human lungs show limited permissiveness for SARS-CoV-2 due to scarce ACE2 levels but virus-induced expansion of inflammatory macrophages[J]. Eur Respir J, 2022, 60(6): 2102725. DOI:10.1183/13993003.02725-2021 |
| [26] | 王丽姝, 莫玉珍, 王锋, 等. 微小RNA-215调控TLR4/NF-κB信号通路在ARDS中的作用[J]. 广西医学, 2021, 43(18): 2202-2208. DOI:10.11675/j.issn.0253-4304.2021.18.13 |
| [27] | 钟艺. 重庆某儿童医院抗菌药物合理应用专项整治前后重症肺炎疗效对比研究[D]. 重庆: 重庆医科大学, 2014. |
| [28] | 车霄, 王乐霄, 赵磊, 等. 重症新型冠状病毒肺炎患者的临床特征及预后风险因素分析[J]. 解放军医学院学报, 2023, 44(2): 101-107. DOI:10.3969/j.issn.2095-5227.2023.02.001 |
| [29] | 苏翔宇, 程璐, 邓雨霞, 等. 血清PCT水平预测成人恶性肿瘤粒细胞缺乏性发热伴感染的荟萃分析[J]. 山东医药, 2013, 53(21): 78-80. DOI:10.3969/j.issn.1002-266x.2013.21.029 |
| [31] | 李芳菲, 冀晓东, 沈文, 等. COVID-19相关中枢神经系统损伤的发病机制及影像学表现[J]. 国际医学放射学杂志, 2023, 46(2) 173-176, 201. DOI:10.19300/j.2023.z20552 |
| [32] | Ogando NS, Elaish M, Mahabadi HM, et al. Immunometabolism perturbations in post-COVID-19 condition: interleukin-6 and monoamine oxidase interactions drive neuropsychiatric syndromes[J]. Brain Behav Immun, 2025, 129: 690-708. DOI:10.1016/j.bbi.2025.07.002 |
| [33] | Papayannopoulos V, Kaplan MJ, Carmona-Rivera C, et al. NETs-induced microcirculatory dysfunction via HMGB1-TLR9 pathway[J]. Blood, 2023, 141(12): 1421-1433. DOI:10.1182/blood.2022017865 |
| [34] | Singer M, DE Santis V, Vitale D, et al. Mitochondrial dysfunction drives hypoalbuminemia in critical illness[J]. Cell Metab, 2023, 35(3): 456-470. DOI:10.1016/j.cmet.2023.01.011 |
| [35] | Incent JL, Martin GS, Levy MM, et al. PIRO system 2.0:a machine learning-driven grading tool for sepsis[J]. Crit Care, 2023, 27(1): 88. DOI:10.1186/s13054-023-04376-y |
| [36] | Roodgar M, Ross CT, Tataryn A, et al. Single-cell atlas of immune-metabolic crosstalk in chronic critical illness[J]. Nat Med, 2023, 29(7): 1789-1800. DOI:10.1038/s41591-023-02394-5 |
| [37] | Austin PC, Steyerberg EW, Pencina MJ. Restricted cubic splines in clinical prediction models[J]. Stat Med, 2023, 42(5): 735-752. DOI:10.1002/sim.9634 |
| [38] | Pencina MJ, D'agostino RB, Demler OV. Net Reclassification Index as a metric for model improvement[J]. JAMA, 2023, 329(11): 931-933. DOI:10.1001/jama.2023.1575 |
| [39] | Wong A, Otles E, Donnelly JP, et al. Point-of-care prediction models in critical care[J]. Intensive Care Med, 2023, 49(6): 689-701. DOI:10.1007/s00134-023-07033-8 |
| [40] | Zhang Z, Chen L, Xu F, et al. Temporal matrix analysis for disease progression[J]. Crit Care, 2023, 27(1): 45. DOI:10.1186/s13054-023-04344-6 |
| [41] | Girard TD, Alhazzani W, Kessler AE, et al. Liberation from mechanical ventilation[J]. N Engl J Med, 2023, 388(17): 1566-1578. DOI:10.1056/NEJMra2205256 |
| [42] | Wischmeyer PE, Kaiser H, Schroeder S, et al. Immunonutrition in chronic critical illness[J]. JPEN J Parenter Enteral Nutr, 2023, 47(Suppl 2): S18-S27. DOI:10.1002/jpen.2467 |
| [43] | Collins GS, Reitsma JB, Altman DG, et al. Transparent reporting of multivariable prediction models[J]. BMJ, 2023, 381: e073538. DOI:10.1136/bmj-2022-073538 |
| [44] | Henry KE, Hager DN, Osborn TM, et al. Real-time sepsis prediction in EHR systems[J]. NPJ Digit Med, 2023, 6(1): 42. DOI:10.1038/s41746-023-00789-9 |
| [45] | Liu X, Wang Y, Zhang H, et al. Exosomal miRNAs as biomarkers in critical care[J]. Crit Care Explor, 2023, 5(3): e0892. DOI:10.1097/CCE.0000000000000892 |
| [46] | Pairó-Castineira E, Clohisey L, Klarić L, et al. Viral variants and host susceptibility in critical illness[J]. Nature, 2023, 615(7952): 458-467. DOI:10.1038/s41586-023-05769-3 |
 2025, Vol. 34
2025, Vol. 34