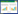2. 经血管植入器械全国重点实验室,杭州 311215;
3. 浙江省心血管病诊治重点实验室,杭州 310009
3. State Key Laboratory of Transvascular Implantation Devices, Hangzhou 310009, China
三尖瓣疾病是心脏病学领域日益受到关注的一个领域,以其患病率高、病死率高、预后差而越来越受到人们的重视。其中,三尖瓣反流(TR)是公认的右室心内膜电极导线植入的并发症之一。有研究表明跨三尖瓣电极导线可直接损伤三尖瓣,包括碰撞或黏附瓣叶、瓣叶穿孔或断裂、瓣下腱索或乳头肌缠绕等[1-2]。术后TR的发生率与影响因素仍不明确。基于国内外多个单中心回顾性研究数据,与器械相关的严重三尖瓣反流的发生率在7%~45%[2-9]。各中心研究报道的术后TR发生率存在巨大差异,不同中心报道不一。根据最新国外专家共识[10],因其病因复杂,将心脏植入式电子装置(cardiac implantable electronic devices,CIEDs)相关TR在继发性TR中单独分类,其病因可分为起搏导线介导的TR和CIEDs存在带来的不可控因素。有研究显示三维超声在起搏器植入术中可清晰显示导线的路径、导线头端在右心室的位置以及与周边毗邻组织的关系,可以提供二维图像无可比拟的丰富、直观信息[11]。已有研究表明植入右心室内膜电极导线后三尖瓣反流的恶化可在1~12个月之间检测到[12-13],而产生对心衰的影响需超过12个月以上[14],短期内一般不会出现右心重构。现调查本中心心脏起搏器导线植入后短期内TR的相关情况。
1 资料与方法 1.1 研究对象连续收集2019年6月至2023年12月于浙江大学医学院附属第二医院首次植入永久心脏起搏器(permanent pacemaker,PPM)的患者,起搏器的类型包括单腔右心室起搏(VVI)和双腔起搏器(DDD)。纳入标准:①所有入选患者术前符合心脏起搏器植入Ⅰ类和Ⅱa类适应证,其中2019年6月至2021年8月的患者根据《2018 ACC/AHA/HRS心动过缓和心脏传导延迟患者评估及管理指南》,2021年9月至2023年12月的患者根据《2021ESC心脏起搏器和心脏再同步治疗指南》;②经锁骨下静脉途径植入心脏起搏导线。排除标准:①年龄小于18周岁;②既往植入过起搏器;③基线TR>中度;④无完整术前及术后超声心动图;⑤术后随访超声心动图超过12个月;⑥合并有重度肺动脉高压、风湿免疫系统疾病、心肌病、心脏瓣膜病的患者。
根据纳排标准,一共有219例植入VVI型或DDD型起搏器电极导线的研究对象纳入最终分析。如图 1。本研究通过浙江大学医学院附属第二医院人体研究伦理委员会审查[2024伦审研第(1518)号],符合1964《赫尔辛基宣言》及之后的修订版或类似的伦理标准, 研究豁免患者知情同意。
|
| 图 1 研究对象纳入流程图 Fig 1 Flow chart |
|
|
通过查询浙江大学医学院附属第二医院病历系统的方式获取临床资料:①基本信息:性别、年龄、身高、体重、身体质量指数(body mass index,BMI)、基础疾病[包括阵发性房颤/房扑、持续性房颤/房扑、高血压、糖尿病、冠心病、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、脑梗死];②起搏器相关资料:起搏器适应证、起搏器类型、植入时间;③常规心电图参数:QRS时限;④三维超声心动图参数:左房前后径(LA-ap内径)、左室射血分数(left ventricular ejection fraction,LVEF)、肺动脉收缩压(pulmonary artery systolic pressure,PASP)、二尖瓣反流(mitral regurgitation,MR)程度、TR程度、导线与瓣环的位置关系、导线头端固定位置。
1.3 随访与终点事件本研究为回顾性研究,所有随访数据均通过医院信息管理系统(HIS)、电子病历系统(EMR)和医学影像存档与通讯系统(PACS)收集获得。随访时间从首次植入心脏永久起搏器手术当日开始,至末次有效病历记录日期、患者死亡或研究截止日期(2024年6月30日)为止。本研究对所有纳入的患者均进行了常规门诊或住院随访,中位随访时间为99 d(26~199 d)。由经过统一培训的心内科医师在不知晓研究分组的情况下独立查阅病历系统,采集随访数据。
1.4 TR分级根据美国超声心动图学会(American Society of Echocardiography,ASE)指南[15]推荐采用6分法进行评估,根据严重程度从轻到重分别为:无/轻微(无/微量0级)、轻度(少量1级)、轻度至中度(少量-中等量2级)、中度(中等量3级)、中度至严重(中等量至大量4级)、严重(大量5级)。根据术前术后TR,将TR无变化定义为无进展组,术后TR程度减轻1级以上为改善组,术后TR程度加重1级以上为进展组。
1.5 统计学方法计量资料中呈正态分布数据采用均数±标准差(x±s)表示,组间比较采用独立t检验;非正态分布数据以中位数和四分位数间距表示,组间比较采用Mann-Whitney U非参数检验,三组间比较采用Kruskal-Wallis检验。计数资料以例数(百分率)表示,组间比较采用非配对检验或Fisher精确概率法。采用有序多分类Logistic回归法分析心脏起搏器术后短期内TR程度变化的影响因素。以P<0.05为差异有统计学意义。采用SPSS 29.0软件对数据进行分析。
2 结果 2.1 基线数据描述及术后TR情况2019年6月至2023年12月因缓慢型心律失常于本院首次行PPM植入术的患者共1 789例,排除年龄<18周岁、既往植入过心脏起搏器、基线TR>中度、无完整术前及术后在本院复查至少一次经胸三维超声心动图(three-dimensional transthoracic echocardiography, 3D-TTE)、术后随访超声心动图超过12个月、合并有重度肺动脉高压、风湿免疫系统疾病、心肌病、心脏瓣膜病,同时排除3例术后三维超声心动图显示心室电极位于冠状静脉窦内,最终219例纳入调查。如图 1。其中,男性128例(58.4%),女性91例(41.6%),年龄(69.7±11.2)岁。随访中位数99(26,199)d,BMI为(23.24±3.47)kg/m2;其中植入DDD起搏器134例(61.2%),VVI起搏器13例(5.9%),单/双腔左束支起搏器(left bundle branch area pacing, LBBAP)72例(32.9%);起搏器适应证为病态窦房结综合征(sick sinus syndrome, SSS)117例(53.4%),房室传导阻滞(atrioventricular block, AVB)102例(46.6%);合并患有阵发性房颤/房扑41例(18.7%),持续性房颤/房扑18例(8.2%),高血压135例(61.6%),糖尿病44例(20.1%),冠心病44例(20.1%),COPD 9例(4.1%),脑梗死18例(8.2%)。最终114例(52.1%)TR无变化;46例(21.0%)TR得到改善,其中36例(16.4%)TR减轻1级,9例(4.1%)TR减轻2级,1例(0.5%)TR减轻3级;59例(26.9%)TR进展,其中51例(23.3%)TR中度以下,均加重一级,8例(3.7%)TR中度及以上,均加重二级以上,其中1例导线穿孔瓣叶,2例导线碰撞瓣叶。见表 2。
| 指标 | 进展组 | 改善组 | 无进展组 | P值 |
| 例数 | 59 | 46 | 114 | |
| 男(n, %) | 33(55.9) | 31(67.4) | 64(56.1) | 0.383 |
| 年龄(岁,x±s) | 70.41±12.0 | 70.83±11.0 | 68.81±10.9 | 0.495 |
| BMI | 22.72±3.5 | 23.17±3.6 | 23.53±3.4 | 0.340 |
| 随访时间(d) | 143.00(28.00,215.50) | 83.00(26.00, 188.00) | 90.00(21.00,191.00) | 0.286 |
| PPM(n, %) | 0.162 | |||
| 双腔DDD | 40(67.8) | 27(58.7) | 67(58.8) | |
| 单腔VVI | 4(6.8) | 0 | 9(7.9) | |
| 单/双腔左束支 | 15(25.4) | 19(41.3) | 38(33.3) | |
| 适应证(n, %) | 0.012 | |||
| AVB | 22(37.3) | 30(65.2) | 50(43.9) | |
| 病窦 | 37(62.7) | 16(34.8) | 64(56.1) | |
| 合并症(n, %) | ||||
| 阵发性房颤/房扑 | 8(13.6) | 13(28.3) | 20(17.5) | 0.143 |
| 持续性房颤/房扑 | 6(10.2) | 3(6.5) | 9(7.9) | 0.805 |
| 高血压 | 37(62.7) | 27(58.7) | 71(62.3) | 0.897 |
| 糖尿病 | 12(20.3) | 10(21.7) | 22(19.3) | 0.940 |
| 冠心病 | 11(18.6) | 5(10.9) | 28(24.6) | 0.140 |
| COPD | 1(1.7) | 4(8.7) | 4(3.5) | 0.202 |
| 脑梗死 | 5(8.5) | 5(10.9) | 8(7.0) | 0.722 |
| 电极导线头端位置(n, %) | 0.204 | |||
| 间隔部 | 43(72.9) | 27(58.7) | 76(66.7) | |
| 左束支区域 | 15(25.4) | 19(41.3) | 38(33.3) | |
| 心尖 | 1(1.7) | 0 | 0 | |
| QRS时限(ms,x±s) | 98(89.5,125) | 104.5(90.25,146.5) | 97(89,120) | 0.352 |
对比右心室电极导线植入前后三维超声心动图资料MR程度在手术前后视为差异无统计学意义(P>0.05);起搏器植入术后短期内LA-ap内径较术前减小视为差异有统计学意义(P<0.001),术后轻度以上TR的比例明显高于术前视为差异有统计学意义(P<0.05)。见表 1。
| 参数 | 术前(n=219) | 术后(n=219) | P值 |
| LA-ap内径(mm) | 3.81(3.45,4.16) | 3.68(3.29,4.06) | <0.001 |
| MR程度 | 0.105 | ||
| ≥轻度 | 110(50.2) | 97(44.3) | |
| <轻度 | 109(49.8) | 122(55.7) | |
| TR程度 | 0.042 | ||
| ≥轻度 | 113(51.6) | 132(60.3) | |
| <轻度 | 106(48.4) | 87(39.7) |
本研究根据右心室电极导线植入后TR程度变化的情况分为进展组、改善组、无进展组。其中进展组59例(26.9%),改善组46例(21%),无进展组114例(52.1%)。如图 1。通过对比三组患者的临床资料及右心室电极导线植入前的三维超声心动图参数,评估可能影响TR程度变化的预测因素。
对TR进展组、TR改善组及TR无进展组的基线特征进行比较分析,在性别、年龄、BMI、随访时间、起搏模式、基础合并症、右心室电极导线头端位置及术前QRS时限差异均无统计学意义(P>0.05)。两组之间的起搏适应证(AVB、SSS)差异有统计学意义(P<0.05),其中,TR进展组的适应证中SSS(62.7%)的比例更高,TR改善组的适应证中AVB(65.2%)的比例更高。见表 2。
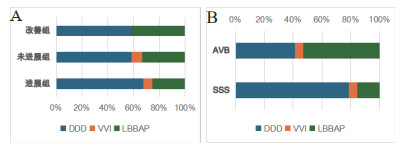
对TR进展组、TR改善组及TR未进展组的不同起搏模式(DDD、VVI、LBBAP)占比进行分析,TR进展组中的LBBAP相较于其他两组的占比更低,TR改善组中的LBBAP相较于其他两组的占比更高。如图 2A。
|
| 图 2 三组起搏模式百分比堆积条形图 Fig 2 Bar chart of pacing mode percentage in three groups |
|
|
对两组起搏器适应证(AVB、SSS)的不同起搏模式(DDD、VVI、LBBAP)占比进行分析,AVB组VVI 5.9%,DDD 41.2%,LBBAP 52.9%;SSS组VVI 6%,DDD 78.6%,LBBAP 15.4%。两组间差异有统计学意义(P<0.001)。如图 2B。
对TR进展组、TR改善组及TR未进展组的三维超声心动图基线参数进行比较分析。三维超声心动图参数中的术前LVEF差异无统计学意义(P>0.05);术前LA-ap内径、PASP、MR程度及TR程度的差异有统计学意义(P<0.05)。见表 3。
| 指标 | 进展组 | 改善组 | 无进展组 | P值 |
| LA-ap内径[mm, M(Q1, Q3)] | 3.59(3.33, 3.94) | 4.05(3.70, 4.31) | 3.81(3.51, 4.17) | 0.005 |
| LVEF[%, M(Q1, Q3)] | 65.90(58.80, 69.40) | 63.35(57.68, 70.45) | 65.20(57.65, 69.60) | 0.825 |
| PASP [mmHg, M(Q1, Q3)] | 25.50(22.00, 32.25) | 32.00(28.00, 40.50) | 29.00(25.00, 33.75) | < 0.001 |
| MR程度(n,%) | 0.005 | |||
| ≥轻度 | 21(35.6) | 31(67.4) | 58(50.9) | |
| <轻度 | 38(64.4) | 15(32.6) | 56(49.1) | |
| TR程度(n,%) | < 0.001 | |||
| ≥轻度 | 9(15.3) | 46(100) | 58(50.9) | |
| <轻度 | 50(84.7) | 0 | 56(49.1) |
根据表 2~3分析结果可知,术后出现TR短期内程度变化可能与适应证(AVB、SSS)、术前LA-ap内径、PASP、MR程度、TR程度有关。入选如上5个临床变量作为自变量,TR进展组、TR无进展组和TR改善组为因变量,平行线检验显示P>0.05,满足比例优势假定,进行有序多分类Logistic回归分析,显示术前LA-ap内径、PASP和MR程度对术后TR进展的预测均无统计学意义(P>0.05);术前TR严重程度[OR =10.57(3.77~29.68),P<0.001]和起搏器适应证[OR=0.452(0.222~0.918),P<0.005]对术后TR进展的预测有统计学意义。见表 4。
| 临床变量 | 估算值 | 标准误 | Wald | 自由度 | P值 | OR(95%CI) |
| LA-ap内径 | 0.212 | 0.301 | 0.497 | 1 | 0.481 | 1.237(0.683~2.238) |
| PASP | -0.036 | 0.025 | 2.088 | 1 | 0.148 | 0.965(0.918~1.013) |
| MR分级 | -0.086 | 0.368 | 0.055 | 1 | 0.814 | 0.917(0.446~1.887) |
| TR分级 | 2.357 | 0.525 | 20.131 | 1 | <0.001 | 10.57(3.77~29.68) |
| 适应证(AVB) | -0.794 | 0.362 | 4.823 | 1 | 0.028 | 0.452(0.222~-0.918) |
| 适应证(SSS) | 0a | - | - | 0 | - | - |
本研究通过对本院近5年内219例首次植入永久心脏起搏器的患者进行回顾性分析,探讨了右心室电极导线植入后短期内TR的变化情况及其影响因素。发现术后短期内不同程度的TR进展率较高,与近年来国内外多项研究结果一致,表明电极导线的植入确实可能对三尖瓣功能产生不利影响,尤其是在导线与瓣叶的机械性相互作用方面。
三尖瓣疾病是最常见的心脏瓣膜病之一,其发病率随着年龄增长而逐渐增加[16]。其中三尖瓣反流会影响多种心血管疾病的临床结局。在最近的一项大规模多中心前瞻性对照研究中,CIEDs相关TR占所有严重三尖瓣反流病例的5%[17]。Tatum等[18]报道,植入导线的患者术后三尖瓣反流恶化的发生率为20%,其中41%的患者至少达到中度三尖瓣反流。因此,CIEDs相关TR是三尖瓣疾病诊疗中不容忽视的部分。
国内外多个单中心回顾性研究数据显示,CIEDs植入后导线相关TR的发生率为7%~45%[2-9],本中心回顾性研究得出的术后短期内TR发生率26.9%在上述范围内。造成研究报道心脏起搏器导线植入后TR发生率不一致的可能原因:①TR加重的定义不统一:Klutstein等[19]报道的研究中将TR加重二级以上定义为TR进展;而Rothschild等[20]报道的研究中将TR加重一级以上定义为TR进展;②随访时间差异:Wiechecka等[21]报道的研究中超声随访时间设定为术后7 d内;而Anvardeen等[22]报道的研究将随访时间分段设定为术后4~6周、术后6个月、术后1年;③不同起搏器植入种类差异:Stassen等[23]主要研究了首次CRT植入后对TR的影响;而Al-bawardy等[24]主要研究了首次ICD或PPM植入后对TR进展的影响;④研究入组筛选对象差异:近年来国内外多个研究中入组对象的纳排标准并不统一;⑤采用不同的超声心动图评价方法:Addetia等[25]报道的回顾性研究中采用了3D超声心动图的评价方法;而Cho等[26]报道的回顾性研究中仅采用了普通的二维超声心动图或彩色多普勒超声心动图评价TR。
根据最新的国际共识,CIEDs相关的TR因其病因复杂已被单独分类为继发性TR的一种,可分为起搏导线介导的TR和CIEDs存在带来的不可控因素。本研究进一步证实了导线植入后TR的恶化可能在短期内术后12个月内发生,且与术前TR的严重程度密切相关。说明术前存在轻度或轻度以上TR的患者在右心室电极导线植入过程中更不容易受到损伤或影响,这可能是由于基线TR程度越重的患者三尖瓣开口面积相对较大,右心室电极导线随机性过瓣时对三尖瓣瓣叶产生直接机械性损伤的发生率相对较小;也可能是由于基线TR程度越重的患者瓣膜已处于病理状态,导线产生的额外影响有限,以上观念需大规模研究进一步验证。
目前,影响右心室电极导线植入后TR进展的预测因素尚无定论。如持续性心房颤动、毛细血管前和后肺动脉高压、右心室扩张、心尖起搏、右心室高起搏比例、既往曾行左心瓣膜手术和高龄等均可能是心脏起搏导线植入后TR加重的危险因素[19, 26-28]。本研究发现,术前LA-ap内径、PASP、MR程度等因素在TR进展组和改善组之间差异有统计学意义,提示这些因素可能在TR的病理生理过程中起到一定作用。此外,本研究还发现,术后短期内TR的加重与起搏适应证(如房室传导阻滞和病态窦房结综合征)存在一定关联,尤其是术前房室传导阻滞的患者在TR改善组中占比较高。这可能与不同起搏适应证患者的心脏基础结构和功能差异有关。本研究证实,起搏适应证对术后短期内TR进展的预测作用显著,术前病态窦房结综合征的患者术后短期内TR进展的可能性越大,提示TR的进展可能更多依赖于术前的心脏结构和功能状态。此外,术前房室传导阻滞的患者选择左束支起搏模式的占比高且差异有统计学意义显著性,说明左束支起搏模式的选择与起搏器导线植入后短期内TR的程度变化有关。由于房室传导阻滞的患者心室起搏比例需求较高,左束支起搏模式在此类患者中更能维持电同步性的能力优于右室起搏,可避免因非生理起搏导致的右室功能恶化。尽管左束支起搏可能因导线植入位置靠近三尖瓣隔瓣引发机械性损伤风险,但其生理性起搏的获益可能部分抵消此风险。因此,AVB患者高比例选择左束支起搏模式,可能是其TR风险较低的关键因素之一。
本研究发现短期内起搏导线介导的TR进展发生率为26.9%,其中TR中度以下发生率为23.3%,可能是起搏导线存在角度过瓣,以致存在轻度压瓣,故TR程度加重较少,但随着时间的推移,由于长期压瓣可能出现导线与瓣叶黏连,该类患者远期可能出现TR进一步加重,该观点有待进一步研究证实;TR中度及以上的发生率为3.7%,其中1例导线穿孔瓣叶,2例导线碰撞瓣叶,考虑右室电极植入过程中直接对三尖瓣复合体产生机械损伤或干扰,这与既往研究[1-2]发现跨三尖瓣电极导线可直接损伤三尖瓣,包括碰撞或黏附瓣叶、瓣叶穿孔或断裂、瓣下腱索或乳头肌缠绕等原因相符。
值得注意的是,本研究左束支起搏(LBBAP)的应用在TR改善组中占比较高,而在TR进展组中占比较低。这一发现与近年来国际上提倡的生理性起搏理念相吻合。LBBAP作为一种新兴的生理性起搏方式,能够减少对右心室结构和功能的干扰,从而可能降低TR的发生风险。然而,由于本研究样本量有限,LBBAP对TR的长期影响仍需进一步大规模研究验证。
综上所述,右心室电极导线植入后短期内TR的进展与术前TR的严重程度和起搏器适应证密切相关,且生理性起搏模式可能在一定程度上减少TR的发生风险。未来的研究应进一步探讨不同起搏方式对TR的长期影响,并结合更先进的影像学技术来评估导线与三尖瓣的相互作用,以期为临床提供更精准的预防和治疗策略。
本研究是单中心进行的回顾性研究,因部分病例缺失完整的术前及术后三维超声心动图资料、随访程控资料,只能对现有的数据进行分析,潜在选择偏倚可能对结果产生影响,应谨慎解释结果。由于是回顾性研究,随访时间不一,会进一步影响TR加重率的比较。同时,起搏导线产生的超声成像伪影及信号衰减影响对TR的评估。有待多中心、大样本量的前瞻性研究进一步证实。
总之,心脏起搏器术后短期内TR进展发生率较高,严重TR发生率较低,术前TR程度和起搏器适应证是TR短期内进展的独立预测因素,生理性起搏模式的选择或许可以降低起搏导线植入后短期内TR的发生率。
利益冲突 所有作者声明无利益冲突
作者贡献声明 俞丹青:酝酿和设计实验、实施研究、采集/min析/解释数据、起草文章、统计分析;朱齐丰:酝酿和设计实验、分析/解释数据、对文章的知识性内容作批判性审阅、统计分析;林艳:实施研究、分析/解释数据、对文章的知识性内容作批判性审阅、行政/技术/材料支持、指导、支持性贡献;林小平:分析/解释数据、对文章的知识性内容作批判性审阅、行政/技术/材料支持、指导;刘先宝:酝酿和设计实验、对文章的知识性内容作批判性审阅、获取研究经费、行政/技术/材料支持、指导、支持性贡献;王建安:酝酿和设计实验、对文章的知识性内容作批判性审阅、获取研究经费、行政/技术/材料支持、支持性贡献
| [1] | Andreas M, Gremmel F, Habertheuer A, et al. Case report: Pacemaker lead perforation of a papillary muscle inducing severe tricuspid regurgitation[J]. J Cardiothorac Surg, 2015, 10: 39. DOI:10.1186/s13019-015-0244-7 |
| [2] | Gelves-Meza J, Lang RM, Valderrama-Achury MD, et al. Tricuspid regurgitation related to cardiac implantable electronic devices: an integrative review[J]. J Am Soc Echocardiogr, 2022, 35(11): 1107-1122. DOI:10.1016/j.echo.2022.08.004 |
| [3] | de Cock CC, Vinkers M, Van Campe LC, et al. Long-term outcome of patients with multiple (> or=3) noninfected transvenous leads: a clinical and echocardiographic study[J]. Pacing Clin Electrophysiol, 2000, 23(4 Pt 1): 423-426. DOI:10.1111/j.1540-8159.2000.tb00821.x |
| [4] | Al-Bawardy R, Krishnaswamy A, Bhargava M, et al. Tricuspid regurgitation in patients with pacemakers and implantable cardiac defibrillators: a comprehensive review[J]. Clin Cardiol, 2013, 36(5): 249-254. DOI:10.1002/clc.22104 |
| [5] | Höke U, Auger D, Thijssen J, et al. Significant lead-induced tricuspid regurgitation is associated with poor prognosis at long-term follow-up[J]. Heart, 2014, 100(12): 960-968. DOI:10.1136/heartjnl-2013-304673 |
| [6] | Lee RC, Friedman SE, Kono AT, et al. Tricuspid regurgitation following implantation of endocardial leads: incidence and predictors[J]. Pacing Clin Electrophysiol, 2015, 38(11): 1267-1274. DOI:10.1111/pace.12701 |
| [7] | Saito M, Iannaccone A, Kaye G, et al. Effect of right ventricular pacing on right ventricular mechanics and tricuspid regurgitation in patients with high-grade atrioventricular block and sinus rhythm (from the protection of left ventricular function during right ventricular pacing study)[J]. Am J Cardiol, 2015, 116(12): 1875-1882. DOI:10.1016/j.amjcard.2015.09.041 |
| [8] | Seo J, Kim DY, Cho I, et al. Prevalence, predictors, and prognosis of tricuspid regurgitation following permanent pacemaker implantation[J]. PLoS One, 2020, 15(6): e0235230. DOI:10.1371/journal.pone.0235230 |
| [9] | Andreas M, Burri H, Praz F, et al. Tricuspid valve disease and cardiac implantable electronic devices[J]. Eur Heart J, 2024, 45(5): 346-365. DOI:10.1093/eurheartj/ehad783 |
| [10] | Hahn RT, Lawlor MK, Davidson CJ, et al. Tricuspid valve academic research consortium definitions for tricuspid regurgitation and trial endpoints[J]. Eur Heart J, 2023, 44(43): 4508-4532. DOI:10.1093/eurheartj/ehad653 |
| [11] | Zhang YY, Cheng Y, Zheng LR, et al. Association between cardiovascular implantable electronic devices and tricuspid regurgitation: a case-control study[J]. World J Emerg Med, 2022, 13(5): 403-405. DOI:10.5847/wjem.j.1920-8642.2022.084 |
| [12] | Beurskens NEG, Tjong FVY, de Bruin-Bon RHA, et al. Impact of leadless pacemaker therapy on cardiac and atrioventricular valve function through 12 months of follow-up[J]. Circ Arrhythm Electrophysiol, 2019, 12(5): e007124. DOI:10.1161/CIRCEP.118.007124 |
| [13] | Nakajima H, Seo Y, Ishizu T, et al. Features of lead-induced tricuspid regurgitation in patients with heart failure events after cardiac implantation of electronic devices-A three-dimensional echocardiographic study[J]. Circ J, 2020, 84(12): 2302-2311. DOI:10.1253/circj.CJ-20-0620 |
| [14] | Kanawati J, Ng ACC, Khan H, et al. Long-term follow-up of mortality and heart failure hospitalisation in patients with intracardiac device-related tricuspid regurgitation[J]. Heart Lung Circ, 2021, 30(5): 692-697. DOI:10.1016/j.hlc.2020.08.028 |
| [15] | Zoghbi WA, Adams D, Bonow RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the American society of echocardiography developed in collaboration with the society for cardiovascular magnetic resonance[J]. J Am Soc Echocardiogr, 2017, 30(4): 303-371. DOI:10.1016/j.echo.2017.01.007 |
| [16] | Xu HY, Liu QR, Cao K, et al. Distribution, characteristics, and management of older patients with valvular heart disease in China: China-DVD study[J]. JACC Asia, 2022, 2(3): 354-365. DOI:10.1016/j.jacasi.2021.11.013 |
| [17] | Vieitez JM, Monteagudo JM, Mahia P, et al. New insights of tricuspid regurgitation: a large-scale prospective cohort study[J]. Eur Heart J Cardiovasc Imaging, 2021, 22(2): 196-202. DOI:10.1093/ehjci/jeaa205 |
| [18] | Tatum R, Maynes EJ, Wood CT, et al. Tricuspid regurgitation associated with implantable electrical device insertion: a systematic review and meta-analysis[J]. Pacing Clin Electrophysiol, 2021, 44(8): 1297-1302. DOI:10.1111/pace.14287 |
| [19] | Klutstein M, Balkin J, Butnaru A, et al. Tricuspid incompetence following permanent pacemaker implantation[J]. Pacing Clin Electrophysiol, 2009, 32(Suppl 1): S135-S137. DOI:10.1111/j.1540-8159.2008.02269.x |
| [20] | Rothschild DP, Goldstein JA, Kerner N, et al. Pacemaker-induced tricuspid regurgitation is uncommon immediately post-implantation[J]. J Interv Card Electrophysiol, 2017, 49(3): 281-287. DOI:10.1007/s10840-017-0266-2 |
| [21] | Wiechecka K, Wiechecki B, Kapłon-Cieślicka A, et al. Echocardiographic assessment of tricuspid regurgitation and pericardial effusion after cardiac device implantation[J]. Cardiol J, 2020, 27(6): 797-806. DOI:10.5603/CJ.a2019.0053 |
| [22] | Anvardeen K, Rao R, Hazra S, et al. Lead-specific features predisposing to the development of tricuspid regurgitation after endocardial lead implantation[J]. CJC Open, 2019, 1(6): 316-323. DOI:10.1016/j.cjco.2019.10.002 |
| [23] | Stassen J, Galloo X, Hirasawa K, et al. Tricuspid regurgitation after cardiac resynchronization therapy: evolution and prognostic significance[J]. Europace, 2022, 24(8): 1291-1299. DOI:10.1093/europace/euac034 |
| [24] | Al-Bawardy R, Krishnaswamy A, Rajeswaran J, et al. Tricuspid regurgitation and implantable devices[J]. Pacing Clin Electrophysiol, 2015, 38(2): 259-266. DOI:10.1111/pace.12530 |
| [25] | Addetia K, Maffessanti F, Mediratta A, et al. Impact of implantable transvenous device lead location on severity of tricuspid regurgitation[J]. J Am Soc Echocardiogr, 2014, 27(11): 1164-1175. DOI:10.1016/j.echo.2014.07.004 |
| [26] | Cho MS, Kim J, Lee JB, et al. Incidence and predictors of moderate to severe tricuspid regurgitation after dual-chamber pacemaker implantation[J]. Pacing Clin Electrophysiol, 2019, 42(1): 85-92. DOI:10.1111/pace.13543 |
| [27] | Yu YJ, Chen Y, Lau CP, et al. Nonapical right ventricular pacing is associated with less tricuspid valve interference and long-term progress of tricuspid regurgitation[J]. J Am Soc Echocardiogr, 2020, 33(11): 1375-1383. DOI:10.1016/j.echo.2020.06.014 |
| [28] | Zhang XX, Wei M, Xiang R, et al. Incidence, risk factors, and prognosis of tricuspid regurgitation after cardiac implantable electronic device implantation: a systematic review and meta-analysis[J]. J Cardiothorac Vasc Anesth, 2022, 36(6): 1741-1755. DOI:10.1053/j.jvca.2021.06.025 |
 2025, Vol. 34
2025, Vol. 34