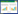一氧化碳(carbon monoxide, CO)中毒是一个重要的全球公共卫生问题,严重损害患者的生命质量,且我国的CO中毒疾病负担高于全球平均水平[1-3]。对于急性一氧化碳中毒(acute carbon monoxide poisoning, ACOP)患者,高达半数的幸存者遗留有神经系统后遗症[4-6],其中一氧化碳中毒迟发性脑病(delayed encephalopathy after acute carbon monoxide poisoning, DEACMP)是严重且常见的神经系统后遗症[7-9],可能导致永久性残疾,严重影响患者的生活质量。因此,早期识别DEACMP的相关危险因素,有助于及时调整治疗方案,改善患者的预后。然而,既往关于预测DEACMP的研究差异较大,报道的预测因素包括高龄、意识丧失、CO暴露时间和血清生物标志物,如乳酸清除率、肌酸激酶水平、中枢神经特异性蛋白(S100-β)等[10-13]。然而,上述指标的预测效能目前仍有争议,且由于一些指标难以获得和成本以及时间限制,预测DEACMP仍然具有非常大的挑战性[7, 14]。亟需一种更加简单、实用、准确的预测模型。
近年来,随着医学大数据的崛起,机器学习已成为医学领域风险预测的核心工具[15-17]。机器学习算法种类多样,常见的比如:随机森林(random forest, RF)、极限梯度提升(extreme gradient boosting, XGBoost)、神经网络(neural network, NeuralNet)、梯度提升机(GBM)、LightGBM、支持向量机(support vector machine, SVM)、K最近邻法(K-Nearest neighbors, KNN)、贝叶斯分类器(Naïve Bayes)、Logistic回归(Logistic regression)。各种机器学习算法不断更新、优化,在各种疾病的预后预测方面广泛应用,但目前尚无应用机器学习算法预测ACOP患者预后的模型。因此,本研究基于多种机器学习算法,旨在构建并验证ACOP患者发生DEACMP的预测模型,以期有助于临床早期识别高危患者,早期干预,从而改善患者预后。
1 资料与方法 1.1 伦理审查本研究通过郑州大学第一附属医院科研和临床试验伦理委员会的批准,伦理编号:2019-KY-190。因为是回顾性研究,豁免了患者签署知情同意,研究遵循赫尔辛基宣言。
1.2 研究设计与患者来源本研究是单中心回顾性研究。纳入自2019年8月至2024年10月,在郑州大学第一附属医院住院的ACOP的患者,探究ACOP发生DEACMP的危险因素,并基于机器学习算法构建预测模型。
1.3 研究的纳入及排除标准纳入标准:(1)在CO中毒急性期于本院就诊,诊断为ACOP;(2)年龄≥18岁;(3)患者的临床资料完整,无明显缺失。
排除标准:(1)中毒急性期未在本院住院,在本院就诊时,已发生DEACMP,或查不到中毒急性期的病历资料;(2)既往有痴呆、帕金森、精神分裂症等与DEACMP有相似症状疾病者;(3)合并头部外伤、混合中毒的患者;(4)急性期死亡的患者;(5)临床资料缺失≥20%者。
1.4 数据的收集经病案科工作人员检索本院诊断为CO中毒的患者,经培训的工作人员收集患者的基本信息、病史、检查检验结果等信息,包括年龄、性别、职业;既往史以及个人史;生命体征,格拉斯哥昏迷评分(glasgow coma scale, GCS)评分,昏迷时间;检验检查如血常规、炎症指标、肝功能、肾功能、电解质、心肌酶、凝血功能等、ECG等;以及是否24 h内行高压氧。因个人信息保护,在数据收集与录入阶段对姓名等个人识别信息进行去识别化处理。
1.5 研究结果及随访数据的收集将是否出现DEACMP作为结局指标。患者出院2月后进行电话随访,评估是否出现DEACMP。
1.6 统计学方法数据分析采用R 4.3.3软件和IBM SPSS Statistics 26.0软件进行。连续变量的正态性检验采用Shapiro-Wilk法,正态分布数据以均数±标准差(x±s)表示,组间差异用成组t检验比较;非正态分布数据以中位数(四分位数)[M(Q1, Q3)]表示,组间差异用Wilcoxon秩和检验分析。计数资料以百分比表示,组间差异采用卡方检验或Fisher确切概率法分析。检验水准α=0.05。
将数据按7∶3比例随机分为训练集和验证集。应用Lasso回归在训练集筛选影响结局的特征因素。根据筛选的因素,采用9种机器学习算法(RF、XGBoost、NeuralNet、LightGBM、GBM、SVM、KNN、Naïve Bayes、Logistic回归)构建预测模型。绘制受试者工作特征曲线(receiver operator characteristic curve, ROC)并计算曲线下面积(area under curve, AUC),同时计算准确率、敏感度、特异度、F1评分等指标,综合评估每种模型的预测能力。绘制校准曲线评价模型准确度,临床决策曲线(decision curve analysis, DCA)评估模型的临床适用性。运用沙普利可加性特征解释方法(shapley additive explanations, SHAP)对模型进行解释和可视化展示。
2 结果 2.1 ACOP患者的基线特征共纳入264例ACOP的患者,其中发生DEACMP的患者有54例(20.5%)。两组在年龄、入住ICU、高血压病史、冠心病史、GCS评分、昏迷时间、白细胞水平、中性粒细胞绝对值、单核细胞绝对值、CRP、PCT、谷丙转氨酶、谷草转氨酶、白蛋白、直接胆红素、肾小球滤过率、肌红蛋白(myoglobin,Myo)、肌酸激酶同工酶MB(CK-MB)等指标差异有统计学意义(P < 0.05)。其他指标如性别、职业、既往糖尿病史、高血脂、脑血管病史、电解质等指标差异均无统计学意义(P > 0.05)(表 1)。
| 项目 | 总例数(n=264) | DEACMP | P值 | |
| 否(n=210) | 是(n=54) | |||
| 年龄(岁) a | 50.5 (32.25, 59) | 48 (31.5, 54) | 55 (33.5, 67.25) | < 0.001 |
| 男性(n, %) | 134(50.8) | 107(51) | 27(50) | 0.511 |
| 入住ICU(n, %) | 78(29.5) | 48(22.9) | 30(55.6) | < 0.001 |
| 职业(n, %) | 0.128 | |||
| 农民 | 109(41.3) | 83(39.5) | 26(48.1) | |
| 工人 | 20(7.6) | 14(6.7) | 6(11.1) | |
| 退休 | 8(3) | 5(2.4) | 3(5.6) | |
| 其他 | 127(48.1) | 108(51.4) | 19(35.2) | |
| 既往史(n, %) | ||||
| 糖尿病 | 25(9.5) | 20(9.5) | 5(9.3) | 1 |
| 高血压 | 55(20.80) | 38(18.1) | 17(31.5) | 0.039 |
| 高血脂 | 21(8) | 18(8.6) | 3(5.6) | 0.583 |
| 脑血管病 | 12(4.5) | 10(4.8) | 2(3.7) | 1 |
| 冠心病 | 16(6.1) | 5(2.4) | 11(20.4) | < 0.001 |
| 慢性肾病 | 1(0.4) | 1(0.5) | 0 | 1 |
| 肿瘤 | 5(1.9) | 5(2.4) | 0 | 0.587 |
| 个人史(n, %) | ||||
| 吸烟 | 41(15.5) | 29(13.8) | 12(22.2) | 0.142 |
| 饮酒 | 35 (13.3) | 25(11.9) | 10(18.5) | 0.259 |
| GCS评分 | 15 (13, 15) | 15 (15, 15) | 8 (6, 10.5) | < 0.001 |
| 昏迷时间(n, %) | < 0.001 | |||
| 无 | 74 (28) | 71(33.8) | 3(5.6) | |
| < 24 h | 141(53.4) | 123(58.6) | 18(33.3) | |
| > 24 h | 49(18.6) | 16(7.6) | 33(61.1) | |
| SBP(mmHg) a | 125 (119, 135) | 124 (120, 133) | 125.5 (105.5, 135.25) | 0.899 |
| DBP(mmHg) a | 78 (70, 84) | 77 (68, 82) | 79.5 (66.75, 85) | 0.554 |
| HR(次/min) a | 80 (76, 89) | 80 (78, 92) | 80 (72.75, 88.25) | 0.702 |
| 白细胞(×109/L) a | 9.59 (6.91, 13.29) | 9.68 (7.09, 12.95) | 12.1 (9.59, 18.67) | 0.002 |
| 红细胞(×1012/L) a | 4.3 (3.99, 4.7) | 4.5 (4, 4.95) | 4.32 (4.01, 4.67) | 0.293 |
| 血小板(×109/L) a | 224 (188, 263) | 222 (193.5, 259.5) | 215.5 (174.25, 251.75) | 0.08 |
| 中性粒绝对值(×109/L) a | 7.48 (4.95, 11.7) | 7.76 (5.07, 10.85) | 10.56 (8.16, 16.65) | 0.003 |
| 淋巴细胞绝对值(×109/L) a | 1.2 (0.87, 1.64) | 1.3 (0.96, 1.75) | 1.1 (0.86, 1.63) | 0.296 |
| 单核细胞绝对值(×109/L) a | 0.42 (0.28, 0.62) | 0.42 (0.26, 0.54) | 0.52 (0.36, 0.93) | 0.001 |
| CRP(mg/L) a | 5.4 (0.88, 36.93) | 2.48 (0.78, 14.03) | 44.29 (13.63, 81.62) | < 0.001 |
| PCT(ng/mL) a | 0.08 (0.036, 0.34) | 0.56 (0.02, 0.25) | 0.34 (0.17, 1.95) | < 0.001 |
| 血钾(mmol/L) a | 3.85 (3.61, 4.16) | 3.85 (3.52, 4.14) | 3.82 (3.67, 4.16) | 0.474 |
| 血钠(mmol/L) a | 140.5 (139, 142) | 140.5 (139.05, 141.85) | 140.7 (138.87, 142.02) | 0.113 |
| 谷丙转氨酶(U/L) a | 21 (12.5, 35.5) | 16 (12, 26.5) | 33.5 (13, 57) | < 0.001 |
| 谷草转氨酶(U/L) a | 23 (17, 43) | 20 (15, 30.5) | 44 (24, 154.25) | < 0.001 |
| 白蛋白(g/L) a | 41.2 (38.6, 43.5) | 42.2 (39.65, 44.85) | 38.15 (36.72, 42.2) | < 0.001 |
| 总胆红素(μmol/L) a | 8.3 (6.2, 12.21) | 8.5 (6.14, 12) | 10.1 (7.2, 14.12) | 0.17 |
| 直接胆红素(μmol/L) a | 3.8 (2.6, 5.1) | 3.8 (2.6, 4.9) | 4.65 (3.85, 6.15) | 0.008 |
| 间接胆红素(μmol/L) a | 4.8 (3.3, 7.1) | 4.7 (3.25, 7.1) | 5.35 (3.12, 8.25) | 0.1 |
| 肌酐(μmol/L) a | 63.5 (51, 78) | 63 (53.5, 76.5) | 64.5 (58.5, 81.75) | 0.077 |
| 肾小球滤过率 a | 105.87 (94.08, 117.86) | 105.75 (98.82, 118.76) | 99.23 (74.99, 111.15) | < 0.001 |
| D二聚体(mg/L) a | 0.19 (0.08, 0.42) | 0.12 (0.07, 0.27) | 0.59 (0.21, 1.22) | < 0.001 |
| Myo(ng/mL) a | 52.97 (26.1, 302.6) | 41.9 (22.11, 137.65) | 344.05 (45.18, 1016.5) | < 0.001 |
| CK-MB(ng/mL) a | 3.55 (1.29, 15.56) | 2.93 (1.22, 7.95) | 17.06 (4.82, 47.64) | < 0.001 |
| ECG异常(n, %) | 98(37.1) | 68(44.4) | 30(66.7) | 0.011 |
| 24 h内行高压氧(n, %) | 122(46.2) | 102(48.6) | 20(37) | 0.168 |
| 注:a为[M(Q1, Q3)] | ||||
将数据按7:3比例随机分为训练集和验证集,两个数据集的DEACMP的发生率、性别、年龄等主要指标差异均无统计学意义(P > 0.05)。应用Lasso回归在训练集筛选影响结局的特征因素,最终纳入8个预测因素:年龄、既往冠心病史、饮酒个人史、舒张压(DBP)、GCS评分、昏迷时间、单核细胞绝对值、CK-MB水平。
2.3 多种机器学习模型的构建与评价应用9种机器学习算法构建预测模型,结果显示,训练集AUC值在0.92~0.99范围波动,验证集AUC值在0.85~0.91范围波动。其中最佳的两个模型是RF和SVM模型,RF模型AUC值训练集为0.99,验证集为0.9;SVM模型的AUC值训练集为0.96,验证集为0.91(见图 1)。在多指标性能评估中,RF和SVM模型同样显示出较好的分类能力。其他模型如XGBoost、Logistic、NeuralNet、LightGBM等模型也表现良好,在AUC、准确率和特异度方面均有较高的值(见表 2)。
|
| 图 1 不同模型在训练集、验证集上的ROC曲线比较 Fig 1 ROC curves of different models on the training set and validation set |
|
|
| 训练集性能指标 | 验证集性能指标 | |||||||||||
| 模型 | AUC | 准确率 | 敏感度 | 特异度 | F1 | 模型 | AUC | 准确率 | 敏感度 | 特异度 | F1 | |
| XGBoost | 0.998 | 0.978 | 0.914 | 0.993 | 0.941 | XGBoost | 0.879 | 0.835 | 0.631 | 0.9 | 0.648 | |
| NeuralNet | 0.991 | 0.967 | 0.885 | 0.986 | 0.911 | NeuralNet | 0.859 | 0.835 | 0.736 | 0.866 | 0.682 | |
| KNN | 0.971 | 0.908 | 0.571 | 0.986 | 0.701 | KNN | 0.867 | 0.86 | 0.526 | 0.966 | 0.645 | |
| NaïveBayes | 0.928 | 0.881 | 0.828 | 0.893 | 0.725 | NaïveBayes | 0.857 | 0.81 | 0.789 | 0.816 | 0.666 | |
| SVM | 0.962 | 0.962 | 0.828 | 0.993 | 0.892 | SVM | 0.909 | 0.822 | 0.578 | 0.9 | 0.611 | |
| RF | 0.996 | 0.972 | 0.885 | 0.993 | 0.925 | RF | 0.9 | 0.835 | 0.631 | 0.9 | 0.648 | |
| LightGBM | 0.998 | 0.972 | 0.914 | 0.986 | 0.927 | LightGBM | 0.87 | 0.835 | 0.631 | 0.9 | 0.648 | |
| GBM | 0.962 | 0.924 | 0.742 | 0.966 | 0.787 | GBM | 0.877 | 0.835 | 0.631 | 0.9 | 0.648 | |
| Logistic | 0.949 | 0.924 | 0.742 | 0.966 | 0.787 | Logistic | 0.882 | 0.835 | 0.684 | 0.883 | 0.666 | |
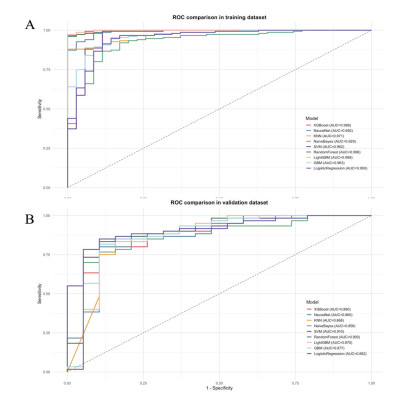
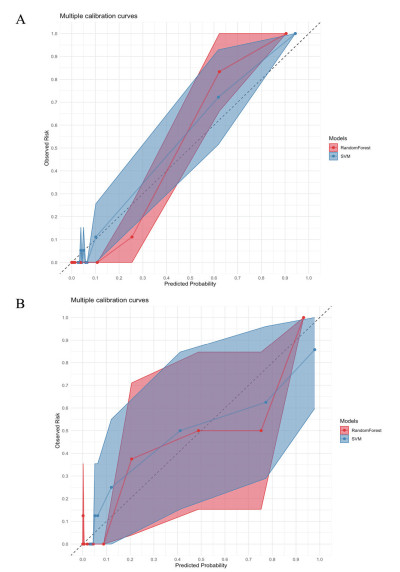
校准曲线显示,RF模型和SVM模型在训练集和验证集表现良好(均Brier分数 < 0.25),RF模型略优于SVM模型(见图 2)。DCA曲线显示,RF和SVM模型临床获益良好,RF模型略优于SVM模型(见图 3)。综合各指标,RF是预测ACOP患者发生DEACMP最优的机器学习模型。
|
| 图 2 RF和SVM模型训练集(A)与验证集(B)的校准曲线 Fig 2 Calibration curves of the training set (A) and validation set (B) for the RF and SVM models |
|
|
|
| 图 3 训练集(A)与验证集(B)的决策曲线分析(DCA) Fig 3 Decision Curve Analysis (DCA) of the training set (A) and the validation set (B) |
|
|
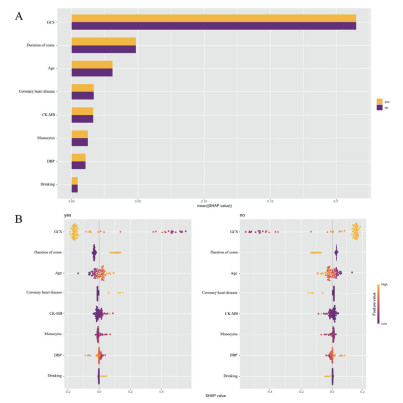
应用SHAP方法对RF预测模型进行可视化和解释,并得到每个特征对结局事件的影响及与结局的关系。如图 4A所示,影响因素的权重由高到低依次是GCS评分、昏迷时间、年龄、既往冠心病史、CK-MB水平、单核细胞水平、DBP、饮酒史(见图 4)。各变量与结局的关系如图 4B所示,以GCS评分为例,随着GCS评分降低,SHAP值逐渐增大,发生DEACMP的可能性越大。在临床工作中,对于单个患者,即可根据此模型得出发生DEACMP的概率。
|
| 图 4 运用SHAP方法对RF模型进行可视化和解释 Fig 4 Visualization and explanation of the RF model using the SHAP method |
|
|
本研究结果表明,基于8个因素构建的机器学习模型中,RF模型预测ACOP发生DEACMP的效能最优。预测因素的权重由高到低依次GCS评分、昏迷时间、年龄、既往冠心病史、CK-MB水平、单核细胞水平、DBP、饮酒史。
DEACMP是ACOP后常见但棘手的神经系统后遗症。尽管针对这一问题开展了许多研究,但预测工具异质性较大,预测指标也是多种多样[13]。既往研究关于DEACMP的预测模型的主要指标包括:年龄,高血压,CO来源,CO暴露时间,COHb水平,GCS评分,休克,脑磁共振异常改变,血清肌酸激酶水平,炎症免疫指标等[10, 18-20]。总体来看,既往研究结果与本研究有相同的指标,但也存在一定的差异,下面笔者逐条进行分析。
本研究结果显示,GCS评分是最重要的预测因素,GCS评分越低,发生DEACMP的可能性越大。既往许多预测模型把较低的GCS评分作为预测指标,但GCS的临界值差异较大。有研究表明GCS评分 < 9分是预测DEACMP的主要决定因素[21-22],而其他研究[20]表明GCS ≤ 13分预测DEACMP发生的准确性高(AUC为0.936)。本研究的模型可根据具体GCS评分得出对结局影响,更加便捷精确。此外,研究显示昏迷时间也是权重较重的影响因素,昏迷时间越长,发生DEACMP的概率越大。昏迷时间与GCS评分均是反应神经功能状态的指标,表明中毒后神经功能受损越重、持续时间越长,发生DEACMP的可能性越大。
本研究显示,高龄是CO中毒患者发生DEACMP的主要预测因素之一,与既往研究一致。随着年龄增长,中枢神经系统出现功能减退、细胞凋亡,脑血管舒缩机能减退,CO中毒后导致脑代谢异常,年龄越大DEACMP发生率越高[19]。
本研究表明血清CK-MB水平升高是DEACMP的危险因素,与此类似,既往有研究表明血清CK水平升高是DEACMP的预测因素[19]。ACOP时,CK-MB升高提示心肌细胞受损,心功能下降,可导致脑灌注不足,加剧大脑受损情况。此外,本研究还显示,冠心病史是预测DEACMP的风险因素,亦有关心脏。冠心病与动脉粥样硬化密切相关,而动脉粥样硬化是多种神经系统疾病的易感因素。对于冠心病患者而言,由于冠状动脉粥样硬化导致冠状动脉狭窄,心脏泵血功能受损,ACOP时可能加剧大脑缺氧的状况,进而增加发生DEACMP的风险。总之,若患者有心脏基础疾病或者在中毒急性期出现心肌损伤,发生DEACMP的概率会大大增加。
CO中毒后12 h内中性粒细胞和单核细胞计数较高,淋巴细胞计数较低,发生DEACMP的可能性更大。其机制可能与免疫炎症反应有关。ACOP时可通过诱导机体产生免疫炎症反应,导致神经变性。而单核细胞在免疫反应和炎症调节中发挥重要作用,但具体的机制还有待进一步研究。其他指标如DBP、饮酒史既往极少有研究报道,本研究也显示这两个指标权重最低,其具体作用和机制还有待进一步研究。
关于COHb,我国专家共识建议可根据COHb水平评估ACOP患者的病情严重程度,但COHb具有较大的局限性以及不稳定性。COHb的半衰期在不同的环境中差异较大,在室内空气中为250 ~ 320 min,在吸入100%氧气时为90 min,在高压氧条件下为30 min[10]。在到达医院前迅速启动的氧疗即有可能使COHb快速恢复到正常水平,因此COHb水平的预测价值存疑。许多研究表明COHb与DEACMP发展之间没有显著关联。然而,也有研究支持COHb水平与预后密切相关[20]。而本研究未纳入COHb,一是考虑到COHb的快速代谢会影响其水平,二是COHb缺失较多。从理论上讲,如果采血及时,COHb应该具有一定的预测价值。但若采血较晚或已经给予氧疗,预测则不一定准确,此时,即使COHb处于正常水平,也不能完全排除其发生DEACMP的风险。因此,临床医师在将COHb作为预测指标时,需综合考虑多方面的因素。
利益冲突 所有作者声明无利益冲突
作者贡献声明 余言午:研究设计、实施研究、分析/解释数据、论文撰写;张岩,袁丁:研究设计、实施研究、论文修改;郝慧慧,杨放,闫弘义,蒋品,郭梦楠:数据收集及整理、统计分析;徐志高,孙昌华,闫改勤,车璐,郭建军,陈继红,李岩:数据收集及整理、支持性贡献;高艳霞:研究设计、论文修改、技术支持、获取研究经费
| [1] | GBD 2021 Carbon Monoxide Poisoning Collaborators. Global, regional, and national mortality due to unintentional carbon monoxide poisoning, 2000-2021:results from the Global Burden of Disease Study 2021[J]. Lancet Public Health, 2023, 8(11): e839-e849. DOI:10.1016/S2468-2667(23)00185-8 |
| [2] | Mattiuzzi C, Lippi G. Worldwide epidemiology of carbon monoxide poisoning[J]. Hum Exp Toxicol, 2020, 39(4): 387-392. DOI:10.1177/0960327119891214 |
| [3] | Oliverio S. Current challenges in carbon monoxide poisoning diagnosis from an analytical perspective[J]. Front Med (Lausanne), 2023, 10: 1304294. DOI:10.3389/fmed.2023.1304294 |
| [4] | Huang CC, Chung MH, Weng SF, et al. Long-term prognosis of patients with carbon monoxide poisoning: a nationwide cohort study[J]. PLoS One, 2014, 9(8): e105503. DOI:10.1371/journal.pone.0105503 |
| [5] | American College of Emergency Physicians Clinical Policies Subcommittee on Thromboembolic Disease:, Wolf SJ, Hahn SA, et al. Clinical policy: critical issues in the evaluation and management of adult patients presenting to the emergency department with suspected acute venous thromboembolic disease[J]. Ann Emerg Med, 2018, 71(5): e59-e109. DOI:10.1016/j.annemergmed.2018.03.006 |
| [6] | Huang CC, Lee JC, Lin KC, et al. Exposure duration and history of hypertension predicted neurological sequelae in patients with carbon monoxide poisoning[J]. Epidemiology, 2019, 30(Suppl 1): S76-S81. DOI:10.1097/EDE.0000000000001000 |
| [7] | Namgung M, Oh J, Ahn C, et al. Association between Glasgow Coma scale in early carbon monoxide poisoning and development of delayed neurological sequelae: a meta-analysis[J]. J Pers Med, 2022, 12(4): 635. DOI:10.3390/jpm12040635 |
| [8] | Zhang LN, Wu D, Xu MY, et al. Acute carbon monoxide poisoning in Shandong, China: an observational study[J]. Chin Med J (Engl), 2022, 135(13): 1539-1544. DOI:10.1097/CM9.0000000000001942 |
| [9] | Wang SH, Han WX, Sun TZ, et al. Development of a nomogram based on diffusion-weighted imaging and clinical information to predict delayed encephalopathy after acute carbon monoxide poisoning[J]. J Integr Neurosci, 2023, 22(6): 165. DOI:10.31083/j.jin2206165 |
| [10] | Hafez AS, El-Sarnagawy GN. S-100β in predicting the need of hyperbaric oxygen in CO-induced delayed neurological sequels[J]. Hum Exp Toxicol, 2020, 39(5): 614-623. DOI:10.1177/0960327119897104 |
| [11] | 刘桓, 刘永建, 肖青勉, 等. 乳酸清除率联合脑电双频指数对一氧化碳中毒迟发性脑病的价值[J]. 中华急诊医学杂志, 2020, 29(4): 556-558. DOI:10.3760/cma.j.issn.1671-0282.2020022.010-1 |
| [12] | Lee H, Kang H, Ko BS, et al. Initial creatine kinase level as predictor for delayed neuropsychiatric sequelae associated with acute carbon monoxide poisoning[J]. Am J Emerg Med, 2021, 43: 195-199. DOI:10.1016/j.ajem.2020.02.054 |
| [13] | Lee H, Oh J, Kang H, et al. Association between early phase serum lactate levels and occurrence of delayed neuropsychiatric sequelae in adult patients with acute carbon monoxide poisoning: a systematic review and meta-analysis[J]. J Pers Med, 2022, 12(4): 651. DOI:10.3390/jpm12040651 |
| [14] | Liao SC, Mao YC, Hung YM, et al. Predictive role of QTc prolongation in carbon monoxide poisoning-related delayed neuropsychiatric sequelae[J]. Biomed Res Int, 2018, 2018: 2543018. DOI:10.1155/2018/2543018 |
| [15] | Kavakiotis I, Tsave O, Salifoglou A, et al. Machine learning and data mining methods in diabetes research[J]. Comput Struct Biotechnol J, 2017, 15: 104-116. DOI:10.1016/j.csbj.2016.12.005 |
| [16] | Xu H, Wang GJ, Zhu LL, et al. Eight immune-related genes predict survival outcomes and immune characteristics in breast cancer[J]. Aging (Albany NY), 2020, 12(16): 16491-16513. DOI:10.18632/aging.103753 |
| [17] | Oikonomou EK, Khera R. Machine learning in precision diabetes care and cardiovascular risk prediction[J]. Cardiovasc Diabetol, 2023, 22(1): 259. DOI:10.1186/s12933-023-01985-3 |
| [18] | 李晨, 王敏, 梁梦琳, 等. 表观扩散系数联合C-反应蛋白对一氧化碳中毒迟发性脑病的相关性分析[J]. 中华急诊医学杂志, 2023, 32(3): 327-331. DOI:10.3760/cma.j.issn.1671-0282.2023.03.009 |
| [19] | Kim SH, Lee Y, Kang S, et al. Derivation and validation of a score for predicting poor neurocognitive outcomes in acute carbon monoxide poisoning[J]. JAMA Netw Open, 2022, 5(5): e2210552. DOI:10.1001/jamanetworkopen.2022.10552 |
| [20] | El-Sarnagawy GN, Elgazzar FM, Ghonem MM. Development of a risk prediction nomogram for delayed neuropsychiatric sequelae in patients with acute carbon monoxide poisoning[J]. Inhal Toxicol, 2024, 36(6): 406-419. DOI:10.1080/08958378.2024.2374394 |
| [21] | Pepe G, Castelli M, Nazerian P, et al. Delayed neuropsychological sequelae after carbon monoxide poisoning: predictive risk factors in the Emergency Department: A retrospective study[J]. Scand J Trauma Resusc Emerg Med, 2011, 19: 16. DOI:10.1186/1757-7241-19-16 |
| [22] | Liao SC, Mao YC, Yang KJ, et al. Targeting optimal time for hyperbaric oxygen therapy following carbon monoxide poisoning for prevention of delayed neuropsychiatric sequelae: a retrospective study[J]. J Neurol Sci, 2019, 396: 187-192. DOI:10.1016/j.jns.2018.11.025 |
 2025, Vol. 34
2025, Vol. 34