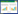2. 中国医学科学院北京协和医院急诊科, 北京 100730
2. Department of Emergency, Peking Union Medical College Hospital of Chinese Academy of Medical Sciences, Beijing 100730, China
脓毒性休克(septic shock)是脓毒症(sepsis)的严重类型,是感染导致的循环衰竭综合征,其早期识别与干预直接影响患者预后。在发病早期,宏观血流动力学指标(如血压)尚未异常时,微循环灌注不足已然发生,因此微循环监测成为早期评估的关键[1-2]。目前临床常用的微循环评估手段各有局限:乳酸(Lac)虽能反映组织缺氧,但受肝肾功能代谢影响,且升高存在时间滞后[2-3];SOFA评分、APACHE Ⅱ评分需整合多系统指标,计算复杂且难以实时动态监测[4-5];正交偏振光谱成像和旁流暗视野成像虽能直观观察微循环血流,但操作繁琐、设备昂贵,难以在急诊广泛应用[6]。因此,寻找一种无创、便捷、可实时监测的微循环评估工具,对脓毒症患者的早期病情评估具有重要意义。
血氧饱和度监测已广泛应用于临床,而基于脉搏血氧技术的脉搏血氧波形(pulse oximetry plethysmographic waveform, POP)及其衍生参数尚未被充分应用。其中,脉搏血氧波形曲线下面积(POPAUC)可实时反映外周循环状态的动态变化[7-8],外周灌注指数(periphery perfusion index, PPI)作为POP搏动与非搏动部分的比值,能体现外周灌注水平[9-10]。与传统评估方法相比,该技术具有无创、连续监测的特点,依托常规脉搏血氧仪即可获取,在急诊场景中更具实用性。
课题组前期研究已证实脉搏血氧技术在心肺复苏质量评估中的价值[11],但其在脓毒症患者病情评估中的应用尚未明确。本研究旨在探索POPAUC和PPI对脓毒症患者预后的评估价值,通过与Lac、APACHEⅡ评分、SOFA评分等传统指标的比较,明确其在早期病情评估中的优势,为临床提供更便捷、高效的微循环监测工具。
1 资料与方法 1.1 研究对象本研究对象为2021年1月至2021年12月就诊于天津医科大学总医院急诊医学科符合脓毒症3.0诊断标准的患者[1]。根据患者病情严重程度分为脓毒症非休克组和脓毒性休克组,根据患者28 d生存情况分为存活组和死亡组。纳入标准:①年龄≥18周岁;②符合脓毒症及脓毒性休克诊断标准。排除标准:①杵状指者;②慢性皮肤病导致指甲变厚者;③甲板增厚变形者;④先天性厚甲;⑤具有影响血氧饱和度监测的微血管疾病,如雷诺征;⑥其他对血氧监测仪器采集光信号所造成干扰的现象。
1.2 研究方法本研究为前瞻性描述性研究无特殊干预措施。中华人民共和国国家临床试验登记管理中心注册号:ChiCTR2000040542。天津医科大学总医院医学伦理委员会伦理批件号:IRB2020-YX-035-01。
1.2.1 数据采集采集患者基本信息资料,并动态记录和计算患者在入院治疗后第0小时、第24小时、第48小时、第72小时、第96小时的POPAUC、PPI、Lac;并收集PaO2/FiO2、血小板计数、血清胆红素浓度、平均动脉压、治疗过程中血管活性药物的使用情况、GCS评分、血清肌酐值、24 h尿量,计算SOFA评分;收集体温、平均动脉压、心率、呼吸频率、PaO2、血气pH、Na+、K+、Cr、红细胞比容、白细胞计数、GCS评分、年龄、既往器官功能不全或免疫抑制病史,计算APACHE Ⅱ评分。
1.2.2 样本量估算样本量估算基于主要结局指标POPAUC和PPI的组间差异分析。参考前期同类研究中脓毒性休克患者与非休克患者的PPI差异(效应量d=1.2,大效应量)[12],采用GPower 3.1软件进行计算。设定统计参数:α值= 0.05(双侧),β值= 0.2(把握度1-β=80%),预期效应量d=1.2。计算结果显示,每组所需最小样本量为22例,以满足两组间POPAUC、PPI差异的统计学检验效能。
1.3 统计学方法所得数据均录入计算机,采用SPSS 26.0、MedCal软件包进行数据处理。定量资料进行正态性检验(K-S法)。符合正态分布的计量资料以均数±标准差(x±s)表示,非正态分布的资料用中位数、25分位数、75分位数表示。正态分布的计量资料采用独立样本t检验(其中方差不齐者采用t' 检验)或方差分析(F);非正态分布计量资料采用秩和检验(Z);定性资料采用χ2检验。以P<0.05为差异有统计学意义。针对28 d存活者绘制受试者工作特征曲线(receiver operating characteristic curve, ROC曲线),计算ROC曲线下面积,并通过计算约登指数(Youden's index =灵敏度+ 特异度-1) 寻找最佳截断点,比较各指标对判断患者预后的ROC曲线下面积,并计算其阳性和阴性预测值。
2 结果 2.1 一般资料入组的68例患者中,脓毒症非休克组42例(其中死亡1例),脓毒性休克组26例(其中死亡14例),其性别、基础疾病、感染部位两组间差异无统计学意义,年龄在两组间差异有统计学意义(表 1)。存活组53例,死亡组15例,其性别、年龄、基础疾病、感染部位两组间差异无统计学意义(表 2)。
| 指标 | 病例分组 | χ2/t/t'/Z值 | P值 | |
| 脓毒症非休克组n=(42) | 脓毒性休克组n=(26) | |||
| 基本情况 | ||||
| 男性(n,%) | 20(64.5) | 11(35.5) | 0.652 | 0.419 |
| 女性(n,%) | 22(59.5) | 15(40.5) | ||
| 年龄(岁) | 68(57, 75) | 70(63, 76) | -2.677 | 0.007a |
| 基础疾病(n,%) | ||||
| 糖尿病 | 14(58.3) | 10(41.7) | 0.185 | 0.667 |
| 高血压 | 14(60.9) | 9(39.1) | 0.012 | 0.914 |
| 冠心病 | 14(56) | 11(44) | 0.556 | 0.456 |
| 慢性肾脏病 | 5(83.3) | 1(16.6) | 1.296 | 0.255 |
| 慢性肺疾病 | 2(50) | 2(50) | 0.249 | 0.218 |
| 感染部位(n,%) | ||||
| 肺 | 22(57.9) | 16(42.1) | 0.546 | 0.460 |
| 泌尿道 | 13(83.3) | 6(31.6) | 0.495 | 0.480 |
| 软组织 | 3(60) | 2(40) | 1.000 | 0.639 |
| 颅内 | 2(66.7) | 1(33.3) | 1.000 | 0.676 |
| 2个及以上 | 14(66.7) | 7(33.3) | 0.309 | 0.578 |
| 注:aP < 0.05 | ||||
| 指标 | 病例分组 | χ2/t/t'/Z值 | P值 | |
| 存活组n=(53) | 死亡组n=(15) | |||
| 基本情况 | ||||
| 男性(n,%) | 23(74.2) | 8(25.8) | 0.465 | 0.495 |
| 女性(n,%) | 30(81.1) | 7(18.9) | ||
| 年龄(岁) | 68(63, 72) | 74(46, 79) | -0.963 | 0.336 |
| 基础疾病(n,%) | ||||
| 糖尿病 | 20(83.3) | 4(16.7) | 0.627 | 0.428 |
| 高血压 | 19(82.6) | 4(17.4) | 0.440 | 0.507 |
| 冠心病 | 19(73.1) | 7(26.9) | 0.579 | 0.447 |
| 慢性肾脏病 | 5(83.3) | 1(16.7) | 1.000 | 0.603 |
| 慢性肺疾病 | 4(100) | 0 | 0.569 | 0.360 |
| 感染部位(n,%) | ||||
| 肺 | 29(76.3) | 9(23.7) | 0.132 | 0.716 |
| 泌尿道 | 15(78.9) | 4(21.1) | 1.000 | 0.590 |
| 软组织 | 4(80.0) | 1(20.0) | 1.000 | 0.697 |
| 颅内 | 2(66.7) | 1(33.3) | 0.533 | 0.533 |
| 2个及以上 | 17(80.9) | 4(19.1) | 0.763 | 0.476 |
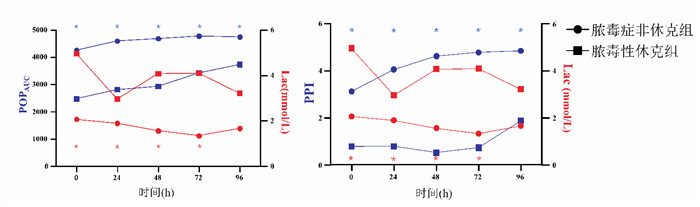
POPAUC、PPI、Lac(除96 h)、APACHE Ⅱ、SOFA在两组间差异有统计学意义(P<0.05),见表 3,图 1。
| 临床参数 | 病例分组 | χ2/t/t'值 | P值 | |
| 脓毒症非休克组 | 脓毒性休克组 | |||
| POPAUC | ||||
| 0 h | 4 260.3±1 028.5 | 2 475.1±899.0 | 7.289 | <0.001a |
| 24 h | 4 596.9±1 025.4 | 2 804.0±828.6 | 6.822 | <0.001a |
| 48 h | 4 681.2±1 023.8 | 2 925.3±987.8 | 6.150 | <0.001a |
| 72 h | 4 774.1±979.1 | 3 418.2±1 238.9 | 4.177 | <0.001a |
| 96 h | 4 742.5±1 106.0 | 3 733.1±1 566.6 | 2.521 | 0.015a |
| PPI | ||||
| 0 h | 3.13±2.18 | 0.78±0.74 | 6.383 | <0.001a |
| 24 h | 4.06±3.50 | 0.79±0.67 | 5.857 | <0.001a |
| 48 h | 4.62±3.91 | 0.52±0.37 | 6.735 | <0.001a |
| 72 h | 4.78±3.66 | 0.73±0.71 | 6.741 | <0.001a |
| 96 h | 4.84±3.82 | 1.88±1.69 | 2.595 | 0.012a |
| Lac(mmol/L) | ||||
| 0 h | 2.07±1.55 | 4.95±4.32 | -3.092 | 0.005a |
| 24 h | 1.89±1.17 | 2.96±2.33 | -2.086 | 0.043a |
| 48 h | 1.56±1.04 | 4.07±2.89 | -3.438 | 0.003a |
| 72 h | 1.34±0.73 | 4.09±3.72 | -2.835 | 0.013a |
| 96 h | 1.66±1.19 | 3.21±3.43 | -1.454 | 0.174 |
| APACHE Ⅱ(分) | ||||
| 1 d | 11.82±4.89 | 16.78±5.59 | -3.658 | 0.001a |
| SOFA(分) | ||||
| 1 d | 5.06±2.60 | 8.89±3.25 | -4.702 | <0.001a |
| 注:POPAUC: 脉搏血氧波形曲线下面积; PPI: 外周灌注指数; Lac: 乳酸; APACHE Ⅱ: 急性生理学与慢性健康状况评分; SOFA: 序贯器官衰竭评分; aP<0.05 | ||||
|
| POPAUC: 脉搏血氧波形曲线下面积; PPI: 外周灌注指数; Lac: 乳酸 图 1 脓毒症非休克组与脓毒性休克组不同时间点POPAUC、PPI变化及与Lac比较 Fig 1 Changes in POPAUC and PPI at different time points and comparison with Lac between the sepsis non-shock group and the septic shock group |
|
|
将POPAUC、PI与Lac、APACHE Ⅱ评分、SOFA评分分别进行相关性分析,得出该5项参数间具有相关关系(P<0.05),其中除了POPAUC与APACHE Ⅱ评分、PPI与APACHE Ⅱ评分,余参数间相关关系较显著(P<0.01)。
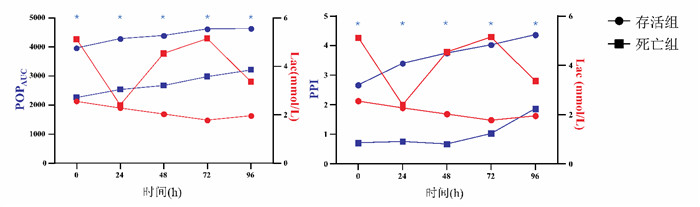
2.4 存活组与死亡组组间临床参数变化比较POPAUC、PPI(0 h、24 h、48 h))、APACHE Ⅱ、SOFA在两组间差异有统计学意义(P<0.05),见表 4,图 2。
| 临床参数 | 病例分组 | χ2/t/t'值 | P值 | |
| 存活组 | 死亡组 | |||
| POPAUC | ||||
| 0 h | 3 950.7±1 150.5 | 2 259.8±944.7 | 5.208 | <0.001a |
| 24 h | 4 271.3±1 160.4 | 2 530.4±892.2 | 4.280 | <0.001a |
| 48 h | 4 382.2±1 136.8 | 2 674.2±1 324.5 | 3.873 | <0.001a |
| 72 h | 4 606.8±1 047.5 | 2 976.6±1 456.6 | 3.450 | 0.001a |
| 96 h | 4 621.0±1 212.6 | 3 202.2±1 565.4 | 2.207 | 0.032a |
| PPI | ||||
| 0 h | 2.66±2.18 | 0.71±0.71 | 5.556 | <0.001a |
| 24 h | 3.39±3.38 | 0.75±0.74 | 5.128 | <0.001a |
| 48 h | 3.74±3.85 | 0.67±1.29 | 4.582 | <0.001a |
| 72 h | 4.02±3.68 | 1.02±1.64 | 1.962 | 0.055 |
| 96 h | 4.36±3.71 | 1.86±2.02 | 1.321 | 0.193 |
| Lac(mmol/L) | ||||
| 0 h | 2.55±2.04 | 5.11±5.21 | -1.802 | 0.093 |
| 24 h | 2.27±1.82 | 2.39±1.63 | -0.184 | 0.855 |
| 48 h | 2.02±1.67 | 4.53±3.30 | -2.214 | 0.054 |
| 72 h | 1.77±1.79 | 5.14±4.24 | -2.066 | 0.081 |
| 96 h | 1.95±2.18 | 3.36±2.32 | -1.330 | 0.193 |
| APACHEⅡ(分) | ||||
| 1 d | 12.57±5.30 | 17.07±5.57 | -2.826 | 0.006a |
| SOFA(分) | ||||
| 1 d | 5.71±3.12 | 8.92±3.15 | -3.131 | 0.003a |
| 注:POPAUC: 脉搏血氧波形曲线下面积; PPI: 外周灌注指数; Lac: 乳酸; APACHE Ⅱ: 急性生理学与慢性健康状况评分; SOFA: 序贯器官衰竭评分; aP<0.05 | ||||
|
| 注:POPAUC: 脉搏血氧波形曲线下面积; PPI: 外周灌注指数; Lac: 乳酸 图 2 存活组与死亡组不同时间点POPAUC、PPI变化及与Lac比较 Fig 2 Changes in POPAUC and PPI at different time points and comparison with Lac between the survival group and the death group |
|
|
将不同时间POPAUC、PPI、Lac和SOFA、APACHⅡ对于预后差异有统计学意义的参数针对脓毒症患者预后绘制ROC曲线,计算AUC,并寻找最佳截断点,计算其灵敏度、特异度、阳性预测值和阴性预测值(表 5),经相同时间点各参数间两两比较,24 h POPAUC和PPI与Lac ROC曲线下面积间差异有统计学意义(z=2.690, P=0.007和z=2.316, P=0.020),余ROC曲线下面积间差异无统计学意义(P>0.05)。
| 参数 | 最佳截断点 | AUC | 敏感度 | 特异度 | 阳性预测值 | 阴性预测值 |
| POPAUC | ||||||
| 0 h | 2741.43 | 0.863 | 0.733 | 0.868 | 0.847 | 0.765 |
| 24 h | 3257.09 | 0.890 | 0.889 | 0.849 | 0.855 | 0.884 |
| 48 h | 3741.82 | 0.832 | 0.875 | 0.654 | 0.717 | 0.840 |
| 72 h | 4012.14 | 0.823 | 0.833 | 0.714 | 0.744 | 0.810 |
| 96 h | 3851.37 | 0.770 | 0.750 | 0.975 | 0.754 | 0.800 |
| PPI | ||||||
| 0 h | 0.97 | 0.817 | 0.800 | 0.698 | 0.726 | 0.777 |
| 24 h | 0.81 | 0.855 | 0.727 | 0.811 | 0.794 | 0.748 |
| 48 h | 0.36 | 0.896 | 0.800 | 0.962 | 0.955 | 0.828 |
| 72 h | 1.02 | 0.828 | 0.833 | 0.760 | 0.776 | 0.820 |
| 96 h | 2.80 | 0.770 | 0.750 | 0.694 | 0.710 | 0.735 |
| Lac | ||||||
| 0 h | 2.05 | 0.757 | 0.857 | 0.640 | 0.704 | 0.817 |
| 24 h | 1.75 | 0.576a | 0.700 | 0.541 | 0.604 | 0.643 |
| 48 h | 1.95 | 0.844 | 0.889 | 0.686 | 0.739 | 0.861 |
| 72 h | 3.00 | 0.714 | 0.882 | 0.858 | 0.858 | 0.755 |
| 96 h | 3.15 | 0.747 | 0.600 | 0.867 | 0.818 | 0.684 |
| APACHⅡ | ||||||
| <24 h | 12.5 | 0.734 | 0.867 | 0.532 | 0.649 | 0.800 |
| SOFA | ||||||
| <24 h | 5.5 | 0.765 | 0.917 | 0.561 | 0.676 | 0.871 |
| 注:POPAUC: 脉搏血氧波形曲线下面积; PPI: 外周灌注指数; Lac: 乳酸; APACHE Ⅱ: 急性生理学与慢性健康状况评分; SOFA: 序贯器官衰竭评分;受试者工作曲线下面积与相同时间点其他参数间差异有统计学意义(aP<0.05) | ||||||
脓毒性休克在临床上多以组织灌注改变引起的皮肤低灌注、精神改变、尿量减少和乳酸水平升高为常见表现,失代偿期休克可表现为低血压。脓毒性休克早期,中心动脉与外周动脉血流动力学出现不一致变化,微循环灌注不足,阻碍组织灌注和氧合[2, 6]。对于脓毒性休克的复苏,在宏观血流动力学指标获得改善的同时,进一步提高局部微循环血流灌注十分重要,可以使大循环和微循环相匹配,达到“血流动力学一致性”[13]。因此,微循环监测对于脓毒性休克患者病情评估十分重要。
乳酸作为组织细胞在无氧环境中代谢产生的重要产物之一,是对组织器官灌注不足和氧代谢异常的重要敏感指标。研究表明,当脓毒症患者初始血Lac升高时,死亡风险会大大增加[14],当血Lac水平>4 mmol/L时,脓毒性休克病死率将会达到80%[15-16]。然而从组织器官低灌注到血Lac水平的升高需要一定时间,且血Lac受肝脏、肾脏等器官代谢因素的影响,需要每1~2 h测量一次Lac浓度。在脓毒性休克患者中,往往存在肝功能异常,从而降低Lac清除能力,导致血Lac水平升高[3]。
本研究结果表明,Lac在脓毒性休克组明显高于与非休克组;Lac早期对患者死亡评估的截断点为2.05,其阳性预测值0.704,阴性预测值0.817。
脉搏血氧波形参数可以反映容量状态和外周循环状态改变,在失血性休克犬模型中证实脉搏血氧波形参数在失血相表现出“头部-体部失偶联现象”,即外周血管失偶联,可能作为休克早期的预警[19]。CQI基于脉搏血氧技术,目前应用于心肺复苏质量监测[11],反应外周组织灌注。PPI同样基于脉搏血氧技术,是POP搏动部分与非搏动部分的比值,其数值范围在0~10,预测外周灌注不足的阈值为1.4。
本研究发现,POPAUC和PPI在脓毒性休克组显著降低,且早期(0 h)差异较显著,死亡组的两项指标亦持续低于存活组,提示其变化与脓毒性休克的微循环障碍进程密切相关。从病理生理学角度看,这种变化源于脓毒性休克时“外周血管失偶联”的核心机制[6, 13]。脓毒性休克早期,感染引发的炎症风暴激活交感神经系统和肾素-血管紧张素-醛固酮系统,导致外周血管强烈收缩,这是机体为维持心脑等重要器官灌注的代偿性反应。此时,宏观血流动力学指标(如血压)可能仍在正常范围,但外周血管(如皮肤、指端)的阻力已显著增加,导致微循环血流速度减慢、灌注量减少。POP的形成依赖于外周血管内血流的搏动性变化:当外周灌注不足时,血管搏动幅度降低,波形峰值变平、上升支变缓,直接导致POPAUC减小;而PPI作为搏动血流与静息血流的比值,在外周血管收缩时,搏动成分占比下降,故数值降低。这符合本研究中POPAUC和PPI的早期差异(0 h)最为显著,其体现了休克早期“微循环障碍”的特征。
本研究发现,在入院后24 h,POPAUC和PPI相较于Lac在预后评估中具有优势。Lac变化存在一定时间滞后,考虑在治疗24 h后组织灌注的改善可能无法立即体现在Lac的下降上,导致其在该时间点评估预后的能力相对减弱。POPAUC和PPI作为基于脉搏血氧技术的指标,能够实时动态反映外周微循环灌注的变化,对预后评估的曲线下面积与Lac相比呈现出优势。这说明POPAUC和PPI能更好地反映患者早期治疗反应,为临床判断预后提供更及时的参考。
随着休克进展,若炎症反应持续加剧,会导致血管内皮损伤、毛细血管通透性增加,甚至出现微循环血栓形成[2]。此时外周血管从收缩代偿进入舒张失调节状态,血管对缩血管物质的反应性降低,有效循环血量进一步减少,POPAUC和PPI持续处于低水平。而死亡组两项指标始终低于存活组,可能与严重微循环衰竭导致的不可逆组织缺氧相关。这种动态变化与本研究中POPAUC、PPI早期评估价值更优的结果一致,体现其作为微循环监测指标的病理生理学基础。
本研究发现POPAUC、PPI与Lac、APACHEⅡ评分、SOFA评分呈显著相关性,进一步支持其体现“组织灌注-氧代谢”的病理生理学通路。乳酸升高是组织缺氧的代谢终产物,APACHEⅡ评分、SOFA评分反映器官功能障碍的累积效应,而POPAUC、PPI则是微循环灌注的直接动态指标,前者更侧重“结果”,后者更聚焦“过程”[5]。POPAUC、PPI的阳性预测值更高的研究结果符合这种关联,其能更早捕捉到微循环的细微变化,为早期干预提供依据。
本研究存在不足之处,脓毒性休克多于入院时已诊断,未能获取脓毒性休克超早期临床参数。这也是本研究后续要继续研究的方向。
综上所述,基于脉搏血氧技术的POPAUC和PPI在脓毒症患者病情严重程度评估和预后评价方面均非劣效于乳酸、SOFA评分及APACHE Ⅱ评分。其评估价值在病情早期更优,其无创、便捷、有效、可连续监测的特点,有望广泛应用于临床。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 李晨:研究设计、论文撰写;董宇新、王悠然:数据收集及整理;牛亚莉:统计学分析;柴艳芬、徐军:研究设计、论文修改;于学忠、寿松涛:论文修改
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Yajnik V, Maarouf R. Sepsis and the microcirculation: the impact on outcomes[J]. Curr Opin Anaesthesiol, 2022, 35(2): 230-235. DOI:10.1097/aco.0000000000001098 |
| [3] | 许瑞涛, 李双凤, 黄淑雅, 等. 乳酸清除率联合多配体聚糖-1对脓毒性休克并急性呼吸窘迫综合征预后的预测价值[J]. 中华急诊医学杂志, 2023, 32(5): 660-666. DOI:10.3760/cma.j.issn.1671-0282.2023.05.017 |
| [4] | Phillip Dellinger R, Bagshaw SM, Antonelli M, et al. Effect of targeted polymyxin B hemoperfusion on 28-day mortality in patients with septic shock and elevated endotoxin level: the EUPHRATES randomized clinical trial[J]. JAMA, 2018, 320(14): 1455-1463. DOI:10.1001/jama.2018.14618 |
| [5] | Qiu X, Lei YP, Zhou RX. SIRS, SOFA, qSOFA, and NEWS in the diagnosis of sepsis and prediction of adverse outcomes: a systematic review and meta-analysis[J]. Expert Rev Anti Infect Ther, 2023, 21(8): 891-900. DOI:10.1080/14787210.2023.2237192 |
| [6] | 李晨, 董宇新, 柴艳芬, 等. 脓毒性休克患者微循环监测研究进展[J]. 中华急诊医学杂志, 2023, 32(4): 565-569. DOI:10.3760/cma.j.issn.1671-0282.2023.04.022 |
| [7] | 李晨, 徐军, 付阳阳, 等. 高级气道建立对心肺复苏质量指数评估心肺复苏预后的影响[J]. 中华急诊医学杂志, 2020, 29(2): 257-261. DOI:10.3760/cma.j.issn.1671-0282.2020.02.0028 |
| [8] | Kouz K, Thiele R, Michard F, et al. Haemodynamic monitoring during noncardiac surgery: past, present, and future[J]. J Clin Monit Comput, 2024, 38(3): 565-580. DOI:10.1007/s10877-024-01161-2 |
| [9] | 徐欣欣, 白静, 冯凯, 等. 脉搏灌注指数监测评估脓毒症及脓毒性休克患者血流动力学的研究进展[J]. 中华急诊医学杂志, 2022, 31(11): 1571-1574. DOI:10.3760/cma.j.issn.1671-0282.2022.11.030 |
| [10] | 刘倩, 王啸, 袁会敏, 等. 外周灌注指数联合中心静脉-动脉二氧化碳分压差/动脉-中心静脉氧含量差对脓毒性休克患者预后的预测价值[J]. 中华急诊医学杂志, 2022, 31(4): 508-513. DOI:10.3760/cma.j.issn.1671-0282.2022.04.014 |
| [11] | Xu J, Li C, Tang HQ, et al. Pulse oximetry waveform: a non-invasive physiological predictor for the return of spontaneous circulation in cardiac arrest patients: : a multicenter, prospective observational study[J]. Resuscitation, 2021, 169: 189-197. DOI:10.1016/j.resuscitation.2021.09.032 |
| [12] | Wang C, Wang XT, Zhang HM, et al. Effect of norepinephrine on peripheral perfusion index and its association with the prognosis of patients with sepsis[J]. J Intensive Care Med, 2024, 39(1): 21-27. DOI:10.1177/08850666231187333 |
| [13] | Bakker J, Ince C. Monitoring coherence between the macro and microcirculation in septic shock[J]. Curr Opin Crit Care, 2020, 26(3): 267-272. DOI:10.1097/MCC.0000000000000729 |
| [14] | Zhao JJ, Zhang Y, Wang JY, et al. Correlation analyses between serum interleukin-7, interleukin-15 and lactate provide insights into their potential roles in the regulation of inflammation in elderly septic patients[J]. Biomark Insights, 2024, 19: 11772719241275525. DOI:10.1177/11772719241275525 |
| [15] | Biyikli E, Kayipmaz AE, Kavalci C. Effect of platelet-lymphocyte ratio and lactate levels obtained on mortality with sepsis and septic shock[J]. Am J Emerg Med, 2018, 36(4): 647-650. DOI:10.1016/j.ajem.2017.12.010 |
| [16] | Liu ZQ, Meng ZB, Li YF, et al. Prognostic accuracy of the serum lactate level, the SOFA score and the qSOFA score for mortality among adults with sepsis[J]. Scand J Trauma Resusc Emerg Med, 2019, 27(1): 51. DOI:10.1186/s13049-019-0609-3 |
 2025, Vol. 34
2025, Vol. 34