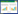2. 苏州大学附属第二医院急重症医学科,苏州 215004
2. Department of Emergency and Critical Care Medicine, The Second Affiliated Hospital of Soochow University, Suzhou 215004, China
脓毒症(sepsis)是机体对感染反应失调导致危及生命的器官功能障碍综合征,具备极高的发病率和病死率 [1-2],脓毒症早期呈现大量分解代谢状态,步入恢复期后逐步转为合成代谢,病程中极易出现代谢需求与供给的失衡,导致营养不良,并发症发生率、病死率显著提高,并严重影响患者远期临床预后 [3-5],普遍存在出院后生活质量下降[6]。
目前临床常用营养风险筛查工具,如危重症营养风险评分(nutrition risk in the critically ill, NUTRIC)、改良危重症营养风险评分(modified nutrition risk in the critically ill, mNUTRIC)等 [6],仅能识别营养风险,无法有效评估营养状况。而传统的营养评估方法,如(body mass index, BMI)、上臂肌围和皮褶厚度、实验室指标如血红蛋白、白蛋白等,受重症特殊疾病状态和治疗干预影响较大,难以有效评估患者的营养状态[3]。
全球营养不良倡议标准(global leadership intitative on malnutrition, GLIM)的提出为重症患者的营养评估提供了科学依据,有助于准确识别重症患者营养不良[7],GLIM标准建议使用[8]计算机断层扫描、生物电阻抗分析法、磁共振成像、双能X射线吸收法和肌肉超声来进行肌肉质量评估,而相较于其他方法,肌肉超声因其安全性、方便性、低成本效益,更适用于ICU患者。
基于此,本研究选取最能反应全身营养状况的骨骼肌——股直肌[9]作为观察对象,采用超声技术对股直肌的横截面积和厚度进行评估,分析股直肌的变化与脓毒症患者出院时营养状况和远期功能预后之间的相关性,进而探讨股直肌肌肉超声在评估脓毒症患者的营养状况中的作用。
1 资料与方法 1.1 研究设计和患者选择本观察性研究,选择2023年10月至2024年10月入住苏州大学附属第二医院重症医学科的脓毒症患者。本研究经苏州大学第二附属医院机构审查委员会批准(JD-LK2024099-I01)。患者在入院时获得了对患者亲属的知情同意,并签署相应知情同意书。纳入标准如下:(1)年龄≥18周岁;(2)符合Sepsis3.0诊断标准[10];(3)预计入住ICU时间≥ 72 h;(4)获得患者本人或家属(授权委托人)知情同意书。排除标准如下:(1)妊娠患者;(2)癌症恶病质;(3)有长期服用类固醇激素史[11];(4)存在神经肌肉疾病(如多发性神经病、运动神经元病、长期瘫痪、肌病等)。
1.2 数据收集 1.2.1 人口学特征性别、年龄、体重指数(BMI)、既往史(脑血管疾病、冠状动脉粥样硬化性心脏病、慢性肾病、肿瘤病、血液系统疾病、免疫系统疾病、高血压、糖尿病)、入ICU后住院时间(d)=出ICU时间- 入ICU时间。[注:BMI=体重(kg)/身高2(m2)]。
1.2.2 临床资料 1.2.2.1 感染部位和病原学(1)根据影像学/临床表现等,临床最终确定/可疑的感染部位,如中枢神经系统、呼吸系统、消化系统、泌尿系统、血流感染、软组织等;(2)通过在可疑/确诊感染部位采取标本进行病原微生物检查来明确病原体,如革兰阴性菌、革兰阳性菌、真菌感染、病毒感染等。
1.2.2.2 实验室检查指标收集患者诊断脓毒症后1、3、5、7 d的血常规、生化全套等相关实验室检验结果,包括白细胞计数(white blood cell count, WBC)、淋巴细胞计数(lymphocyte Count, LYC)、血红蛋白(hemoglobin, HGB)、血小板计数(platelet Count, PLT)、超敏C反应蛋白(hypersensitive C-reactive protein, hs-CRP)、降钙素原(procalcitonin)、乳酸(lactic acid, Lac)、总胆固醇(total cholesterol, TC)、甘油三酯(Triglyceride, TG)。营养相关参数:白蛋白(albumin, ALB)、前白蛋白(prealbumin, PA)、尿素(urea)、肌酐(creatinine, CRE)。
1.2.2.3 超声测量参数及方法(1)测量参数:收集患者入组后1、3、5、7 d股直肌厚度及横截面积。测量方法由2名具有5年的超声检查经验的超声科医师带领一名接受床旁超声培训的ICU医师进行股直肌测量,主要测量参数为股直肌厚度(Thickness of rectus femoris muscle, RF-MLT)与股直肌横截面积(rectus femoris cross sectional area, RF-CSA)[12]:受试者接受超声检查时均取平卧位,床头抬高0°,下肢放松,双膝伸直且放松,脚趾伸直指向天花板,在髂前上棘和髌骨上缘连线的中点测量股直肌厚度,确保探头给予最小压力,探头长轴与大腿长轴保持垂直,横向扫描,扫描深度设置为可以识别股骨方向的位置,获得最佳股骨回声以保证探头垂直于目标肌肉,采集图像,股直肌厚度则取呈高回声的筋膜间的内部垂直距离,重复测量3次,直到3次测量差别在10%以内,并计算这3次测量值的平均值;在髂前上棘和髌骨上缘连线的中下三分之一处测量股直肌横截面积,方法同上,利用超声软件勾画筋膜内回声线并自动计算面积,重复测量3次,直到3次测量差别在10%以内,并计算这三次测量值的平均值,见图 1。
|
| 注:图A为超声显影的股直肌厚度及测量区域,图B为超声显影的股直肌横截面积及测量区域 图 1 超声测量区域示意图 Fig 1 Schematic diagram of the ultrasound measurement area |
|
|
(2)计算获得的参数:股直肌厚度变异率(ΔRF-MLT)(以患者诊断脓毒症后第1天测量的股直肌厚度作为该患者的基线水平,按公式第N天股直肌厚度变异率=(第1天股直肌厚度-第N天股直肌厚度)/第1天股直肌厚度),分别计算出第3、5、7天股直肌厚度的变异率,并记录为D3、5、7厚度变异率(D3ΔRF-MLT、D5ΔRF-MLT、D7ΔRF-MLT)。股直肌横截面积变异率(ΔRF-CSA)(以患者诊断脓毒症后第1天测量的股直肌横截面积作为该患者的基线水平,按公式股直肌横截面积第N天变异率=(股直肌第1天横截面积-第N天股直肌横截面积)/第1天股直肌横截面积),分别计算出第3、5、7天股直肌横截面积的变异率,并记录为D3、5、7面积变异率(D3ΔRF-CSA、D5ΔRF-CSA、D7ΔRF-CSA)。
(3)测量设备:本研究采用床旁便携式彩超机床旁超声仪(索诺声,产品型号:M-Turbo,探头频率:13~6 MHz,生产公司:索诺声公司,产地:美国华盛顿州西雅图市,国家:美国。)
1.2.2.4 营养状况评分根据GLIM共识诊断标准表对患者出院时行营养状况评估,分为无营养不良组、营养不良组。功能预后评分:在患者诊断脓毒症后第1天及治疗第28天,分别对患者进行肌肉减少萎缩症评估表(sarcopenia-five, SARC-F)[13]、简易体能状况量表(short physical performance battery, SPPB)[14]、徒手肌力评定法(manual muscle test, MMT)[15]评分,根据相应分值确定患者是否为肌肉萎缩、肌力状况、活动能力情况,根据前后两次评分是否存在差异,记录为功能未受影响组、功能受影响组。
1.3 统计学方法数据分析采用R 4.4.1、SPSS 27.0、GraphPad Prism 8和Origin 24软件进行。计数资料以频数和百分比表示,组间比较使用Pearson χ2检验。计量资料通过Shapiro-Wilk检验评估正态性,正态分布资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验;非正态分布资料以中位数(四分位数)表示,组间比较采用Mann-Whitney U检验。通过ROC曲线评估参数的预测能力,计算曲线下面积(AUC),AUC > 0.5表示具有预测意义,约登指数确定最佳截断值。以P < 0.05为差异有统计学意义。
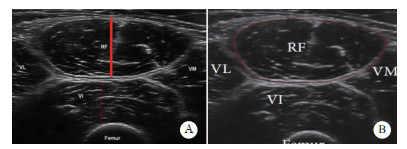
2 结果 2.1 一般资料分析本研究共纳入苏州大学附属第二医院重症医学科符合标准的脓毒症患者71例,根据患者出院时的营养状况,分为无营养不良37例,营养不良34例,两组间年龄、BMI、APACHE-Ⅱ评分、既往史(脑血管疾病、恶性肿瘤、糖尿病)、病原体(真菌)间差异有统计学意义;在入院当天常规营养实验指标,如白蛋白、前白蛋白等,两组间差异无统计学意义。见表 1,图 2。
| 参数 | 无营养不良组(n = 37) | 营养不良组(n = 34) | Z/t/χ2值 | P值 |
| 人口学特征(IQR) | ||||
| 性别(n,%) | χ2 = 0.37 | 0.542 | ||
| 女 | 19 (51.35) | 15 (44.12) | ||
| 男 | 18 (48.65) | 19 (55.88) | ||
| 年龄(岁) | 69.00 (56.00, 76.00) | 77.00 (71.00, 82.00) | Z = -3.08 | 0.002 |
| BMIb(kg/m2) | 24.22 (22.58, 26.47) | 20.08 (18.51, 21.88) | Z = -5.89 | < .001 |
| 既往史(n,%) | ||||
| 脑血管病 | 4 (10.81) | 12 (35.29) | χ2 = 6.08 | 0.014 |
| 冠状动脉粥样硬化性心脏病 | 4 (10.81) | 1 (2.94) | χ2 = 0.69 | 0.406 |
| 慢性肾脏病 | 2 (5.41) | 6 (17.65) | χ2 = 1.57 | 0.210 |
| 恶性肿瘤 | 2 (5.41) | 9 (26.47) | χ2 = 6.01 | 0.014 |
| 血液系统疾病 | 1 (2.70) | 0 (0.00) | - | 1.000 |
| 免疫系统疾病 | 1 (2.70) | 1 (2.94) | - | 1.000 |
| 高血压 | 18 (48.65) | 21 (61.76) | χ2 = 1.23 | 0.267 |
| 糖尿病 | 6 (16.22) | 13 (38.24) | χ2 = 4.38 | 0.036 |
| 感染部位(n,%) | ||||
| 呼吸系统 | 12 (32.43) | 15 (44.12) | χ2 = 1.03 | 0.311 |
| 消化系统 | 12 (32.43) | 11 (32.35) | χ2 = 0.00 | 0.994 |
| 泌尿系统) | 8 (21.62) | 6 (17.65) | χ2 = 0.18 | 0.674 |
| 软组织 | 1 (2.70) | 1 (2.94) | - | 1.000 |
| 腹盆腔 | 1 (2.70) | 2 (5.88) | χ2 = 0.01 | 0.940 |
| 感染病原菌(n,%) | ||||
| 革兰阳性球菌 | 3 (8.11) | 4 (11.76) | χ2 = 0.01 | 0.906 |
| 革兰阴性球菌 | 19 (51.35) | 21 (61.76) | χ2 = 0.78 | 0.377 |
| 真菌 | 3 (8.11) | 9 (26.47) | χ2 = 4.25 | 0.039 |
| 病毒 | 3 (8.11) | 1 (2.94) | χ2 = 0.18 | 0.669 |
| 严重程度 | ||||
| APCHE-Ⅱ评分(分) | 17.00 (14.00, 19.00) | 19.00 (17.00, 23.00) | Z = -2.32 | 0.020 |
| SOFA评分(分) | 5.00 (4.00, 7.00) | 5.00 (4.00, 7.75) | Z = -0.66 | 0.511 |
| 入ICU后住院天数(d) | 15.00 (9.00, 25.00) | 22.00 (11.75, 28.50) | Z = -1.68 | 0.094 |
| 实验室检查参数 | ||||
| WBC(109/L) | 9.70 (5.30, 16.20) | 12.90 (6.43, 17.55) | Z = -0.39 | 0.696 |
| LYC(109/L) | 0.50 (0.30, 1.00) | 0.45 (0.20, 0.70) | Z = -1.50 | 0.133 |
| HGB(g/L) | 119.24 ± 24.61 | 109.80 ± 23.75 | t = 1.64 | 0.105 |
| Plti(109/L) | 145.00(102.00, 179.00) | 159.50(113.25, 198.50) | Z = -1.31 | 0.191 |
| hs-CRP(mg/L) | 123.50 (32.20, 221.00) | 90.00 (50.57, 160.25) | Z = -0.91 | 0.363 |
| PCT(ng/mL) | 12.30 (1.38, 61.78) | 11.64 (1.09, 38.02) | Z = -0.19 | 0.849 |
| Lac(mmol/L) | 2.20 (1.40, 3.60) | 2.80 (1.45, 4.50) | Z = -0.68 | 0.497 |
| TC(mmol/L) | 3.13 ± 1.01 | 2.95 ± 1.11 | t = 0.71 | 0.481 |
| TG, (mmol/L) | 1.24 (0.81, 1.82) | 1.12 (0.90, 1.39) | Z = -0.93 | 0.354 |
| 常规营养实验室指标 | ||||
| ALB(g/L) | 30.60 (26.10, 34.30) | 31.35 (28.02, 33.27) | Z = -0.17 | 0.863 |
| PA(g/L) | 0.09 (0.07, 0.15) | 0.08 (0.05, 0.13) | Z = -1.05 | 0.292 |
| Urea(mmol/L) | 8.80 (6.30, 13.20) | 11.25 (7.93, 17.08) | Z = -1.73 | 0.084 |
| CRE(μmol/L) | 104.00 (62.00, 160.00) | 109.00 (99.25, 204.25) | Z = -1.16 | 0.245 |
| 注:IQR:人口学特征;BMI:身体质量指数;APACHE-Ⅱ:急性生理与慢性健康评分-Ⅱ;SOFA:序贯器官功能衰竭评分;ICU:重症监护室;WBC:白细胞计数;LYC:淋巴细胞计数;HGB:血红蛋白;Plt:血小板计数;hs-CRP:超敏C反应蛋白;PCT:降钙素原;Lac:乳酸;TC:血清总胆固醇;TG:血清总甘油三酯 | ||||
|
| 注:A为无营养不良组,B为营养不良组;图A为年龄在两组之间比较结果;图B为BMI在两组之间比较结果;图C为APACHE-Ⅱ评分在两组之间比较结果;aP<0.050,bP<0.010,cP<0.001 图 2 入组脓毒症患者基线资料 Fig 2 Baseline data of admitted septicemia patients |
|
|
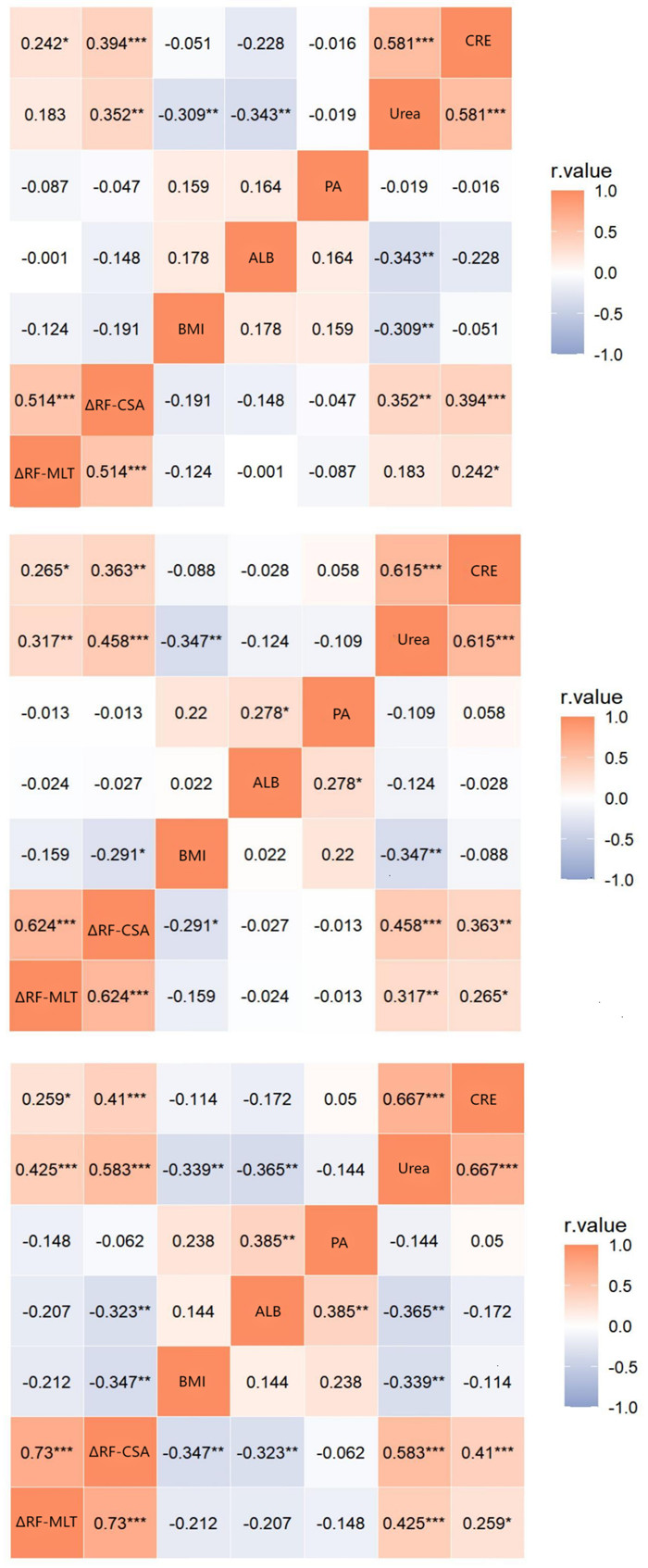
入组患者不同时间节点(D3、5、7天)股直肌厚度变异率及面积变异率与当天临床常规营养参数:BMI、白蛋白、前白蛋白、尿素、肌酐均存在良好相关性。见图 3。
|
| 注:A:第3天股直肌厚度变异率及面积变异率与其他营养参数间的相关性热图;B:第5天股直肌厚度变异率及面积变异率与其他营养参数间的相关性热图;C:第7天股直肌厚度变异率及面积变异率与其他营养参数间的相关性热图。ΔRF-MLT:股直肌厚度变异率;ΔRF-CSA:股直肌横截面积变异率;BMI:身体质量指数;ALB:血清白蛋白;PA:血清前白蛋白;Urea:血清尿素;CRE:血清肌酐;aP<0.050,bP<0.010,cP<0.001。 图 3 营养参数间的相关性热图 Fig 3 Correlation map of nutritional parameters |
|
|
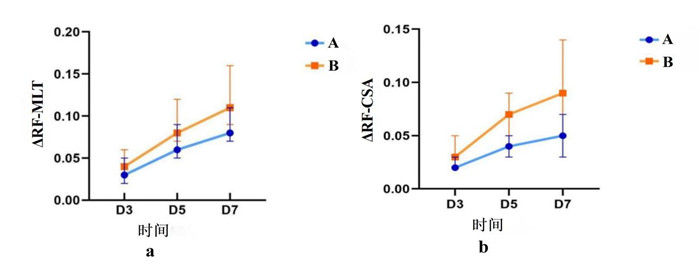
对比非营养不良组和营养不良组D3、5、7的股直肌厚度变异率和股直肌横截面积变异率,营养不良组的股直肌厚度变异率(ΔRF-MLT)及股直肌横截面积变异率(ΔRF-CSA)较无营养不良组显著较大,组间差异有统计学意义。见表 2,图 4。
| 参数 | 无营养不良组 | 营养不良组 | Z值 | P值 |
| 股直肌厚度变异率 | ||||
| D3股直肌厚度变异率(n= 71) | 0.03 (0.02, 0.05) | 0.04 (0.03, 0.06) | Z = -2.17 | 0.030 |
| D5股直肌厚度变异率(n= 69) | 0.06 (0.05, 0.09) | 0.08 (0.07, 0.12) | Z = -2.63 | 0.008 |
| D7股直肌厚度变异率(n= 66) | 0.08 (0.07, 0.11) | 0.11 (0.09, 0.16) | Z = -2.83 | 0.005 |
| 股直肌横截面积变异率 | ||||
| D3股直肌面积变异率(n= 71) | 0.02 (0.02, 0.03) | 0.03 (0.03, 0.05) | Z = -2.79 | 0.005 |
| D5股直肌面积变异率(n= 69) | 0.04 (0.03, 0.05) | 0.07 (0.05, 0.09) | Z = -3.97 | < .001 |
| D7股直肌面积变异率(n= 66) | 0.05 (0.03, 0.07) | 0.09 (0.07, 0.14) | Z = -4.41 | < .001 |
|
| 注:A组:无营养不良组,B组营养不良组;A:不同时间股直肌厚度变异率组间差异图,B:不同时间股直肌横截面积变异率组间差异图。 图 4 股直肌厚度变异率、股直肌横截面积变异率无营养不良和营养不良组间差异图 Fig 4 Variation rates of rectus femoris thickness and cross-sectional area between the non-malnutrition group and the malnutrition group |
|
|
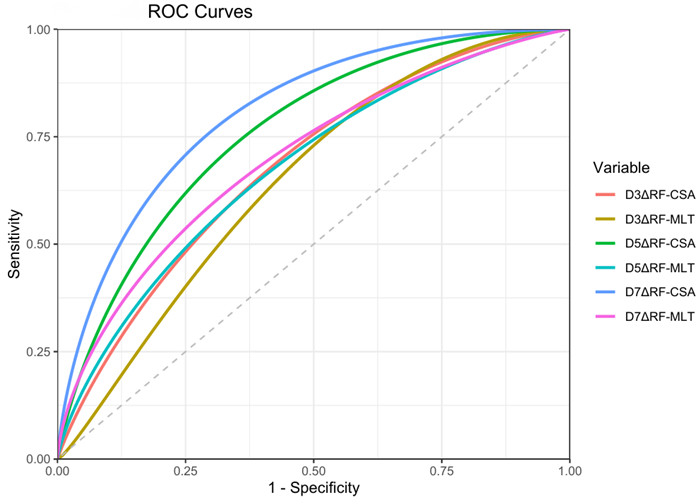
D3、5、7天股直肌厚度变异率及面积变异率进行ROC曲线分析,D7天股直肌面积变异率对预测脓毒症患者发生营养不良最具诊断价值,当临界值为6.6%时,敏感度为87.9%,特异度为72.7%,见表 3、图 5。
| 检验结果变量 | AUC | P值 | 渐近95% 置信区间 | 敏感度 | 特异度 | 截断值 | |
| 下限 | 上限 | ||||||
| D3ΔRF-MLT | 0.691 | 0.008 | 0.563 | 0.818 | 0.818 | 0.515 | 0.031 |
| D5ΔRF-MLT | 0.692 | 0.007 | 0.565 | 0.820 | 0.758 | 0.606 | 0.066 |
| D7ΔRF-MLT | 0.703 | 0.005 | 0.577 | 0.829 | 0.697 | 0.697 | 0.092 |
| D3ΔRF-CSA | 0.731 | 0.001 | 0.608 | 0.854 | 0.636 | 0.818 | 0.031 |
| D5ΔRF-CSA | 0.794 | < 0.001 | 0.681 | 0.907 | 0.818 | 0.788 | 0.051 |
| D7ΔRF-CSA | 0.817 | < 0.001 | 0.713 | 0.920 | 0.879 | 0.727 | 0.066 |
| 注:D3ΔRF-MLT为第3天股直肌厚度变异率;D5ΔRF-MLT为第5天股直肌厚度变异率;D7ΔRF-MLT为第7天股直肌厚度变异率;D3ΔRF-CSA为第3天股直肌横截面积变异率;D5ΔRF-CSA为第5天股直肌横截面积变异率;D7ΔRF-CSA为第7天股直肌横截面积变异率 | |||||||
|
| 图 5 不同时间点股直肌厚度变异率、横截面积变异率预测营养不良发生的ROC曲线 Fig 5 ROC curves for predicting the occurrence of malnutrition based on the thickness and cross-sectional area variation rate of rectus femoris at different time points |
|
|
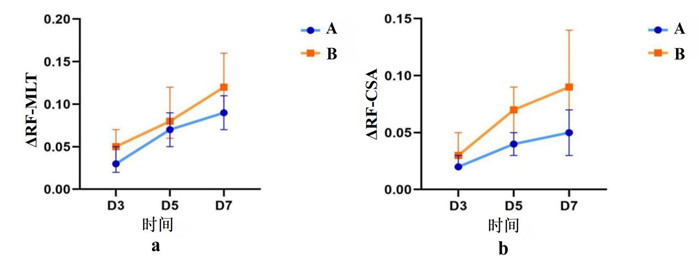
对比功能预后良好组和功能预后不良组D3、5、7的股直肌厚度变异率和股直肌横截面积变异率,功能预后不良组的股直肌厚度变异率(ΔRF-MLT)及股直肌横截面积变异率(ΔRF-CSA)较功能预后良好组显著较大,组间差异有统计学意义。见表 4,图 6。
| 参数 | 功能未受影响组 | 功能受影响组 | Z值 | P值 |
| 股直肌厚度变异率 | ||||
| D3股直肌厚度变异率(n= 71) | 0.03 (0.02, 0.05) | 0.05 (0.03, 0.07) | Z = -3.11 | 0.002 |
| D5股直肌厚度变异率(n= 69) | 0.07 (0.05, 0.09) | 0.08 (0.06, 0.12) | Z = -2.15 | 0.031 |
| D7股直肌厚度变异率(n= 66) | 0.09 (0.07, 0.11) | 0.12 (0.09, 0.16) | Z = -2.48 | 0.013 |
| 股直肌横截面积变异率 | ||||
| D3股直肌面积变异率(n= 71) | 0.02 (0.02, 0.03) | 0.03 (0.03, 0.07) | Z = -3.20 | 0.001 |
| D5股直肌面积变异率(n= 69) | 0.04 (0.03, 0.06) | 0.07 (0.05, 0.11) | Z = -3.46 | < .001 |
| D7股直肌面积变异率(n= 66) | 0.06 (0.04, 0.08) | 0.10 (0.07, 0.15) | Z = -3.41 | < .001 |
|
| 注:A组:功能未受影响组,B组功能受影响组;A: 不同时间股直肌厚度变异率组间差异图,B: 不同时间股直肌横截面积变异率组间差异图 图 6 股直肌厚度变异率、股直肌横截面积变异率功能受影响和功能未受影响组间差异图 Fig 6 Variation rates of the thickness and cross-sectional area of rectus femoris between the function-affected group and the function-unaffected group |
|
|
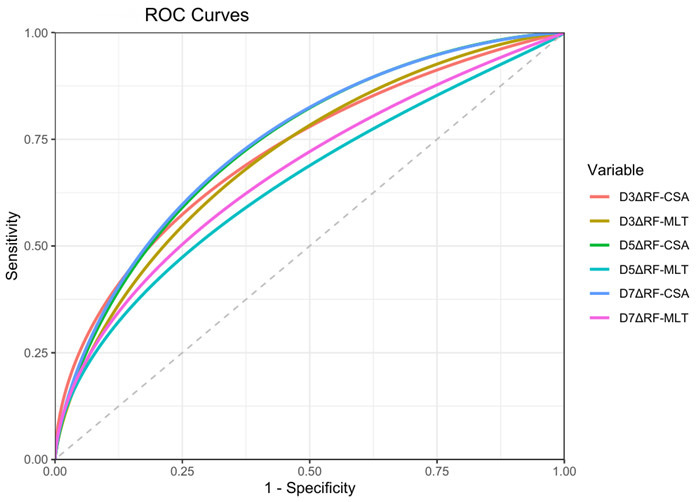
D3、5、7股直肌厚度变异率及面积变异率进行ROC曲线分析,D7股直肌面积变异率对预测脓毒症患者发生远期功能不良预后最具诊断价值,当临界值为7.0%时,敏感度为74.1%,特异度为64.1%,见表 5、图 7。
| 检验结果变量 | AUC | P值 | 渐近95% 置信区间 | 敏感度 | 特异度 | 截断值 | |
| 下限 | 上限 | ||||||
| D3ΔRF-MLT | 0.686 | 0.011 | 0.555 | 0.817 | 0.815 | 0.590 | 0.033 |
| D5ΔRF-MLT | 0.643 | 0.049 | 0.504 | 0.783 | 0.630 | 0.718 | 0.077 |
| D7ΔRF-MLT | 0.68 | 0.013 | 0.545 | 0.816 | 0.667 | 0.692 | 0.097 |
| D3ΔRF-CSA | 0.698 | 0.006 | 0.569 | 0.828 | 0.667 | 0.718 | 0.031 |
| D5ΔRF-CSA | 0.727 | 0.002 | 0.604 | 0.850 | 0.741 | 0.641 | 0.051 |
| D7ΔRF-CSA | 0.749 | 0.001 | 0.632 | 0.867 | 0.741 | 0.641 | 0.070 |
| 注:D3ΔRF-MLT为第3天股直肌厚度变异率;D5ΔRF-MLT为第5天股直肌厚度变异率;D7ΔRF-MLT为第7天股直肌厚度变异率;D3ΔRF-CSA为第3天股直肌横截面积变异率;D5ΔRF-CSA为第5天股直肌横截面积变异率;D7ΔRF-CSA为第7天股直肌横截面积变异率 | |||||||
|
| 图 7 不同时间点股直肌厚度、横截面积变异率功能预后的ROC曲线 Fig 7 ROC curves for the functional prognosis of the thickness and cross-sectional area variation rates of the rectus femoris at different time points |
|
|
本研究提出,超声评估股直肌厚度及横截面积变异率可作为评估脓毒症患者营养状况及预测功能预后的指标。结果显示,两者在诊断营养不良方面准确性较高,并与BMI、白蛋白、尿素、肌酐等常规营养参数存在一定相关性,同时二者在预测脓毒症患者功能预后中也有较大的意义。
超声测量的股直肌面积和回声强度与握力、生物电阻抗显著相关,提示超声可用于评估肌肉质量[16],能有效预测肌肉减少症的发生[17]。本研究发现,脓毒症患者中营养不良组的股直肌厚度及横截面积变异率显著高于无营养不良组(P < 0.05),且第7天的股直肌横截面积变异率(AUC = 0.817, 95%CI: 0.713~0.930)在诊断营养不良方面有着不错的表现。此外,功能预后受影响组患者的股直肌厚度及横截面积变异率同样显著升高(P < 0.05),提示肌肉萎缩与远期运动功能障碍密切相关[18]。这些结果表明,超声动态监测股直肌变化能够敏感反映脓毒症患者的代谢失衡与肌肉消耗,为早期识别营养不良和预测功能预后提供了客观依据。
脓毒症相关的蛋白质消耗、肌肉萎缩是一个复杂且严重的病理生理过程[3-4, 19],涉及多个机制,包括以下方面:①炎症介质驱动:骨骼肌分解反应增加、毛细血管渗漏增加;②代谢紊乱:高代谢状态导致能量负平衡,优先分解肌肉蛋白以维持脏器功能;③制动与神经肌肉抑制,这可能是导致肌肉质量下降的一个重要原因。而股直肌作为人体最大的浅表肌肉之一,其厚度和横截面积的变化能够直观反映全身肌肉消耗程度,动态监测变异率可捕捉早期肌肉丢失。股直肌横截面积较厚度更能敏感反映危重症患者的肌肉消耗[20],本研究第7天股直肌横截面积变异率的高预测价值相符。此外在本研究结果中,值得注意的是股直肌厚度及横截面积变异率与尿素、肌酐之间的相关性,尿素和肌酐水平的升高通常反映了患者肾功能的减退和蛋白质分解代谢的增强,结合人体蛋白质代谢途径,进一步验证了股直肌厚度及横截面积变异率临床应用的准确性、有效性[21]。相比传统营养指标(如血清白蛋白和前白蛋白),股直肌超声测量具有以下优势:无创、操作简便,可实时监测肌肉变化;不受炎症状态等外源性因素干扰,数据更可靠;适用于ICU环境,克服体重测量受限的难题;兼具营养评估与预后预测的价值。
本研究为脓毒症患者的营养管理提供了新思路:早期识别营养不良:超声参数(如D7ΔRF-CSA)可作为GLIM标准的补充工具,帮助临床医生在传统指标尚未异常时识别高风险患者,更有利于指导个性化干预[22]:针对肌肉快速消耗的患者,可强化蛋白质补充、联合抗炎治疗以改善合成代谢。并提供预后评估[23]:股直肌变异率与功能预后显著相关,早期康复训练及肌肉质量恢复可能是改善患者长期生活质量的潜在靶点。
本研究也存在需要改进及进一步分析的地方,首先,本研究为单中心前瞻性观察性研究、病例数仍较少,循证力度较低,其普遍适用性可能有限,后续可开展多中心的相关研究。其次,本研究随访时间跨度长,有部分脓毒症患者病情发展迅速,短期内死亡,无法追踪更长时间节点的超声参数,导致D5、7股直肌厚度及面积变异率丢失,最终数据分析结果存在一定偏倚。第三,本研究无法排除镇静镇痛药物使用、机械通气时间、液体过负荷水肿对肌肉状态的影响。因此,未来研究应进一步探索并控制潜在的混杂因素,以提高准确性和临床应用价值。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 陈梦怡、姜煜浩、高甲科、冯辉、马丽梅:文献检索、数据整理、论文撰写;朱建军:研究设计、论文修改、资金资助
| [1] | Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. DOI:10.1007/s00134-021-06506-y |
| [2] | 刘红升, 张庆红. GLP-1在脓毒症持续性炎症反应-免疫抑制-分解代谢综合征中的作用机制[J]. 中华急诊医学杂志, 2023, 32(12): 1737-1741. DOI:10.3760/cma.j.issn.1671-0282.2023.12.030 |
| [3] | De Waele E, Malbrain MLNG, Spapen H. Nutrition in sepsis: a bench-to-bedside review[J]. Nutrients, 2020, 12(2): 395. DOI:10.3390/nu12020395 |
| [4] | Schuetz P, Seres D, Lobo DN, et al. Management of disease-related malnutrition for patients being treated in hospital[J]. Lancet, 2021, 398(10314): 1927-1938. DOI:10.1016/S0140-6736(21)01451-3 |
| [5] | 李探, 张潇月, 刘克琴, 等. 超声测量胃窦横截面积指导脓毒症患者早期个体化肠内营养实施的应用价值分析[J]. 中华急诊医学杂志, 2024, 33(2): 193-200. DOI:10.3760/cma.j.issn.1671-0282.2024.02.009 |
| [6] | Singer P, Blaser AR, Berger MM, et al. ESPEN practical and partially revised guideline: Clinical nutrition in the intensive care unit[J]. Clin Nutr, 2023, 42(9): 1671-1689. DOI:10.1016/j.clnu.2023.07.011 |
| [7] | Cederholm T, Jensen GL, Correia MITD, et al. GLIM criteria for the diagnosis of malnutrition-A consensus report from the global clinical nutrition community[J]. Clin Nutr, 2019, 38(1): 1-9. DOI:10.1016/j.clnu.2018.08.002 |
| [8] | Barazzoni R, Jensen GL, Correia MITD, et al. Guidance for assessment of the muscle mass phenotypic criterion for the Global Leadership Initiative on Malnutrition (GLIM) diagnosis of malnutrition[J]. Clin Nutr, 2022, 41(6): 1425-1433. DOI:10.1016/j.clnu.2022.02.001 |
| [9] | Lee ZY, Ong SP, Ng CC, et al. Association between ultrasound quadriceps muscle status with premorbid functional status and 60-day mortality in mechanically ventilated critically ill patient: a single-center prospective observational study[J]. Clin Nutr, 2021, 40(3): 1338-1347. DOI:10.1016/j.clnu.2020.08.022 |
| [10] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [11] | Bleecker ER, Menzies-Gow AN, Price DB, et al. Systematic literature review of systemic corticosteroid use for asthma management[J]. Am J Respir Crit Care Med, 2020, 201(3): 276-293. DOI:10.1164/rccm.201904-0903SO |
| [12] | Connolly B, MacBean V, Crowley C, et al. Ultrasound for the assessment of peripheral skeletal muscle architecture in critical illness: a systematic review[J]. Crit Care Med, 2015, 43(4): 897-905. DOI:10.1097/CCM.0000000000000821 |
| [13] | Maurus J, Terzer T, Benner A, et al. Validation of a proxy-reported SARC-F questionnaire for current and retrospective screening of sarcopenia-related functional impairments[J]. J Cachexia Sarcopenia Muscle, 2022, 13(1): 264-275. DOI:10.1002/jcsm.12871 |
| [14] | Ghiotto L, Muollo V, Tatangelo T, et al. Exercise and physical performance in older adults with sarcopenic obesity: a systematic review[J]. Front Endocrinol (Lausanne), 2022, 13: 913953. DOI:10.3389/fendo.2022.913953 |
| [15] | Lee SJ, Yoo J, Park S, et al. Concordance between needle electromyography and manual muscle test findings for muscles with motor grades 0 and 1[J]. PM R, 2024, 16(3): 210-218. DOI:10.1002/pmrj.13032 |
| [16] | López-Gómez JJ, García-Beneitez D, Jiménez-Sahagún R, et al. Nutritional ultrasonography, a method to evaluate muscle mass and quality in morphofunctional assessment of disease related malnutrition[J]. Nutrients, 2023, 15(18): 3923. DOI:10.3390/nu15183923 |
| [17] | de Luis Roman D, Almeida JMG, Guerrero DB, et al. Ultrasound cut-off values for rectus femoris for detecting sarcopenia in patients with nutritional risk[J]. Nutrients, 2024, 16(11): 1552. DOI:10.3390/nu16111552 |
| [18] | Mayer KP, Thompson Bastin ML, Montgomery-Yates AA, et al. Acute skeletal muscle wasting and dysfunction predict physical disability at hospital discharge in patients with critical illness[J]. Crit Care, 2020, 24(1): 637. DOI:10.1186/s13054-020-03355-x |
| [19] | Adejumo AC, Akanbi O, Pani L. Protein energy malnutrition is associated with worse outcomes in sepsis-a nationwide analysis[J]. J Acad Nutr Diet, 2019, 119(12): 2069-2084. DOI:10.1016/j.jand.2019.04.019 |
| [20] | Palakshappa JA, Reilly JP, Schweickert WD, et al. Quantitative peripheral muscle ultrasound in sepsis: Muscle area superior to thickness[J]. J Crit Care, 2018, 47: 324-330. DOI:10.1016/j.jcrc.2018.04.003 |
| [21] | Toscano A, Bellone F, Maggio N, et al. Unlocking the predictive power of nutritional scores in septic patients[J]. Nutrients, 2025, 17(3): 545. DOI:10.3390/nu17030545 |
| [22] | Wischmeyer PE, Bear DE, Berger MM, et al. Personalized nutrition therapy in critical care: 10 expert recommendations[J]. Crit Care, 2023, 27(1): 261. DOI:10.1186/s13054-023-04539-x |
| [23] | Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness[J]. JAMA, 2013, 310(15): 1591-1600. DOI:10.1001/jama.2013.278481 |
 2025, Vol. 34
2025, Vol. 34