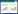2. 南开大学附属天津市第一中心医院麻醉科, 天津 300192
2. Department of Anesthesiology, Tianjin First Center Hospital Affiliated to Nankai University, Tianjin 300192, China
老年患者常合并多种慢性病,手术耐受性差、脏器易受损且恢复期长。危重老年患者术后常需长时间机械通气,这不仅增加呼吸机相关肺损伤和感染风险,还可能引发多器官功能衰竭[1]。因此,老年危重患者手术需加强围术期呼吸循环功能监测与管理,以最大限度减少并发症,提高手术成功率和生存质量。
随着年龄的增长,肺的主要结构和功能发生进行性变化,包括肺弹性、防御机制降低、呼吸肌力量减弱以及肺对麻醉的耐受性降低[1]。既往研究显示,65岁以上接受外科手术的患者中,有近33%的患者出现术后肺部并发症(postoperative pulmonary complications, PPCs)[2]。由此可见,老年患者本身就是PPCs的高危人群[3]。PPCs包括胸腔积液、肺不张、肺炎、急性呼吸窘迫综合征、心源性肺水肿、术后需要机械通气等[4-5],它可延长住院时间,加重患者经济负担,增加长期病死率[6]。因此,早期识别有PPCs风险的患者并尽早干预治疗,以减少呼吸机相关肺部并发症的发生,具有重要的临床和社会价值。
基于上述背景,肺部超声评分(lung ultrasound score, LUS)以及联合多种生理参数的组合有可能构建一种新的、更准确的临床预测模型,以预测老年外科患者发生PPCs的高危因素。
1 资料与方法 1.1 研究对象本研究是一项多中心前瞻性研究,2022年12月至2023年8月在天津市第一中心医院、天津市第四中心医院、天津市第五中心医院、天津市泰达医院、山西医科大学附属第一医院及山西省肿瘤医院开展。
纳入标准:年龄≥65岁,全麻手术,机械通气≥3 h。排除标准:气管切开术;无法完成肺部超声检查[病态肥胖(BMI≥37.5 kg/m2)、胸椎敷料、禁翻身];中枢性呼吸衰竭;严重肌肉无力;膈肌自主活动缺失;以及合并终末期心肺疾病。
根据术后随访结果(至出院或术后第7天),将患者分为无PPCs组和PPCs组。
研究开展之前,由超声科主治职称及以上医生对6家医院研究人员进行超声培训,并成立专门质控小组对数据收集表进行不定期抽查。该研究开发并验证了基于非心脏手术后肺部并发症的多变量预测模型。该方法是根据透明报告个体预后或诊断的多变量预测模型(TRIPOD)声明[7]开发的。该研究已获得天津市第一中心医院科技伦理委员会批准,审查编号为2022DZX06。并在Clinical Trials.gov注册,注册号为NCT05674812。所有患者或其近亲属均提供知情同意。
1.2 研究方法 1.2.1 脱机拔管的流程全麻患者行外科手术后带气管插管转入麻醉复苏室(postanaesthesia intensive care unit, PACU),由主治医师根据自主呼吸试验(spontaneous breathing trial, SBT)结果和患者的临床表现负责拔管,并判断拔管后是否需要无创呼吸机支持治疗(经鼻高流量氧疗、无创通气、再插管)[8]。
常规操作如下:首先,评估开始脱机过程的准备情况。(1)导致机械通气的病因得到改善或解决;(2)氧合指数(oxygenation index, OI):OI≥150~300 mmHg(1 mmHg=0.133 kPa);(3)血流动力学稳定,心肌缺血无动态变化,无明显低血压;(4)患者能自主呼吸(呼吸中枢功能维持自主呼吸节律);(5)术后72 h内无计划全麻手术。若各方面均满足,则进行SBT评估。
其次,只要患者符合预先设定的撤机标准,就有资格进行SBT[9]。SBT在患者连接呼吸机时进行低水平压力辅助(PEEP =5~7 cmH2O,压力支持水平5~7 cmH2O,1 cmH2O=0.098 kPa)30 min。SBT的成功或失败以及拔管的决定由主管医师决定,而该医师不参与这项研究。拔管后,通过鼻导管输送氧气。调整氧流量以保持经皮动脉血氧饱和度≥92%。如果出现任何呼吸窘迫的迹象,则在负责医生的监督下使用无创呼吸支持。当出现以下情况时需要重新插管:(1)呼吸频率 > 35次/min持续超过5 min;(2)经皮动脉血氧饱和度 < 90%;(3)心率 > 140次/min或心率 > 持续变化20%;(4)动脉氧分压 < 80 mmHg;(5)拔管后动脉血二氧化碳分压 > 45 mmHg或变化≥20%,酸碱度 < 7.33;(6)有呼吸肌疲劳或呼吸困难增加的迹象[9]。
1.2.2 数据测量与收集使用便携式超声(飞利浦CX50,荷兰)对患者进行肺部超声检查并计算LUS评分。LUS评分[10-11]建立在将肺脏分成12个区域的基础上,对每一肺脏区域进行扫描。根据扫描结果对每一分区分别评分,12个分区评分相加得出最终评分。最低评分为0分,最高36分;分值越高肺部病变越重。0分:肺含气量正常(即正常肺脏);1分:肺含气量中度减少,存在多条孤立的B线或垂直扫描时融合B线小于肋间隙的50%;2分:肺含气量重度减少,弥漫存在的融合B线,占据全部肋间隙;3分:肺含气量完全消失,存在肺实变。全部、前部、侧部和背部LUS评分范围分别为0~36分、0~12分、0~12分和0~12分。肺部超声的测量在患者拔管后5 min进行,进行三次测量,并计算平均值。
收集所有入组患者的基线数据,收集患者术前最后一次和术后第一次的实验室检查结果。拔管后5 min,收集以下变量:动脉血气、OI、LUS,并记录患者机械通气时间、PACU和住院时间等。所有患者均接受术后随访,直至出院、死亡或入组后60 d。超声测量由独立于临床团队的研究人员进行。停止SBT或拔管的决定是由负责的医生独立做出。
1.2.3 结局终点本研究观察的PPCs包括:肺不张、急性呼吸窘迫综合征、肺炎、胸腔积液、支气管痉挛、气胸、早期拔管失败或需要重新插管,以及病死率。研究采用前瞻性随访设计,对所有患者随访30 d或直至其出院(以先发生者为准),以收集相关临床数据。研究的主要终点为术后7 d内PPCs的首次发生率。PPCs的确诊由负责患者的临床医生团队完成。在患者随访结束时,由参与本研究的一位麻醉医生研究者,依据患者的电子病历记录,统一收集汇总PPCs的发生率数据。
1.3 统计学方法应用R语言4.3.0软件进行数据处理和分析。对计量资料进行正态分布检验,符合正态分布数据以均数±标准差(x±s)表示,采用Student's t检验比较;在非正态分布数据以中位数(四分位数)[M(Q1, Q3)]表示,采用Mann-Whitney U检验比较。分类变量以数字和百分比表示,并通过卡方检验或Fisher精确检验进行分析。
将单因素分析(P<0.05)筛选的危险因素进行多因素Logistic回归分析。绘制受试者工作特征(receiver operating characteristic, ROC)曲线并计算曲线下面积(area under the curve, AUC)及敏感度、特异度、最佳截断值等评价指标。并绘制预测PPCs的列线图,列线图总分为每个危险因素被赋予的相应分值的总和,得分对应相应的患病风险,分数越高说明发生PPCs的风险越高。Bootstrap重抽样1 000次绘制校准曲线做一致性评价,构建决策曲线分析(decision curve analysis, DCA)评估不同阈值概率下的临床净获益,绘制ROC曲线对模型进行区分度评价,进一步验证模型的准确性。以P<0.05为差异有统计学意义。
2 结果 2.1 所有患者的临床特征2022年12月至2023年8月期间的6家医院共有227例符合标准的患者,经排除后最终入组130例患者,其中17例患者术后7 d内发生PPCs,发生率为13.1%(图 1)。17例患者中,诊断为胸腔积液3例,肺炎5例,肺不张6例,呼吸衰竭3例。
|
| 图 1 所有患者入组流程 Fig 1 Enrollment Process of All Patients |
|
|
患者基线资料和术中指标见表 1,两组患者手术类型、既往插管史、脑血管病史、ASA分级、术中总入量、机械通气时长、PACU时长和拔管后是否需要高流量氧气支持的差异有统计学意义(均P<0.05),其他指标均差异无统计学意义。
| 指标 | 总体(n=130) | 无PPCs组(n=113) | PPCS组(n=17) | t/Z/χ2值 | P值 |
| 一般情况 | |||||
| 年龄(岁)a | 70.87±5.49 | 70.81±5.18 | 71.29±7.41 | 0.341 | 0.733 |
| BMI(kg/m2)a | 23.36±3.17 | 23.55±3.31 | 22.11±1.51 | -1.756 | 0.081 |
| 男性b | 83 (63.85) | 72 (63.72) | 11 (64.71) | 0.079 | 0.937 |
| 既往史b | |||||
| 插管史 | 47 (36.15) | 37 (32.74) | 10 (58.82) | 2.023 | 0.037 |
| 糖尿病 | 33 (25.38) | 29 (25.66) | 4 (23.53) | 0.188 | 0.850 |
| 脑血管病 | 16 (12.31) | 10 (8.85) | 6 (35.29) | 2.848 | 0.002 |
| 手术部位b | 6.780 | 0.526 | |||
| 腹部 | 107 (82.31) | 91 (80.53) | 16 (94.12) | ||
| 脑部 | 10 (7.69) | 10 (8.85) | 0 (0.00) | ||
| 其他 | 13 (10.00) | 12 (10.62) | 1 (5.88) | ||
| 手术类型(急症)b | 13 (10.00) | 5 (4.42) | 8 (47.06) | 4.428 | < 0.001 |
| ASA分级b | 10.110 | 0.019 | |||
| 1 | 3 (2.31) | 3 (2.65) | 0 (0.00) | ||
| 2 | 79 (60.77) | 72 (63.72) | 7 (41.18) | ||
| 3 | 46 (35.38) | 38 (33.63) | 8 (47.06) | ||
| 4 | 2 (1.54) | 0 (0.00) | 2 (11.76) | ||
| 手术时长(min)a | 270.88±105.06 | 270.67±102.71 | 272.29±122.93 | -0.059 | 0.953 |
| 麻醉时长(min)a | 324.42±108.23 | 325.31±106.65 | 318.53±121.47 | 0.239 | 0.811 |
| 术中总入量(mL)a | 2 545.85±1 003.60 | 2 450.36±858.74 | 3 175.00±1 567.59 | -2.850 | 0.005 |
| 机械通气时长(min)c | 391.00(303.50, 517.25) | 377.00(300.00, 479.00) | 570.00(356.00, 735.00) | -1.917 | 0.027 |
| PACU时长(min)c | 167.00(114.00, 300.00) | 155.50(108.75, 211.25) | 1 020.00(480.00, 1 815.00) | -5.803 | < 0.001 |
| 拔管后高流量氧气支持b | 17 (13.08) | 4 (3.54) | 13 (76.47) | 15.780 | < 0.001 |
| 注:BMI为身体质量指数,ASA分级(American Society of Anesthesiologists Physical Status Classification System)是美国麻醉医师协会制定的患者术前健康状况评估标准;a为x±s,b为(例,%),c为[[M(Q1, Q3)] | |||||
单因素Logistic回归分析结果显示,术前最后一次化验指标:LY、RBC、Hb、AST、ALB、CREA;术后第一次化验指标:LY、RBC、Hb、ALB;术中及监测指标:术中总入量、切皮前Hb、拔管后5 min Hb、K、OI、LUS总分、侧部LUS、背部LUS;患者病史与手术因素:插管史、脑血管病史、手术类型均对是否发生PPCs有影响。见表 2。
| 指标 | Estimate | Std. Error | Z值 | P值 | OR值 | 95%CI |
| Hb | ||||||
| 术前最后一次 | -0.033 | 0.011 | -2.960 | 0.003 | 0.967 | 0.946~0.989 |
| 术后第一次 | -0.038 | 0.013 | -2.802 | 0.005 | 0.963 | 0.938~0.989 |
| RBC | ||||||
| 术前最后一次 | -0.766 | 0.371 | -2.065 | 0.039 | 0.465 | 0.225~0.962 |
| 术后第一次 | -1.136 | 0.430 | -2.642 | 0.008 | 0.321 | 0.138~0.746 |
| LY | ||||||
| 术前最后一次 | -1.224 | 0.540 | -2.268 | 0.023 | 0.294 | 0.102~0.847 |
| 术后第一次 | -1.275 | 0.630 | -2.024 | 0.043 | 0.279 | 0.081~0.961 |
| ALB | ||||||
| 术前最后一次 | -0.207 | 0.056 | -3.724 | < 0.001 | 0.813 | 0.729~0.907 |
| 术后第一次 | -0.187 | 0.051 | -3.650 | < 0.001 | 0.830 | 0.751~0.917 |
| AST-术前最后一次 | 0.013 | 0.005 | 2.710 | 0.007 | 1.013 | 1.004~1.023 |
| CREA-术前最后一次 | 0.021 | 0.009 | 2.281 | 0.023 | 1.021 | 1.003~1.040 |
| 手术类型-择期 | -2.955 | 0.667 | -4.428 | < 0.001 | 0.052 | 0.014~0.193 |
| LUS总分 | 0.274 | 0.059 | 4.679 | < 0.001 | 1.316 | 1.173~1.476 |
| 侧部LUS | 0.568 | 0.132 | 4.304 | < 0.001 | 1.764 | 1.362~2.285 |
| 背部LUS | 0.459 | 0.103 | 4.437 | < 0.001 | 1.582 | 1.292~1.937 |
| 插管史 | 1.076 | 0.532 | 2.023 | 0.043 | 2.934 | 1.034~8.325 |
| 脑血管病史 | 1.726 | 0.606 | 2.848 | 0.004 | 5.618 | 1.713~18.427 |
| 拔管后5 min K | -1.223 | 0.599 | -2.042 | 0.041 | 0.294 | 0.091~0.952 |
| 拔管后5 min OI | -0.004 | 0.002 | -2.010 | 0.044 | 0.996 | 0.993~1.000 |
| 术中总入量 | 0.001 | 0.000 | 2.642 | 0.008 | 1.001 | 1.000~1.001 |
| 注:RBC为红细胞,Hb为血红蛋白,LY为淋巴细胞,ALB为白蛋白,AST为谷草转氨酶,CREA为肌酐,LUS为肺部超声评分,OI为氧合指数 | ||||||
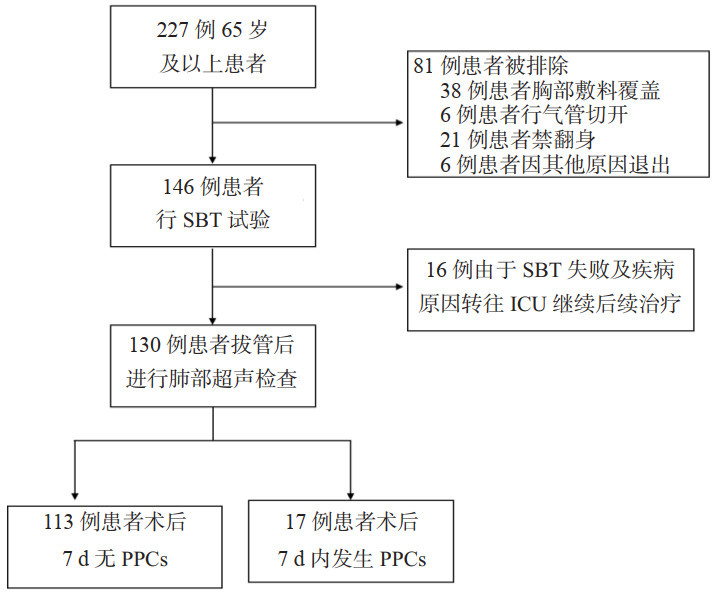
将单因素Logistic回归分析P<0.05的变量纳入LASSO回归,用5折交叉验证法依据lambda.1se筛选特征变量有手术类型、LUS总分。见图 2。
|
| 图 2 影响PPCs的LASSO回归分析结果 Fig 2 Results of LASSO regression analysis affecting PPCs |
|
|
将LASSO分析筛选的变量纳入多因素Logistic回归分析(表 3)。在多因素Logistic回归模型中,LUS总分是患者术后7 d发生PPCs的独立危险因素(OR=1.248, 95%CI: 1.099~1.417, P=0.001);手术类型为择期相对于手术类型急症是独立保护因素(OR=0.206, 95%CI: 0.043~0.988, P=0.048)。
| 指标 | Estimate | Std. Error | Z值 | P值 | OR值 | 95%CI |
| 常数项 | -2.064 | 0.982 | -2.103 | 0.036 | ||
| 手术类型-择期 | -1.579 | 0.800 | -1.975 | 0.048 | 0.206 | 0.043~0.988 |
| LUS总分 | 0.221 | 0.065 | 3.411 | 0.001 | 1.248 | 1.099~1.417 |
| 注:LUS为肺部超声评分 | ||||||
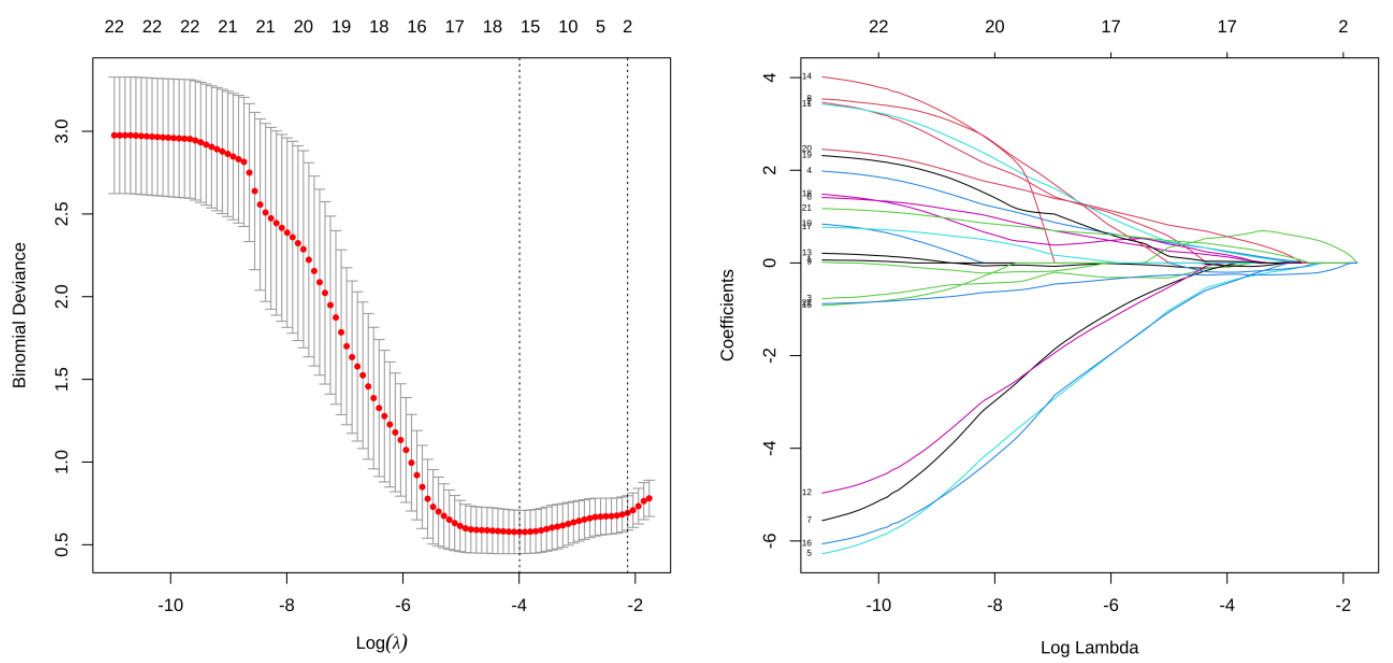
基于多因素Logistic回归分析的结果,绘制列线图(图 3),用于预测术后7 d肺部并发症的发生。根据每一项指标,垂直画一条线到评分轴上,从而得到相应分值,最后将分值相加得到总分,总分向下的垂直线对应老年患者全麻手术后肺部并发症的发生概率,列线图包括手术类型和LUS总分两项指标。
|
| 图 3 PPCs的列线图临床预测模型 Fig 3 Clinical prediction nomogram model for PPCs |
|
|
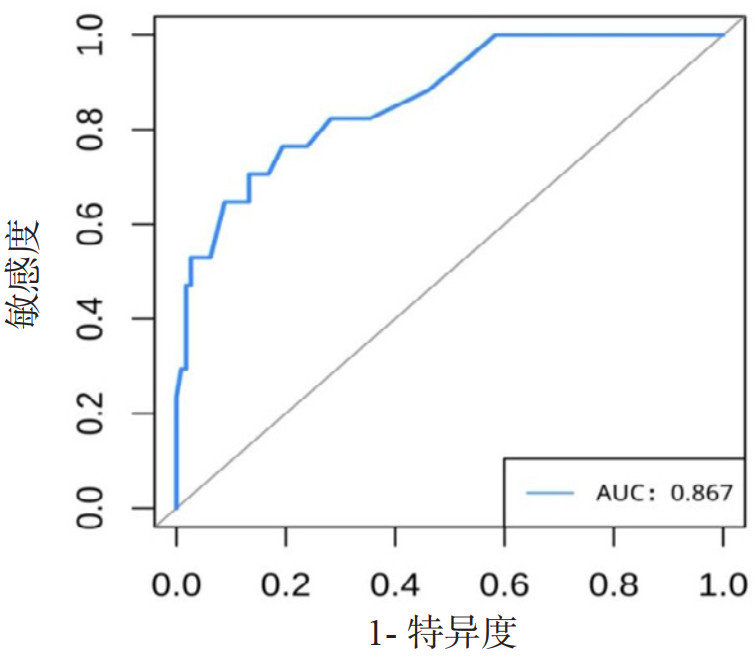
构建列线图预测模型ROC曲线,AUC=0.867(95%CI: 0.775~0.959),约登指数为0.573,敏感度为70.6%,特异度为86.7%。对原始数据集进行内部验证Bootstrap抽样1 000次,AUC=0.863(95%CI: 0.778~0.972)。证明LUS总分和手术类型作为预测PPCs具有良好的区分度。
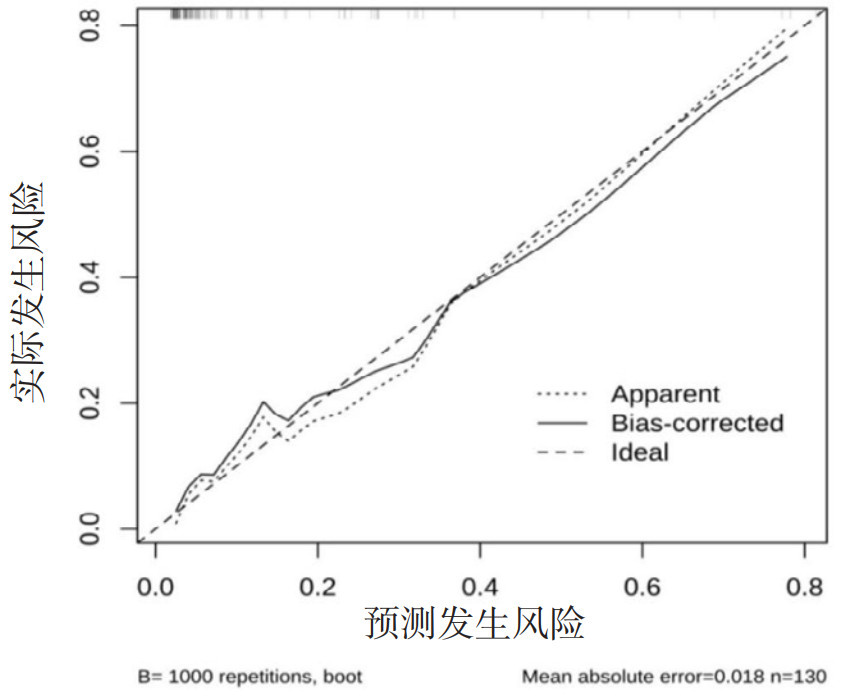
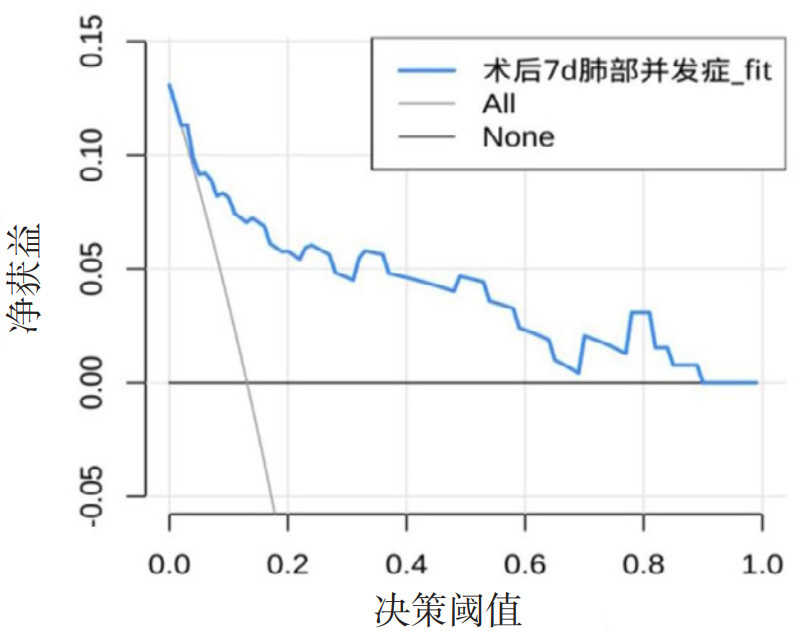
校准曲线显示模型预测风险与实际风险基本一致,见图 5。决策分析曲线提示,模型在阈概率0.03~0.89之间,比None和All有更高的净获益,见图 6。
|
| 图 4 PPCs的列线图ROC曲线 Fig 4 ROC curve for validating the PPCs nomogram |
|
|
|
| 图 5 PPCs的列线图校准曲线 Fig 5 Calibration curve of the PPCs nomogram |
|
|
|
| 图 6 PPCs的列线图DCA曲线 Fig 6 Decision curve analysis of the PPCs nomogram |
|
|
在这项前瞻性观察研究中,本团队探讨了机械通气后老年外科手术患者发生PPCs的结果,并评估了几个潜在的预测因素。本研究构建了一个基于LASSO回归结果的列线图来预测发生术后肺部并发症的可能性。预测模型显示,LUS总分是患者术后7 d发生PPCs的独立危险因,手术类型为择期相对于手术类型急症是独立保护因素。
已经开发了预测评分来识别存在PPCs风险的患者,例如加泰罗尼亚外科手术患者的呼吸风险(ARISCAT)评分[3]。然而,这些评分总结了许多项目,难以在床边使用;有些过于敏感,可预测轻微的呼吸系统并发症,对结果影响不大,而另一些则已在具有特定特征的队列中得到验证,这是很难外推的。目前仍缺少针对老年外科手术后特定的风险评分。
肺部超声在检测和诊断广泛的肺部疾病方面具有重要的作用[12]。有研究表明LUS在诊断腹部大手术后PPCs方面比胸部X线摄影更准确[13]。尽管CT扫描被认为是阐明肺部疾病原因的金标准,但由于需要辐射暴露和转移患者等不稳定因素使CT扫描成为一种不太理想的工具。相比之下,LUS可在床边进行,使其成为一种超便携工具,已被广泛证明具有无创、无辐射、快速、灵敏和可重复性[12]。LUS还可以用于诊断肺炎[14-15],并可用于诊断和随访呼吸机相关性肺炎患者[10];还可以用来检测胸腔积液并量化其体积[16-17],同时可以追踪围手术期肺不张的情况[18]或气胸[19]的发生;B线可以用于诊断肺损伤早期血管外肺水指数[20]。这些发现表明LUS检测到的肺不张可能是呼吸衰竭的早期预测因子[21]。本研究显示,LUS是一种预测患者发生PPCs风险的方法。近期一项研究[22]证明术后第一天LUS评分升高与腹部大手术后10 d内发生的PPCs相关,简化的前外侧LUS评分与12区LUS评分相关性良好,也可预测PPCs。这省去了术后早期对患者进行背部区域检查,减轻了患者翻身的痛苦,患者的依从性较好。本团队的分析结果显示LUS总分与PPCs的发生具有显著相关性
本研究表明,手术类型与PPCs之间存在明显的相关性。值得注意的是,接受紧急手术的患者,主要涉及腹部手术(常是探查性开腹手术),此类患者普遍基础疾病多,患者术后往往需要高流量氧气支持。这些腹部手术的急迫性和广泛的组织操作可能会增加PPCs的风险。急症腹部手术患者常常伴有严重的全身炎症反应、器官功能不全、休克等,这同样增加了机械通气的风险和复杂性。这强调了对患者进行细致的拔管评估和早期对肺部情况干预的重要性,特别是在涉及老年患者的紧急腹部手术中。该研究将手术部位分为三类: 腹部、头部和其他。需要说明的是,为避免手术操作本身对拔管后肺部超声评分的潜在影响,分析中排除了胸外科手术病例。然而,胸外科手术的缺失构成研究的一个局限性,在解读结果时必须考虑其潜在影响。未来研究应纳入更广泛的手术部位,包括胸外科手术,以更全面地评估手术部位对PPCs的影响。本研究采用了标准化的撤机方案,宽泛的纳入标准可能有助于提高研究结果的普遍适用性。然而,本研究也有一些局限性。首先,这是一项在PACU进行内部验证的多中心研究,但样本量太小,应将继续收集大样本研究的数据,进一步进行外部验证。其次,之前的研究大多集中在ICU,患者有严重的基础疾病和长时间的机械通气时间[23-27],PPCs的发生率较高。而本研究人群是由机械通气时间较短的老年外科手术患者组成,因此,结果的准确性有待进一步验证。另外,研究人员只对患者进行了一次肺部超声的检查,其结果可能存在误差。最后,由于担心手术操作对拔管后肺部超声评分的潜在影响,研究没有将胸部手术纳入分析,造成一些局限性。
综上所述,本研究的结果具有实质性的临床意义。通过整合LUS、手术类型等因素,临床医生可以对老年患者手术后PPCs风险做出更明智的评估,从而进行早期干预,并制定个性化的治疗方案,减少术后并发症的发生。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张靖君:研究设计、数据收集、论文撰写;喻文立:研究设计、论文修改、经费支持;贾莉莉:统计学指导、论文修改;盛明薇、孙英、丁梅:数据收集;刘伟华、李红霞、翁亦齐:技术指导
致谢: 本研究衷心感谢各分中心研究团队在数据收集工作中的鼎力支持与辛勤付出;特别感谢以下分中心单位的研究负责人天津市第四中心医院麻醉科张扬、天津市第五中心医院张艳莉、天津市泰达医院马浩南、山西省肿瘤医院张丽、山西医科大学附属第一医院郭志佳;各位同仁严谨的数据采集与质控为研究提供了坚实保障,其专业精神与协作态度深刻体现了多中心临床研究的核心价值
| [1] | Crowe S. Anaesthesia and the elderly[J]. Anaesthesia, 2002, 57(5): 501-521. DOI:10.1046/j.1365-2044.2002.26261.x |
| [2] | Smetana GW, Lawrence VA, Cornell JE, et al. Preoperative pulmonary risk stratification for noncardiothoracic surgery: systematic review for the American College of Physicians[J]. Ann Intern Med, 2006, 144(8): 581-595. DOI:10.7326/0003-4819-144-8-200604180-00009 |
| [3] | Canet J, Gallart L, Gomar C, et al. Prediction of postoperative pulmonary complications in a population-based surgical cohort[J]. Anesthesiology, 2010, 113(6): 1338-1350. DOI:10.1097/ALN.0b013e3181fc6e0a |
| [4] | Arozullah AM, Daley J, Henderson WG, et al. Multifactorial risk index for predicting postoperative respiratory failure in men after major noncardiac surgery. The National Veterans Administration Surgical Quality Improvement Program[J]. Ann Surg, 2000, 232(2): 242-253. DOI:10.1097/00000658-200008000-00015 |
| [5] | Jammer I, Wickboldt N, Sander M, et al. Standards for definitions and use of outcome measures for clinical effectiveness research in perioperative medicine: European Perioperative Clinical Outcome (EPCO) definitions: a statement from the ESA-ESICM joint taskforce on perioperative outcome measures[J]. Eur J Anaesthesiol, 2015, 32(2): 88-105. DOI:10.1097/EJA.0000000000000118 |
| [6] | Wang W, Zhu SC, He Q, et al. Fluid balance and ventilator-associated events among patients admitted to ICUs in China: a nested case-control study[J]. Crit Care Med, 2022, 50(2): 307-316. DOI:10.1097/CCM.0000000000005227 |
| [7] | Collins GS, Reitsma JB, Altman DG, et al. Transparent reporting of a multivariable prediction model for individual prognosis or diagnosis (TRIPOD): the TRIPOD statement[J]. Br J Cancer, 2015, 112(2): 251-259. DOI:10.1038/bjc.2014.639 |
| [8] | Maggiore SM, Battilana M, Serano L, et al. Ventilatory support after extubation in critically ill patients[J]. Lancet Respir Med, 2018, 6(12): 948-962. DOI:10.1016/S2213-2600(18)30375-8 |
| [9] | Boles JM, Bion J, Connors A, et al. Weaning from mechanical ventilation[J]. Eur Respir J, 2007, 29(5): 1033-1056. DOI:10.1183/09031936.00010206 |
| [10] | Bouhemad B, Liu ZH, Arbelot C, et al. Ultrasound assessment of antibiotic-induced pulmonary reaeration in ventilator-associated pneumonia[J]. Crit Care Med, 2010, 38(1): 84-92. DOI:10.1097/CCM.0b013e3181b08cdb |
| [11] | Bouhemad B, Brisson H, Le-Guen M, et al. Bedside ultrasound assessment of positive end-expiratory pressure-induced lung recruitment[J]. Am J Respir Crit Care Med, 2011, 183(3): 341-347. DOI:10.1164/rccm.201003-0369OC |
| [12] | Lichtenstein D, Goldstein I, Mourgeon E, et al. Comparative diagnostic performances of auscultation, chest radiography, and lung ultrasonography in acute respiratory distress syndrome[J]. Anesthesiology, 2004, 100(1): 9-15. DOI:10.1097/00000542-200401000-00006 |
| [13] | Touw HR, Schuitemaker AE, Daams F, et al. Routine lung ultrasound to detect postoperative pulmonary complications following major abdominal surgery: a prospective observational feasibility study[J]. Ultrasound J, 2019, 11(1): 20. DOI:10.1186/s13089-019-0135-6 |
| [14] | Reissig A, Copetti R, Mathis G, et al. Lung ultrasound in the diagnosis and follow-up of community-acquired pneumonia A prospective, multicenter, diagnostic accuracy study[J]. Chest, 2012, 142(4): 965-972. DOI:10.1378/chest.12-0364 |
| [15] | Cortellaro F, Colombo S, Coen D, et al. Lung ultrasound is an accurate diagnostic tool for the diagnosis of pneumonia in the emergency department[J]. Emerg Med J, 2012, 29(1): 19-23. DOI:10.1136/emj.2010.101584 |
| [16] | Vignon P, Chastagner C, Berkane V, et al. Quantitative assessment of pleural effusion in critically ill patients by means of ultrasonography[J]. Crit Care Med, 2005, 33(8): 1757-1763. DOI:10.1097/01.ccm.0000171532.02639.08 |
| [17] | Balik M, Plasil P, Waldauf P, et al. Ultrasound estimation of volume of pleural fluid in mechanically ventilated patients[J]. Intensive Care Med, 2006, 32(2): 318. DOI:10.1007/s00134-005-0024-2 |
| [18] | Monastesse A, Girard F, Massicotte N, et al. Lung ultrasonography for the assessment of perioperative atelectasis: a pilot feasibility study[J]. Anesth Analg, 2017, 124(2): 494-504. DOI:10.1213/ANE.0000000000001603 |
| [19] | Xie C, Sun K, You YY, et al. Correction to: Feasibility and efficacy of lung ultrasound to investigate pulmonary complications in patients who developed postoperative Hypoxaemia-a prospective study[J]. BMC Anesthesiol, 2020, 20(1): 281. DOI:10.1186/s12871-020-01196-3 |
| [20] | Redondo Calvo FJ, Bejarano Ramirez N, Uña Orejon R, et al. Elevated extravascular lung water index (ELWI) as a predictor of failure of continuous positive airway pressure via helmet (helmet-CPAP) in patients with acute respiratory failure after major surgery[J]. Arch De Bronconeumología Engl Ed, 2015, 51(11): 558-563. DOI:10.1016/j.arbr.2015.05.013 |
| [21] | Gargani L, Lionetti V, Di Cristofano C, et al. Early detection of acute lung injury uncoupled to hypoxemia in pigs using ultrasound lung comets[J]. Crit Care Med, 2007, 35(12): 2769-2774. DOI:10.1097/01.CCM.0000287525.03140.3F |
| [22] | Boussier J, Lemasle A, Hantala N, et al. Lung ultrasound score on postoperative day 1 is predictive of the occurrence of pulmonary complications after major abdominal surgery: a multicenter prospective observational study[J]. Anesthesiology, 2024, 140(3): 417-429. DOI:10.1097/ALN.0000000000004855 |
| [23] | Dres M, Similowski T, Goligher EC, et al. Dyspnoea and respiratory muscle ultrasound to predict extubation failure[J]. Eur Respir J, 2021, 58(5): 2100002. DOI:10.1183/13993003.00002-2021 |
| [24] | Spadaro S, Grasso S, Mauri T, et al. Can diaphragmatic ultrasonography performed during the T-tube trial predict weaning failure? The role of diaphragmatic rapid shallow breathing index[J]. Crit Care, 2016, 20(1): 305. DOI:10.1186/s13054-016-1479-y |
| [25] | Jung B, Moury PH, Mahul M, et al. Diaphragmatic dysfunction in patients with ICU-acquired weakness and its impact on extubation failure[J]. Intensive Care Med, 2016, 42(5): 853-861. DOI:10.1007/s00134-015-4125-2 |
| [26] | Vivier E, Muller M, Putegnat JB, et al. Inability of diaphragm ultrasound to predict extubation failure: a multicenter study[J]. Chest, 2019, 155(6): 1131-1139. DOI:10.1016/j.chest.2019.03.004 |
| [27] | Ferré A, Guillot M, Lichtenstein D, et al. Lung ultrasound allows the diagnosis of weaning-induced pulmonary oedema[J]. Intensive Care Med, 2019, 45(5): 601-608. DOI:10.1007/s00134-019-05573-6 |
 2025, Vol. 34
2025, Vol. 34