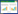2. 广东省揭阳市人民医院医学影像中心,揭阳 522000;
3. 南方医科大学附属广东省人民医院急诊科,广州 510100
非伤寒沙门氏菌(Non-typhoidal Salmonella, NTS)感染是全球感染性腹泻的四大原因之一,常经由污染的食物或水源传播[1-3]。多数患者支持治疗后得以恢复,但老年患者或免疫缺陷者合并严重并发症的风险较高[4]。NTS菌血症多出现在该类人群,常导致迁徙感染和并发症,甚至动脉瘤发生。动脉瘤可出现在不同血管,腹主动脉受累在NTS主动脉感染中几乎占到20%[5]。而胸主动脉受累,特别是主动脉壁内膜撕裂导致主动脉夹层的情况更为凶险,需要详尽的临床检查和积极的干预[6-7]。本院2023年收治1例NTS菌血症合并胸主动脉夹层病例,现报道如下。
1 资料与方法64岁男性患者,因“反复发热19 d,腹痛、声嘶1 d”入院。既往合并2型糖尿病,血糖控制欠佳;无高血压、马凡综合征病史,无外伤史。患者入院前19 d出现发热,体温最高达39℃,无腹痛、腹泻、咳嗽和咳痰等。外院查体示血压正常,四肢血压无异常,腹部平软。心电图示窦性心律,无ST段抬高。血清心肌酶水平正常。胸部CT检查未见显著异常。外院给予对症治疗后仍反复发热。1 d前出现腹痛、声嘶,来本院就诊,测收缩压158 mmHg。血气分析示呼吸性碱中毒。血常规示白细胞计数升高(10.15×103/μL,正常范围:3.5~9.5×103/μL),中性粒细胞升高为主[7.62×103/μL,正常范围:(1.5~6.3)×103/μL],超敏C反应蛋白(hs-CRP)升高(71.2 mg/dL,正常范围:0~10 mg/L)。入院血培养13 h后报“沙门氏菌属,O4血清型”,药敏提示头孢曲松敏感。
入院后查肌酸激酶-MB、肌红蛋白和N端脑钠肽前体结果均为阴性。肌酐和甲状腺功能结果正常。超敏肌钙蛋白T(hs-TNT)轻度升高(19.7 ng/L,正常范围:0~14 ng/L),D-二聚体(D-D)为2.21 mg/L(正常范围:0~0.5 mg/L)。感染四项阴性。经胸超声心动图除外心内膜炎,诊断考虑肺栓塞或其他潜在病因,行胸腹部增强CT扫描,结果显示Stanford B型主动脉夹层,近端左锁骨下动脉附近1.6 cm内膜破裂,延伸至T12和L1椎体水平;其中假腔由主动脉弓延伸至腹主动脉,伴腔内血栓形成(图 1)。
|
| A、B、C为Stanford B型主动脉夹层,假腔由近端左锁骨下动脉附近1.6 cm延伸至腹主动脉T12-L1椎体水平 图 1 起病19 d时胸腹增强CT |
|
|
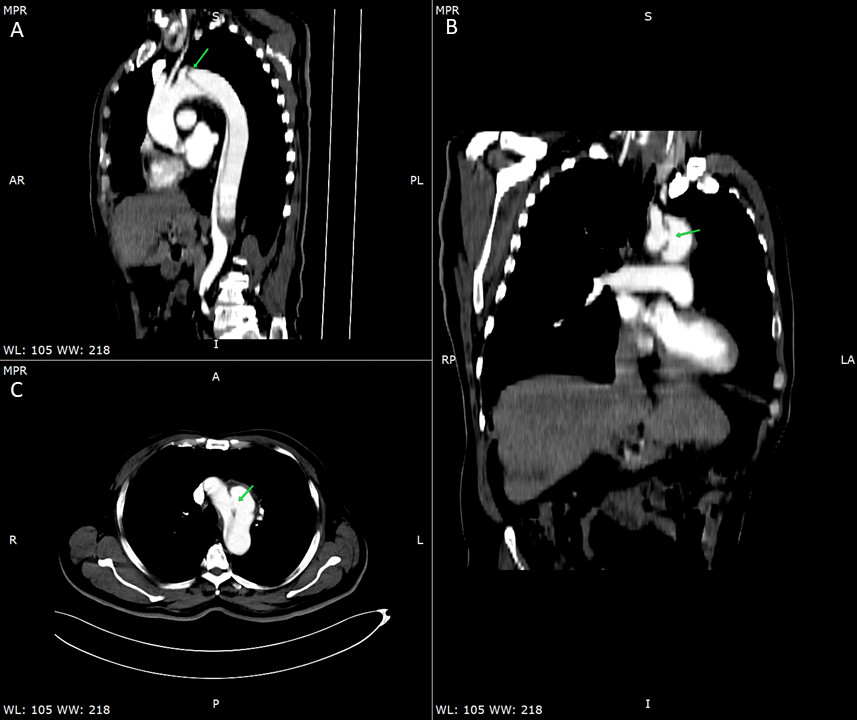
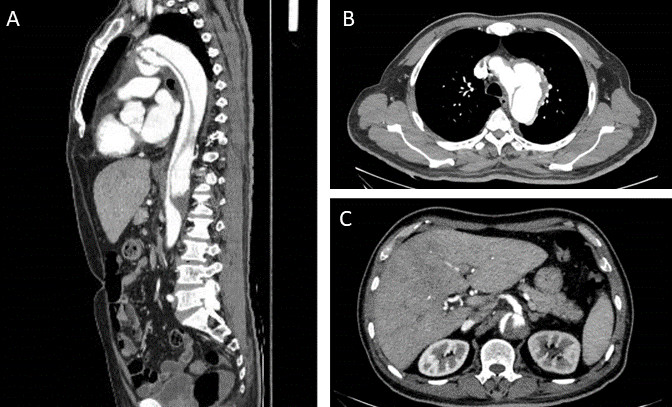
监测患者血流动力学稳定,临床评估提示NTS菌血症伴发B型主动脉夹层,鉴于菌血症,予以抗感染治疗(头孢曲松),计划感染控制后行手术干预。入院4 d后复查CT显示主动脉夹层向远处延伸,从主动脉弓延伸至腹主动脉中段,与L2-L3椎体水平一致;且真腔小于假腔,腹腔干和左肾动脉均起源于假腔(图 2),考虑假腔内高压挤压真腔。在充分抗菌和降糖治疗后,患者的感染指标逐渐下降,临床症状改善,遂建议进行手术治疗。但患者家属因经济原因放弃治疗,自行要求出院。出院1月余,患者于家中心搏骤停。
|
| A为Stanford B型主动脉夹层,夹层由主动脉弓延伸至腹主动脉中段L2-L3椎体水平;B为假腔大于真腔;C为腹腔干和左肾动脉均起源于假腔 图 2 起病23 d时胸腹盆增强CT |
|
|
|
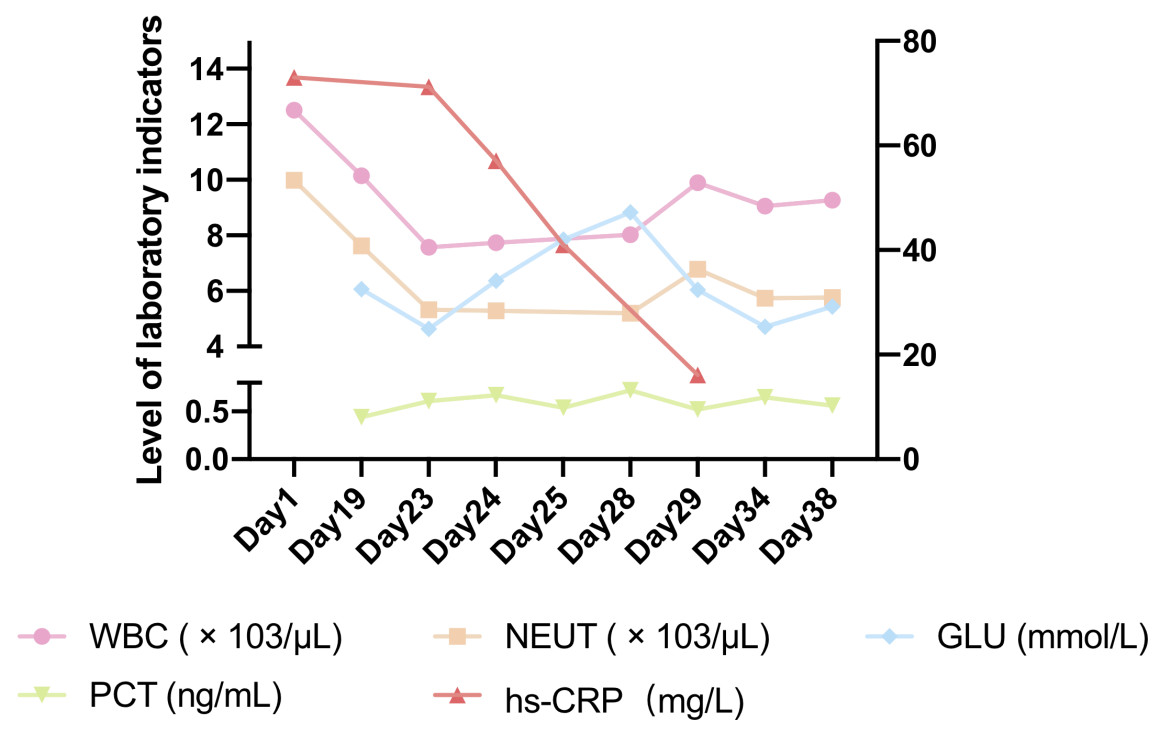
| 图 3 患者的临床指标变化(右侧纵坐标为hs-CRP水平) |
|
|
NTS感染是世界性公共卫生问题,其发病率因地区、季节和感染群体年龄而异[13]。社区感染的系统性综述表明NTS是非洲和亚洲最常见的致病菌[14],也是中国急性腹泻的主要原因[15]。菌血症是NTS感染的并发症,合并糖尿病、免疫缺陷、慢性肾脏病和肝脏疾病以及肠道屏障异常的患者更容易发生菌血症。近年来已有数个个案报道NTS菌血症与主动脉夹层间存在罕见但不容忽视的联系[8-12](表 1)。
| 参考文献 | 年份 | 类型/数量 | 年龄/性别 | 首发症状 | 既往史 | 发病部位 | 药物治疗 | 手术治疗 | 结局 |
| 1[8] | 2007 | 病例/1 | 59/男性 | 背痛 | 高血压,糖尿病 | 胸降主动脉 | 美罗培南4周,后长期口服左氧氟沙星 | 胸主动脉置换术 | 生存4个月 |
| 2[9] | 2016 | 病例/1 | 84/男性 | 胸痛 | 缺血性心脏病 | 胸主动脉近端和中段降主动脉 | 头孢曲松4周,后口服环丙沙星终身 | 主动脉腔内修复术 | 生存6周 |
| 3[10] | 2022 | 病例/1 | 89/男性 | 发热、寒战、全身疲劳和轻度腹泻 | 慢性阻塞性肺病,高血压,高脂血症,慢性肾脏病 | 胸降主动脉 | 左氧氟沙星6周,后口服喹诺酮类药物 | 主动脉腔内修复术 | 生存6周 |
| 4[11] | 2022 | 病例/1 | 53/女性 | 双下肢水肿、少尿、呼吸困难和端坐呼吸 | 高血压,心力衰竭,脑梗死个人史,肾移植术后 | 升主动脉 | 不详 | 无 | 死亡 |
| 5[12] | 2023 | 病例/1 | 62/男性 | 胸痛、上腹痛、呕吐 | 高血压,高脂血症,慢性阻塞性肺病, 硬膜下血肿史,吸毒史(海洛因) | 升主动脉和主动脉弓 | 头孢曲松钠 | 升主动脉半弓置换 | 生存30 d |
NTS菌血症继发主动脉炎是一种罕见但致命的并发症。当NTS进入血液后,侵入主动脉壁,导致炎症和内皮损伤[16-18]。随着主动脉炎进展,血管壁衰弱,导致感染性主动脉瘤或假性动脉瘤,甚至夹层出现;进展的过程可能隐匿发生。而NTS是导致腹主动脉瘤和胸主动脉瘤的主要病原体[19-20]。此外,感染性主动脉炎的病死率显著高于非感染性主动脉炎[21]。流行病学研究表明,50岁以上年龄段的NTS菌血症患者发生动脉瘤的概率为6.5%,而在伴有血管感染的患者中,病死率可高达43%[22]。因此,了解NTS菌血症与主动脉动脉瘤和夹层的关联对早期诊断和干预至关重要。
本例患者年龄大于50岁,且有糖尿病史,NTS菌血症及血管受累的发生风险增加。患者起病初期以发热为主要症状,无高血压,四肢血压无异常,且胸部CT未见显著异常,提示其感染在先,出现主动脉夹层在后。而血培养结果表明患者存在NTS活动性感染,NTS菌血症容易继发主动脉感染,导致主动脉炎和内膜破损,进而出现主动脉瘤甚至主动脉夹层。另一方面,本例患者除外了主动脉夹层的其他危险因素如高血压、马凡综合征病史和外伤史等,亦无梅毒等其他病原体感染。因此,本例患者的NTS感染和主动脉夹层之间存在较明显的因果提示,但两者间的具体联系仍需进一步的大样本前瞻性临床研究或动物实验以证实。
放射影像学(如CT和MRI)在确诊沙门氏菌引起的主动脉感染中起关键作用[7]。有研究建议50岁以上出现NTS菌血症的患者进行CT检查以排除血管感染的可能[22]。此外,NTS血管感染评分(NTSVI)系统可以预测50岁以上NTS菌血症患者发生血管感染的风险。如果NTSVI评分≥1,建议进行CT血管造影(CTA)。本患者的NTSVI评分已超过了1分,放射影像学证实存在主动脉夹层,该病病死率显著高于主动脉炎和主动脉瘤[6]。因此,50岁以上的NTS菌血症患者应强烈考虑进行影像学检查。
在怀疑NTS菌血症或合并血管感染的患者中,在等待药敏结果的同时应立即开始应用第三代头孢菌素和氟喹诺酮类药物进行经验性抗生素治疗。氟喹诺酮类药物可有效穿透细胞,且具有良好的口服生物利用度,临床症状改善后可转换为口服治疗;其他抗生素如磺胺甲噁唑-甲氧苄啶和氨苄青霉素也可以考虑。但由于缺乏指南或随机对照试验,目前抗感染的最佳时间仍存在争议。沙门氏菌主动脉炎的总体病死率为60%,仅使用抗生素的病死率高达96%,而抗生素和手术修复受损主动脉的联合治疗可将其降低到40%[5]。沙门氏菌易出现高度耐药性,特别存在受损组织或假体材料中可能难以根除。对于假体关节、心脏瓣膜或血管移植物出现感染的患者,应采用长期抗菌治疗以防复发性感染。合理治疗方案应基于药敏结果,可包括磺胺甲噁唑-甲氧苄啶、左氧氟沙星或环丙沙星。
到目前为止,有5例NTS菌血症合并主动脉夹层的报道[8-12],所有患者年龄均大于50岁。仅有一名患者最初临床表现为背痛(主动脉夹层最常见的症状),其余均为非典型症状。其中4例在接受抗感染和手术修复的联合治疗后存活。而其中1名患者,患有升主动脉夹层,于术前去世[11]。术后,4名患者均接受了长期的抗生素治疗。特别的是,其中有1名89岁伴有细菌性肺炎的患者,由于不适合手术,采用血管内介入治疗联合抗菌治疗,最终存活[10]。这些病例证明NTS菌血症合并主动脉夹层多隐匿起病,症状不典型,而抗感染联合及时手术治疗的方式具有良好疗效。
总之,NTS菌血症合并主动脉夹层虽罕见但致命。医护人员必须意识到该关联,及时识别以便早期诊断,采用感染疾病专家和心胸外科团队协作的方式进行干预,改善患者预后、降低病死率。对于50岁及以上者,在发现NTS菌血症时应考虑CTA检查,以排除主动脉受累的可能。后续仍需要更多的研究来深入了解两者间关联的确切机制并制定治疗指南。
利益冲突 所有作者声明无利益冲突
作者贡献声明 麦聪及陈轩馥: 论文撰写,侯贵松、施琳莉资料收集及整理,李欣及麦聪:研究设计、论文修改
| [1] | Hu YY, Wang J, Chen S, et al. Non-typhoidal Salmonella invasive infections in China[J]. Lancet Infect Dis, 2022, 22(7): 939. DOI:10.1016/S1473-3099(22)00347-4 |
| [2] | Chousalkar KK, Willson NL. Nontyphoidal Salmonella infections acquired from poultry[J]. Curr Opin Infect Dis, 2022, 35(5): 431-435. DOI:10.1097/QCO.0000000000000876 |
| [3] | Marchello CS, Birkhold M, Crump JA, et al. Complications and mortality of non-typhoidal Salmonella invasive disease: a global systematic review and meta-analysis[J]. Lancet Infect Dis, 2022, 22(5): 692-705. DOI:10.1016/S1473-3099(21)00615-0 |
| [4] | Fierer J. Invasive non-typhoidal Salmonella (iNTS) infections[J]. Clin Infect Dis, 2022, 75(4): 732-738. DOI:10.1093/cid/ciac035 |
| [5] | Soravia-Dunand VA, Loo VG, Salit IE. Aortitis due to Salmonella: report of 10 cases and comprehensive review of the literature[J]. Clin Infect Dis, 1999, 29(4): 862-868. DOI:10.1086/520450 |
| [6] | Bossone E, Eagle KA. Epidemiology and management of aortic disease: aortic aneurysms and acute aortic syndromes[J]. Nat Rev Cardiol, 2021, 18(5): 331-348. DOI:10.1038/s41569-020-00472-6 |
| [7] | Hameed I, Cifu AS, Vallabhajosyula P. Management of thoracic aortic dissection[J]. JAMA, 2023, 329(9): 756-757. DOI:10.1001/jama.2023.0265 |
| [8] | Kimura N, Yamaguchi A, Noguchi K, et al. Type B aortic dissection associated with Salmonella infection[J]. Gen Thorac Cardiovasc Surg, 2007, 55(5): 212-216. DOI:10.1007/s11748-007-0109-7 |
| [9] | Smith S, Okereke Q, Hanson J. Nontyphoidal Salmonella bacteremia resulting in thoracic aortic dissection[J]. Am J Trop Med Hyg, 2016, 95(5): 979. DOI:10.4269/ajtmh.16-0355 |
| [10] | Patil S, Wieser M, Chen C, et al. Acute Salmonella typhimurium aneurysmal aortitis with bacteremia, pneumonia, and thoracic aortic dissection in an elderly male[J]. Cureus, 2022, 14(1): e21431. DOI:10.7759/cureus.21431 |
| [11] | Jan HE, Lee WH, Hsieh CC, et al. Salmonella aortitis complicated with ascending aortic dissection[J]. Acta Cardiol Sin, 2023, 39(1): 169-171. DOI:10.6515/ACS.202301_39(1).20220625A |
| [12] | Yoshida S, Manerikar A, Zhu MG, et al. Successful surgical treatment of Stanford type A aortic dissection due to Salmonella aortitis[J]. J Cardiothorac Surg, 2023, 18(1): 233. DOI:10.1186/s13019-023-02318-x |
| [13] | Marchello CS, Fiorino F, Pettini E, et al. Incidence of non-typhoidal Salmonella invasive disease: a systematic review and meta-analysis[J]. J Infect, 2021, 83(5): 523-532. DOI:10.1016/j.jinf.2021.06.029 |
| [14] | Marchello CS, Dale AP, Pisharody S, et al. A systematic review and meta-analysis of the prevalence of community-onset bloodstream infections among hospitalized patients in Africa and Asia[J]. Antimicrob Agents Chemother, 2019, 64(1): e01974-19. DOI:10.1128/AAC.01974-19 |
| [15] | Wang LP, Zhou SX, Wang X, et al. Etiological, epidemiological, and clinical features of acute diarrhea in China[J]. Nat Commun, 2021, 12(1): 2464. DOI:10.1038/s41467-021-22551-z |
| [16] | Deipolyi AR, Czaplicki CD, Oklu R. Inflammatory and infectious aortic diseases[J]. Cardiovasc Diagn Ther, 2018, 8(Suppl 1): S61-S70. DOI:10.21037/cdt.2017.09.03 |
| [17] | Pugh D, Grayson P, Basu N, et al. Aortitis: recent advances, current concepts and future possibilities[J]. Heart, 2021, 107(20): 1620-1629. DOI:10.1136/heartjnl-2020-318085 |
| [18] | Quintana RA, Taylor WR. Cellular mechanisms of aortic aneurysm formation[J]. Circ Res, 2019, 124(4): 607-618. DOI:10.1161/CIRCRESAHA.118.313187 |
| [19] | Hsu RB, Chang CI, Chan CY, et al. Infected aneurysms of the suprarenal abdominal aorta[J]. J Vasc Surg, 2011, 54(4): 972-978. DOI:10.1016/j.jvs.2011.04.024 |
| [20] | Hsu RB, Lin FY. Infected aneurysm of the thoracic aorta[J]. J Vasc Surg, 2008, 47(2): 270-276. DOI:10.1016/j.jvs.2007.10.017 |
| [21] | Carrer M, Vignals C, Berard X, et al. Retrospective multicenter study comparing infectious and noninfectious aortitis[J]. Clin Infect Dis, 2023, 76(3): e1369-e1378. DOI:10.1093/cid/ciac560 |
| [22] | Nielsen H, Gradel KO, Schønheyder HC. High incidence of intravascular focus in nontyphoid Salmonella bacteremia in the age group above 50 years: a population-based study[J]. APMIS, 2006, 114(9): 641-645. DOI:10.1111/j.1600-0463.2006.apm_480.x |
 2025, Vol. 34
2025, Vol. 34