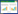2. 解放军总医院第一医学中心急诊科,北京 100039;
3. 解放军总医院海南医院重症医学科,三亚 572013;
4. 天津医科大学总医院急诊医学科 天津 300041;
5. 赣南医科大学第一附属医院急诊科,赣州 341000;
6. 海南省人民医院,海口 570311;
7. 南方医科大学第二临床医学院,广州 510000;
8. 解放军总医院海南医院急诊医学科,三亚 572013
2. Department of Emergency, The First Medical Center, Chinese PLA General Hospital, Beijing, 100039, China;
3. Department of Critical Care Medicine, Hainan Hospital of PLA General Hospital, Sanya, Hainan Province, 572013, China;
4. Department of Emergency, Tianjin Medical University General Hospital, Tianjin, 300041, China;
5. Department of Emergency, The First Affiliated Hospital of Gannan Medical University, Ganzhou, Jiangxi Province, 341000;
6. Hainan General Hospital, Haikou, Hainan Province, 570311, China;
7. The Second School of Clinical Medicine, Southern Medical University, Guangzhou, Guangdong Province, 510000, China;
8. Department of Emergency, Hainan Hospital of PLA General Hospital, Sanya, Hainan Province, 572013, China
中国急性冠状动脉综合征(acute coronary artery disease,ACS)患病率、死亡率总体呈快速上升态势,其临床发病到死亡时间短暂,病情恶化迅速,其不良预后严重危害人民健康,是一种严重威胁国人健康的多因素疾病。近年来,GDF15因其在心血管领域的重要作用,受到国内外学者的广泛关注[1-3],多项研究数据表明,GDF15在心血管疾病中的联合诊断、危险分层、预后判断等多个方面均表现出显著优势[4]。本课题组前期研究发现,GDF15在急性胸痛早期诊断具有很好的诊断及预后预测价值,GDF15联合TnT可提高ACS的诊断率[5]。经过进一步研究,笔者发现部分ACS患者血清GDF15表达模式不同于“单峰”状的传统心肌损伤标志物,其表达水平呈时相性表达,即随时间变化呈“双峰”形态,GDF15水平升高至4 h后逐渐下降,24 h再次达高峰。但是未指出“双峰”与“单峰”的具体差异。本研究根据GDF15随时间变化的特征,将急性心肌缺血患者分为GDF15时相性表达和非时相性表达两个“亚型”,旨在分析两个疾病“亚型”间患者一般情况、临床特征和预后的差异。
1 资料与方法 1.1 研究对象选取2023年2月-10月于三个中心急诊科就诊的ACS患者289名进行比较。三个中心联合成立了质控分析小组,建立严格的可执行方案并统一执行,保证三个中心纳排标准、诊断标准、检测标准的一致化和标准化。纳入标准:①年龄≥18岁。②符合急性冠脉综合征急诊快速诊治指南(2019)。③其他无法鉴别的急性胸痛患者。排除标准:①近期内有手术史、颅内出血史。②合并恶性肿瘤。③有糖尿病史。④近2个月有发热、急性或慢性炎症性疾病。⑤血液病、凝血功能障碍以及自身免疫性疾病患者。⑥伴有肝肾功能障碍、感染性疾病。⑦先天性心血管系统疾病、心源性休克、严重性心力衰竭等患者。⑧收缩压 > 180 mmHg,未按时服用降压药者。根据测得入组患者入院后0 h,4 h,8 h,24 h,48 h,60 h血清中GDF15水平将患者分为时相性表达组与非时相性表达组。其中时相性表达组男性14人,女性1人,年龄(61.13±14.79)岁,非时相性表达组男性9人,女性6人,年龄(64.57±11.71)岁,均有完整的检验结果。
1.2 研究方法 1.2.1 一般信息及临床检验指标患者入组后即刻收集首次静脉血标本,采血离心后留取血浆样本,检测糖化血红蛋白、甘油三酯、高密度脂蛋白、低密度脂蛋白、肌酐、尿酸及GDF15水平等。生化检查采用自动生化分析仪(全自动生化分析仪罗氏C8000,德国),在赣南医学院第一附属医院检验科以及海南省人民医院检验科进行GDF15采用人生长分化因子-15(GDF15)检测试剂盒(荧光免疫层析法),试剂盒由上海乐合生物科技有限公司提供。统计患者相关资料并记录研究所需基础资料情况。基础资料主要包括年龄、性别、BMI等基本资料。本研究所有结果分别通过赣南医学院第一附属医院伦理委员会审查(伦理审核号:22SC-2022112403),海南省人民医院伦理委员会审查(伦理审核号:S2022-048-01),天津总医院伦理委员会审查(伦理审核号:IRB2022-YX-171-01),所有结果均征得患者知情同意。
1.2.2 超声心电图检测使用床旁超声机(Mindary M9,中国)检测,记录室壁运动、肺动脉压、主肺动脉宽度、心包积液、左室收缩末容积、左室舒张末容积、左室射血分数、左室收缩指数等指标。操作人员均为超声科主治医师。
1.2.3 冠状动脉造影及Gensini评分(定量评价冠状动脉病变程度)冠脉造影手术均由心内科医师进行,分别于赣南医学院第一附属医院以及海南省人民医院导管室实施操作。植入支架有两种,包括Firekingfisher支架(中国)和Firebird2支架(中国)。手术前均得到患者本人及家属知情同意并签字。根据美国心脏病协会所规定的冠状动脉血管图像记分分段评价标准,采用Gensini积分系统,对每支冠脉血管病变狭窄程度进行定量评定:即狭窄程度以最严重处为标准,狭窄直径 < 25 % 计1分,≥ 25 % ~ < 50 % 计2分,≥ 50 % ~ < 75 % 计4分,≥ 75 % ~ < 90 % 计8分,≥ 90 % ~ < 99 % 计16分,≥ 99 % 计32分。根据不同冠脉分支将以上得分乘以相应系数,左主干病变:得分×5;左前降支病变:近端×2.5,中段×1.5;对角支病变:D 1×1,D 2×0.5;左回旋支病变:近端×2.5,远端×1;后降支×1;后侧支×0.5;右冠状动脉病变:近、中、远和后降支均×1。各病变支得分总和即为患者的冠状动脉病变狭窄程度总积分[6]。
1.3 统计学方法统计软件采用SPSS 27和R语言。计量资料以均数±标准差(x±s)表示,非正态分布数据以M(Qr)表示。计量资料的比较采用成组的t检验,方差分析(ANOVA)和多重比较检验,计数资料采用χ2检验,ROC曲线采用DeLong检验。以P < 0.05具有统计学意义。
2 结果 2.1 急性冠脉综合征各组间一般情况比较通过比较ACS各组间的年龄、性别、既往史(吸烟史),发现ACS中总的趋势呈现男多女少(73.36% vs. 26.64%), 年龄(60.24±14.92)岁。其中以STEMI组男女比例最大,均为(78.57% vs. 21.43%),年龄最大的组别为UA,年龄为(63.98±15.19)岁,年龄最小的组别是非ACS胸痛组,年龄仅为(54.29±16.39)岁。UA组,STEMI组,NSTEMI组中既往有吸烟史的比例较高。见表 1。
| 类型 | 例数 | 性别(男,%) | 年龄(岁,x±s) | 吸烟史(n,%) |
| UA | 63 | 49(77.78) | 63.98±15.19 | 36(57.14) |
| STEMI | 98 | 77(78.57) | 60.30±12.78 | 64(65.31) |
| NSTEMI | 64 | 45(70.31) | 62.31±14.37 | 31(48.44) |
| 非ACS胸痛 | 64 | 41(64.06) | 54.29±16.39 | 22(34.38) |
| 总数 | 289 | 212(73.36) | 60.24±14.92 | 153(52.94) |
进一步比较ACS各组间检验指标的差异情况,发现急性胸痛中肌钙蛋白T(TnT)、肌酸激酶同工酶(CK-MB)、脑利钠肽前体(BNP)在各组间的差异均具有统计学意义,表明这些指标在ACS均具有鉴别诊。见表 2。
| 类型 | 肌钙蛋白T(ng/mL) | 肌酸激酶同工酶(U/L) | 脑利钠肽前体(pg/mL) | GDF15 (ng/mL) |
| UA | 23.70(7.35, 54.65) | 1.56(1.09, 3.61) | 410.50(95.70, 2330.65) | 200.54(149.61, 382.57) |
| STEMI | 686.50(178.60, 1626.50) | 17.33(3.08, 68.86) | 993.20(252.05, 4204.55) | 237.40(142.65, 455.70) |
| NSTEMI | 500.30(150.40, 1525.10) | 18.75(3.11, 49.60) | 1159.70(163.00, 3049.20) | 203.48(130.84, 316.90) |
| 非ACS胸痛 | 6.20(2.60, 16.60) | 1.30(0.73, 2.90) | 106.70(0.10, 649.10) | 158.53(100.00, 321.55) |
| Z值 | 99.077 | 68.009 | 23.372 | 7.075 |
| P值 | < 0.001 | < 0.001 | < 0.001 | 0.042 |
TnT,GDF15,TNT联合GDF15的AUC值分别为0.823、0.743、0.841,而BNP以及TNT+BNP作为指标的AUC值分别为0.679、0.757。与传统的诊断标志物相比较,TnT联合GDF15具有更加良好的诊断价值。如图 1。
|
| 图 1 TnT、BNP和GDF15在ACS中的诊断价值 Fig 1 Diagnostic value of TNT, BNP and GDF15 in ACS |
|
|
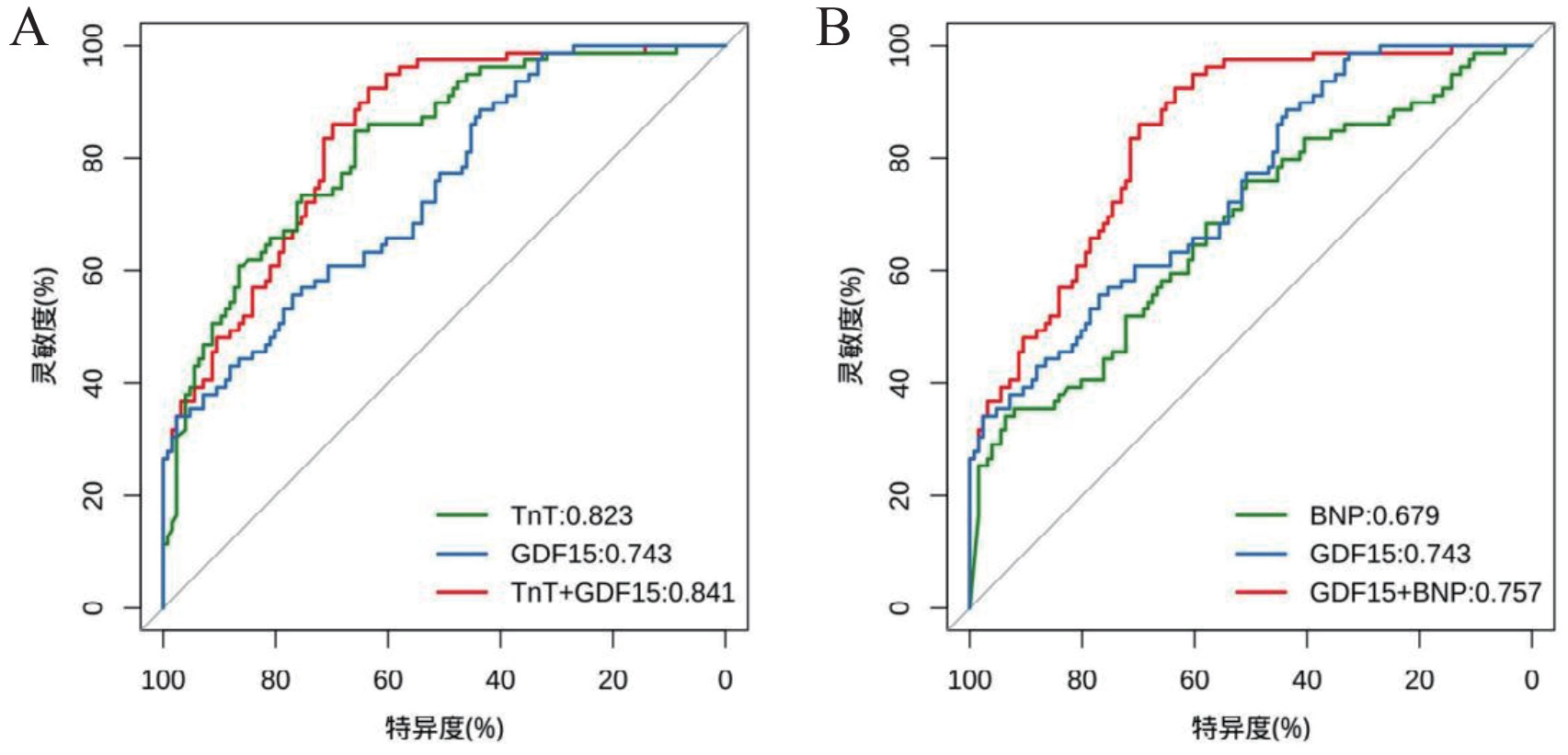
分别测量了两组患者0 h,4 h,8 h,24 h,48 h,60 h五个时间点血清中GDF15的浓度,发现了非时相性表达组的患者血清GDF15水平呈单峰现象,即0 h开始升高至24 h后开始下降。而时相性表达组的患者血清GDF15水平呈双峰现象,即0 h升高至4 h后逐渐下降,24 h后再次达峰。如图 2。
|
| 注:aP < 0.05 图 2 GDF15趋势变化曲线 Fig 2 Trend change curve of GDF15 |
|
|
将时相性表达组的一般情况与非时相性表达组患者的一般情况进行对比分析,结果显示年龄、性别、BMI因素差异无统计学意义(P > 0.05),见表 3。
| 组别 | 年龄(x±s) | 男性(n, %) | BMI(x±s) |
| 非时相性表达组 | 59.133 ± 14.407 | 9(60) | 22.647±2.095 |
| 时相性表达组 | 63.563 ± 12.681 | 15(93.8) | 22.610±3.234 |
| P值 | 0.370 | 0.069 | 0.974 |
将时相性表达组临床检验组指标空腹血糖、糖化血红蛋白、甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白、肌酐、尿酸与非时相性表达组对比,结果显示临床生化指标差异均无统计学意义(P > 0.05),见表 4。
| 组别 | 空腹血糖(mmol/L) | 糖化血红蛋白(%) | 甘油三酯(mmol/L) | 总胆固醇(mmol/L) | 高密度脂蛋白(mmol/L) | 低密度脂蛋白(mmol/L) | 肌酐(μmol/L) | 尿酸(μmol/L) |
| 非时相性表达 | 5.699±1.215 | 4.383±2.843 | 1.132±0.479 | 4.515±0.959 | 1.171±0.306 | 2.938±0.804 | 75.600±19.294 | 362.800±130.961 |
| 时相性表达 | 5.293±1.205 | 5.878±0.874 | 1.203±0.408 | 4.505±1.649 | 1.126±0.295 | 2.963±1.466 | 89.688±28.577 | 443.875±117.360 |
| P值 | 0.358 | 0.146 | 0.675 | 0.985 | 0.697 | 0.957 | 0.121 | 0.079 |
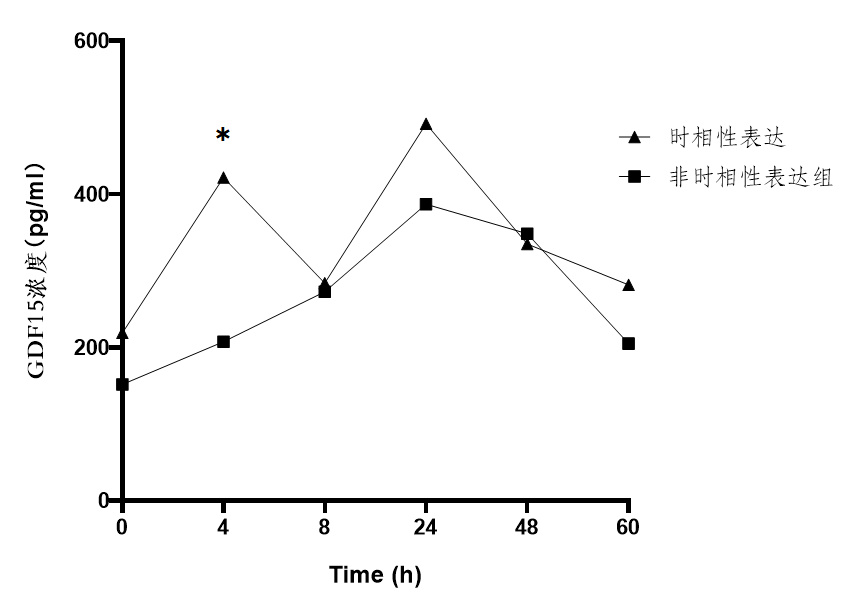
为了评估两组患者心脏功能以及血管的狭窄程度,比较时相性表达组与非时相性表达组的射血分数、左室舒张末内径以及Gensini评分。结果显示时相性表达组患者的心脏射血分数(48.33±15.32)%高于非时相性表达组患者(61.86±6.336)%。结果显示时相性表达组患者的左室舒张末内径(50.89±4.807)mm高于非时相性表达组患者(49±7.362)mm。如图 2。此外,根据美国心脏病协会所规定的Gensini评分表作为定量评价冠状动脉病变程度的依据,将各个部位的病变程度乘以相应的权重系数,所得数值相加,最终计算得出Gensini评分,病变程度越重,Gensini评分越高。计算出非时相性表达组患者的评分(57.59±15.67)明显高于时相性表达组患者的评分(33.88±21.24),如图 4。这些结果表明,时相性表达组患者的心脏收缩功能要优于非时相性表达组患者,并且冠脉血管的病变程度低于非时相性表达组患者。
|
| 图 3 时相性表达组与非时相表达组心功能比较 Fig 3 Comparison of Cardiac Function Between the Temporal Expression Group and the Non-Temporal Expression Group |
|
|
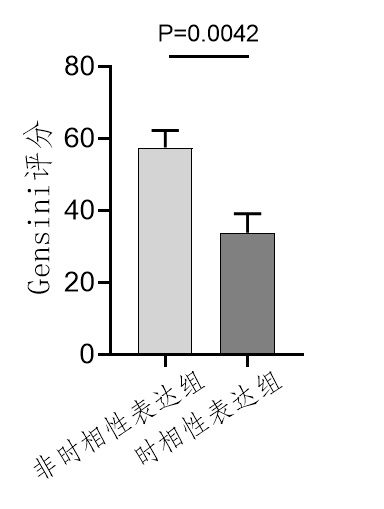
|
| 图 4 时相性表达组与非时相性表达组Gensini评分比较 Fig 4 Comparison of gensini scores between the temporal expression group and the non-temporal expression group |
|
|
为了预测两组患者的预后水平,笔者进一步引入了Grace风险评分。Grace风险评分对各种类型的ACS患者的预后判断有重要价值,本研究选取了Grace(院内)评估量表,根据分数的高低分为低危、中危、高危,即≤ 108,低危,院内死亡风险 < 1 %;109~140,中危,院内死亡风险1 %~3 %;> 140,高危,院内死亡风险 > 3 %。根据统计得出,非时相性表达组患者中低危组有2人,中危组有12人,高危组有1人。时相性表达组患者中低危组有11人,中危组有3人,高危组有1人。非时相性表达组患者的Grace风险评分(116.1±23.46)要高于时相性表达组(100.7±14.72),且差异具有统计学意义(P < 0.001),见图 4。这些结果表明,时相性表达组患者的死亡风险要低于非时相性表达组。
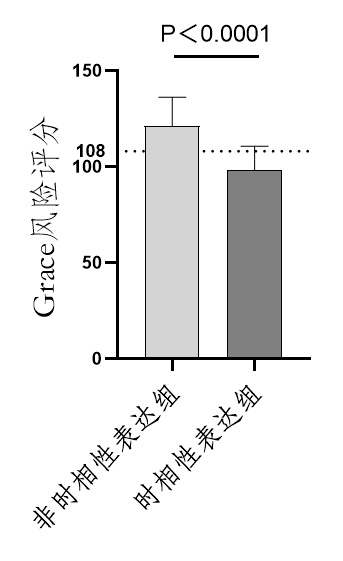
|
| 图 5 时相性表达组与非时相性表达组Grace风险评分比较 Fig 5 Comparison of GRACE risk scores between the temporal expression group and the non-temporal expression group |
|
|
ACS是由冠状动脉供血不足引起的心肌缺血或坏死的一组临床综合征,以急性胸痛为主要症状,病情进展迅猛,危险性高[7-9],因此早期建立快速、合理、正确的诊疗至关重要。临床需要使用准确且具有高敏感性和高特异性的心肌损伤标志物。B型脑钠肽(brain natriuretic peptide,BNP)、D- 二聚体(D-Dimer)、心肌肌钙蛋白(cardiac troponin,cTn)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)则是目前较为常见的主要检测指标[10-11]。其中cTn在指南中推荐级别高[12],但是,非冠脉事件也会导致传统心肌损伤标志物升高。为提高传统标志物的敏感性与特异性探索新型生物标志物是一种必然趋势。
GDF15作为转化生长因子(transformation growth factor,TGF-β)超家族成员之一[13],在血管生成、炎症反应和急性损伤中发挥作用,是一种能够独立反映心血管功能的新型生物标志物[14-15]。研究表明,心肌损伤时GDF15开始升高的时间更早,敏感度优于传统心肌损伤标志物(如BNP/NT-proBNP、CK-MB、cTnT/cTnI、D-二聚体等),并能显示出传统标志物不具有的预后价值[16-17]。经过深入研究,课题组发现血清GDF15联合传统心肌损伤标志物可以提高ACS早期诊断的敏感性和特异性,且血清GDF15浓度与疾病严重程度呈正相关[18-19]。通过对患者各时间段GDF15分泌水平的分析,本课题组发现部分ACS患者血清GDF15表达模式不同于“单峰”状的传统心肌损伤标志物,其表达水平随时间变化呈“双峰”形态,即升高至4 h后逐渐下降,24 h再次达高峰。通过分析两组患者的左室射血分数和左室收缩末期内径,发现时相性表达组患者的心脏功能要优于非时相性表达组的患者。同时,根据Gensini评分标准来评价血管狭窄程度,发现时相性表达组患者的狭窄程度要低于非时相性表达组患者。这可能提示GDF15对心肌细胞同时也具有保护作用,这与本课题组之前的研究一致。对时相性表达现象出现原因做出合理的假设:血清中GDF15第一个高峰来自于受到损伤的心肌细胞,这与之前的研究相符。第二个峰的出现可能来源于于中枢GDF15-GFRAL信号的正反馈神经调节[20],刺激肺,肾,肝脏,胰腺等效应器官分泌GDF15入血,从而使血浆中的GDF15再次升高。
GFRAL作为GDF15的唯一受体,能与GDF15结合形成复合物影响下游通路从而发挥作用。GFRAL全称Glial cell line derived neurotrophic factor-family receptor α-like,属于胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor,GDNF)家族α样受体[21],是一种Ⅰ型跨膜蛋白且仅存在于脑干的NTS和AP区中[22]。2014年,Tsai等[23]证实GDF15通过激活小鼠脑干中的孤束核(NTS)和脑干后区(AP)抑制食物摄入,但其潜在机制尚不明确。之后,越来越多的研究也表明,GDF15-GFRAl不止可以抑制食物的摄入,同时在调节新陈代谢,炎症反应以及肿瘤的恶病质中同样发挥重要作用[24-25]。Luan等[26]发表在《Cell》上的研究发现:在急性炎症条件下,循环GDF15激活AP中的GFRAL,通过调节交感神经流出控制肝脏甘油三酯代谢,以维持正常的心脏功能所需要的能量代谢需求。这提示,心肌梗死的患者在心肌受损的情况下可能通过脑中的GFRAL受体调节肝脏、肾、肺等一系列靶器官,从而进一步影响GDF15的分泌水平。
通过本次研究,笔者发现了GDF15在ACS患者血清中的时相性表达现象,并通过对比临床一般情况资料,临床生化指标,超声心动图以及冠状动脉造影发现了时相性表达组的患者的心脏受损程度较非时相性表达组患者更轻,且本研究通过计算Grace风险评分得出了出现时相性表达患者的预后更好的结论。这些研究结果进一步说明了GDF15在ACS中的诊断及判断预后的价值,并且时相性表达现象的出现提示了GDF15可能对心肌有保护作用,这为本基础实验提供了临床支持。
通过本课题组的研究希望在AMI诊疗研究领域构建GDF15系统性调控心肌保护关联的新知识体系,能够为以GDF15为核心的用于AMI诊疗的新型靶分子药物开发提供来自基础研究的证据支持。
利益冲突 所有作者声明无利益冲突
作者贡献声明 潘博:采集/分析/解释数据、起草文章、统计分析;马唯一:设计实验采集数据、实施研究、对文章的知识性内容作批评性审阅;王猛/柴艳芬/寿松涛/刘先发/欧阳艳红:实施研究、采集/分析/解释数据、对文章的知识性内容作批评性审阅、指导;黄晶晶:设计实验、分析/解释数据、对文章的知识性内容作批评性审阅、指导;丁新焕/徐茂林/彭亚文:分析/解释数据、对文章的知识性内容作批评性审阅、指导;朱海燕:酝酿和设计实验、对文章的知识性内容作批评性审阅、指导,行政、技术或材料支持,支持性贡献
| [1] | Sharma A, Vaduganathan M, Ferreira JP, et al. Clinical and biomarker predictors of expanded heart failure outcomes in patients with type 2 diabetes mellitus after a recent acute coronary syndrome: insights from the EXAMINE trial[J]. J Am Heart Assoc, 2020, 9(1): e012797. DOI:10.1161/JAHA.119.012797 |
| [2] | Wang Y, Chen CJ, Chen JJ, et al. Overexpression of NAG-1/GDF15 prevents hepatic steatosis through inhibiting oxidative stress-mediated dsDNA release and AIM2 inflammasome activation[J]. Redox Biol, 2022, 52: 102322. DOI:10.1016/j.redox.2022.102322 |
| [3] | Liu H, Liu JH, Si L, et al. GDF-15 promotes mitochondrial function and proliferation in neuronal HT22 cells[J]. J Cell Biochem, 2019, 120(6): 10530-10547. DOI:10.1002/jcb.28339 |
| [4] | Tzikas S, Palapies L, Bakogiannis C, et al. GDF-15 predicts cardiovascular events in acute chest pain patients[J]. PLoS One, 2017, 12(8): e0182314. DOI:10.1371/journal.pone.0182314 |
| [5] | 昌上清, 盛云婧, 邢沁蕊, 等. 生长分化因子15对急性胸痛早期诊断价值分析[J]. 中华急诊医学杂志, 2021, 30(6): 694-698. DOI:10.3760/cma.j.issn.1671-0282.2021.06.010 |
| [6] | Gensini GG. A more meaningful scoring system for determining the severity of coronary heart disease[J]. Am J Cardiol, 1983, 51(3): 606. DOI:10.1016/s0002-9149(83)80105-2 |
| [7] | Smith LM, Ashburn NP, Snavely AC, et al. Identification of very low-risk acute chest pain patients without troponin testing[J]. Emerg Med J, 2020, 37(11): 690-695. DOI:10.1136/emermed-2020-209698 |
| [8] | Yang ZY, Liu HR, Lu DZ, et al. Effects of high-dose glucose-insulin-potassium on acute coronary syndrome patients receiving reperfusion therapy: a meta-analysis[J]. World J Emerg Med, 2024, 15(3): 181-189. DOI:10.5847/wjem.j.1920-8642.2024.048 |
| [9] | Thoppil J, Kraut L, Montgomery C, et al. A retrospective analysis of gender among patients admitted to a clinical decision unit at risk for acute coronary syndrome[J]. World J Emerg Med, 2023, 14(2): 133-137. DOI:10.5847/wjem.j.1920-8642.2023.018 |
| [10] | 马岳峰, 张国强. 急诊胸痛心血管标志物联合检测专家共识[J]. 实用休克杂志(中英文), 2022, 6(2): 103-112. |
| [11] | 卢尚欣, 汤雯, 孙颖. 衰弱与老年急性冠脉综合征的治疗进展[J]. 中国医学前沿杂志(电子版), 2024, 16(8): 54-58. |
| [12] | 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 非ST段抬高型急性冠脉综合征诊断和治疗指南(2024)[J]. 中华心血管病杂志, 2024, 52(06): 615-646. |
| [13] | Rochette L, Zeller M, Cottin Y, et al. Insights into mechanisms of GDF15 and receptor GFRAL: therapeutic targets[J]. Trends Endocrinol Metab, 2020, 31(12): 939-951. DOI:10.1016/j.tem.2020.10.004 |
| [14] | Wollert KC, Kempf T, Wallentin L. Growth differentiation factor 15 as a biomarker in cardiovascular disease[J]. Clin Chem, 2017, 63(1): 140-151. DOI:10.1373/clinchem.2016.255174 |
| [15] | Monzo L, Jarolim P, Borlaug BA, et al. Growth differentiation factor-15 is associated with congestion-related anorexia and weight loss in advanced heart failure[J]. JACC Heart Fail, 2025, 13(2): 315-329. DOI:10.1016/j.jchf.2024.10.023 |
| [16] | Arkoumani M, Papadopoulou-Marketou N, Nicolaides NC, et al. The clinical impact of growth differentiation factor-15 in heart disease: a 2019 update[J]. Crit Rev Clin Lab Sci, 2020, 57(2): 114-125. DOI:10.1080/10408363.2019.1678565 |
| [17] | Batra G, Lindbäck J, Becker RC, et al. Biomarker-based prediction of recurrent ischemic events in patients with acute coronary syndromes[J]. J Am Coll Cardiol, 2022, 80(18): 1735-1747. DOI:10.1016/j.jacc.2022.08.767 |
| [18] | 中国医师协会急诊医学专业委员会, 中国女医师协会急诊医学专业委员会. 生长分化因子-15在急性冠状动脉综合征中急诊临床应用的专家共识[J]. 中华急诊医学杂志, 2022, 31(10): 1319-1325. DOI:10.3760/cma.j.issn.1671-0282.2022.10.004 |
| [19] | 王瑞, 余雯瑾, 郝井志. 心房颤动患者NT-proBNP、Lp-PLA2、hs-cTnT、GDF-15水平及其对MACE发生的预测价值[J]. 检验医学与临床, 2023, 21(22): 3310-3315. |
| [20] | Wang DD, Day EA, Townsend LK, et al. GDF15: emerging biology and therapeutic applications for obesity and cardiometabolic disease[J]. Nat Rev Endocrinol, 2021, 17(10): 592-607. DOI:10.1038/s41574-021-00529-7 |
| [21] | Hsu JY, Crawley S, Chen M, et al. Non-homeostatic body weight regulation through a brainstem-restricted receptor for GDF15[J]. Nature, 2017, 550(7675): 255-259. DOI:10.1038/nature24042 |
| [22] | Sjøberg KA, Sigvardsen CM, Alvarado-Diaz A, et al. GDF15 increases insulin action in the liver and adipose tissue via a β-adrenergic receptor-mediated mechanism[J]. Cell Metab, 2023, 35(8): 1327-1340.e5. DOI:10.1016/j.cmet.2023.06.016 |
| [23] | Tsai VW, Manandhar R, Jørgensen SB, et al. The anorectic actions of the TGFβ cytokine MIC-1/GDF15 require an intact brainstem area postrema and nucleus of the solitary tract[J]. PLos One, 2014, 9(6): e100370. DOI:10.1371/journal.pone.0100370 |
| [24] | Yang LD, Chang CC, Sun Z, et al. GFRAL is the receptor for GDF15 and is required for the anti-obesity effects of the ligand[J]. Nat Med, 2017, 23(10): 1158-1166. DOI:10.1038/nm.4394 |
| [25] | Mullican SE, Lin-Schmidt X, Chin CN, et al. GFRAL is the receptor for GDF15 and the ligand promotes weight loss in mice and nonhuman Primates[J]. Nat Med, 2017, 23(10): 1150-1157. DOI:10.1038/nm.4392 |
| [26] | Luan HH, Wang A, Hilliard BK, et al. GDF15 is an inflammation-induced central mediator of tissue tolerance[J]. Cell, 2019, 178(5): 1231-1244.e11. DOI:10.1016/j.cell.2019.07.033 |
 2025, Vol. 34
2025, Vol. 34