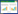2. 宁夏医科大学总医院重症医学科,银川 750004
2. Department of Intensive Care Unit, General Hospital of Ningxia Medical University, Yinchuan 750004, China
休克后肠缺血-再灌注损伤是常见的病理生理过程,是危重症患者并发肠源性感染及多器官功能障碍综合征的“发动机”和“催化剂”。休克发生时肠道是最早损伤,但最迟恢复的器官。因此,保护休克肠屏障功能,对改善休克预后至关重要[1-2]。一氧化碳(carbon monoxide,CO)长期以来被认为是一种有毒气体,近年越来越多的研究发现CO是机体内源性产生的气体信号分子,在哺乳动物体内可以自由穿过细胞膜,迅速与细胞内靶点富含血红素的蛋白结合,发挥调节血管张力、抗炎、抗聚集、抗增殖、抗凋亡、免疫调节等多重细胞保护作用[3-6]。本课题组前期已成功建立Caco-2细胞缺氧复氧损伤模型用于体外模拟肠缺血-再灌注损伤[7]。本研究使用一氧化碳释放分子3(carbon monoxide-releasing molecule-3, CORM-3)处理缺氧再复氧(hypoxia-reoxygenation,HR)损伤Caco-2细胞,观察其对Caco-2细胞活力、凋亡坏死率、细胞单层屏障功能影响并分析各组细胞差异基因表达以及功能富集,旨在阐述探索一氧化碳减轻肠缺血-再灌注损伤的作用机制。
1 材料和方法 1.1 材料 1.1.1 细胞来源Caco-2细胞购自中国武汉普诺赛生物科技有限公司
1.1.2 主要试剂材料CORM-3:美国GLPBIO公司;高糖DMEM培养基、PBS:美国Gibco公司;胎牛血清(FBS):以色列BI公司;青-链霉素混合液(100×母液)、非必须氨基酸、Hepes、0.25%胰酶-EDTA、4%多聚甲醛、曲拉通以及荧光素钠:中国北京索莱宝科技有限公司;牛血清白蛋白(BSA):美国Sigma公司;(Cell Counting Kit-8)CCK8:日本同仁化学研究所;FITC-Annexin V/PI细胞凋亡试剂盒:中国苏州优逸兰迪生物科技有限公司;山羊抗人ZO-1多克隆抗体、兔抗人Occludin、Claudin2多克隆抗体:英国Abcam公司;Cy3标记山羊抗兔IgG和Alexa Fluor 488标记的驴抗山羊IgG、无糖DMEM培养基、T25培养瓶:武汉赛维尔生物科技有限公司;24孔transwell小室培养板:美国Corning公司。TRIzol试剂:美国赛默飞世尔科技公司。
1.2 方法 1.2.1 Caco-2细胞缺氧再复氧损伤模型制备及实验分组Caco-2细胞生长6 d且状态良好时,添加无血清无糖DMEM培养基,置于1% O2的缺氧培养箱中培养8 h,缺氧结束后培养基换成正常高糖DMEM完全培养基,转移到正常培养箱中培养4 h,建立缺氧再复氧(HR)模型[7]。将CORM-3粉末溶于无菌无酶水中,配成10 mmol/L的浓储液,-20℃保存,使用时无糖DMEM培养基进行稀释为300 µmol/L、400 µmol/L和500 µmol/L。取部分浓缩液置于正常培养箱中3 d,使其释放CO,制备失活性CORM-3(iCORM-3),使用时稀释为500 µmol/L iCORM3。细胞缺氧同时加入各浓度CORM-3和iCORM-3进行干预。实验分组为空白对照组(Control组)、缺氧复氧损伤模型组(HR组)、缺氧复氧损伤+300 µmol/L CORM-3(HR_C1组)、缺氧复氧损伤+400 µmol/L CORM-3(HR_C2组)、缺氧复氧损伤+500 µmol/L CORM-3(HR_C3组)和缺氧复氧损伤+500 µmol/L iCORM-3(HR_iC组)。
1.2.2 Caco-2细胞活力的测定Caco-2细胞以8000个/孔接种于96孔板,培养4 d后细胞按不同实验分组予以相应干预处理。根据Cell counting kit-8(CCK8)试剂盒操作说明进行,酶标仪于450 nm处测定吸光度值并计算细胞存活率,每组重复6次。
1.2.3 流式细胞术测定细胞凋亡率以4×105个/ml的浓度接种于6孔板中,培养6 d,按照不同分组干预处理,取各实验分组的Caco-2细胞,用胰蛋白酶(不含EDTA)消化收集。PBS洗涤两次,每次1000 rpm离心5 min,弃上清液,缓冲液重悬细胞,根据FITC-Annexin V/PI细胞凋亡试剂盒操作说明进行,流式细胞仪分析细胞凋亡和坏死情况,每组实验重复3次以上。
1.2.4 荧光素钠渗透实验评价Caco-2细胞单层完整性用HBSS分别配制0、0.05、0.5、1.5、3、5和7 μg/mL荧光素钠溶液。用多功能酶标仪测定荧光强度(激发波长480 nm,发射波长530 nm)。以荧光强度为横坐标,浓度(μg/mL)为纵坐标绘制标准曲线。Caco-2细胞在24孔Transwell小室培养21 d,形成肠上皮单层屏障,按照不同分组进行干预处理。干预结束后弃掉培养基,AP(顶端)和BL(底部)侧均用预热HBSS清洗3次,AP侧加荧光素钠溶液(300 μg/mL)200 μl,BL侧加HBSS 1 mL,培养箱培养120 min,从BL侧取样100 μL,使用多功能酶标仪检测荧光强度。根据标准曲线与回归方程计算各组荧光素钠在BL侧转运液的浓度以此算出表观渗透系数(Papp)(cm/s),每组重复6次。
1.2.5 激光共聚焦显微镜下观察Caco-2细胞单层紧密连接蛋白的免疫荧光分布及结构Caco-2细胞在24孔Transwell小室培养21 d,按照实验分组处理细胞,将生长在Transwell小室的Caco-2细胞单层用4% (w/v)多聚甲醛固定20 min,PBS洗3次,5 min/次,用0.2% Triton X-100透化15 min,用2%牛血清白蛋白(BSA)封闭1 h。抗体稀释度:ZO-1(1:200),Occludin(1:300),Claudin2(1:100),4℃孵育过夜。应用Cy3和Alexa Fluor 488标记的荧光二抗(1:100)孵育1 h,避光操作,裁下Transwell小室的膜,抗荧光淬灭剂封片,使用Zeiss LSM900激光共聚焦荧光显微镜观察(放大400倍),采集图像。
1.2.6 蛋白印迹法检测Caco-2细胞单层紧密连接蛋白表达各实验分组的Caco-2细胞干预完毕后,PBS冲洗细胞三次,胰酶消化细胞,得细胞沉淀加入RIPA裂解液提取总蛋白,用BCA法定量后,进行SDS-PAGE电泳并转移至PVDF膜上,5%BSA-TBST缓冲液室温封闭2 h,加入一抗Occludin、Claudin2(均1:1000稀释),4℃摇床孵育过夜,TBST洗膜3次,加入HRP标记山羊抗兔(1:5000稀释),室温下孵育1 h,化学发光(ECL),曝光、显像。保存原始图为TIFF格式,用AIWBwellTM分析软件进行数据分析。目的蛋白灰度值与内参灰度值的比值表示Occludin、Claudin2蛋白的表达水平。每组重复4次。
1.2.7 Caco-2细胞转录组学测定及分析根据前期实验数据,选取500 µmol/L CORM3和iCORM3作为实验组干预浓度。转录组测序分组:空白对照组(Control)、缺氧复氧损伤模型组(HR)、缺氧复氧损伤+500 µmol/L CORM-3组(HR_CORM3)和缺氧复氧损伤+500 µmol/L iCORM3组(HR_iCORM3),每组4个样本。取各组Caco-2细胞,加入适量TRIzol试剂,收集细胞悬液。提取总RNA,通过Oligo(dT)磁珠分选所需mRNA,以mRNA为模版,随机寡核苷酸为引物合成cDNA,纯化、修饰后进行PCR扩增、纯化,最终获得文库。并且使用Qubit 2.0 Fluorometer进行初步检测,qRT-PCR准确定量分析,保证文库质量。将获得文库进行Illumina测序,荧光标记后进行扩增,测序仪通过捕获荧光信号,计算机软件转化,获得待测片段的序列信息。测序片段被高通量测序仪测得的图像数据经CASAVA碱基识别转化为序列数据(reads),对原始数据进行过滤(Qphred≤5的碱基数占整个read长度的50%reads),获得高质量及可靠数据,同时对clean data进行Q20,Q30和GC含量计算。使用DESeq2软件(1.20.0)进行差异表达分析。使用Benjamini和Hochberg的方法来调整所得P值以控制错误发现率。通过DESeq2发现调整的P值≤0.05的基因被分配为差异表达的。校正后的P值以及|log2foldchange|作为显著差异表达的阈值。通过clusterProfiler(3.8.1)软件实现差异表达基因的GO富集分析、KEGG通路富集分析和Reactome富集分析。
1.3 统计学方法采用Flowjo软件对流式实验的凋亡结果进行分析,ImageJ软件对共聚焦免疫荧光图片进行转换分析,GraphPad Prism 10.0软件对各组进行统计学分析以及柱状图绘制。所有数据均按照均数±标准差(x±s)表示,两组间比较符合正态分布采用独立样本t检验,非正态分布时采用非参数检验分析,多组间数据分析符合正态分布采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 CORM3提高缺氧复氧后Caco-2细胞增殖活力与Control组相比,缺氧复氧后各组细胞活力均下降(均P < 0.05),但HR_C3组的细胞活力差异无统计学意义(P>0.05)。与HR组相比,HR_C2组和HR_C3组细胞活力提高(P < 0.05)。而HR_iC组与HR组细胞活力比较差异无统计学意义(P>0.05)。(见图 1)
|
| 注:与Control组相比,aP < 0.05;与HR组相比,bP < 0.05 图 1 CORM-3干预缺氧复氧损伤Caco-2细胞后细胞活力变化 Fig 1 Effect of CORM-3 on cell viability changes of Caco-2 cells after HR injury |
|
|
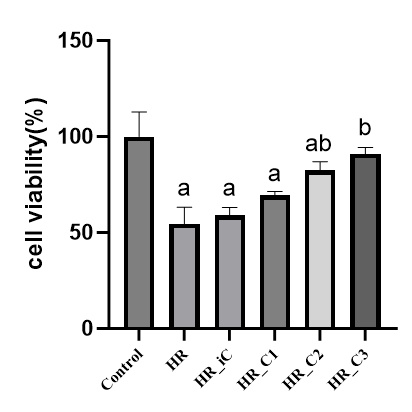
如图 2所示,与Control组相比,HR组、HR_C2组和HR_iC组的Caco-2细胞凋亡坏死率明显增加(均P<0.05),而HR_C1组和HR_C3组与Control组相比差异无统计学意义(P>0.05)。与HR组相比,仅HR_C3组细胞凋亡坏死率明显降低(P<0.05)。HR_C1组和HR_C2组与HR组相比有降低的趋势,但无统计学意义。说明CORM3是具有减轻缺氧复氧损伤Caco-2细胞凋亡坏死的作用。
|
| 注:与Control组相比,aP < 0.05;与HR组相比,bP < 0.05 图 2 CORM-3干预缺氧复氧损伤Caco-2细胞的凋亡及坏死的流式图和统计 Fig 2 Effect of CORM-3 on the apoptosis and necrosis rate of Caco-2 cells after HR injury |
|
|
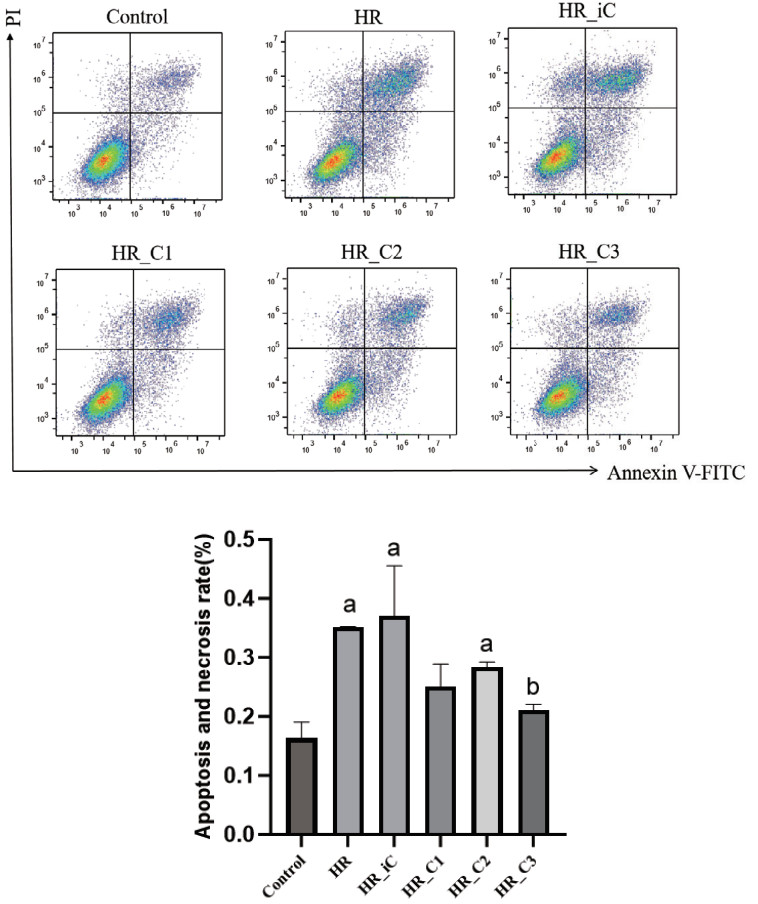
荧光素钠渗透Caco-2细胞单层的表观渗透系数(Papp),可观察细胞单层屏障的完整性。本实验荧光素钠浓度标准曲线的绘制结果为:y = 2E-09x - 0.1896,R2=0.9962。与Control组相比,HR组、HR_iC组、HR_C1组、HR_C2和HR_C3的Caco-2细胞单层通透性均增大(均P<0.05);但与HR组相比,HR_C2和HR_C3组细胞单层通透性明显降低(P<0.05)。且随着CORM3浓度逐步升高,Caco-2细胞单层通透性降低越明显。(见图 3),见表 1。
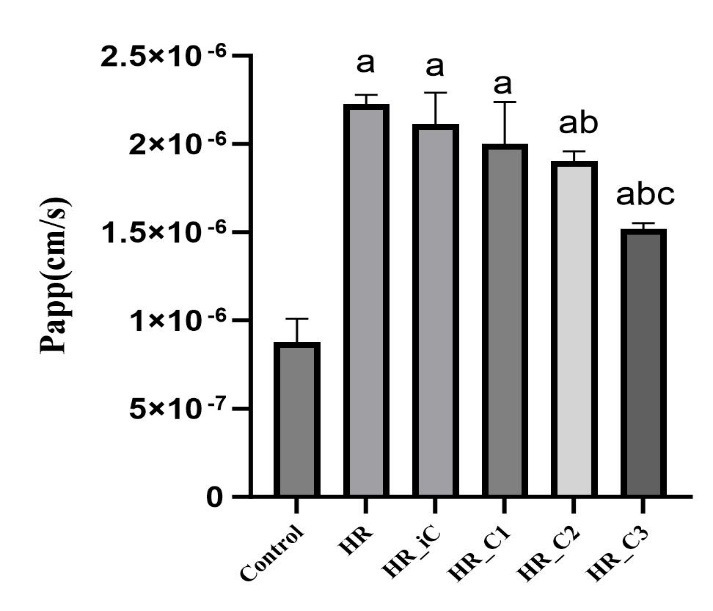
|
| 注:与Control组相比,aP < 0.05;与HR组相比,bP < 0.05;与HR_iC组相比,cP < 0.05 图 3 CORM-3干预缺氧复氧损伤Caco-2细胞单层表观渗透系数Papp的影响 Fig 3 Effect of CORM-3 on apparent permeability coefficient Papp of Caco-2 cells monolayers after HR injury |
|
|
| 组别 | 例数(n) | 荧光素钠浓度 |
| Control | 6 | 0.625±0.094 |
| HR | 6 | 1.585±0.038a |
| HR_iC | 6 | 1.506±0.127a |
| HR_C1 | 6 | 1.426±0.169a |
| HR_C2 | 6 | 1.357±0.039ab |
| HR_C3 | 6 | 1.083±0.022abc |
使用激光共聚焦显微镜观察Caco-2细胞单层紧密连接蛋白(ZO-1、Occludin、Claudin2)的免疫荧光可发现,Control组的Caco-2细胞单层中ZO-1、Occludin、Claudin2蛋白表达可见荧光沿胞膜分布,边界清楚,呈网状结构,细胞间连接紧密,无明显缝隙。但是HR组和HR_iC组细胞荧光分布不均,边界不清,有断裂及锯齿等不连续现象,且Claudin2蛋白的免疫荧光胞内外弥散分布。而不同浓度CORM-3预处理,虽然相比Control组紧密连接蛋白荧光强度稍减弱,但仍沿胞膜分布,排列较规则,相比HR组和HR_iC组明显改善,边界清晰。见图 4。
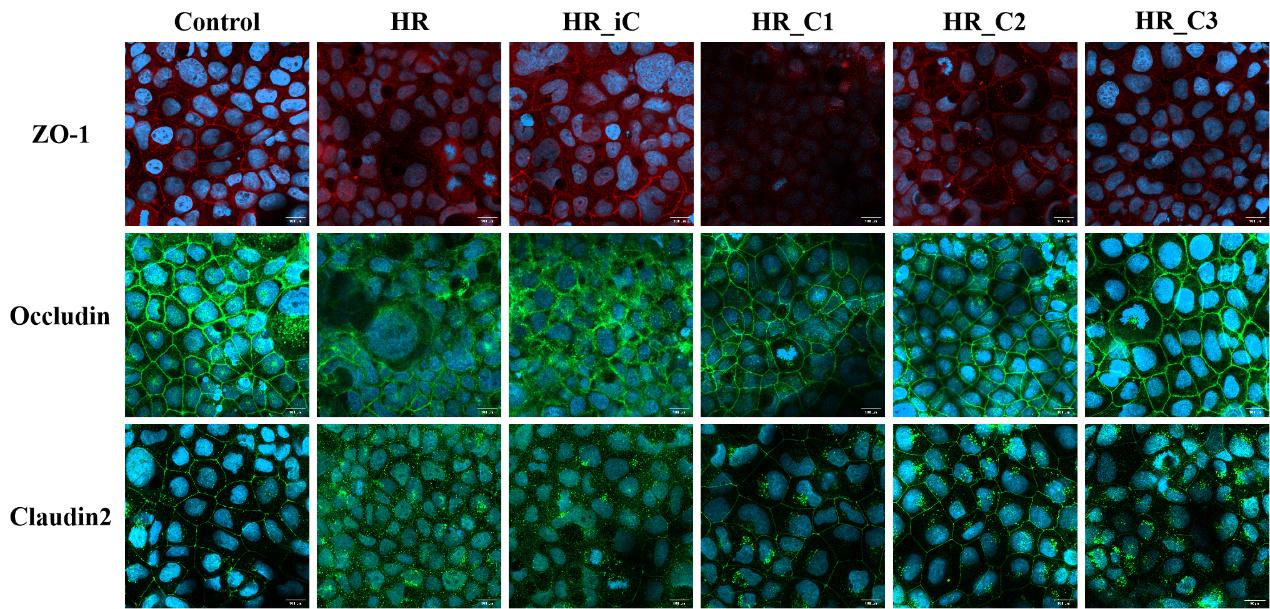
|
| 注:红色荧光为ZO-1表达、绿色荧光分别为Occludin和Claudin2表达,蓝色为细胞核 图 4 各组Caco-2细胞单层紧密连接蛋白荧光表达(放大400倍) Fig 4 Fluorescent expression of tight junction proteins in monolayers of Caco-2 cells of various groups (400x) |
|
|
蛋白质印迹实验显示,与Control组比较,HR组、HR_iC组和HR_C1组细胞的Occludin蛋白表达降低(P < 0.05),与HR组相比,HR_C3组和HR_C2组的Occludin蛋白表达有增加的趋势但差异无统计学意义(P > 0.05)。与Control组比较,HR组Claudin2蛋白表达有增加趋势,与HR组相比,HR_C3组Claudin2蛋白表达降低(P < 0.05)。见图 5。
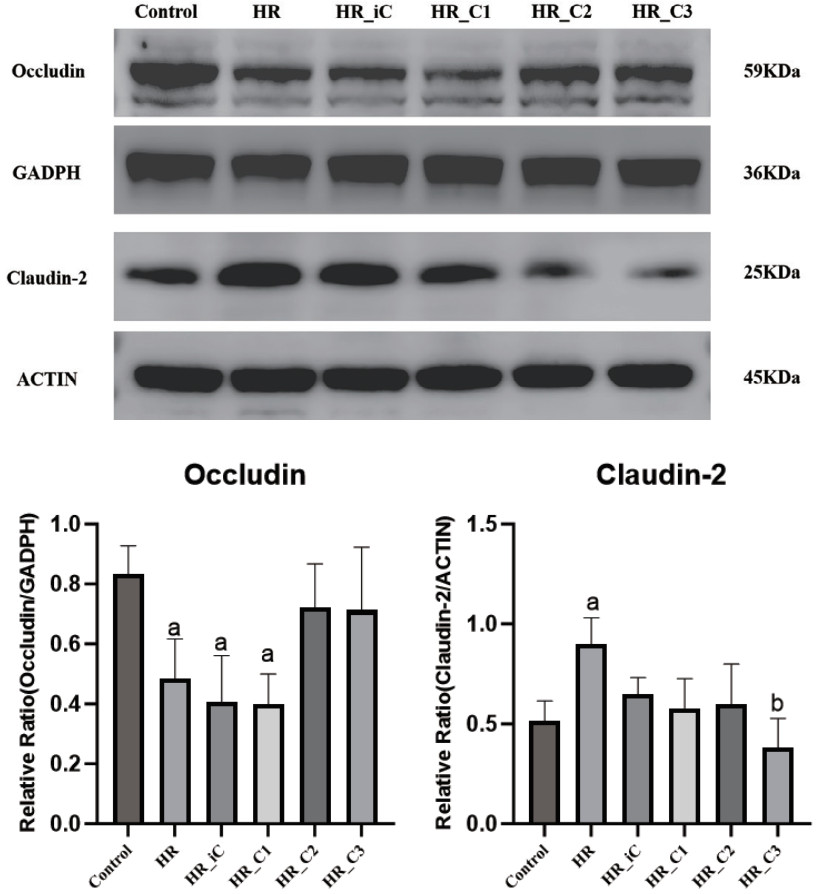
|
| 注:与Control组相比,aP < 0.05,与HR组相比,bP < 0.05 图 5 各组Caco-2细胞单层Occludin蛋白和Claudin2蛋白的表达 Fig 5 Expression of Occludin protein and Claudin2 protein in different groups of Caco-2 cell monolayers |
|
|
本研究利用转录组测序技术,对Control组、HR组、HR_CORM3组和HR_iCORM3组进行基因检测和组间差异分析。16个样本的测序数据获得了高质量的clean reads,每个样本clean reads超过3600万;所有样本的测序错误率为0.03以下,Q20值(Phred数值大于20的碱基占总碱基的百分比)均高于97%,而Q30值(Phred数值大于30的碱基占总碱基的百分比)均高于93%;此外,GC含量在49%-52.5%之间;这些均表明样本准确性很高。样品间基因表达水平相关性的检验中样品间皮尔逊相关系数的平方(R2)均大于0.92。这些结果证实了所获数据的可靠性。
为了筛选出一氧化碳减轻缺氧复氧损伤Caco-2细胞的影响基因,本研究比较各组之间的基因表达水平,寻找差异表达基因。Control组与HR组细胞比较(Control vs. HR),共发现1 299个差异表达基因(DEGs)显着上调,461个基因下调。HR_CORM3组与HR组比较(HR_CORM3 vs. HR),21个DEGs上调,36个DEGs下调。HR_iCORM3组与HR组比较(HR_iCORM3 vs. HR),42个DEGs上调,62个DEGs下调(padj < 0.05,|log2FC| > 1)(图 6)。随后对HR_CORM3 vs. HR和HR_iCORM3 vs. HR的差异表达基因进行比对,发现他们有相同的差异表达基因30个,且各基因上下调方向一致;131个不同的差异表达基因,其中仅存在于HR_CORM3 vs HR的差异表达基因有27个,将这27个基因与Control vs. HR的差异基因进行比对,发现相同的有5个差异表达基因(图 7),其中2个基因分别在Control vs. HR和HR_CORM3 vs. HR时,上下调方向不一致。由于本研究注重于CO对Caco-2细胞的保护作用,在设计时,将仅表达在HR_CORM3组以及和Control组上下调方向一致的相同差异表达基因作为CORM3保护缺氧复氧Caco-2细胞的可能基因,因此筛选出的差异表达基因总共25个(表 2)。
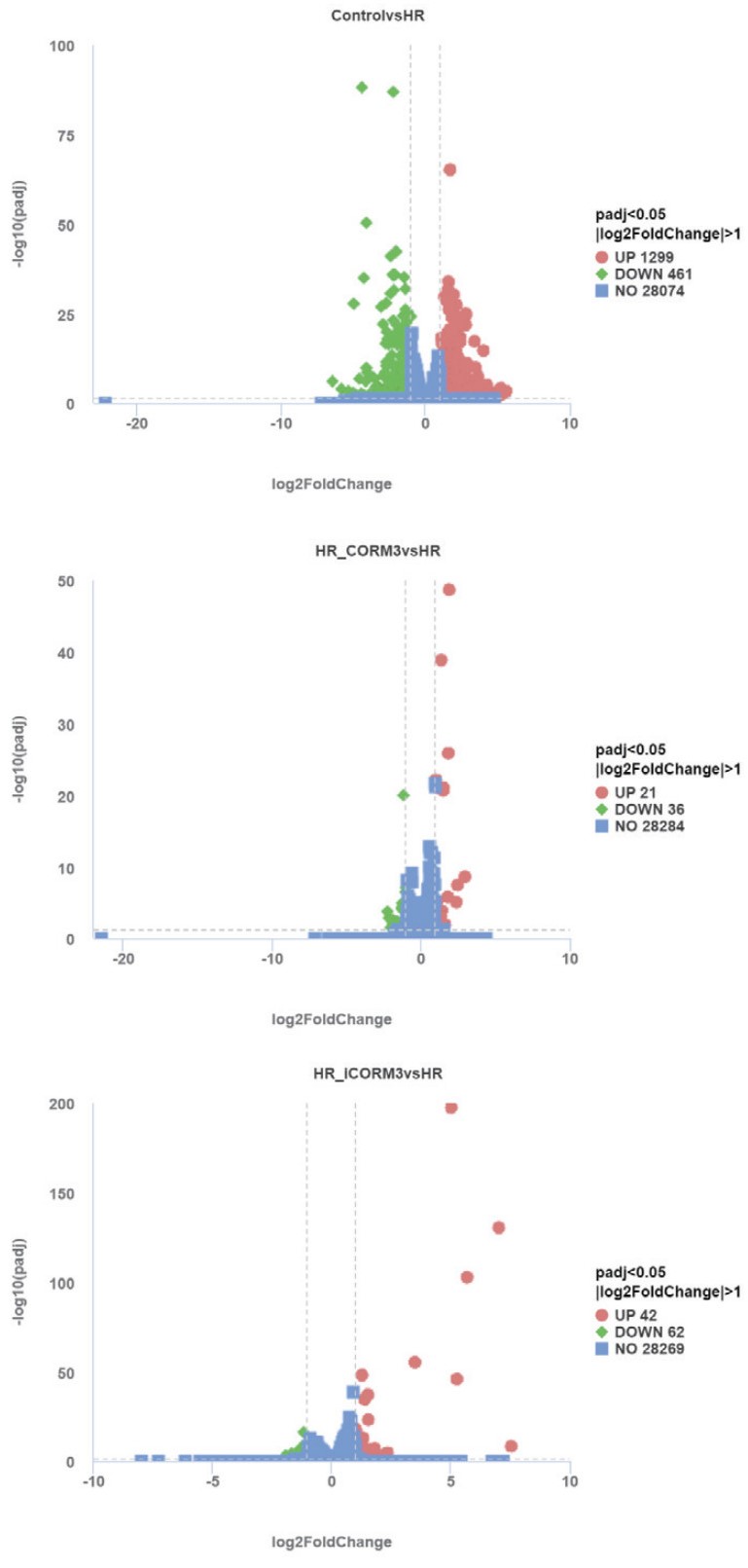
|
| 图 6 分别显示Control组vs. HR组、HR_CORM3组vs. HR组、HR_iCORM3组vs. HR组DEGs火山图 Fig 6 DEGs volcano plots for Control group vs. HR group, HR_CORM3 group vs. HR group, and HR_iCORM3 group vs. HR group |
|
|
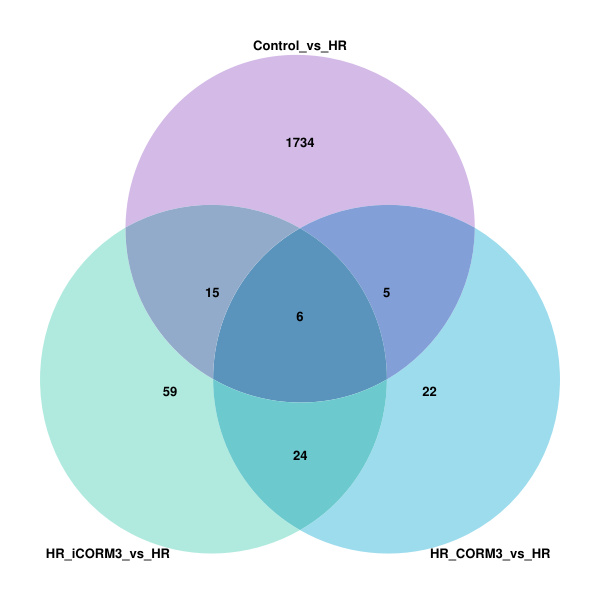
|
| 图 7 Venn图展示Control组vs. HR组、HR_CORM3组vs. HR组、HR_iCORM3组vs. HR组DEGs的overlap。 Fig 7 Venn diagram showing overlap of DEGs for Control group vs. HR group, HR_CORM3 group vs. HR group, HR_iCORM3 group vs. HR group |
|
|
| HR_CORM3_vs_HR DOWN |
HR_CORM3_vs_HR UP |
| MASP2 | CLIP4 |
| LTF | TREML3P |
| TGFB3 | TXNDC5 |
| BHLHE41 | FECH |
| FAM83A | |
| CACNA1D | |
| BTNL9 | |
| KSR2 | |
| ATAD3C | |
| AC009948.1 | |
| RUSC1-AS1 | |
| C14orf132 | |
| COX10-AS1 | |
| AC108112.1 | |
| TBC1D3G | |
| LIX1L | |
| AL355488.1 | |
| APOBEC3G | |
| CABP5 | |
| SYT16 | |
| MAMDC2 |
为了进一步了解CORM3对缺氧复氧损伤Caco-2细胞作用的基因功能影响。对筛选出的25个差异表达基因进行GO和KEGG以及Reactome功能富集分析,均以|FC > 1.5|,P < 0.05为阈值。GO功能富集分析时,富集在生物学过程中有161条、细胞组分有9条,分子功能有32条;我们仅在图中展示了30条GO富集分类条目(图 8),25个差异基因的生物学过程在免疫反应、炎症反应以及细胞器膜变化等过程中富集,细胞组分包含了在细胞质囊泡腔、肌膜、信号识别颗粒受体复合物和电压门控钙通道复合体等的富集;分子功能中在亚铁结合、补体结合、肌动蛋白结合和转化生长因子结合等功能中富集。KEGG功能富集分析中,有14条KEGG通路在阈值范围内,主要有MAPK信号通路、炎症性肠病、碳水化合物的消化和吸收以及细胞衰老等(图 8)。筛出的25个基因中,参与GO和KEGG富集分析的基因是TGFB3、MASP2、FECH、CACNAID、LTF、APOBEC3G和BHLHE41。对本研究找出的25个基因进行Reactome富集,是对细胞各项反应及其生物学通路的分析,有19条Reactome通路符合设定的阈值,包含有血红素生物合成、C4和C2激活剂的创建、补体的初始触发以及MAP2K和MAPK激活等等(图 8)。
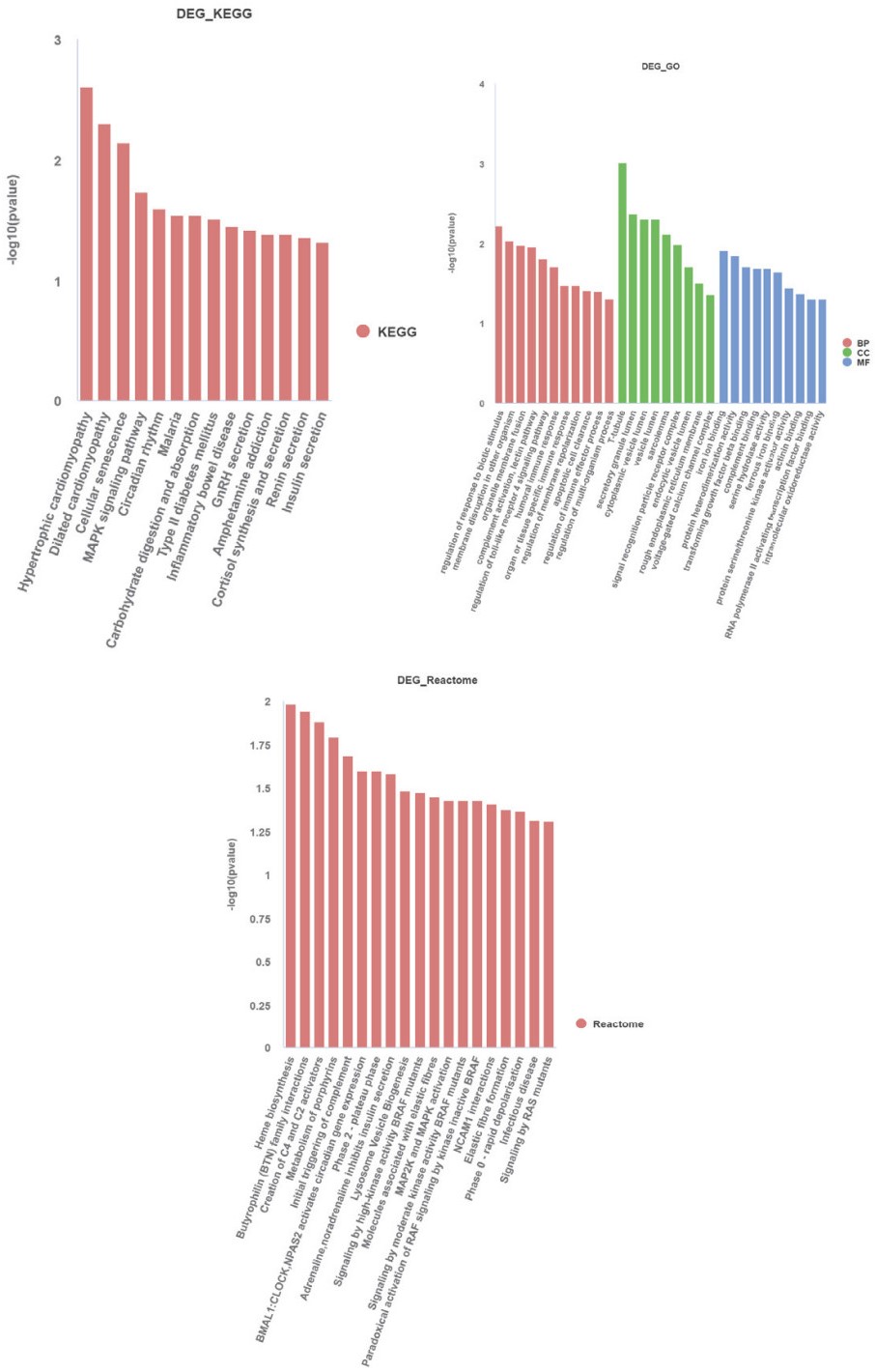
|
| 图 8 差异表达基因的GO富集分析、KEGG富集分析、Reactome富集分析(P < 0.05) Fig 8 GO enrichment analysis, KEGG enrichment analysis, and Reactome enrichment analysis of differentially expressed genes. (P < 0.05) |
|
|
肠道是应激反应的核心器官[8],是休克时最敏感和最容易发生缺血-再灌注损伤的器官之一[9]。肠道缺血-再灌注损伤时,启动一系列细胞死亡机制应对刺激,而肠上皮细胞死亡的主要方式是凋亡,占死亡细胞总数的80%,是肠屏障功能受损的主要原因[10-11]。研究表明适量的CO在多种疾病和细胞模型中均具有抗凋亡效应[12-13]。
本研究使用CORM3干预缺氧复氧损伤Caco-2细胞,证实CORM3可增加缺氧复氧损伤Caco-2细胞活力,减少细胞凋亡,降低细胞单层渗透率,证实CORM3可保护肠上皮屏障。且免疫荧光观察CORM3干预缺氧复氧损伤Caco-2细胞,其紧密连接蛋白沿胞膜分布排列更加致密规则,证实CORM3对细胞紧密连接结构具有保护作用。在对紧密连接蛋白的免疫印迹分析中,我们发现CORM3干预后缺氧复氧损伤Caco-2细胞紧密连接蛋白Occludin有增加趋势,同时降低Caco-2细胞Claudin2表达。众所周知,Claudin2主要在肠上皮中表达,它能够诱导紧密连接蛋白形成通道、介导阳离子和水的运输,并阻止大分子物质抗原的摄取[14-15]。研究发现,在肠易激综合征、炎症性肠病中Claudin2表达上调,Claudin2还可引起紧密连接不连续,并能诱导其他紧密连接蛋白如Claudin3、Occludin下调,这些都标志着肠黏膜屏障受损[16-18]。本研究中免疫荧光实验显示缺氧复氧后Caco-2细胞的Claudin2蛋白荧光在胞内外弥散分布,CORM3干预后明显沿胞膜分布,且CORM3干预后Claudin2表达水平下调,提示CORM3通过降低紧密连接中通道蛋白表达,保护肠上皮屏障功能。
为进一步探索CORM3保护缺氧再复氧损伤肠上皮细胞的可能机制,使用RNA-seq技术对CORM3干预的Caco-2细胞进行转录组测序分析,检测Control组、HR组、HR_CORM3组和HR_iCORM3组的全部mRNA,以HR组为基线,其余三组数据分别与HR组进行比较(Control vs. HR、HR_CORM3 vs. HR、HR_iCORM3 vs. HR),分析得出三组mRNA差异表达数据,再对这三组差异表达数据进行比较,笔者保留了Control vs. HR和HR_CORM3 vs. HR中上调和下调一致的差异表达mRNA作为CORM3发挥保护作用的可能基因。本研究得到了25个差异表达基因(DEGs),并对差异表达物进行功能富集分析发现,仅有基因TGFB3、CACNAID和BHLHE41参与具有统计学意义的14条KEGG富集通路,值得注意的通路有MAPK信号通路、炎症性肠病和细胞衰老等。GO富集分析中生物学过程较多与免疫炎症反应相关,包括体液免疫反应、器官或组织特异性免疫反应以及toll样受体4信号通路的调控等;GO富集分析中细胞组分均与细胞膜屏障相关。25个DEGs进行的Reactome富集分析中,也包含了相关免疫反应通路,例如补体的初始触发以及MAP2K和MAPK激活等。目前研究证明CO是具有抗炎作用[19],并且发现其可能通过调节p38丝裂原活化蛋白激酶(MAPK)、丝裂原激活蛋白激酶/细胞外信号调节激酶1/2(MEK/ERK1/2)信号通路[20-21]以及Toll样受体(TLR)信号通路等来实现的[22],而De Backer等[20]研究亦证实CO通过影响MAPKs信号通路调节炎症反应保护肠黏膜屏障的完整性,支持本研究差异基因功能分析的结果。笔者也关注到参与功能富集分析中免疫相关通路的最主要基因是TGFB3,其是转化生长因子β3(TGFβ3)的编码RNA。而转化生长因子-β(TGF-β)[23],是一种多功能信号蛋白,其受体广泛表达,对维持胃肠道免疫平衡起关键作用[24]。Kanazawa等[25]发现活动性溃疡性结肠炎和克罗恩病患者的肠道固有层淋巴细胞中TGF-β2和TGF-β3表达升高,而TGF-β3可以激活p38和JNK的MAPK信号传导通路[26-28]。这两种丝裂原活化蛋白激酶(MAPKs)含有高度保守的蛋白丝氨酸和苏氨酸激酶,调节一系列生物事件以应对各种环境和细胞内应激,在紧密连接通透性的调节中起核心作用[29-31]。本研究发现相比于HR组,仅HR_CORM3组的TGFB3下调,CORM3可能通过影响转录因子TGFB3的表达,参与相关MAPKs信号通路调节免疫炎症反应,减轻肠上皮损伤。
综上所述,CORM3可通过提高细胞活力、降低细胞凋亡坏死率以及改善细胞间紧密连接,减轻缺氧复氧对Caco-2细胞单层屏障的损伤。通过转录组测序发现其可能机制是调节基因TGFB3的表达,调控相关MAPKs信号通路,干预免疫炎症反应,发挥抗炎作用减轻肠上皮损伤。然而,本研究有诸多不足,对于筛选出的差异基因以及相关信号通路未进行实验验证和进一步的探索;体外模拟肠缺血-再灌注损伤的Caco-2细胞模型与临床病理生理有较大差距。虽有不足,但本研究为CO治疗肠缺血-再灌注损伤提供了新的潜在靶点和途径,为CO进入临床得到安全的治疗效果提供基础。
利益冲突 所有作者声明无利益冲突
作者贡献声明 禹昭群、白毅:实验操作、论文撰写;孙琬琦、寇思卓:数据整理、统计学分析;王晓红:研究设计、论文修改
| [1] | Kalogeris T, Baines CP, Krenz M, et al. Ischemia/reperfusion[J]. Compr Physiol, 2016, 7(1): 113-170. DOI:10.1002/cphy.c160006 |
| [2] | Wang F, Huang HM, Wei XJ, et al. Targeting cell death pathways in intestinal ischemia-reperfusion injury: a comprehensive review[J]. Cell Death Discov, 2024, 10(1): 112. DOI:10.1038/s41420-024-01891-x |
| [3] | 宋健伟, 祁祥, 史克洁, 等. CORM-2减轻脂多糖诱导Caco-2细胞屏障损伤的作用[J]. 中华急诊医学杂志, 2018, 27(2): 145-151. DOI:10.3760/cma.j.issn.1671-0282.2018.02.008 |
| [4] | Wegiel B, Hanto DW, Otterbein LE. The social network of carbon monoxide in medicine[J]. Trends Mol Med, 2013, 19(1): 3-11. DOI:10.1016/j.molmed.2012.10.001 |
| [5] | Yang XX, Lu W, Wang MJ, et al. "CO in a pill": towards oral delivery of carbon monoxide for therapeutic applications[J]. J Control Release, 2021, 338: 593-609. DOI:10.1016/j.jconrel.2021.08.059 |
| [6] | 牛庆晟, 张瑞, 陈磊, 等. 一氧化碳释放分子2调控T淋巴细胞分化介导抗炎保护失血性休克大鼠肠屏障[J]. 中华急诊医学杂志, 2022, 31(5): 628-635. DOI:10.3760/cma.j.issn.1671-0282.2022.05.012 |
| [7] | 禹昭群, 王晓红. Caco-2细胞单层缺氧再复氧损伤的模型构建[J]. 宁夏医学杂志, 2024, 46(03) 194-197, 180, 184. DOI:10.13621/j.1001-5949.2024.03.0194 |
| [8] | Chen YJ, Pu WG, Maswikiti EP, et al. Intestinal congestion and reperfusion injury: damage caused to the intestinal tract and distal organs[J]. Biosci Rep, 2021, 41(9): BSR20211560. DOI:10.1042/BSR20211560 |
| [9] | Sonnier DI, Makley AT, Friend LAW, et al. Hemorrhagic shock induces a proinflammatory milieu in the gut lumen[J]. J Surg Res, 2011, 170(2): 272-279. DOI:10.1016/j.jss.2011.03.010 |
| [10] | Wang Z, Qu YJ, Cui M. Modulation of stem cell fate in intestinal homeostasis, injury and repair[J]. World J Stem Cells, 2023, 15(5): 354-368. DOI:10.4252/wjsc.v15.i5.354 |
| [11] | Deitch EA, Xu DZ, Kaise VL. Role of the gut in the development of injury- and shock induced SIRS and MODS: the gut-lymph hypothesis, a review[J]. Front Biosci, 2006, 11: 520-528. DOI:10.2741/1816 |
| [12] | Damasceno ROS, Soares PMG, Barbosa ALDR, et al. Modulatory role of carbon monoxide on the inflammatory response and oxidative stress linked to gastrointestinal disorders[J]. Antioxid Redox Signal, 2022, 37(1/2/3): 98-114. DOI:10.1089/ars.2020.8223 |
| [13] | Głowacka U, Brzozowski T, Magierowski M. Synergisms, discrepancies and interactions between hydrogen sulfide and carbon monoxide in the gastrointestinal and digestive system physiology, pathophysiology and pharmacology[J]. Biomolecules, 2020, 10(3): 445. DOI:10.3390/biom10030445 |
| [14] | Rosenthal R, Günzel D, Krug SM, et al. Claudin-2-mediated cation and water transport share a common pore[J]. Acta Physiol (Oxf), 2017, 219(2): 521-536. DOI:10.1111/apha.12742 |
| [15] | Rosenthal R, Milatz S, Krug SM, et al. Claudin-2, a component of the tight junction, forms a paracellular water channel[J]. J Cell Sci, 2010, 123(Pt 11): 1913-1921. DOI:10.1242/jcs.060665 |
| [16] | Raju P, Shashikanth N, Tsai PY, et al. Inactivation of paracellular cation-selective claudin-2 channels attenuates immune-mediated experimental colitis in mice[J]. J Clin Invest, 2020, 130(10): 5197-5208. DOI:10.1172/JCI138697 |
| [17] | Zhang YG, Wu SP, Xia YL, et al. Salmonella infection upregulates the leaky protein claudin-2 in intestinal epithelial cells[J]. PLoS One, 2013, 8(3): e58606. DOI:10.1371/journal.pone.0058606 |
| [18] | Wang YY, Mumm JB, Herbst R, et al. IL-22 increases permeability of intestinal epithelial tight junctions by enhancing claudin-2 expression[J]. J Immunol, 2017, 199(9): 3316-3325. DOI:10.4049/jimmunol.1700152 |
| [19] | Danielak A, Wallace JL, Brzozowski T, et al. Gaseous mediators as a key molecular targets for the development of gastrointestinal-safe anti-inflammatory pharmacology[J]. Front Pharmacol, 2021, 12: 657457. DOI:10.3389/fphar.2021.657457 |
| [20] | De Backer O, Elinck E, Blanckaert B, et al. Water-soluble CO-releasing molecules reduce the development of postoperative ileus via modulation of MAPK/HO-1 signalling and reduction of oxidative stress[J]. Gut, 2009, 58(3): 347-356. DOI:10.1136/gut.2008.155481 |
| [21] | Ning W, Choi AMK, Li CJ. Carbon monoxide inhibits IL-17-induced IL-6 production through the MAPK pathway in human pulmonary epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2005, 289(2): L268-L273. DOI:10.1152/ajplung.00168.2004 |
| [22] | Xue J, Habtezion A. Carbon monoxide-based therapy ameliorates acute pancreatitis via TLR4 inhibition[J]. J Clin Invest, 2014, 124(1): 437-447. DOI:10.1172/JCI71362 |
| [23] | Herpin A, Lelong C, Favrel P. Transforming growth factor-beta-related proteins: an ancestral and widespread superfamily of cytokines in metazoans[J]. Dev Comp Immunol, 2004, 28(5): 461-485. DOI:10.1016/j.dci.2003.09.007 |
| [24] | Ihara S, Hirata Y, Koike K. TGF-β in inflammatory bowel disease: a key regulator of immune cells, epithelium, and the intestinal microbiota[J]. J Gastroenterol, 2017, 52(7): 777-787. DOI:10.1007/s00535-017-1350-1 |
| [25] | Kanazawa S, Tsunoda T, Onuma E, et al. VEGF, basic-FGF, and TGF-beta in Crohn's disease and ulcerative colitis: a novel mechanism of chronic intestinal inflammation[J]. Am J Gastroenterol, 2001, 96(3): 822-828. DOI:10.1111/j.1572-0241.2001.03527.x |
| [26] | Zhang L, Zhou FF, García de Vinuesa A, et al. TRAF4 promotes TGF-β receptor signaling and drives breast cancer metastasis[J]. Mol Cell, 2013, 51(5): 559-572. DOI:10.1016/j.molcel.2013.07.014 |
| [27] | Du XM, Duan MM, Kan SY, et al. TGF-β3 mediates mitochondrial dynamics through the p-Smad3/AMPK pathway[J]. Cell Prolif, 2024, 57(5): e13579. DOI:10.1111/cpr.13579 |
| [28] | Yamashita M, Fatyol K, Jin CY, et al. TRAF6 mediates Smad-independent activation of JNK and p38 by TGF-beta[J]. Mol Cell, 2008, 31(6): 918-924. DOI:10.1016/j.molcel.2008.09.002 |
| [29] | Borgonetti V, Cocetta V, Biagi M, et al. Anti-inflammatory activity of a fixed combination of probiotics and herbal extract in an in-vitro model of intestinal inflammation by stimulating Caco-2 cells with LPS-conditioned THP-1 cells medium[J]. Minerva Pediatr (Torino), 2022, 74(5): 511-518. DOI:10.23736/S2724-5276.20.05765-5 |
| [30] | Meir M, Burkard N, Ungewiß H, et al. Neurotrophic factor GDNF regulates intestinal barrier function in inflammatory bowel disease[J]. J Clin Invest, 2019, 129(7): 2824-2840. DOI:10.1172/JCI120261 |
| [31] | Xiong W, Huang J, Li XY, et al. Icariin and its phosphorylated derivatives alleviate intestinal epithelial barrier disruption caused by enterotoxigenic Escherichia coli through modulate p38 MAPK in vivo and in vitro[J]. FASEB J, 2020, 34(1): 1783-1801. DOI:10.1096/fj.201902265R |
 2025, Vol. 34
2025, Vol. 34