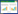2. 连云港市第一人民医院急诊科,连云港 222006
2. Emergency Department, The First People's Hospital of Lianyungang, Lianyungang 222006, China
急性肺损伤(acute lung injury, ALI)主要是由各种肺内因素和肺外因素损伤肺泡上皮细胞及毛细血管内皮细胞,导致弥漫性肺间质及肺泡水肿,临床以进行性低氧血症和呼吸窘迫为主要特征,严重时进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[1]。尽管近年来对ARDS的病理生理学认知和治疗手段均取得显著进展,但其病死率仍超过30%[2]。
随着脂质组学技术的发展,研究者已发现脂质代谢异常与脓毒症、肥胖和癌症等多种重症疾病密切相关[3-4]。而肺组织作为脂质代谢高度活跃的器官,其脂质稳态失衡在ALI/ARDS发生发展中的作用逐渐受到关注。有研究表明,脓毒症等因素可通过诱导脂质代谢紊乱,进而加剧肺内炎症级联反应与氧化损伤,但其具体调控机制尚不清楚[5-6]。在ALI/ARDS领域,缺乏通过建立动物模型联合脂质组学分析对其进行机制阐释的研究,尤其在差异脂质分子的筛选及其与疾病发病机制关联性方面存在明显空白。因此,本研究通过建立ALI大鼠模型并结合脂质组学方法,探索与ALI/ARDS发病机制相关的差异脂质分子,以期筛选出新型的、更为有效的生物标志物,为后续研究提供基础。
1 材料与方法 1.1 实验材料肺表面活性物质相关蛋白A(surfactant-associated protein A,SP-A)、SP-B、SP-C、SP-D抗体均购自武汉Proteintech公司;生理盐水、免疫组织化学检测试剂盒购自上海碧云天生物;水合氯醛、脂多糖购自美国Sigma-Aldrich公司;乙腈、乙酸铵、异丙醇溶液购自德国默克公司。
1.2 实验动物及分组SPF级成年雄性SD大鼠,20只,6~8周龄,300~350 g,购自武汉市万千佳兴生物科技有限公司,动物合格证号:SYXK(鄂)2023-0135。本研究中关于动物的处置和操作符合动物实验福利与伦理的基本要求。实验动物于温度20~26ºC,相对湿度40%~70%,12 h明暗交替,自由进食水、饲料,饲养7 d,分为2组,将大鼠随机(随机数字法)分为对照(control)组,ALI组,每组10只。腹腔注射5%水合氯醛350 mg/kg麻醉大鼠后,气管切开,置入导管并固定。ALI组:将脂多糖(lipopolysaccharide,LPS)溶于0.9%的生理盐水中,配成浓度为5 mg/mL的溶液,然后缓慢地向气管内滴注LPS以诱导大鼠急性肺损伤模型。control组:从气管内缓慢滴入等量的生理盐水。均在24 h后取材。
肺组织的收集:解剖大鼠胸腔立即进行肺组织取材,取左肺肺组织部分用于观察大鼠肺组织病理改变,右肺用于脂质组学检测及分析。
1.3 石蜡切片免疫组织化学检测SP-A、SP-B、SP-C、SP-D的变化。通过脱水、包埋、切片进行组织石蜡包埋切片,待水烤干蜡烤化后取出常温保存备用。然后进行石蜡切片免疫组织化学实验,使用显微镜镜检及Image-pro plus 6.0软件(Media Cybernetics,Inc.,Rockville,MD,美国)进行图像采集及分析。
1.4 脂质组全定量检测 1.4.1 通过液相色谱仪对目标化合物进行色谱分离将收集的肺组织,使用ACQUITY Premier超高效液相色谱仪(Waters,美国),通过液相色谱柱(Waters,美国)对目标化合物进行色谱分离。液相色谱A相为40%水和60%乙腈溶液,其中含10 mmol/L乙酸铵溶液;B相为10%乙腈和90%异丙醇溶液,其中含10 mmol/L乙酸铵溶液。
1.4.2 通过质谱分析对目标化合物进行检测和定量分析使用SCIEX Triple QuadTM 6500+质谱仪器(SCIEX,美国),数据采集时,以多反应监测模式进行质谱分析。
1.5 数据处理通过总离子流色谱图(total ion chromatography,TIC)进行质量控制(quality control,QC)分析。采用Biobud-v2.1.4.1对脂质组学原始数据进行色谱峰识别、提取,对识别的色谱峰进行脂质鉴定。使用SIMCA 16.0.2(Sartorius Stedim Data Analytics AB, Umeå, 瑞典)进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)反映各组之间的差异程度并得到变量权重值(variable importance for the projection,VIP)。结合差异倍数(fold change,FC),以VIP>1,FC>2.0或FC<0.5且P<0.05筛选差异脂质分子。利用R软件(v4.4.3)的ggplot 2包绘制火山图与箱线图。通过MetaboAnalyst 5.0(http://www.metaboanalyst.ca)在线代谢分析软件结合京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行脂质注释及代谢通路分析。
1.6 统计学方法本研究使用R软件(v4.4.3)和GraphPad Prism 9.0软件进行统计学分析和绘图。以P < 0.05为差异具有统计学意义。
2 结果 2.1 各组大鼠肺组织病理学改变光镜下可见,肺损伤组大鼠肺组织呈现较为严重的病理损伤,表现为弥漫性肺泡损伤,可见肺泡腔和间质内充血水肿、炎性细胞浸润、肺不张、透明膜形成等;对照组未见明显的肺组织病理学改变(图 1A)。免疫组织化学结果显示,根据切片平均光密度的变化可知与对照组相比,肺损伤组大鼠的SP-A、SP-B、SP-C、SP-D明显减少,图 1B。

|
| 图 1 LPS诱导急性肺损伤 Fig 1 LPS-induced acute lung injury |
|
|
质量控制结果表明,QC样品TIC保留时间与峰面积重叠良好(图 2A),证实仪器稳定性优异;空白样品无显著干扰峰(图 2B),表明物质残留控制有效且无交叉污染。

|
| 图 2 QC样品TIC叠加与空白样品残留对比图 Fig 2 Comparison of TIC Overlay of QC Samples and Residue Detection in Blank Samples |
|
|
结果显示,本研究分析的脂质化合物主要涵盖五大类,共涉及多个脂质亚类。(1)甘油磷脂(Glycerophospholipids)类占比最高,为46.97%,主要包括磷脂酰乙醇胺(Phosphatidylethanolamine,PE)占12.23%、磷脂酰胆碱(Phosphatidylcholine,PC)占6.36%、半单磷酸甘油酯(Bismonoacylglycerophosphate,BMP)占5.87%、磷脂酰甘油(Phosphatidylglycerol,PG)占5.77%、磷脂酰肌醇(Phosphatidylinositol,PI)占3.13%、溶血磷脂酰乙醇胺(Lysophosphatidylethanolamine,LPE)占1.57%、溶血磷脂酰胆碱(Lysophosphatidylcholine,LPC)及溶血磷脂酰甘油(Lyso-phosphatidylglycerol,LPG)分别占1.17%。(2)甘油酯(Glycerolipids)类占比42.76%,以甘油三酯(Triglycerides,TAG)为主,占比36.3%。(3)鞘脂(Sphingolipids)类占比5.28%,主要为神经酰胺(Ceramide,CER)占1.27%、鞘磷脂(Sphingomyelin,SM)占1.17%、二氢神经酰胺(Dihydroceramide,DCER)占0.78%、己糖基神经酰胺(Hexosylceramide,HexCer)占1.66%。(4)脂肪酰基(Fatty Acyls)类占比3.62%,主要为游离脂肪酸(Nonesterified fatty acid,FFA)。(5)甾醇(Sterol Lipids)类占比最少,为1.37%,主要为胆固醇酯(Cholesterylester,CE)。见图 3。

|
| 图 3 脂质成分分析 Fig 3 Lipid Composition Analysis |
|
|
PCA得分显示,两组样本基本处于95%置信区间(图 4A)。OPLS-DA得分显示,两组样本在脂质代谢物存在显著差异(图 4B)。OPLS-DA模型的置换检验结果提示,两组样本的R2Y和Q2值为0.46和-1.07(图 4C)。
|
| 注:A: PCA得分图;B: OPLS-DA得分图;C: OPLS-DA模型的置换检验结果(红色圆形代表对照组,蓝色正方形代表肺损伤组) 图 4 PCA、OPLS-DA分析 Fig 4 PCA and OPLS-DA analysis |
|
|
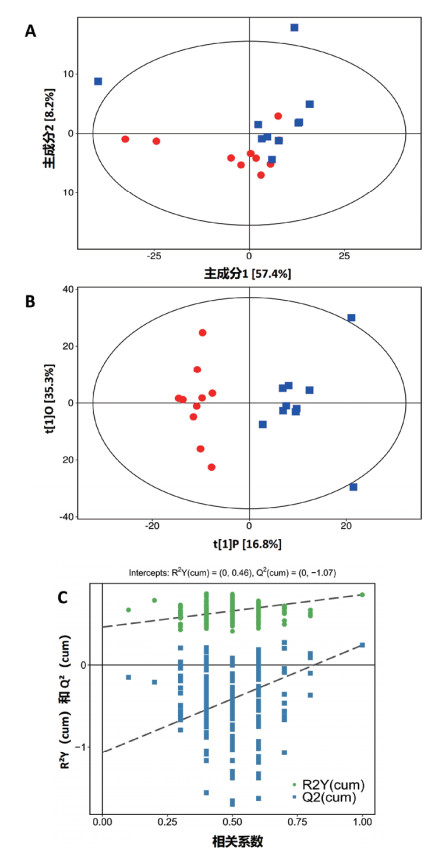
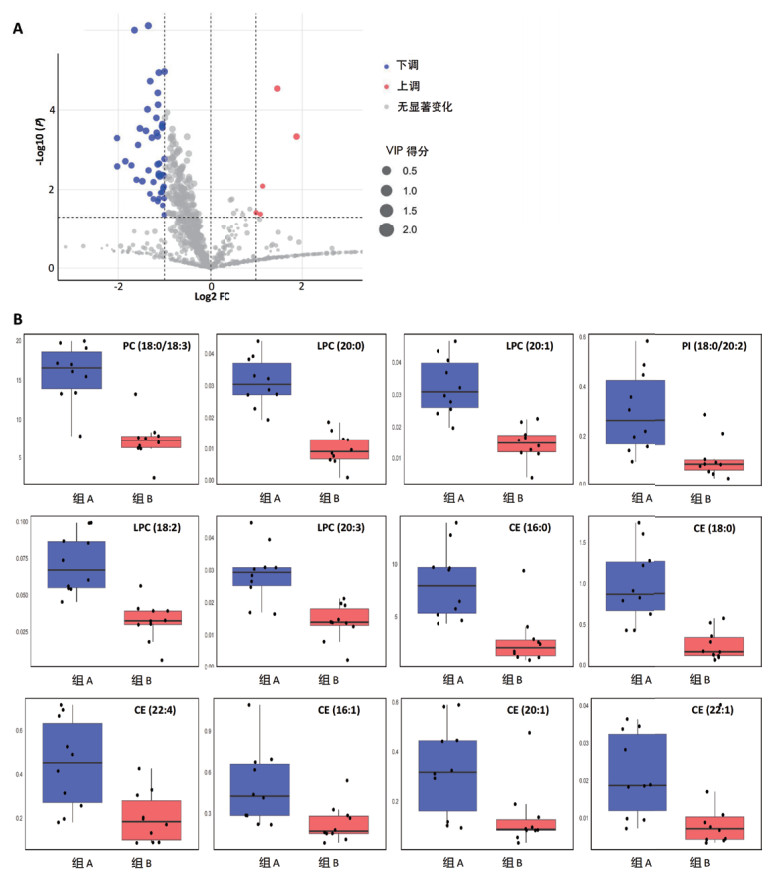
以VIP>1,结合FC>2.0或FC<0.5且P<0.05为标准,共筛选出47个差异脂质分子(表 1),与对照组相比,肺损伤组大部分差异脂质分子表达下调,仅少部分表达上调(图 5A)。利用MetaboAnalyst 5.0结合KEGG比对,鉴定出12个可注释脂质分子(表 2),并与对照组相比,肺损伤组PC(18:0/18:3),LPC(20:0),LPC(20:1),PI(18:0/20:2),LPC(18:2),LPC(20:3),CE(16:0),CE(18:0),CE(22:4),CE(16:1),CE(20:1)和CE(22:2)的含量显著降低(图 5B)。
| 脂质分子 | 脂质亚类 | P值 | VIP | LFC | 变化 |
| PS(18:1/22:5) | PS | 7.66×10-7 | 2.3108 | 0.3919 | ↓ |
| PC(18:0/18:3) | PC | 1.15×10-5 | 2.1609 | 0.4590 | ↓ |
| LPC(20:0) | LPC | 9.91×10-7 | 2.1370 | 0.3183 | ↓ |
| LPE(20:0) | LPE | 2.90×10-4 | 2.1278 | 0.3457 | ↓ |
| LPE(18:3) | LPE | 9.36×10-5 | 2.1260 | 0.3872 | ↓ |
| PS(22:1/22:1) | PS | 1.08×10-5 | 2.1024 | 0.4991 | ↓ |
| LPC(20:1) | LPC | 3.72×10-5 | 2.0552 | 0.4520 | ↓ |
| BMP(18:2/20:2) | BMP | 2.31×10-3 | 2.0423 | 0.4509 | ↓ |
| LPE(18:2) | LPE | 4.93×10-4 | 2.0418 | 0.4136 | ↓ |
| PS(22:0/22:1) | PS | 1.89×10-5 | 2.0330 | 0.4031 | ↓ |
| LPE(16:1) | LPE | 3.32×10-4 | 2.0104 | 0.3783 | ↓ |
| PI(18:0/20:2) | PI | 6.13×10-3 | 2.0075 | 0.3583 | ↓ |
| LPC(18:2) | LPC | 7.36×10-5 | 1.9974 | 0.4534 | ↓ |
| LPE(18:1) | LPE | 3.72×10-4 | 1.9964 | 0.4440 | ↓ |
| LPC(20:3) | LPC | 2.54×10-4 | 1.9926 | 0.4811 | ↓ |
| BMP(16:0/20:1) | BMP | 4.41×10-3 | 1.9724 | 0.4926 | ↓ |
| PE(P-16:0/18:3) | PE | 4.57×10-4 | 1.9611 | 0.4509 | ↓ |
| LPE(20:2) | LPE | 2.24×10-4 | 1.9513 | 0.4845 | ↓ |
| PC(20:0/20:2) | PC | 1.57×10-4 | 1.9217 | 0.4419 | ↓ |
| LPG(18:0) | LPG | 3.95×10-3 | 1.9210 | 0.4583 | ↓ |
| LPS(20:1) | LPS | 1.94×10-3 | 1.9010 | 0.2777 | ↓ |
| LPE(16:0) | LPE | 1.69×10-3 | 1.8980 | 0.4992 | ↓ |
| SM(26:0) | SM | 2.79×10-4 | 1.8600 | 0.4842 | ↓ |
| LPE(18:0) | LPE | 4.29×10-3 | 1.8526 | 0.4827 | ↓ |
| CE(16:0) | CE | 7.53×10-4 | 1.8379 | 0.3362 | ↓ |
| LPS(22:1) | LPS | 2.60×10-3 | 1.8028 | 0.2459 | ↓ |
| CE(18:0) | CE | 5.06×10-4 | 1.7780 | 0.2453 | ↓ |
| HexCer(18:1/14:0) | HCER | 4.64×10-4 | 1.7658 | 3.6726 | ↑ |
| CE(22:5) | CE | 4.71×10-3 | 1.7650 | 0.4656 | ↓ |
| LPG(16:0) | LPG | 2.20×10-3 | 1.7615 | 0.4606 | ↓ |
| LPE(20:1) | LPE | 3.27×10-3 | 1.7575 | 0.3930 | ↓ |
| LPS(20:2) | LPS | 2.45×10-3 | 1.7534 | 0.3042 | ↓ |
| LPS(18:0) | LPS | 5.66×10-3 | 1.7377 | 0.3283 | ↓ |
| PG(18:1/20:1) | PG | 9.15×10-3 | 1.6954 | 0.4892 | ↓ |
| LPG(16:1) | LPG | 8.38×10-3 | 1.6744 | 0.4940 | ↓ |
| PE(O-16:0/16:1) | PE | 6.42×10-3 | 1.6733 | 0.4236 | ↓ |
| HexCer(18:1/16:0) | HCER | 2.90×10-5 | 1.6554 | 2.7576 | ↑ |
| CE(22:4) | CE | 4.39×10-3 | 1.5230 | 0.4557 | ↓ |
| LPS(16:0) | LPS | 1.15×10-2 | 1.4815 | 0.4821 | ↓ |
| LPS(18:1) | LPS | 1.63×10-2 | 1.4564 | 0.4974 | ↓ |
| PC(14:0/20:5) | PC | 1.71×10-2 | 1.4525 | 0.4232 | ↓ |
| CE(16:1) | CE | 1.67×10-2 | 1.3781 | 0.4593 | ↓ |
| CE(20:2) | CE | 1.97×10-2 | 1.3496 | 0.4516 | ↓ |
| CE(20:1) | CE | 1.27×10-2 | 1.3075 | 0.4013 | ↓ |
| CE(22:2) | CE | 4.29×10-2 | 1.2165 | 0.4977 | ↓ |
| PS(16:1/22:3) | PS | 1.20×10-2 | 1.2044 | 0.4711 | ↓ |
| CE(22:1) | CE | 2.50×10-2 | 1.1965 | 0.4867 | ↓ |
| 注:BMP为半单磷酸甘油酯,CE为胆固醇酯,HCER/HexCer为己糖基神经酰胺,LPC为溶血磷脂酰胆碱,LPE为溶血磷脂酰乙醇胺,LPG为溶血磷脂酰甘油,LPS为脂多糖,PC为磷脂酰胆碱,PE为磷脂酰乙醇胺,PG为磷脂酰甘油,PI为磷脂酰肌醇,PS为磷脂酰丝氨酸,SM为鞘磷脂。P值均小于0.05,VIP为变量权重值,LFC为Log2化的差异倍数。变化:↓代表下调,↑代表上调。括号中比号前数字为碳链长度,比号后数字为碳链上双键数目,两组数字表示该化合物由两个较长的碳链组成 | |||||
|
| 注:A:肺损伤组与对照组肺组织差异脂质代谢物的火山图。B:肺损伤组与对照组的差异脂质分子表达(组A:对照组;组B:肺损伤组)。 图 5 组间差异分析 Fig 5 Intergroup Difference Analysis |
|
|
| 脂质分子 | KEGG ID | 脂质亚类 | P值 | VIP | LFC | 变化 |
| PC(18:0/18:3) | C00157 | PC | 1.15×10-5 | 2.1609 | 0.4590 | ↓ |
| LPC(20:0) | C04230 | LPC | 9.91×10-7 | 2.1370 | 0.3183 | ↓ |
| LPC(20:1) | C04230 | LPC | 3.71×10-5 | 2.0552 | 0.4520 | ↓ |
| PI(18:0/20:2) | C00626 | PI | 6.13×10-3 | 2.0075 | 0.3583 | ↓ |
| LPC(18:2) | C04230 | LPC | 7.36×10-5 | 1.9974 | 0.4534 | ↓ |
| LPC(20:3) | C04230 | LPC | 2.54×10-4 | 1.9926 | 0.4811 | ↓ |
| CE(16:0) | C11251 | CE | 7.53×10-4 | 1.8379 | 0.3362 | ↓ |
| CE(18:0) | C02530 | CE | 5.06×10-4 | 1.7780 | 0.2453 | ↓ |
| CE(22:4) | C02530 | CE | 4.39×10-3 | 1.5230 | 0.4557 | ↓ |
| CE(16:1) | C02530 | CE | 1.6×10-2 | 1.3781 | 0.4593 | ↓ |
| CE(20:1) | C02530 | CE | 1.27×10-2 | 1.3075 | 0.4013 | ↓ |
| CE(22:2) | C02530 | CE | 4.20×10-2 | 1.2165 | 0.4977 | ↓ |
| 注:PC为磷脂酰胆碱,LPC为溶血磷脂酰胆碱,PI为磷脂酰肌醇,CE为胆固醇酯。P值均小于0.05,VIP为变量权重值,LFC为Log2化的差异倍数。变化:↓代表下调。括号中比号前数字为碳链长度,比号后数字为碳链上双键数目,两组数字表示该化合物由两个较长的碳链组成 | ||||||
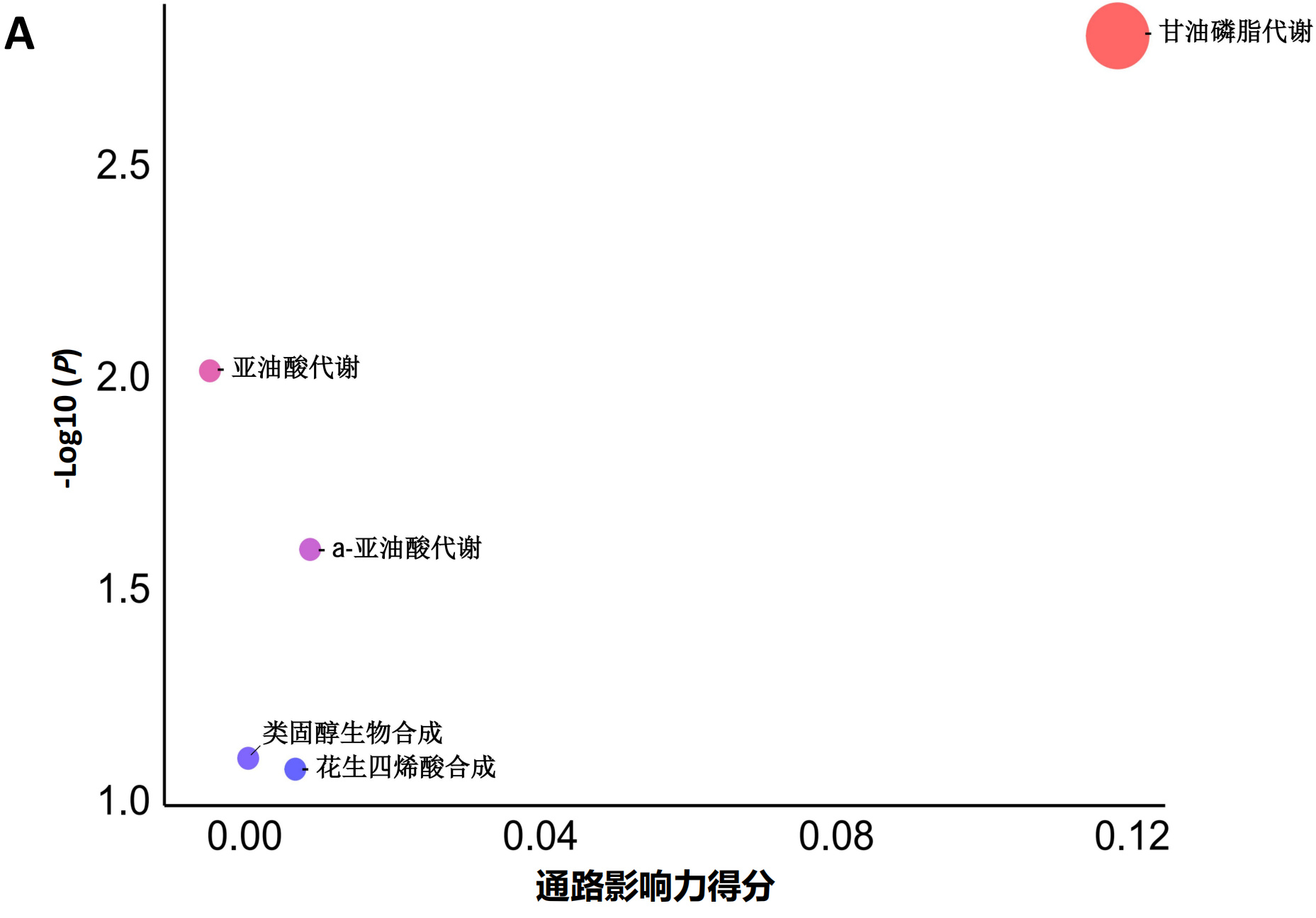
对可识别的12个差异脂质分子进行代谢通路分析,结果显示与ALI/ARDS有关的代谢途径有(1)甘油磷脂代谢(Glycerophospholipid metabolism);(2)亚油酸代谢(Linoleic acid metabolism);(3)α-亚麻酸代谢(α-linolenic acidmetabolism)。见图 6。
|
| 注:颜色:红色代表通路关联的P值更小(统计学显著性更高),蓝色代表P值更大;圆圈大小:圆圈越大,对应通路影响力得分越高 图 6 代谢通路分析 Fig 6 Metabolic Pathway Analysis |
|
|
本研究通过气管内滴注LPS构建急性肺损伤大鼠模型,结合病理评估与非靶向脂质组学分析,发现肺损伤组与对照组脂质代谢谱差异显著:以VIP>1,结合FC>2.0或FC<0.5且P <0.05为标准共筛选出47个差异脂质分子,经MetaboAnalyst 5.0注释得到12个差异脂质分子(以PC、LPC为主),且差异脂质高度富集于甘油磷脂代谢通路,提示其可能作为ALI/ARDS的潜在生物标志物。
以往研究对甘油磷脂代谢在ALI/ARDS中的具体变化尚不明确,但针对矽肺的研究提示甘油磷脂在矽肺进展中具有重要作用[7]。甘油磷脂代谢产物PC和LPC,在氧化应激和炎症反应中发挥重要作用[8]。
PC作为细胞膜主要磷脂,在信号转导中发挥重要作用。在本研究中,PC(18:0/18:3)在肺损伤组显著下调。Dushianthan等[9]发现,ARDS患者血浆中PC浓度显著低于健康对照组,这与本研究结果一致。其他的研究也表明,脓毒症患者的PC水平降低,尤其是以脓毒症为主病因的ARDS患者的PC(34:3)水平显著低于其他病因的患者[10-12],进一步支持PC可能作为ALI/ARDS的潜在脂质标志物。
PC可被磷脂酶A2(phospholipase A2,PLA2)水解产生LPC,后者参与氧化应激和炎症反应等多种信号通路,通过增加趋化因子的产生和激活内皮细胞、中性粒细胞、单核细胞、巨噬细胞和淋巴细胞来促进炎症[13-14]。Chang等[15]研究指出,脓毒症诱导的ARDS模型中LPC显著上调,尤其是LPC(17:6)、LPC(18:0)和LPC(16:0)在直接ARDS中的含量高于间接ARDS。然而,本研究发现LPS诱导的肺损伤模型中的LPC(20:0)、LPC(20:1)等显著降低,这与Chang等[15]的结论不同。值得注意的是,Chang研究的模型是基于脓毒症诱导的ARDS模型,而本研究则使用气管内滴注LPS诱导的肺损伤模型。这两种模型在炎症反应的启动机制上存在显著差异:脓毒症诱导的ARDS模型主要反映全身性感染导致的肺损伤,而气管内滴注LPS诱导的肺损伤模型则偏向模拟局部肺部炎症反应[17]。不同的诱导机制可能导致脂质代谢途径的差异。研究显示,LPC在全身性和局部性炎症反应中可能扮演不同角色,在脓毒症相关的ARDS中,LPC的上调与趋化因子的释放及炎症细胞的激活有关,而在局部肺部炎症的情况下,LPC可能在局部炎症放大的过程中发挥更重要的作用[18]。基于这些不同的炎症特点,本研究的发现能更直接反映局部肺损伤模型中的代谢特征。
本研究不足之处,研究仅分析了肺组织脂质谱,未检测肺泡灌洗液脂质谱;且目前仅完成脂质分子筛选,缺乏机制验证。后续将针对上述问题进一步完善脂质代谢在ALI/ARDS发生发展中的作用机制研究。
综上所述,本研究通过脂质组学分析揭示了LPS诱导的肺损伤模型中甘油磷脂代谢的显著变化,特别是PC(18:0/18:3)、LPC(20:0)、LPC(20:1)、LPC(18:2)、LPC(20:3)模型组中的显著下调,提示PC和LPC系列脂质可能作为潜在的ALI/ARDS生物标志物。
利益冲突 所有作者声明无利益冲突
作者声明贡献 汪晨:研究设计、实验操作、数据采集、统计学分析、论文撰写;张宇华:数据采集、论文撰写;谢永鹏:研究设计、论文修改、工作支持;陈晓兵:论文修改、工作支持;李小民:研究设计、论文修改、工作支持
| [1] | 袁雪燕, 邱海波, 刘玲. 急性呼吸窘迫综合征患者气体交换功能的评估及临床意义[J]. 中华医学杂志, 2022, 102(36): 2834-2838. DOI:10.3760/cma.j.cn112137-20220121-00164 |
| [2] | 薛皓月, 唐心怡, 丁锦秋, 等. 分子氢减轻脂多糖诱导急性肺损伤的机制探究[J]. 中华急诊医学杂志, 2024, 33(10): 1413-1420. DOI:10.3760/cma.j.issn.1671-0282.2024.10.011 |
| [3] | Zhu ZZ, Li JC, Si JH, et al. A large-scale genome-wide association analysis of lung function in the Chinese population identifies novel loci and highlights shared genetic aetiology with obesity[J]. Eur Respir J, 2021, 58(4): 2100199. DOI:10.1183/13993003.00199-2021 |
| [4] | Wang JN, Wang CY, Han XL. Mass spectrometry-based shotgun lipidomics for cancer research[J]. Adv Exp Med Biol, 2021, 1280: 39-55. DOI:10.1007/978-3-030-51652-9_3 |
| [5] | 刘毅, 李宁, 耿庆. 脂质代谢在急性肺损伤中的研究进展[J]. 中华实验外科杂志, 2023, 40(5): 999-1003. DOI:10.3760/cma.j.cn421213-20221116-00831 |
| [6] | 徐建新, 顾双双, 张月圆, 等. 脂质代谢与脓毒症关系研究进展[J]. 中华急诊医学杂志, 2025, 34(4): 599-603. DOI:10.3760/cma.j.issn.1671-0282.2025.04.022 |
| [7] | 何海兰, 戚荣, 崔洁, 等. 基于脂质代谢组学研究矽肺大鼠模型中血浆脂质特征[J]. 中华劳动卫生职业病杂志, 2023, 41(8): 569-575. DOI:10.3760/cma.j.cn121094-20221124-00558 |
| [8] | Papangelis A, Ulven T. Synthesis of lysophosphatidylcholine and mixed phosphatidylcholine[J]. J Org Chem, 2022, 87(12): 8194-8197. DOI:10.1021/acs.joc.2c00335 |
| [9] | Dushianthan A, Cusack R, Grocott MPW, et al. Abnormal liver phosphatidylcholine synthesis revealed in patients with acute respiratory distress syndrome[J]. J Lipid Res, 2018, 59(6): 1034-1045. DOI:10.1194/jlr.P085050 |
| [10] | Hussain H, Vutipongsatorn K, Jiménez B, et al. Patient stratification in sepsis: using metabolomics to detect clinical phenotypes, sub-phenotypes and therapeutic response[J]. Metabolites, 2022, 12(5): 376. DOI:10.3390/metabo12050376 |
| [11] | Mecatti GC, Fernandes Messias MC, Sant' Anna Paiola RM, et al. Lipidomic profiling of plasma and erythrocytes from septic patients reveals potential biomarker candidates[J]. Biomark Insights, 2018, 13: 1177271918765137. DOI:10.1177/1177271918765137 |
| [12] | Neugebauer S, Giamarellos-Bourboulis EJ, Pelekanou A, et al. Metabolite profiles in sepsis: developing prognostic tools based on the type of infection[J]. Crit Care Med, 2016, 44(9): 1649-1662. DOI:10.1097/CCM.0000000000001740 |
| [13] | Saito RF, Andrade LNS, Bustos SO, et al. Phosphatidylcholine-derived lipid mediators: the crosstalk between cancer cells and immune cells[J]. Front Immunol, 2022, 13: 768606. DOI:10.3389/fimmu.2022.768606 |
| [14] | Amunugama K, Pike DP, Ford DA. The lipid biology of sepsis[J]. J Lipid Res, 2021, 62: 100090. DOI:10.1016/j.jlr.2021.100090 |
| [15] | Chang YJ, Yoo HJ, Kim SJ, et al. A targeted metabolomics approach for sepsis-induced ARDS and its subphenotypes[J]. Crit Care, 2023, 27(1): 263. DOI:10.1186/s13054-023-04552-0 |
| [16] | 朱艳, 齐倩, 孟丽. 盲肠结扎穿刺和脂多糖诱导大鼠急性呼吸窘迫综合征模型的建立和分析[J]. 国际呼吸杂志, 2020, 40(3): 195-199. DOI:10.3760/cma.j.issn.1673-436X.2020.03.007 |
| [17] | Yoder M, Zhuge Y, Yang Y, et al. Bioactive lysophosphatidylcholine 16: 0 and 18: 0 are elevated in lungs of asthmatic subjects[J]. Allergy Asthma Immunol Res, 2014, 6(1): 61-65. DOI:10.4168/aair.2014.6.1.61 |
| [18] | Park DW, Kwak DS, Park YY, et al. Impact of serial measurements of lysophosphatidylcholine on 28-day mortality prediction in patients admitted to the intensive care unit with severe sepsis or septic shock[J]. J Crit Care, 2014, 29(5): 882.e5-882.11. DOI:10.1016/j.jcrc.2014.05.003 |
 2025, Vol. 34
2025, Vol. 34