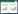体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)是一种先进的技术,涉及体外血液氧合,可救治特定重度呼吸衰竭或心力衰竭患者[1],可为心脏、肺或两者提供短期机械支持。ECMO在1970年代首次用于临床,我国于近几年才开始应用于重症的临床患者。虽然它挽救了许多生命,但其相对高昂的治疗费用及较多的并发症,使临床工作者较难的进行上机支持决策。近年来,为了克服这些限制,研究者们开发了整合器官功能评估系统的特定ECMO模型,其中最具代表性的是序贯器官衰竭SOFA(sequential organ failure assessment, SOFA)评分[2]和APACHE Ⅱ评分系统[3],这些评分系统在计算时都有不同程度的临床复杂性,在临床应用中仍有改进的空间。
终末期肝病模型-排除国际标准化比率(model for end-stage liver disease-excluding international normalized ratio, MELD-XI)是用于评估肝肾功能的临床指标,最初应用于肝硬化患者的临床抗凝指导。MELD-XI评分由总胆红素和血清肌酐水平确定,是一个综合指标,不仅反映肝脏和肾脏的状态,还反映两个器官的相互作用[4]。研究表明,MELD-XI评分正越来越多的应用于心脏疾病的预后预测[5-6]。本研究主要通过回顾性分析VA-ECMO病例,评价MELD-XI在VA-ECMO支持过程中早期预测临床结果的作用。
1 资料与方法 1.1 研究对象本研究通过回顾性分析2015年1月至2023年12月使用ECMO患者的临床数据资料,患者的资料从本院信息化系统收集。本研究通过了阜外华中心血管病医院科研与新技术、新业务伦理委员会批准,批号:(2024)伦理第(24号)。
纳入标准:⑴使用V-A ECMO的临床患者,不包括V-A-V ECMO和V-V ECMO;⑵上机最初24 h内有可用的血肌酐和总胆红素化验值;⑶患者基本信息完整;⑷年龄大于18周岁。
排除标准:⑴家属因经济原因放弃治疗患者;⑵上机时间不足24 h;⑶临床信息不完整患者或未详细记录VA-ECMO一般资料的患者。
MELD-XI计算公式=11.76×log(血肌酐值)+5.112×log(总胆红素值)+9.44(血肌酐值和总胆红素值为24 h内初次抽血生化结果)。
1.2 临床资料收集患者的基本资料:年龄、性别;术前合并症:高血压病、糖尿病、高脂血症、慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)、心脏介入手术史、心脏外科手术史、肝功能不全、肾功能不全、脑梗个人史、心梗个人史;VA-ECMO上机资料:上机地点、上机原因。
收集患者的临床资料:主动脉球囊反驳(intraaortic balloon pump, IABP)支持、持续肾脏替代治疗(continuous renal replacement therapy, CRRT)支持、是否成功撤机、上机后出现死亡、撤机后出现死亡、上机时长、重症监护室(intensive care unit, ICU)停留时间、住院时长;并发症:出血并发症、脑血栓并发症、肺栓塞并发症、下肢血栓并发症、血流感染、肺部感染、肝素诱导的血小板减少症(heparin induced thrombocytopenia, HIT)。
1.3 统计学方法采用X-tile软件,确定cut-off值,根据cut-off值进行分组。
单因素分析:采用SPSS 26.0进行统计学分析筛选出具有差异的变量,符合正态分布的计量资料以x±s表示,采用ANOVA分析进行比较;非正态分布的计量资料以中位数(四分位数)[M(Q1, Q3)]表示,采用Kruskal-Wallis H检验进行比较;计数资料以例(%)表示,比较采用χ2检验。
多因素分析:将单因素分析P<0.05的变量纳入二元Logistic多因素回归模型。以P<0.05为差异具有统计学意义。
2 结果2015年5月至2023年4月,阜外华中心血管病医院使用ECMO患者共1 577例,根据纳入和排除标准,本研究纳入940份病例,通过X-tile软件计算,MELD-XI评分cut-off值为13.90,具体见图 1。
|
| 图 1 基于MELD-XI评分存活率直方图 Fig 1 Histogram of survival rate based on MELD-XI score |
|
|
研究发现在患者特征和合并症方面:高血压病、高脂血症、心脏介入手术史、COPD、肝功能不全、肾功能不全、糖尿病、脑梗个人史、心梗个人史、心脏外科手术史、上机地点、上机原因,差异无统计学意义(P>0.05),具体见表 1。
| 项目 | MELD-XI评分≤13.9 (376例) | MELD-XI评分>13.9 (564例) | Z/χ2值 | P值 |
| 术前年龄a | 50 (36, 65) | 48 (33, 66) | -1.422 | 0.155 |
| 高血压病b | ||||
| 无 | 274 (72.9) | 392 (69.5) | 1.240 | 0.266 |
| 有 | 102 (27.1) | 172 (30.5) | ||
| 高脂血症b | ||||
| 无 | 228 (60.6) | 343 (60.8) | 0.003 | 0.957 |
| 有 | 148 (39.4) | 221 (39.2) | ||
| 心脏介入手术史b | ||||
| 无 | 330 (87.8) | 478 (84.8) | 1.698 | 0.193 |
| 有 | 46 (12.2) | 86 (15.2) | ||
| 慢性阻塞性肺疾病b | ||||
| 无 | 349 (92.8) | 516 (91.5) | 0.543 | 0.461 |
| 有 | 27 (7.2) | 48 (8.5) | ||
| 肝功能不全b | ||||
| 无 | 373 (99.2) | 559 (99.1) | 0.021 | 0.885 |
| 有 | 3 (0.8) | 5 (0.9) | ||
| 肾功能不全b | ||||
| 无 | 332 (88.3) | 484 (85.8) | 1.214 | 0.271 |
| 有 | 44 (11.7) | 80 (14.2) | ||
| 糖尿病b | ||||
| 无 | 304 (80.9) | 443 (78.5) | 0.735 | 0.391 |
| 有 | 72 (19.1) | 121 (21.5) | ||
| 脑梗个人史b | ||||
| 无 | 366 (97.3) | 527 (93.4) | 7.227 | 0.007 |
| 有 | 10 (2.7) | 37 (6.6) | ||
| 心梗个人史b | ||||
| 无 | 308 (81.9) | 424 (75.2) | 5.943 | 0.015 |
| 有 | 68 (18.1) | 140 (24.8) | ||
| 心脏外科手术史b | ||||
| 无 | 296 (78.7) | 424 (75.2) | 1.582 | 0.208 |
| 有 | 80 (21.3) | 140 (24.8) | ||
| 上机地点b | ||||
| 院内 | 254 (67.6) | 389 (69) | 0.457 | 0.796 |
| 他院 | 107 (28.5) | 150 (26.6) | ||
| 户外 | 15 (4) | 25 (4.4) | ||
| 上机原因b | ||||
| 心源性休克 | 250 (66.5) | 361 (64) | 1.288 | 0.257 |
| 心脏外科术后 | 73 (19.4) | 113 (20) | ||
| 心脏骤停 | 34 (9) | 59 (10.5) | ||
| 感染性休克 | 19 (5.1) | 31 (5.5) | ||
| 注:a为(x±s),b为例(%) | ||||
在患者预后方面,IABP使用、出血并发症、血流感染、肺部感染、HIT差异无统计学意义(P>0.05)。成功撤机率、机器运转时死亡、撤机后死亡、脑血栓并发症、下肢血栓并发症、CRRT使用、上机时长、住院时长、ICU停留时间差异具有统计学意义(P<0.05)。
2.2 多因素二元Logistic回归将预后指标:是否成功撤机、使用机器时死亡、撤机后死亡、脑血栓并发症、下肢血栓并发症、CRRT使用、上机时间、住院时长、ICU停留时间纳入多因素二元Logistic回归模型,见表 3。
| 项目 | MELD-XI评分≤13.9(376例) | MELD-XI评分 > 13.9(564例) | Z/χ2值 | P值 |
| IABP使用a | ||||
| 否 | 301 (80.1) | 432 (76.6) | 1.570 | 0.210 |
| 是 | 75 (19.9) | 132 (23.4) | ||
| 成功撤机a | ||||
| 否 | 201 (53.5) | 403 (71.5) | 31.812 | < 0.001 |
| 是 | 175 (46.5) | 161 (28.5) | ||
| 机器运转时死亡a | ||||
| 否 | 312 (83) | 343 (60.8) | 52.453 | < 0.001 |
| 是 | 64 (17) | 221 (39.2) | ||
| 撤机后死亡a | ||||
| 否 | 312 (83) | 437 (77.5) | 4.210 | 0.040 |
| 是 | 64 (17) | 127 (22.5) | ||
| 出血并发症a | ||||
| 无 | 241 (64.1) | 241 (64.1) | 0.131 | 0.717 |
| 有 | 135 (35.9) | 196 (34.8) | ||
| 脑血栓并发症a | ||||
| 无 | 362 (96.3) | 525 (93.1) | 4.319 | 0.038 |
| 有 | 14 (3.7) | 39 (6.9) | ||
| 肺栓塞并发症a | ||||
| 无 | 370 (98.4) | 555 (98.1) | 0.335 | 0.562 |
| 有 | 6 (1.6) | 9 (1.9) | ||
| 下肢血栓并发症a | ||||
| 无 | 347 (92.3) | 485 (86) | 8.789 | 0.003 |
| 有 | 29 (7.7) | 79 (14) | ||
| 血流感染a | ||||
| 无 | 346 (92) | 509 (90.2) | 0.862 | 0.353 |
| 有 | 30 (8) | 55 (9.8) | ||
| 肺部感染a | ||||
| 无 | 337 (89.6) | 518 (91.8) | 1.347 | 0.246 |
| 有 | 39 (10.4) | 46 (8.2) | ||
| CRRT使用a | ||||
| 无 | 307 (81.6) | 396 (70.2) | 15.648 | < 0.001 |
| 有 | 69 (18.4) | 168 (29.8) | ||
| HIT a | ||||
| 无 | 362 (96.3) | 534 (94.7) | 1.288 | 0.257 |
| 有 | 14 (3.7) | 30 (5.3) | ||
| 上机时长(h)b | 127(97, 157) | 208 (149, 261) | -17.786 | < 0.001 |
| ICU停留时间(d)b | 15(12, 18) | 26 (18, 33) | -18.790 | < 0.001 |
| 住院时长(d)b | 32(23, 42) | 53 (39, 67) | -17.503 | < 0.001 |
| 注:a为例(%),b为M(Q, Q3);HIT为肝素诱导的血小板减少症 | ||||
| 指标 | OR | 95%CI | P值 |
| 是否成功撤机 | 2.078 | (1.158~3.731) | 0.014 |
| 使用机器时死亡 | 0.271 | (0.144~0.512) | < 0.001 |
| 撤机后死亡 | 0.927 | (0.461~1.863) | 0.832 |
| 脑血栓并发症 | 0.474 | (0.088~2.538) | 0.383 |
| 下肢血栓并发症 | 0.379 | (0.138~1.038) | 0.059 |
| CRRT使用 | 3.277 | (1.659~6.474) | 0.001 |
| 住院时长(d) | 1.138 | (1.107~1.171) | < 0.001 |
| 上机时长(h) | 1.035 | (1.027~1.043) | < 0.001 |
| ICU停留时间(d) | 1.365 | (1.278~1.458) | < 0.001 |
多因素二元Logistic结果显示:是否成功撤机、运转机器时死亡、CRRT使用、住院时长、上机时长、ICU停留时间是V-A ECMO支持患者预后的独立影响因素。
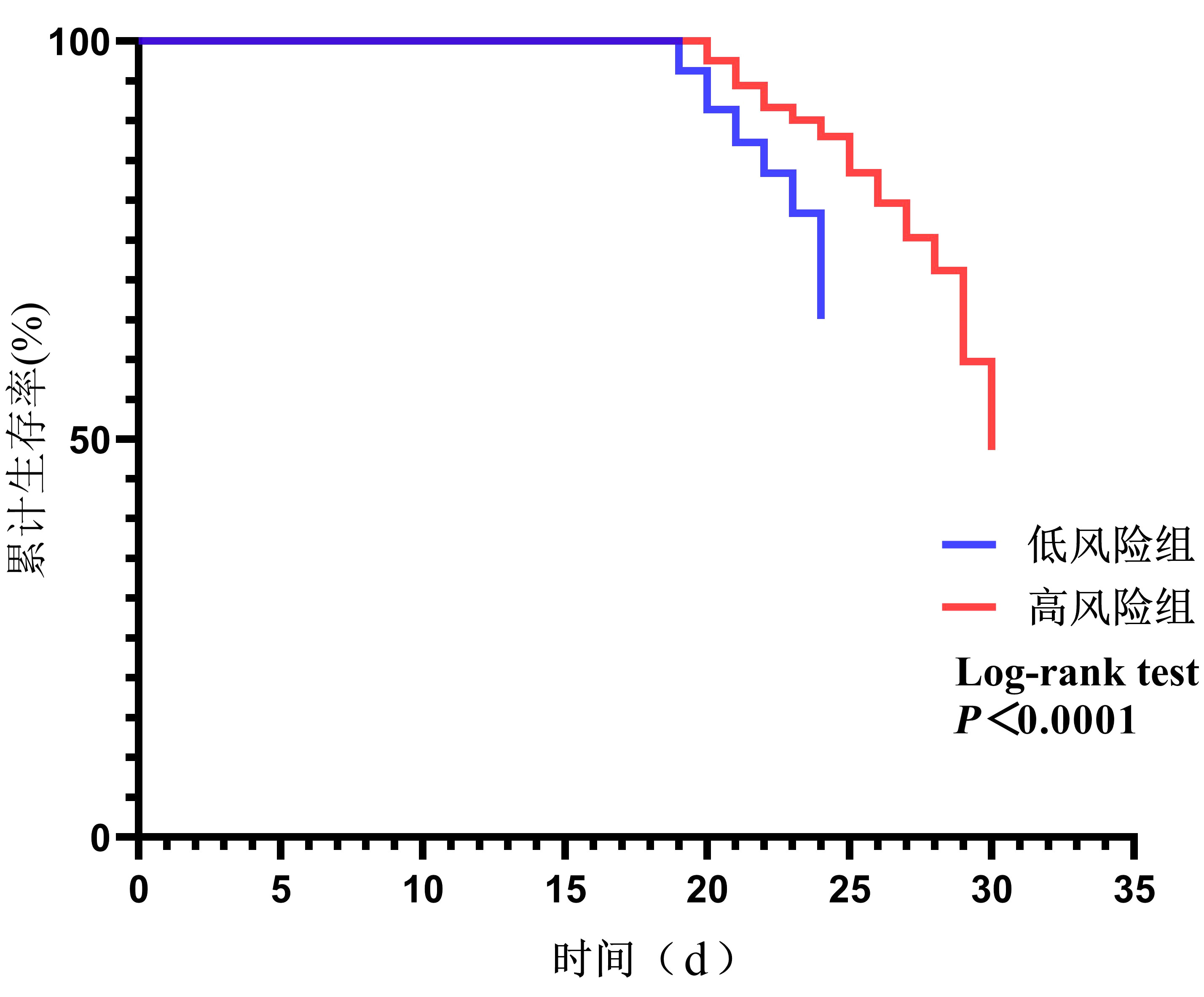
2.3 Kaplan-Meier曲线生存分析以VA-ECMO患者住院时间为观察终点,比较低风险组和高风险组的住院病死率,Kaplan-Meier曲线生存分析显示低风险组住院病死率显著低于高风险组(Log-rank test,HR=2.167,95%CI: 1.508~3.114,P<0.001),见图 2。
|
| 图 2 低风险组与高风险组住院生存曲线 Fig 2 In-hospital survival curves for low-risk and high-risk groups |
|
|
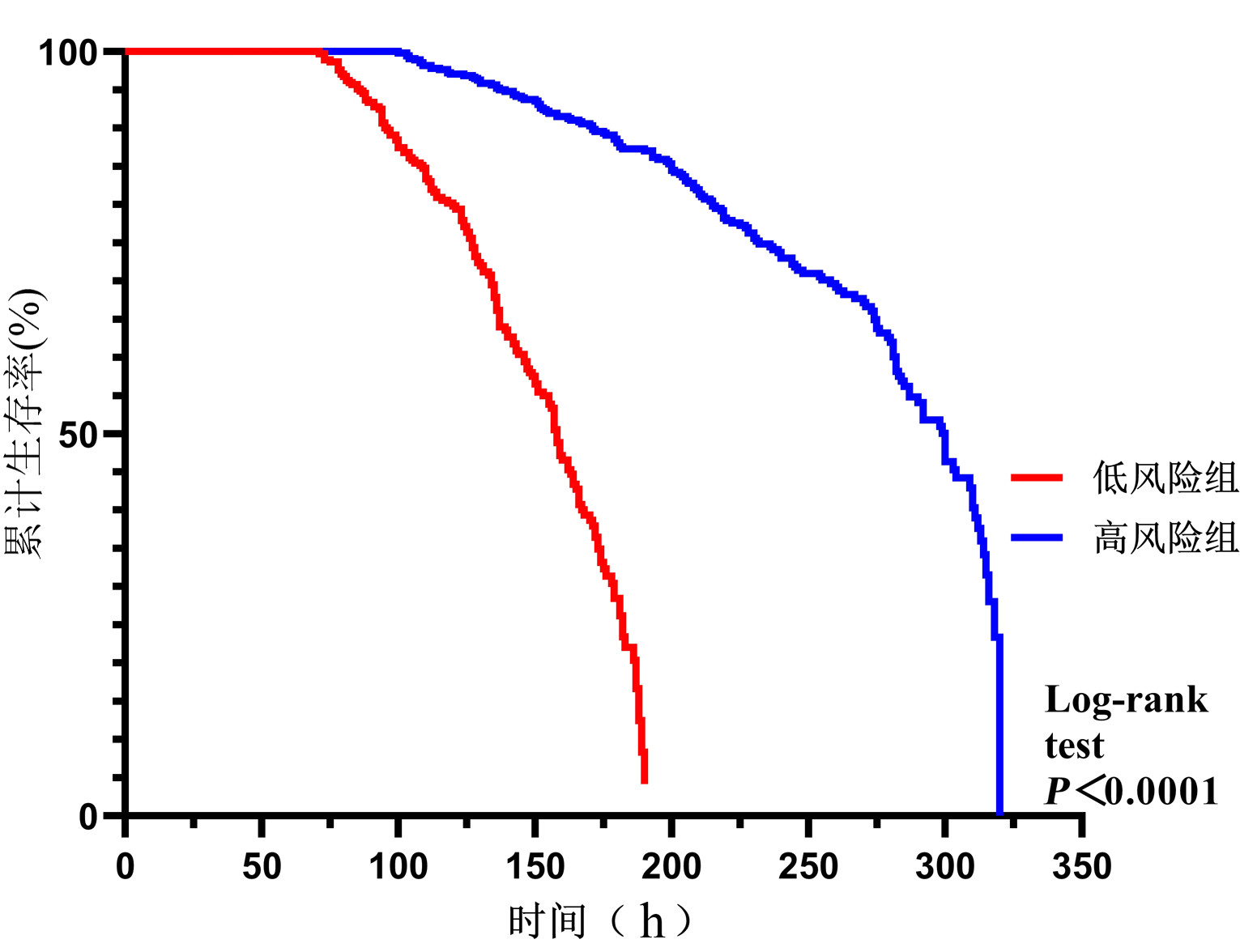
以VA-ECMO患者上机时间为观察终点,比较低风险组和高风险组的撤机成功率,Kaplan-Meier曲线生存分析显示低风险组撤机成功率显著高于高风险组(Log-rank test,HR=5.353,95%CI: 4.023~7.121,P<0.001),见图 3。
|
| 图 3 低风险组与高风险组撤机成功率曲线图 Fig 3 Graph of the success rate of withdrawal in the low-risk group versus the high-risk group |
|
|
VA-ECMO是一种支持性治疗,但要使患者获得良好的预后,须选择风险较低的患者,既往已经开发很多模型用来评估患者接受ECMO治疗后是否能够获得有意义的恢复[7-8],但临床决策较为复杂。本研究结果表明MELD-XI评分可以预测VA-ECMO支持患者的预后。
既往研究表明在ECMO启动后48 h内计算时,MELD评分能够高精度地预测其生存率[9]。以前的研究以血肌酐水平或肾小球滤过率,被广泛用作预测危重患者病死率的指标,其中包括接受VA-ECMO的患者[10]。同样,肝功能障碍也被证明可以预测VA-ECMO患者的预后[11]。由于MELD评分实验室标志物都包含在临床常规中,因此该分数易于计算且经常可用。
本研究发现,MELD-XI评分>13.9组与MELD-XI评分<13.9比较有较高的运转机器病死率和CRRT使用率,较长的住院时间、上机时间、ICU停留时间;Kaplan-Meier曲线分析显示MELD-XI评分>13.9组的住院死亡风险是MELD-XI评分≤13.9的2.167倍,同时MELD-XI评分≤13.9组的撤机成功率是MELD-XI评分>13.9组的5.353倍。
MELD-XI评分是几种改良的MELD评分之一,最初用于评估接受口服抗凝剂的终末期肝病患者的疾病严重程度,以合理的考虑肝移植[12]。先前的研究已经证实,肝肾损害是心源性休克的常见病症,并且病死率与MELD-XI评分高度正相关[13-14]。心脏功能失代偿引起肝肾灌注不足,导致肾小球滤过率降低,此外右心压力升高,进一步加重体循环充血,进一步加重肝缺血和缺氧,这是目前心脏功能受损导致肝肾损害机制的常见解释。
MELD-XI评分在心脏疾病中的预测有较多的研究,包括预测缩窄性心包炎心包切除术后病死率[15]、慢性心力衰竭患者病死率[16]、心脏移植早期病死率[17]等。既往研究[6, 18]提示MELD-XI评分最佳截断值为10~15,本研究的通过X-tile软件计算含有时间依赖变量的MELD-XI评分最佳截断值为13.9。MELD-XI评分标准实验室检查获得的参数(总胆红素和血肌酐),计算简单、快速、客观且可重复。此外,获得MELD-XI分数的速度使其能够在时间紧急情况下使用。与超声检查相比,该分数客观且易于测量,不依赖于个人经验或技能。
本研究的优点和创新性包括,①MELD-XI评分由来已久,但在对VA-ECMO预测作用方面国内探讨较少,为临床大夫提供思路;②通过查阅相关参考文献,本研究提供的VA-ECMO病例数是相对较多的;③既往对于最佳截断值最常采用ROC曲线分析,本研究采用X-tile软件在含有时间的最佳截断值上有较好的优势。
本研究仍存在一些不足之处:①本研究是单中心回顾性研究,仍需外部数据进一步验证;②实验室评估的时间和频率没有标准化;③病例跨越时间较长,在此期间临床技术人员的技术及认知可能发生变化,后期需要进行前瞻性研究;④本研究纳入的为24 h MELD-XI,后期可纳入动态指标,进行观察。
综上所述,MELD-XI评分可以预测VA-ECMO支持患者的预后,帮助临床大夫进行复杂的临床决策。
利益冲突 所有作者声明无利益冲突
作者贡献 李建朝实施研究数据整理和论文撰写、提供基金支持;钱晓亮、孟凡伟、任培军进行数据收集和统计学分析;程兆云进行研究指导
| [1] | Ng GW, Yuen HJ, Sin KC, et al. Clinical use of venovenous extracorporeal membrane oxygenation[J]. Hong Kong Med J, 2017, 23(2): 168-176. DOI:10.12809/hkmj166070 |
| [2] | Magoon R, Shri I, Kohli JK, et al. SOFA scoring in VA-ECMO: plenty to ponder![J]. J Cardiothorac Vasc Anesth, 2020, 34(10): 2844-2845. DOI:10.1053/j.jvca.2020.02.049 |
| [3] | Ng WT, Ling L, Joynt GM, et al. An audit of mortality by using ECMO specific scores and APACHE Ⅱ scoring system in patients receiving extracorporeal membrane oxygenation in a tertiary intensive care unit in Hong Kong[J]. J Thorac Dis, 2019, 11(2): 445-455. DOI:10.21037/jtd.2018.12.121 |
| [4] | Wernly B, Lichtenauer M, Vellinga N, et al. Model for End-Stage Liver Disease Excluding INR (MELD-XI) score is associated with hemodynamic impairment and predicts mortality in critically ill patients[J]. Eur J Intern Med, 2018, 51: 80-84. DOI:10.1016/j.ejim.2018.01.028 |
| [5] | Mizobuchi S, Saito Y, Fujito H, et al. Prognostic importance of improving hepatorenal function during hospitalization in acute decompensated heart failure[J]. ESC Heart Fail, 2022, 9: 3113-3123. DOI:10.1002/ehf2.14046 |
| [6] | Saito Y, Nakai T, Ikeya Y, et al. Prognostic value of the MELD-XI score in patients undergoing cardiac resynchronization therapy[J]. ESC Heart Fail, 2022, 9(2): 1080-1089. DOI:10.1002/ehf2.13776 |
| [7] | Banga S, Challa A, Patel AR, et al. The patient selection criteria for veno-arterial extracorporeal mechanical oxygenation[J]. Cureus, 2019, 11(9): e5709. DOI:10.7759/cureus.5709 |
| [8] | Pineton de Chambrun M, Bréchot N, Combes A. Venoarterial extracorporeal membrane oxygenation in cardiogenic shock: indications, mode of operation, and current evidence[J]. Curr Opin Crit Care, 2019, 25(4): 397-402. DOI:10.1097/MCC.0000000000000627 |
| [9] | Karnib M, Haraf R, Tashtish N, et al. MELD score is predictive of 90-day mortality after veno-arterial extracorporeal membrane oxygenation support[J]. Int J Artif Organs, 2022, 45(4): 404-411. DOI:10.1177/03913988211054865 |
| [10] | Chen W, Pei MY, Chen CX, et al. Independent risk factors of acute kidney injury among patients receiving extracorporeal membrane oxygenation[J]. BMC Nephrol, 2023, 24(1): 81. DOI:10.1186/s12882-023-03112-6 |
| [11] | Nikola D, Robert M, Yin KH, et al. Liver dysfunction associated with in-hospital mortality in adult extracorporeal membrane oxygenation support[J]. Crit Care Explor, 2021, 3(7): e0484. |
| [12] | Heuman DM, Mihas AA, Habib A, et al. MELD-XI: a rational approach to "sickest first" liver transplantation in cirrhotic patients requiring anticoagulant therapy[J]. Liver Transpl, 2007, 13(1): 30-37. DOI:10.1002/lt.20906 |
| [13] | Biegus J, Demissei B, Postmus D, et al. Hepatorenal dysfunction identifies high-risk patients with acute heart failure: insights from the RELAX-AHF trial[J]. ESC Heart Fail, 2019, 6(6): 1188-1198. DOI:10.1002/ehf2.12477 |
| [14] | Biegus J, Zymliński R, Sokolski M, et al. Impaired hepato-renal function defined by the MELD XI score as prognosticator in acute heart failure[J]. Eur J Heart Fail, 2016, 18(12): 1518-1521. DOI:10.1002/ejhf.644 |
| [15] | Diaz Soto JC, Mauermann WJ, Lahr BD, et al. MELD and MELD XI scores as predictors of mortality after pericardiectomy for constrictive pericarditis[J]. Mayo Clin Proc, 2021, 96(3): 619-635. DOI:10.1016/j.mayocp.2020.08.048 |
| [16] | Lin ZB, Liu X, Xiao L, et al. The MELD-XI score predicts 3-year mortality in patients with chronic heart failure[J]. Front Cardiovasc Med, 2022, 9: 985503. DOI:10.3389/fcvm.2022.985503 |
| [17] | Grimm JC, Shah AS, Trent Magruder J, et al. MELD-XI score predicts early mortality in patients after heart transplantation[J]. Ann Thorac Surg, 2015, 100(5): 1737-1743. DOI:10.1016/j.athoracsur.2015.07.026 |
| [18] | Ayers B, Wood K, Melvin A, et al. MELD-XI is predictive of mortality in venoarterial extracorporeal membrane oxygenation[J]. J Card Surg, 2020, 35(6): 1275-1282. DOI:10.1111/jocs.14578 |
 2025, Vol. 34
2025, Vol. 34