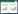脓毒症是机体对感染的反应失调而导致危及生命的器官功能障碍,早期识别和适当治疗可以改善其预后[1]。在其导致的多器官功能障碍中,心脏是可进一步促进脓毒症恶化和发展、严重影响脓毒症患者预后的主要受累器官之一[2]。心肌收缩功能障碍和左心室射血分数降低是脓毒性心肌病(sepsis-induced cardiomyopathy, SIC)的特征性表现。临床往往表现为双室扩张、左室射血分数可逆性下降,静脉输液后血压反应性降低[3-4],SIC患者往往以心肌抑制为死亡的主要原因。随着国内外的深入研究,研究者相继发现细胞因子作用、线粒体功能障碍、细胞凋亡、一氧化氮影响、钙稳态异常等都是可能的发病机制,且各机制之间相互影响。近年来,SIC被发现与细胞焦亡紧密相关[5-6]。细胞焦亡是炎性半胱天蛋白酶(caspase-1/4/5/11)介导的细胞程序性死亡的一种类型,诱导细胞核凝聚和DNA分裂,在细胞膜上形成孔隙,破坏细胞膜的完整性,导致细胞肿胀破裂,引起炎症性坏死[7-9]。
沉默调节蛋白1(Silent information regulator 1, Sirt1)是依赖于烟酰胺腺嘌呤二核苷酸(nicotinamide adenime dinucleotide,NAD+)的第三类组蛋白去乙酰化酶[10]。它对非组蛋白的去乙酰化作用可以调节代谢、减弱炎症反应、抑制氧化应激的损伤、抗凋亡等[11]。已有研究证明,提高Sirt1可降低活性氧(reactive oxygen species, ROS)的生成,进而抑制NLRP3蛋白(NOD-like recept or family pyrin domain containing 3)炎症小体的活性。从而对介导糖尿病心肌病发生的Caspase-1的活化作用起到进一步的抑制作用[12]。有研究报道Sirt1通过PGC-1α/Nrf2信号通路在氧化应激引起的大鼠肝脏和脑损伤中调控细胞焦亡[13]。由此,笔者推测Sirt1/PGC-1α/Nrf2通路的激活可能抑制SIC导致的细胞焦亡。
本研究通过建立SIC大鼠模型,探讨是否可以通过白藜芦醇兴奋Sirt1/PGC-1α/Nrf2信号通路,缓解SIC的焦亡,进而缓解SIC,并对其治疗脓毒症引起的器官功能障碍的有效性和可行性进行思考。
1 材料与方法 1.1 实验动物从新疆医科大学动物实验中心购买32只10周龄、体重180~240 g的雄性SD大鼠(清洁级)。饲养温度保持在18~24℃,湿度控制在40%~60%之间,保持每天12 h的昼夜交替,适应性训练7 d,可以自由地进食进水。经新疆医科大学实验动物伦理委员会审批,伦理审批号为IACUC-JT-20230831-12。
1.2 方法 1.2.1 主要试剂白藜芦醇(CAS编号:501-36-0,武汉三鹰生物技术有限公司);SR-18292(CAS编号:2095432-55-4,MedChemExpress,美国);心肌肌钙蛋白Ⅰ(cardiac troponin-I, cTnI)、白细胞介素(Interleukins, IL-1β、IL-18)酶联免疫吸附测定试剂盒(上海江莱生物科技有限公司);大鼠活性氧ROS酶联免疫吸附测定试剂盒(上海欣彩生物科技有限公式),丙二醛(MDA)试剂盒(微板法,海江莱实业有限公司)。Sirt1抗体(沈阳万类生物科技有限公司),PGC-1α抗体、Nrf2、Caspase-1、NLRP3(武汉三鹰生物技术有限公司),GSDMD(万类生物科技)等抗体。
1.2.2 动物模型制备、分组及处理32只SD雄性大鼠用随机数字法分为假手术组(sham组)、脓毒症组(C组)、Sirt1激动剂组(S组)、Sirt1激动剂+PGC-1α抑制剂组(SP组),每组8只,术前SP组大鼠每日腹腔注射PGC-1α抑制剂SR-18292稀释液45 mg/kg[14],每日1次,连续3日;术前12 h需给大鼠禁食。所有大鼠采用异氟烷吸入麻醉,仰卧位固定,胸腹部心脏超声区域及手术区域脱毛膏脱毛,碘伏消毒,沿腹前正中线作约1.5 cm切口,进入腹腔,分离盲肠,sham组大鼠不进行盲肠穿孔结扎,直接还纳腹腔,其余大鼠在盲肠1/2处用3号线结扎,使用50 mL注射器针头在结扎端作两对穿孔,挤出少量肠内容物后还纳盲肠,腹膜及皮肤用4号线缝合,颈后皮下注射生理盐水30 mL/kg作液体复苏,手术过程中动作轻柔,尽量避免对血管的损伤。术后2 h,S组和SP组大鼠腹腔注射Sirt1激动剂白藜芦醇稀释液50 mg/kg[15]。术后脓毒症大鼠逐渐出现毛发竖立,体温升高,精神萎靡,活动减少,眼角有分泌物,脓尿,肛门有粪便堆积等表现。术后20 h行大鼠心脏超声检查,后经腹主动脉采血处死大鼠,并获取心肌组织用于后续实验。
1.2.3 心脏超声检查术后20 h,大鼠采用异氟烷吸入麻醉后进行心脏超声检查评估心功能,采用RMV 707B型高频超声探头,频率25~30 MHz。大鼠取仰卧位,胸骨旁左心室短轴乳头肌切面采集M型超声心动图,记录大鼠的左室舒张末容积(left ventricular end-diastolic volume, LVEDV)、左室射血分数(left ventricular ejection fraction, LVEF)、左室收缩末容积(left ventricular end systolic volume, LVESV)以及左室短轴缩短率(left ventricular fractional shortening, LVFS)。
1.2.4 心肌组织病理检查大鼠心脏组织由4%多聚甲醛固定72 h,后经脱水、透明、石蜡包埋、切片、烤片、脱蜡、苏木素和伊红染色,观察心肌组织损伤程度及炎症细胞浸润情况。
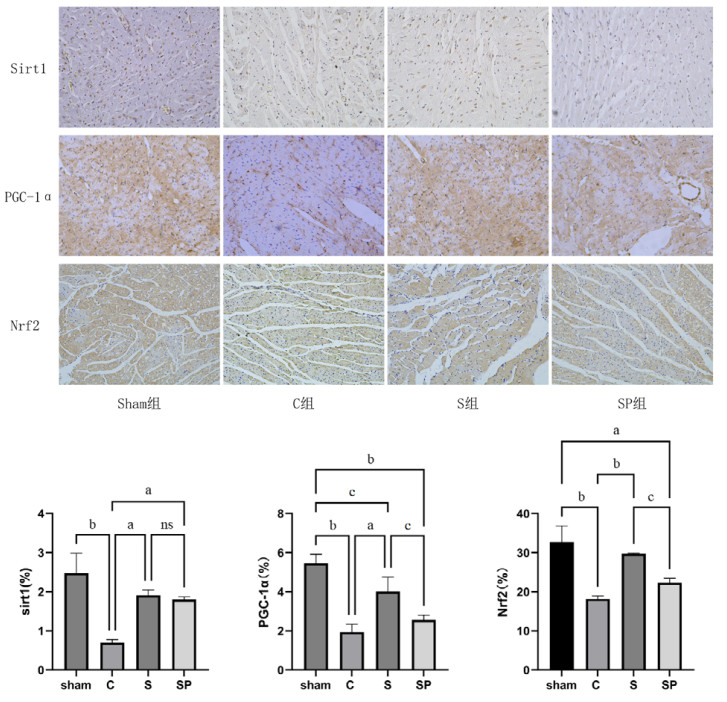
1.2.5 心肌组织免疫组织化学检查取大鼠心肌组织切片,经烤片、脱蜡,柠檬酸盐抗原修复液修复,用3%过氧化氢溶液阻断内源性过氧化物酶,封闭液封闭;加入Sirt1(1∶150)、PGC-1α(1∶250)、Nrf2(1∶200)一抗,4℃孵育过夜;第二日磷酸缓冲盐溶液洗三遍,加用HRP标记的IgG二抗,DAB显色,苏木素复染,显微镜下细胞呈棕褐色为阳性表达。计算心肌组织中Sirt1、PGC-1α、Nrf2的蛋白表达阳性率。
1.2.6 血清cTnI、IL-1、IL-18、ROS、MDA水平检测取大鼠腹主动脉血4 mL,3 000 r/min,4℃离心15 min,取上清液,采用ELISA法检测血清cTnI、IL-1β、IL-18水平;取适量心肌组织匀浆,用ELISA法检测组织内的ROS浓度,用微板法检测心肌组织内MDA水平;严格按照试剂盒说明书进行操作。
1.2.7 Western Blotting检测大鼠心肌Sirt1、PGC-1α、Nrf2、Caspase1、GSDMD、NLRP3蛋白表达水平称取适量心脏组织,BCA法测定心肌组织蛋白浓度,10%的SDS凝胶,上样,电泳结束后将蛋白凝胶转移到PVDF膜上,封闭洗膜,将膜与PGC-1α,Sirt1、Nrf2、Caspase1、GSDMD、NLRP3等蛋白一抗过夜孵育,Tris盐缓冲液(TBST)清洗,孵育生物素标记山羊抗兔的二抗1 h,TBST清洗后加超敏化学发光液(ECL),使用化学发光ECL显影系统成像。
1.3 统计学方法应用Grapad Prism 10.0和SPSS 27.0软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差(x±s)表示,两组比较采用独立样本t检验,多组之间比较采用单因素方差分析,组间两两比较采用LSD-t检验;不符合正态分布者,以四分位数进行描述,采用非参数检验(克鲁斯卡尔-沃利斯H检验);以P < 0.05为差异具有统计学意义。
2 结果 2.1 大鼠心脏超声检查C组LVEDV和LVESV均高于假手术组,而左心室射血分数(LVEF)和左心室缩短率(LVFS)则低于sham组(P < 0.05);而S组较C组LVEF、LVFS升高,差异具有统计学意义(P < 0.05),但LVESV虽较C组有所下降,但差异无统计学意义(P > 0.05)。而SP组较S组的LVESV升高,具有统计学意义(P < 0.05);LVEF、LVFS、LVEDV下降,但差异无统计学意义(P > 0.05)。见表 1。大鼠CLP术后20 h心脏超声结果见图 1,sham组大鼠左心室结构正常,心室腔近椭圆形,侧壁显示清楚,室壁运动正常;C组为脓毒症组,可见大鼠左心室心腔明显扩大,室壁运动减弱,收缩功能下降。
| 指标 | sham组(n=8) | C组(n=7) | S组(n=8) | SP组(n=8) | F值 | P值 |
| LVEDV (μL) | 94.83±18.00 | 154.60±8.43a | 186.18±10.89 a | 178.05±15.36 a | 9.1 | < 0.001 |
| LVESV (μL) | 3.39±1.37 | 30.52±2.97a | 22.89±2.09 a | 32.43±4.66 ac | 19.1 | < 0.001 |
| LVEF (%) | 97.39±0.87 | 80.48±0.82a | 87.79±0.79 ab | 82.30±1.79 a | 44.0 | < 0.001 |
| LVFS (%) | 79.65±3.05 | 49.78±0.79a | 59.03±1.11 ab | 52.35±1.85 a | 50.3 | < 0.001 |
| 注:sham组为假手术组,C组为CLP模型组,S组为CLP+Sirt1激动剂组,SP组为CLP+Sirt1激动剂组+PGC-1α抑制剂组;与sham组比较,aP < 0.05;与C组比较,bP < 0.05;与S组比较,cP < 0.05 | ||||||
|
| 注:sham组为假手术组,C组为CLP模型组,S组为CLP+Sirt1激动剂组,SP组为CLP+sirt1激动剂组+PGC-1α抑制剂组 图 1 各组大鼠心脏超声结果 Fig 1 Ultrasound images of rat hearts in each group |
|
|
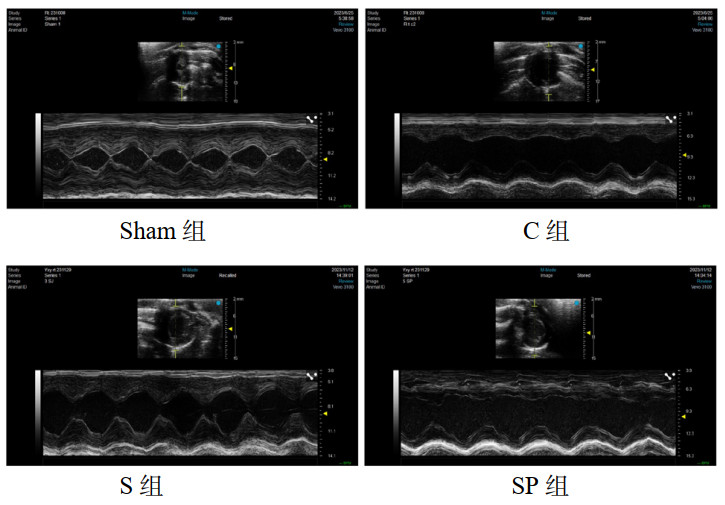
sham组心肌细胞排列正常,无充血、水肿及渗出,心肌纤维排列紧密。C组心肌纤维断裂,心肌细胞有水肿,心肌纤维排列紊乱,心肌纤维横纹消失,间质血管扩张充血,间质大量炎症细胞浸润。与C组相比,S组心肌细胞水肿、坏死减轻,心肌细胞排列较前者规整,炎症浸润减少。SP组较S组心肌细胞水肿、坏死加重,心肌细胞排列较前者紊乱,心肌细胞空泡样变形增多,间质炎症细胞浸润增多。见图 2。
|
| 注:sham组为假手术组,C组为CLP模型组,S组为CLP+Sirt1激动剂组,SP组为CLP+Sirt1激动剂组+PGC-1α抑制剂组 图 2 四组心肌组织病理图(HE×200) Fig 2 Histopathologic picture of myocardial tissue in four groups (HE staining, ×200) |
|
|
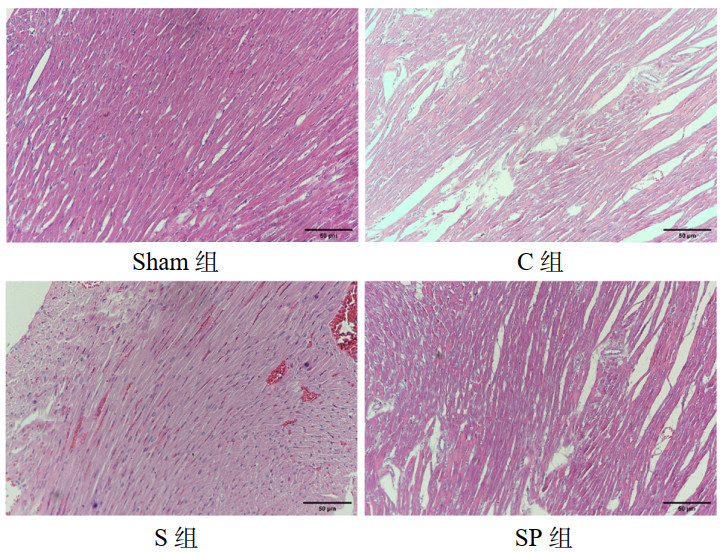
C组大鼠心肌组织Sirt1、PGC-1α、Nrf2蛋白表达低于sham组(P < 0.05),而S组和SP组的Sirt1表达高于C组(P < 0.05),S组的PGC-1α和Nrf2蛋白表达高于C组(P < 0.05),SP组与S组的Sirt1表达差异无统计学意义(P > 0.05),SP组PGC-1α和NRF2低于S组(P < 0.05);而NLRP3、GSDMD以及Caspase1等焦亡相关蛋白在C组的表达高于Sham组(P < 0.05),S组的表达量较C组有所下降(P < 0.05),SP组较S组表达量升高(P < 0.05),差异均具有统计学意义。见图 3。
|
| 注:sham组为假手术组,C组为CLP模型组,S组为CLP+Sirt1激动剂组,SP组为CLP+Sirt1激动剂组+PGC-1α抑制剂组;a为P < 0.001,b为P < 0.01,c为P < 0.0001,d为P < 0.05,ns为差异无统计学意义 图 3 心脏组织中Sirt1、PGC-1α、Nrf2通路蛋白及GSDMD、NLRP3、NRF2蛋白表达水平 Fig 3 Expression levels of Sirt1, PGC-1 α, Nrf2 pathway proteins and GSDMD, NLRP3, Caspase 1 proteins in cardiac tissue |
|
|
C组较sham组的IL-1β、IL-18炎症因子以及cTnI心肌损伤标志物、MDA、ROS氧化应激指标升高(P < 0.05),S组比CLP组的IL-1β、IL-18以及cTnI、MDA、ROS等指标低,差异有统计学意义(P < 0.05);而SP组比S组IL-1β、IL-18以及cTnI、MDA、ROS等指标升高,差异具有统计学意义(P < 0.05)。见表 2。
| 组别 | sham组(n=8) | C组(n=7) | S组(n=8) | SP组(n=8) | F值 | P值 |
| IL-1β(pg/mL) | 46.87±3.28 | 83.65±5.67a | 49.99±4.34b | 71.84±1.92ac | 19.68 | < 0.001 |
| IL-18(pg/mL) | 145.60±9.75 | 244.80±27.17 a | 145.30±12.60 b | 215.00±20.43 ac | 7.52 | < 0.001 |
| cTnI(pg/mL) | 234.90±59.88 | 3283.00±87.89 a | 350.50±62.47 b | 881.90±163.8 c | 177.20 | < 0.001 |
| MDA(nmol/mL) | 427.80±22.27 | 1420.00±57.88 a | 740.80±96.13 ab | 1059.00±107.0 abc | 27.64 | < 0.001 |
| ROS(U/mL) | 2207.00±437.00 | 5407.0±721.0 a | 3308.0±443.00 b | 5383.00±469.60c | 7.16 | < 0.001 |
| 注:sham组为假手术组,C组为CLP模型组,S组为CLP+Sirt1激动剂组,SP组为CLP+Sirt1激动剂组+PGC-1α抑制剂组;与sham组比较,aP < 0.05;与C组比较,bP < 0.05;与S组比较,cP < 0.05 | ||||||
|
| 注:sham组为假手术组,C组为CLP模型组,S组为CLP+Sirt1激动剂组,SP组为CLP+Sirt1激动剂组+PGC-1α抑制剂组;a为P < 0.01,b为P < 0.001,c为P < 0.05,ns为差异无统计学意义 图 4 各组心肌组织中免疫组织化学图(DAB染色,Sirt1、PGC-1α×400,Nrf2 ×200) Fig 4 Immunohistochemistry in myocardial tissues of each group (DAB staining, Sirt1、PGC-1α ×400, Nrf2 ×200) |
|
|
C组的Sirt1、PGC-1α、Nrf2蛋白表达量较sham组低(P < 0.05),S组的大鼠Sirt1、PGC-1α、Nrf2蛋白表达高于C组(P < 0.05),而SP组大鼠与S组大鼠Sirt1表达无明显改变,但PGC-1α和Nrf2的表达量较S组均低(P < 0.05)。
3 讨论宿主在脓毒症的初期激活免疫防御反应,造成免疫细胞的程序性死亡。细胞焦亡作为细胞程序性死亡的一种方式,参与抑制细胞内病原体的复制,激活免疫细胞对病原体的吞噬和杀灭,可以抑制先天性免疫反应的发生。一旦细胞焦亡失控,邻近细胞和组织的炎症反应就会被进一步激活放大,加重炎症损伤,导致全身炎症反应,最终导致多器官衰竭或脓毒性休克。过度的炎症反应可以通过多种机制引起细胞损伤,包括焦亡,这是细胞破坏的关键机制之一。近年来,越来越多的研究探讨了焦亡与脓毒症的关系,包括焦亡在脓毒症中的作用机制和相关靶点。SIC可明显增加患者病死率,它是脓毒症的常见并发症。
本研究采用盲肠结扎穿孔术建立大鼠SIC模型[16],将C组与sham组大鼠比较,心脏超声结果提示LVEF和LVFS明显下降,心脏运动功能减弱,同时血液中的炎症因子IL-1、IL-18和心肌组织中的MDA、ROS等氧化应激指标有明显升高,心肌组织有水肿、坏死,心肌纤维排列紊乱、甚至断裂,炎症细胞浸润,间质血管扩张充血。从心肌组织学、炎症因子水平、心功能等多个维度变化可以证明动物SIC模型构建成功。但给予以Sirt1激动剂后,心脏超声提示LVEDV、LVESV较C组有所下降,但变化差异无统计学意义(P > 0.05);虽SP组较S组大鼠的LVESV有所升高(P > 0.05),但LVEF、LVFS、LVEDV下降,且差异无统计学意义(P > 0.05),可能与实验样本偏少有关。
Sirt1是一种可以存在于细胞核和细胞质的去乙酰化酶,它可以通过影响PGC-1α等下游因子参与多种细胞活动,激活Sirt1,对于线粒体生物合成、能量代谢以及多种疾病发生发展均具有重要作用。近期有研究证明通过激活Sirt1/PGC-1α/TFAM可以减轻急性肺损伤中的炎症反应[17]。另有研究者利用白藜芦醇激活Sirt1,调控铁代谢和脂质过氧化,减少ROS产生和线粒体损伤,继而抑制铁死亡,进而改善了SIC的心功能障碍[18]。Nrf2是一种细胞抗氧化调节因子,提供抗氧化应激能力,其下游因子HO-1参与炎症反应,同时阻止NLRP3的激活,激活Nrf2可以减轻氧化应激引起的细胞焦亡[19]。也有学者发现通过EZH2/Nrf-2/NLRP3途径抑制心肌细胞焦亡从而可以减轻脓毒性心肌损伤[20]。He等[21]报道Sirt1/PGC-1α/Nrf2通路的激活可减轻大鼠心肌缺血模型的结论[22]。但激动Sirt1/PGC-α/Nrf2通路能否改善SIC的心肌功能障碍,以及其与细胞焦亡之间的联系尚不清楚。细胞焦亡是当机体遭到有害物质刺激时,细胞能识别不同应激源的NLR蛋白家族成员(NLRP1、NLRP3、NLCL4)或PYHIN家族蛋白家族成员,焦亡的主要炎症小体即为NLRP3,激活后的NLRP3与胱天蛋白酶募集域结构的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD, ASC)相互作用,使Caspase-1前体(pro-Caspase-1)被切割形成活化的Caspase-1,后者通过识别、剪切前体IL-18和前体IL-1β,形成成熟的IL-18、IL-1β[23]。同时活化的Caspase-1剪切活化Gasdermin蛋白D(GSDMD)的N端,GSDMD可在磷脂膜上聚集形成细胞膜孔,破坏细胞的渗透平衡,细胞肿胀和膜溶解,促使IL-18、IL-1β等炎症因子及其他细胞内容物通过细胞膜孔释放,启动过度免疫,以致细胞焦亡发生[8, 24-25],引起炎症性坏死。本研究在SIC大鼠模型中检测到焦亡相关蛋白较sham组明显升高,证实了SIC大鼠的心肌组织中有细胞焦亡发生,该结果与以往研究相一致[26];同时本研究发现SIC大鼠有Sirt1/PGC1α/Nrf2通路蛋白的表达量下降;在SIC大鼠激活Sirt1后,PGC-1α/Nrf2表达量增加,大鼠的心脏功能略有好转,炎症指标有明显下降,GSDMD、NLRP3、Caspase-1等焦亡相关蛋白表达量显著下降,表明Sirt1激动剂可以缓解SIC大鼠的细胞焦亡;而在SIC大鼠中激动Sirt1的同时,抑制其下游的PGC-1后发现PGC-1α及Nrf2表达量下降,心脏运动功能略有下降,炎症指标及焦亡相关蛋白明显升高,由此可见Sirt1激动剂可以通过PGC-1α/Nrf2通路缓解SIC大鼠的细胞焦亡。这与既往研究的激活Sirt1/PGC-1α/Nrf2通路可减轻脓毒症相关急性肾损伤中的细胞焦亡相一致[22]。
研究首次在动物体内实验中探索了白藜芦醇与Sirt1/PGC-1α/Nrf2通路、SIC的细胞焦亡之间的调节关系。然而不足之处在于新近研究发现“LVEF低、患者病死率反而较低”的现象,考虑这部分患者可能因为心功能极度恶化,更早进行心脏辅助支持治疗或者进入心脏移植等待名单,从而获得了及时的治疗,降低了短期病死率。因此在SIC这种复杂病理状态下,传统的LVEF和心脏指数作为预后指标的局限性更为突出。目前心肌应变是预测SIC患者更高死亡风险的有力指标,它能够更敏感地捕捉到心肌收缩功能的细微异常和不同步性对心肌力学产生的实际影响,这些变化可能早于LVEF的显著下降,更能反映心肌细胞的真实受损程度和长期预后。虽然本研究未能纳入心肌应变作为评估心肌功能的指标,但这恰恰凸显了未来研究将两者结合必要性。另本实验仅进行了药物阻滞,并未从基因层面及体外细胞实验进行验证,这些均有待后续实验继续探索研究。
综上所述,本研究证明,通过白藜芦醇激动Sirt1/PGC-α/NRF2通路减轻SIC的焦亡发生,缓解心功能障碍,在SIC的发挥保护作用。本研究为临床SIC的治疗新靶点提供了新思路。
利益冲突 所有作者声明无利益冲突
作者贡献声明 任彤:实验设计、实验操作、数据分析、论文撰写;伊尔扎提·艾则孜:实验操作,数据分析;王毅:实验设计、修改文章;覃芹丹:数据分析;于湘友:实验设计、论文修改、支持性贡献
| [1] | Rehn M, Chew MS, Olkkola KT, et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock in adults 2021 - endorsement by the Scandinavian society of anaesthesiology and intensive care medicine[J]. Acta Anaesthesiol Scand, 2022, 66(5): 634-635. DOI:10.1111/aas.14045 |
| [2] | L'Heureux M, Sternberg M, Brath L, et al. Sepsis-induced cardiomyopathy: a comprehensive review[J]. Curr Cardiol Rep, 2020, 22(5): 35. DOI:10.1007/s11886-020-01277-2 |
| [3] | Ehrman RR, Sullivan AN, Favot MJ, et al. Pathophysiology, echocardiographic evaluation, biomarker findings, and prognostic implications of septic cardiomyopathy: a review of the literature[J]. Crit Care, 2018, 22(1): 112. DOI:10.1186/s13054-018-2043-8 |
| [4] | Flynn A, Chokkalingam Mani B, Mather PJ. Sepsis-induced cardiomyopathy: a review of pathophysiologic mechanisms[J]. Heart Fail Rev, 2010, 15(6): 605-611. DOI:10.1007/s10741-010-9176-4 |
| [5] | Li N, Zhou H, Wu HM, et al. STING-IRF3 contributes to lipopolysaccharide-induced cardiac dysfunction, inflammation, apoptosis and pyroptosis by activating NLRP3[J]. Redox Biol, 2019, 24: 101215. DOI:10.1016/j.redox.2019.101215 |
| [6] | 陈政. miR-149通过STAT3减轻脓毒性心肌病损伤的机制研究[D]. 广州: 广州中医药大学, 2023. |
| [7] | Miao EA, Rajan JV, Aderem A. Caspase-1-induced pyroptotic cell death[J]. Immunol Rev, 2011, 243(1): 206-214. DOI:10.1111/j.1600-065X.2011.01044.x |
| [8] | Shi JJ, Gao WQ, Shao F. Pyroptosis: gasdermin-mediated programmed necrotic cell death[J]. Trends Biochem Sci, 2017, 42(4): 245-254. DOI:10.1016/j.tibs.2016.10.004 |
| [9] | Jorgensen I, Miao EA. Pyroptotic cell death defends against intracellular pathogens[J]. Immunol Rev, 2015, 265(1): 130-142. DOI:10.1111/imr.12287 |
| [10] | Bravo García-Morato M, Calvo Apalategi A, Bravo-Gallego LY, et al. Impaired control of multiple viral infections in a family with complete IRF9 deficiency[J]. J Allergy Clin Immunol, 2019, 144(1): 309-312. DOI:10.1016/j.jaci.2019.02.019 |
| [11] | Landry J, Slama JT, Sternglanz R. Role of NAD(+) in the deacetylase activity of the SIR2-like proteins[J]. Biochem Biophys Res Commun, 2000, 278(3): 685-690. DOI:10.1006/bbrc.2000.3854 |
| [12] | Chung SD, Lai TY, Chien CT, et al. Activating Nrf-2 signaling depresses unilateral ureteral obstruction-evoked mitochondrial stress-related autophagy, apoptosis and pyroptosis in kidney[J]. PLoS One, 2012, 7(10): e47299. DOI:10.1371/journal.pone.0047299 |
| [13] | Ren TT, Huang C, Cheng ML. Dietary blueberry and bifidobacteria attenuate nonalcoholic fatty liver disease in rats by affecting SIRT1-mediated signaling pathway[J]. Oxid Med Cell Longev, 2014, 2014: 469059. DOI:10.1155/2014/469059 |
| [14] | 李鑫. PGC-1α改善线粒体功能防治中枢神经系统氧中毒的作用机制研究[D]. 上海: 中国人民解放军海军军医大学, 2024. |
| [15] | 曾佑成. 基于铁死亡探讨白藜芦醇对脓毒症大鼠心肌损伤的作用机制的研究[D]. 石河子: 石河子大学, 2023. DOI: 10.27332/d.cnki.gshzu.2023.000370. |
| [16] | Lu ZQ, Wu D, Wang Z, et al. Diminazene aceturate mitigates cardiomyopathy by interfering with renin-angiotensin system in a septic rat model[J]. BMC Pharmacol Toxicol, 2022, 23(1): 44. DOI:10.1186/s40360-022-00584-4 |
| [17] | Abdel-Wahab BA, Zafaar D, Habeeb MS, et al. Nicorandil mitigates arsenic trioxide-induced lung injury via modulating vital signalling pathways SIRT1/PGC-1α/TFAM, JAK1/STAT3, and miRNA-132 expression[J]. Br J Pharmacol, 2024, 181(17): 3215-3231. DOI:10.1111/bph.16414 |
| [18] | Zeng Y, Cao G, Lin L, et al. Resveratrol attenuates sepsis-induced cardiomyopathy in rats through anti-ferroptosis via the Sirt1/Nrf2 pathway[J]. J Invest Surg, 2023, 36(1): 2157521. DOI:10.1080/08941939.2022.2157521 |
| [19] | Liu XT, Zhang X, Ding Y, et al. Nuclear factor E2-related factor-2 negatively regulates NLRP3 inflammasome activity by inhibiting reactive oxygen species-induced NLRP3 priming[J]. Antioxid Redox Signal, 2017, 26(1): 28-43. DOI:10.1089/ars.2015.6615 |
| [20] | Bai X, Yang LT, Liu RX, et al. Long noncoding RNA SOX2OT ameliorates sepsis-induced myocardial injury by inhibiting cellular pyroptosis through mediating the EZH2/nrf-2/NLRP3 signaling pathway[J]. J Inflamm Res, 2024, 17: 3115-3127. DOI:10.2147/JIR.S451643 |
| [21] | He HB, Li XM, Li DJ, et al. Saponins from Rhizoma Panacis Majoris attenuate myocardial ischemia/reperfusion injury via the activation of the Sirt1/Foxo1/Pgc-1α and Nrf2/antioxidant defense pathways in rats[J]. Phcog Mag, 2018, 14(56): 297. DOI:10.4103/pm.pm_467_17 |
| [22] | Ling H, Li Q, Duan ZP, et al. LncRNA GAS5 inhibits miR-579-3p to activate SIRT1/PGC-1α/Nrf2 signaling pathway to reduce cell pyroptosis in sepsis-associated renal injury[J]. Am J Physiol Cell Physiol, 2021, 321(1): C117-C133. DOI:10.1152/ajpcell.00394.2020 |
| [23] | Zheng XT, Chen WW, Gong FC, et al. The role and mechanism of pyroptosis and potential therapeutic targets in sepsis: a review[J]. Front Immunol, 2021, 12: 711939. DOI:10.3389/fimmu.2021.711939 |
| [24] | Shi JJ, Zhao Y, Wang K, et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature, 2015, 526(7575): 660-665. DOI:10.1038/nature15514 |
| [25] | Liu X, Zhang ZB, Ruan JB, et al. Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores[J]. Nature, 2016, 535(7610): 153-158. DOI:10.1038/nature18629 |
| [26] | Zhu HY, Wu JH, Li CZ, et al. Transcriptome analysis reveals the mechanism of pyroptosis-related genes in septic cardiomyopathy[J]. PeerJ, 2023, 11: e16214. DOI:10.7717/peerj.16214 |
 2025, Vol. 34
2025, Vol. 34