2. 南京医科大学附属南京医院(南京市第一医院)心胸血管外科, 南京 210006;
3. 南京医科大学附属南京医院(南京市第一医院)医学影像科, 南京 210006;
4. 南京医科大学附属南京医院(南京市第一医院)病理科, 南京 210006
经皮椎体成形术(percutaneous vertebroplasty, PVP)是通过经椎弓根入路将生物材料(通常是聚甲基丙烯酸甲酯,也称为骨水泥)经皮注射到塌陷的椎骨中,可用于治疗骨质疏松性椎体压缩骨折[1]。骨水泥渗漏(cement leakage, CL)是PVP的常见并发症之一,表现为手术时或术后骨水泥外渗至非目标区域的现象。根据此前报道,PVP导致CL的发生率为56.0%~87.5%,心内栓塞的发生率为3.9%[1-2]。大部分发生CL的患者无临床症状,因此其发生率可能被严重低估。本文将结合相关研究分析1例PVP术后骨水泥渗漏继发右心腔栓塞的案例。
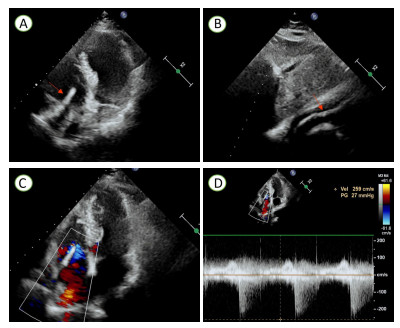
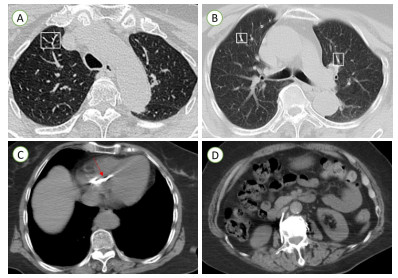
1 病例资料患者,女,71岁,因“检查发现右室异物2 d”入院。患者1个月余前因骨质疏松伴腰2椎体病理性骨折,行经皮椎体成形术。近日拟再次行骨科手术,术前检查发现右心腔内强回声。为进一步手术治疗入院。查体:心率118次/min,血压141/100 mmHg(1 mmHg=0.133 kPa),心前区无隆起,心界向两侧扩大,心律齐,瓣膜听诊区未闻及明显杂音,余正常。辅助检查:心电图检查示:正常心电图。经胸超声心动图检查示:右房室腔内可见一长条状高回声,可见段长约75 mm×5 mm(图 1A~B),不活动,三尖瓣形态、回声及开放活动未见明显异常,右房侧可见少许反流束(图 1C),测三尖瓣口收缩期最大反流速度为2.59 m/s,估测无肺动脉高压(图 1D)。超声诊断:右心腔异常回声,结合临床考虑骨水泥;三尖瓣轻度反流。CT平扫检查示:两肺见条片状致密影,沿血管分支分布(图 2A~B)。心脏形态及大小未见明显异常,右心见条状致密影(图 2C);主动脉钙化;椎体术后改变(图 2D),提示:主动脉钙化。两肺致密影,疑似骨水泥肺栓塞,椎体术后。结合病史,初步诊断:心脏异物、心功能Ⅱ级、腰椎椎体成形术后、骨质疏松。
|
| 注:A为二维心脏超声(心尖四腔心切面)显示右房室腔内高回声(红色箭头处);B为二维心脏超声(剑突下切面)显示右房室腔内长条状高回声(红色箭头处);C为彩色多普勒超声显示三尖瓣反流信号;D为频谱多普勒显示三尖瓣口收缩期最大反流速度为2.59 m/s 图 1 患者术前经胸超声心动图图像 |
|
|
|
| 注:A和B为两肺条片状致密影,沿血管分支分布(方框所示);C为右心条状致密影(红色箭头处);D为椎体术后改变 图 2 患者胸腹部CT平扫图像 |
|
|
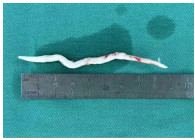
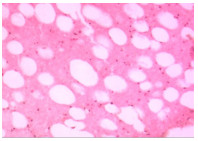
检查无手术禁忌证后,患者于急诊行右心腔异物清除术,全麻成功后,经食管超声心动图检查示:右心腔内见长条形强回声,跨三尖瓣,自右房延伸至右室心尖部。切开右房,见一白色异物,质地硬,右房侧头端稍锐利,未划破右房壁,另一端与右室粘连,难以拔除。行心脏停跳,停跳后探查发现,异物另一端与三尖瓣瓣下乳头肌粘连,剥离后完整取出,为白色7.5~8.0 cm长棍状物体,直径约4 mm(图 3)。反复探查右心腔无异物残留,肺动脉无异物,心脏表面无破口,行心脏复跳。病理检查示:血栓内见脂肪、胶原化的纤维组织及灰褐色无定形物质(图 4)。术后诊断:心脏异物(考虑骨水泥)。术后患者恢复良好,术后2周患者病情稳定,予以出院。
|
| 图 3 患者术后标本 |
|
|
|
| 图 4 患者病理图像(HE染色) |
|
|
PVP是临床中治疗胸腰椎压缩性骨折常用的手术方法,将骨水泥注射到塌陷的椎骨中,帮助患者缓解疼痛、稳定椎体并恢复活动能力。PVP容易发生CL,骨水泥可以向椎间盘、硬膜外或椎间孔、脊柱旁和椎旁静脉渗漏,给患者带来潜在风险[3]。虽然存在各种CL分类方案,但尚未制定通用标准,通常采用基于位置的解剖学分类,分为B型(经椎基底静脉)、S型(经椎间静脉)和C型(经椎骨皮质缺损),椎间盘渗漏被指定为C型的特定亚型[4]。与无椎间盘渗漏相比,存在渗漏的患者术后相邻椎体骨折的发生率高5.9倍[5],且直接与邻近椎骨终板接触是其独立危险因素[6]。当骨水泥渗漏到椎管或椎间孔,可导致脊髓或神经根受压[7-8];渗漏到椎旁静脉,沿血管迁移肺动脉,可导致血管栓塞、肺栓塞等[9];若在心腔内聚合,可形成心脏异物,导致心脏穿孔[10-11]。尽管以上并发症可无临床症状,但严重时可导致截瘫,甚至死亡[7, 12]。
PVP术后骨水泥渗漏的原因主要为:骨水泥聚合不足、穿刺针越靠近椎体皮质骨折部位及椎体内骨水泥过度填充[12]。此外,患者年龄、骨折严重程度、手术方法等因素也与椎旁骨水泥渗漏密切相关[13]。根据骨水泥的聚合状态,导致心内栓塞有两种机制。首先,在游离的骨水泥栓子聚合后,栓子进入腹膜后,然后到达心脏。其次,注射时聚合不足的骨水泥直接进入腹膜后静脉系统,到达心脏后完成聚合[14]。心内栓塞最常见的症状是胸痛和呼吸困难,可能在手术后数天、数月甚至数年出现。大多数骨水泥位于右心房和右心室,同时累及三尖瓣导致三尖瓣反流。在本案例中,患者影像上显示L2椎体旁静脉骨水泥渗漏,随体循环回心形成异物,入肺循环引起肺小动脉多发栓塞。骨水泥一端与三尖瓣瓣下乳头肌粘连,可推断骨水泥是在到达心脏后完成聚合。因而,聚合的骨水泥在心脏中活动度较小,未随心脏跳动引发心脏穿孔。在发生CL后无明显不适症状,由于需再次骨科手术行超声心动图检查才发现其的存在。
预防CL的发生是确保PVP手术安全和成功的关键。Li等[15]的研究结果发现,高黏度骨水泥的PVP发生骨水泥渗漏率更低,与低黏度骨水泥相比,高黏度骨水泥的填充均匀性增加,并可以以更快的速度达到最大黏度,在更长的时间内保持这种较高的黏度。注射相似体积的骨水泥,接受高黏度骨水泥PVP的患者发生较少的CL。当发生CL后,参考现有文献,没有治疗指南。治疗方法取决于患者临床表现、栓子定位以及PVP和临床表现之间的时间间隔[14]。本例后经超声心动图、CT、术中探查和病理检查,结合病史诊断为骨水泥渗漏。该患者心腔内骨水泥聚合后形成坚硬的线状物体,有刺穿房室壁造成心脏穿孔的风险,应及时将其取出。因此,对于行PVP手术患者,应术前充分评估椎体损伤情况,术中严密监测并适量骨水泥注射,术后及时复查确认骨水泥位置。对于已渗出的骨水泥,应定期随访,并完善CT和超声心动图等影像学检查,尽早发现并处理渗漏,避免心脏或其他器官的骨水泥形成导致临床不良事件发生。
利益冲突 所有作者声明无利益冲突
| [1] | Wu Y, Zhou ZL, Lu GL, et al. Risk factors for cement leakage after percutaneous vertebral augmentation for osteoporotic vertebral compression fractures: a meta-analysis[J]. Int J Surg, 2025, 111(1): 1231-1243. DOI:10.1097/JS9.0000000000001895 |
| [2] | Fadili Hassani S, Cormier E, Shotar E, et al. Intracardiac cement embolism during percutaneous vertebroplasty: incidence, risk factors and clinical management[J]. Eur Radiol, 2019, 29(2): 663-673. DOI:10.1007/s00330-018-5647-0 |
| [3] | Pitton MB, Herber S, Koch U, et al. CT-guided vertebroplasty: analysis of technical results, extraosseous cement leakages, and complications in 500 procedures[J]. Eur Radiol, 2008, 18(11): 2568-2578. DOI:10.1007/s00330-008-1020-z |
| [4] | Alvarez L, Pérez-Higueras A, Granizo JJ, et al. Predictors of outcomes of percutaneous vertebroplasty for osteoporotic vertebral fractures[J]. Spine (Phila Pa 1976), 2005, 30(1): 87-92. DOI:10.1097/00007632-200501010-00016 |
| [5] | Jesse MK. Effect of the location of endplate cement extravasation on adjacent level fracture in osteoporotic patients undergoing vertebroplasty and kyphoplasty[J]. Pain Phys, 2015, 5(5;9): E805-E814. DOI:10.36076/ppj.2015/18/e805 |
| [6] | Xie SM, Cui LQ, Wang CL, et al. Contact between leaked cement and adjacent vertebral endplate induces a greater risk of adjacent vertebral fracture with vertebral bone cement augmentation biomechanically[J]. Spine J, 2025, 25(2): 324-336. DOI:10.1016/j.spinee.2024.09.021 |
| [7] | Baek IH, Park HY, Kim KW, et al. Paraplegia due to intradural cement leakage after vertebroplasty: a case report and literature review[J]. BMC Musculoskelet Disord, 2021, 22(1): 741. DOI:10.1186/s12891-021-04625-7 |
| [8] | Ma QH, Liu GP, Sun Q, et al. Delayed complications of intradural cement leakage after percutaneous vertebroplasty: a case report[J]. World J Clin Cases, 2022, 10(25): 8998-9003. DOI:10.12998/wjcc.v10.i25.8998 |
| [9] | Chai CS, Kho SS, Chan SK, et al. Images of the month: pulmonary cement embolism[J]. Clin Med (Lond), 2021, 21(1): e114-e115. DOI:10.7861/clinmed.2020-0913 |
| [10] | Trongtorsak A, Saad E, Mustafa A, et al. Incidental detection of an intracardiac cement embolism complicating percutaneous vertebroplasty during cardiac catheterization: a case report[J]. J Cardiol Cases, 2022, 26(2): 151-153. DOI:10.1016/j.jccase.2022.04.003 |
| [11] | Schoechlin S, Schröfel H, Czerny M, et al. Massive cardiopulmonary cement embolism with cardiac perforation after vertebroplasty: a case series[J]. Eur Heart J Case Rep, 2022, 6(9): ytac385. DOI:10.1093/ehjcr/ytac385 |
| [12] | Deng K, Yu JL, Feng YJ, et al. Case report: Inspiration from a rare fatal heart perforation after percutaneous vertebroplasty[J]. Front Surg, 2023, 10: 1227056. DOI:10.3389/fsurg.2023.1227056 |
| [13] | Zhu SY, Zhong ZM, Wu Q, et al. Risk factors for bone cement leakage in percutaneous vertebroplasty: a retrospective study of four hundred and eighty five patients[J]. Int Orthop, 2016, 40(6): 1205-1210. DOI:10.1007/s00264-015-3102-2 |
| [14] | Sun HB, Jing XS, Shan JL, et al. Risk factors for pulmonary cement embolism associated with percutaneous vertebral augmentation: a systematic review and meta-analysis[J]. Int J Surg, 2022, 101: 106632. DOI:10.1016/j.ijsu.2022.106632 |
| [15] | Li KP, Ji CB, Luo DW, et al. Role of percutaneous vertebroplasty with high-viscosity cement in the treatment of severe osteoporotic vertebral compression fractures[J]. Sci Rep, 2021, 11(1): 4602. DOI:10.1038/s41598-021-84314-6 |
 2025, Vol. 34
2025, Vol. 34




