心脏骤停(cardiac arrest, CA)后发生的复苏后综合征(post-cardiac arrest syndrome, PCAS)以心脏功能障碍、神经系统损伤以及全身缺血-再灌注反应为特征[1],但其并发急性胰腺炎(acute pancreatitis, AP)的病例极为罕见且易被漏诊。本文报告了一例肺栓塞(pulmonary embolism, PE)诱发CA后并发AP的病例,旨在通过分析该病例的临床特征、诊断过程及治疗转归,探讨其可能的病理生理机制以及临床管理策略。
1 资料与方法患者女性,65岁,因“突发呼吸CA心肺复苏术后8 h”于2024年3月9日转入本院。患者如厕时突发意识丧失并倒地,呼喊不能应答,呼吸停止,家属立即行胸外按压,并呼救急救电话,当地县医院医师出诊后评估患者CA,行心肺复苏(cardiopulmonary resuscitation, CPR),肾上腺素静推及气管插管呼吸机辅助呼吸抢救,CPR期间疑诊PE,家属拒绝肺动脉溶栓治疗,给予低分子肝素钙针皮下注射;CPR约12 min,患者自主循环恢复(return of spontaneous circulation, ROSC),家属为求进一步治疗转入本院。既往史:患者1个月前左髋关节置换手术,出院前及术前检查均已排除下肢深静脉血栓形成,术后患者居家未服用抗凝药物。否认高血压病、糖尿病、冠心病、胰腺炎、胆结石等病史。入院查体:体温36.8℃,脉搏107次/min,呼吸频率20次/min,血压: 87/62 mmHg(1 mmHg=0.133 kPa)[有创呼吸机辅助呼吸,P-A/C模式,PS 18 cmH2O(1 cmH2O=0.098 kPa),PEEP 5 cmH2O,呼吸频率20次/min,FiO2 0.5]。神志中昏迷,双侧瞳孔等大等圆,直径约2.5 mm,对光反射存在;颈软,双肺呼吸音粗,心律齐,各瓣膜听诊区未闻明显杂音;腹软,肠鸣音弱,腹部触诊及肌力检查不合作,肌张力正常,病理反射未引出。
入院查下肢静脉彩超:双下肢深静脉血栓;心脏彩超:右房扩大(横径41 mm),右室扩大(前后径30 mm),三尖瓣中量反流;脑CT:脑萎缩;肺动脉CTA:左、右肺动脉及分支内多发栓塞;胸部肋骨CT:左侧第2~8肋骨、右侧第1~7肋骨骨折、双肺下叶炎症;腹部CT:胰体部下方片絮状渗出影(见图 1)。D二聚体5.26 mg/L;动脉血气分析pH 7.405,二氧化碳分压35.5 mmHg,氧分压46.2 mmHg,血乳酸2.4 mmol/L,血氧饱和度79.9%,剩余碱-2.56 mmol/L,实际碳酸氢根21.7 mmol/L;血脂、血清淀粉酶及脂肪酶正常;肝肾功能正常。
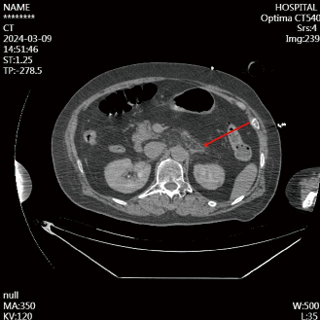
|
| 图 1 2024-03-09患者胰腺形态、大小及密度未见明显异常,胰体部下方见少许片絮状渗出影 |
|
|
入院诊断:PE、心脏停搏复苏成功、PCAS、下肢静脉血栓形成、双侧多发肋骨骨折。治疗上持续心电监护、呼吸机辅助呼吸、入院24 h目标温度管理(targeted temperature management, TTM)、镇痛镇静、补液及多巴酚丁胺强心升压、维持脑灌注压及改善脑代谢、抑酸护胃、灌肠导泻通便、胸围外固定、抗感染及气道管理、静脉营养支持及低分子肝素抗凝治疗,为防止下肢静脉血栓脱落再次导致PE,经家属同意后紧急植入下腔静脉滤器。
入院第4天,患者神志尚未转清,有自主睁眼,但对呼喊无反应,对疼痛刺激有局部屈曲反应,查体腹软,左上腹触诊患者有明显疼痛刺激反应,复查腹部CT(见图 2),提示胰腺体下方渗液明显增加,改良的CT严重指数评分(modified CT severity index, MCTSI)4分。动态复查血清淀粉酶及脂肪酶,尽管胰酶指标仍在正常范围,修正临床诊断:AP。调整治疗,在之前胃肠道功能支持治疗基础上,加用生长抑素抑制胰液分泌。治疗3 d后复查腹部增强CT(见图 3),胰腺无坏死,胰周渗液明显吸收,MCTSI 2分,逐步减停生长抑素。
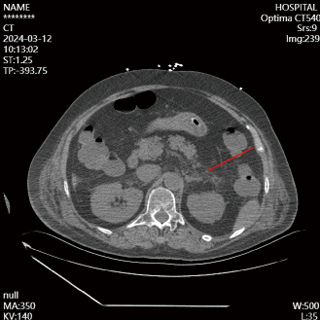
|
| 图 2 2024-03-12患者胰腺下方见少许片絮状渗出影,范围较前(2024-03-09)增大 |
|
|
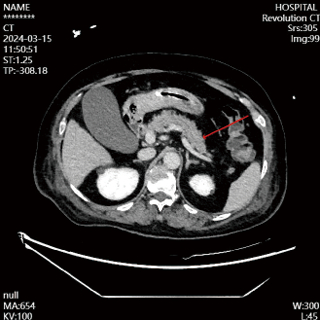
|
| 图 3 2024-03-15患者胰腺形态及强化未见明显异常 |
|
|
入院第6天患者神志恢复正常,腹部无压痛反跳痛,自主呼吸试验通过,拔除气管导管;抗凝治疗上调整为利伐沙班口服;入院第14天神经功能正常,痊愈出院。
2 讨论AP指因胰酶异常激活对胰腺自身及周围器官产生消化作用而引起的、以胰腺局部炎性反应为主要特征,甚至可导致器官功能障碍的急腹症,胆石病、高甘油三酯血症及过度饮酒是急性胰腺炎的最常见病因,其次为病毒性感染、代谢因素、妊娠、创伤及医源性因素等[2],而CA继发AP临床较罕见。AP的诊断标准包括以下3项[3]:①上腹部持续性疼痛;②血清淀粉酶和(或)脂肪酶浓度至少高于正常上限值3倍;③腹部影像学检查(增强CT、MRI或腹部超声)结果显示符合AP影像学改变,上述3项标准中符合2项即可诊断为AP。如果具有典型的临床症状和实验室检查结果,通常不需要额外的影像学检查来确认AP的诊断[3]。
首先,本例患者发病前无腹痛腹胀、恶心呕吐等消化道症状,无高脂血症、饮酒等常见病因,无基础胆道结石病史,缺乏AP典型的症状及病因;其次,本例CA患者入院TTM及镇静治疗,由于沟通条件受限,通过腹部触诊判断患者的疼痛反应存在客观性难度;另外,血清淀粉酶及脂肪酶指标正常,缺乏AP的胰酶诊断条件,腹部CT胰腺形态、大小及密度正常,尽管提示胰腺下方有少量渗液(图 1),但临床未予以足够重视,早期漏诊AP。
本例患者病程中多次监测血清淀粉酶和脂肪酶指标均处于正常范围,这与AP典型的胰酶变化趋势不一致:根据现有文献,血清淀粉酶水平通常在6~12 h内升高,24~48 h达到峰值,在随后的3~7 d内降至正常或接近正常水平;脂肪酶在4~8 h内上升,24 h达到峰值,在之后的8~14 d内下降到正常或接近正常水平[4]。Park等[5]纳入355例发生院外CA接受TTM的患者,在ROSC后24 h内,约46.8%的患者出现了胰酶水平升高;在ROSC后的12 h内,淀粉酶的水平最高(775.2±691.9) U/L,而在24 h后,脂肪酶的水平最高(135.3±292.7) U/L。胰酶水平升高与较长的ROSC时间、较低的初始电击心律(室速/室颤)和冠状动脉疾病病史有相关性[5]。但PCAS作为CA患者一种特殊的病理生理状态,胃肠道功能障碍及肾功能不全均对淀粉酶代谢产生影响,其研究中并未涉及。
CA后早期,难以准确评估腹痛情况,这可能是早期漏诊AP的原因之一。在Park等[5]人的研究中,尽管166例患者的胰酶水平升高,但仅有6例患者进行了腹部CT检查,其中3例患者被确诊为AP,这表明CA后加强腹部影像学检查的重要性尚未得到充分重视。Piton等[6]报道指出,CA后患者出现腹部积液增加并伴有腹胀,应警惕AP的可能性,常规将ROSC后的早期腹胀视为PCAS之一,可能忽视与AP相关的症状。
CA继发AP的机制是一个复杂的过程,然而目前的研究仍然相对匮乏,需要进一步的临床和基础研究来揭示其中的具体机制,尽管如此,根据现有资料可以初步推测以下几种可能的机制:(1)缺血缺氧性损伤:胰腺低灌注是AP的一个重要病因[7],CA后循环衰竭就会引发胰腺缺血缺氧性损伤,诱发缺血性AP[6-7];(2)炎症介质的损伤:缺血-再灌注损伤常触发炎症反应,导致炎症介质释放增多,包括白细胞介素(IL)-6、IL-8、IL-10和肿瘤坏死因子(TNF)-α等,这些炎症介质不仅可能进一步引发全身性炎症反应综合征,也可能直接作用于胰腺组织,刺激胰腺细胞,导致进一步的胰腺损伤和炎症[8];(3)医源性损伤:CPR的持续时间是引发医源性创伤的常见风险因素。Deras等[9]报道一例长时间自动机械CPR致胰腺损伤,进而出现胰管瘘、化学性腹膜炎和最终导致死亡的出血性胰腺炎。Aziz[10]报道CPR过程中施加在剑突上的错误的胸部按压也可导致AP,最终死于并发症脓毒性休克。
CA患者并发AP的确切发生时间目前尚不明确。然而,在本例中,患者在CPR后8 h影像学检查即显示出早期渗出性改变,而在病后1周,胰周渗液则明显吸收好转。相比之下,Donat等[11]报道的一例病案中,患者在CPR后11 d出现了坏死性胰腺炎,并且在患者因感染性坏死导致临床恶化之前,AP的存在尚未被及时识别出。这提示了AP作为CA患者的罕见但严重并发症的重要性,提醒临床医生在处理CA患者时要警惕AP发生的可能,无论是早期还是病程后期。
综上所述,该病例的报道具有重要的临床意义。首先,它提醒临床医生在处理CA患者时应警惕AP的发生,特别是在缺乏典型症状和常见病因的情况下。其次,通过加强影像学检查,有助于早期识别并及时治疗AP,从而改善患者预后。最后,本文为扩展CA后并发症的研究范围以及优化患者预后和治疗策略提供了重要的启发,期待进一步的临床研究以更好地探讨CA后AP发病机制、胰酶诊断价值及随时间变化的CT影像学特征,以优化临床管理策略。
利益冲突 所有作者声明无利益冲突
| [1] | 孙琳, 万本杰, 宋娟娟, 等. 心脏骤停患者心肺复苏后的综合管理中若干问题的思考[J]. 中华急诊医学杂志, 2024, 33(7): 883-890. DOI:10.3760/cma.j.issn.1671-0282.2024.07.004 |
| [2] | 李非, 曹锋. 中国急性胰腺炎诊治指南(2021)[J]. 中国实用外科杂志, 2021, 41(7): 739-746. DOI:10.19538/j.cjps.issn1005-2208.2021.07.03 |
| [3] | Boxhoorn L, Voermans RP, Bouwense SA, et al. Acute pancreatitis[J]. Lancet, 2020, 396(10252): 726-734. DOI:10.1016/S0140-6736(20)31310-6 |
| [4] | 中华医学会急诊分会, 京津冀急诊急救联盟, 北京医学会急诊分会, 等. 急性胰腺炎急诊诊断及治疗专家共识[J]. 中华急诊医学杂志, 2021, 30(2): 161-172. DOI:10.3760/cma.j.issn.1671-0282.2021.02.005 |
| [5] | Park SY, Kim MJ, Park I, et al. Predisposing factors and neurologic outcomes of patients with elevated serum amylase and/or lipase after out-of-hospital cardiac arrest: a retrospective cohort study[J]. J Clin Med, 2022, 11(5): 1426. DOI:10.3390/jcm11051426 |
| [6] | Piton G, Barbot O, Manzon C, et al. Acute ischemic pancreatitis following cardiac arrest: a case report[J]. JOP, 2010, 11(5): 456-459. |
| [7] | Baldursdottir MB, Andresson JA, Jonsdottir S, et al. Ischemic pancreatitis is an important cause of acute pancreatitis in the intensive care unit[J]. J Clin Gastroenterol, 2023, 57(1): 97-102. DOI:10.1097/MCG.0000000000001651 |
| [8] | Jou C, Shah R, Figueroa A, et al. The role of inflammatory cytokines in cardiac arrest[J]. J Intensive Care Med, 2020, 35(3): 219-224. DOI:10.1177/0885066618817518 |
| [9] | Deras P, Manzanera J, Millet I, et al. Fatal pancreatic injury due to trauma after successful cardiopulmonary resuscitation with automatic mechanical chest compression[J]. Anesthesiology, 2014, 120(4): 1038-1041. DOI:10.1097/ALN.0000000000000147 |
| [10] | Aziz M. Traumatic pancreatitis: a rare complication of cardiopulmonary resuscitation[J]. Cureus, 2017, 9(8): e1574. DOI:10.7759/cureus.1574 |
| [11] | Donat C, Farah M, Jobbins K. Necrotizing pancreatitis after cardiac arrest with cardiopulmonary resuscitation[J]. ACG Case Rep J, 2023, 10(12): e01223. DOI:10.14309/crj.0000000000001223 |
 2025, Vol. 34
2025, Vol. 34




