心脏骤停后脑损伤(post-cardiac arrest brain injury, PCABI)是心脏骤停(cardiac arrest, CA)患者在接受心肺复苏(cardiopulmonary resuscitation, CPR)并恢复自主循环(return of spontaneous circulation, ROSC)后死亡的主要原因,同时也是急性期存活患者发生长期功能残疾的首要因素[1-3]。尽管随着CPR技术和理念的不断进步,ROSC率有所提高,但仍有45%~70%的患者继发PCABI[4]。更有研究报道,高达70%的ROSC患者在住院期间因PCABI而死亡[5]。目前,对ROSC患者的神经功能评估通常选择在复苏成功后至少72 h或完成目标温度管理(targeted temperature management, TTM)复温后进行[2,6],此时,神经功能预后的评估不仅影响后续医疗决策,也直接关系到患者家属是否继续治疗的信心。据报道,由于神经功能预后不良而导致的过早撤除生命支持治疗(withdrawal of life-sustaining therapy, WLST)是PCABI患者死亡的主要原因[6]。然而,其中高达20%的神经功能预后不良的判断可能是错误的[7],这进一步凸显了精准预测神经功能预后的重要性[8,9]。目前,多项研究已开发不同模型用于预测CA后神经功能预后[10-12],但结论不一,且预测效能及临床使用便捷性仍存在局限。为此,本研究团队基于PCABI患者的早期临床相关指标,构建交互式网络动态列线图,以期开发一种早期获取、预测准确、临床适用性强且便于交互使用的模型,从而更好地指导临床决策并改善患者预后。
1 资料与方法 1.1 研究对象回顾性收集2020年1月至2024年4月天津医科大学总医院收治的CA后ROSC住院患者。纳入标准:(1)CA经CPR发生ROSC后住院且存活出院患者;(2)年龄≥18岁。排除标准:(1)CA前意识状态严重受损或既往明确颅脑疾患史;(2)临床资料不完整。
本研究方案通过天津医科大学总医院伦理审查委员会审查(IRB2021-YX-240-01)。本研究为病历资料的回顾性分析且未涉及隐私知情同意等事项,免于患者知情同意。
1.2 资料收集收集入选患者一般人口学资料(性别、年龄)、既往病史(冠心病、高血压、糖尿病等)、烟酒史、CA家族史、身体质量指数、CPR相关资料[初始可除颤心律(是/否)、电除颤(是/否)、复苏时间(min)、肾上腺素剂量(mg)]、入院24 h内相关资料{重症评分[序贯器官衰竭评分及急性生理学与慢性健康状况(acute physiology and chronic health evaluation, APACHE)-Ⅱ评分最差值]、机械通气(是/否)、生命体征、一般实验室检查}及出院时格拉斯哥-匹兹堡脑功能表现分级(cerebral performance category, CPC)评分。CPC评分分级方法参照《心肺复苏后昏迷患者早期神经功能预后评估专家共识》[4]:1级,脑功能完好,患者清醒警觉,有正常生活和工作能力;2级,中度脑功能残疾,患者清醒,可在特定环境中部分时间工作或独立完成日常活动;3级,严重脑功能残疾,患者清醒,但需依赖他人日常帮助,保留有限的认知力;4级,昏迷及植物状态,患者无知觉,对环境无意识、无认知力;5级,死亡,患者确认脑死亡或传统标准认定的死亡。CPC评分1~2级纳入预后良好组,CPC评分3~5级纳入预后不良组。
1.3 统计学方法应用SPSS软件(version 25.00)、R软件(version 4.4.0)、Medcalc软件(version 20.022)进行统计分析,通过GraphPad Prism软件[version 10.1.2(324)]绘制ROC曲线。应用Shapiro-wilk方法检验数据正态性。符合正态分布的计量资料用均数±标准差(x±s)表示,采用Levene方差等同性检验分析方差齐性,组间比较采用两独立样本t检验,若方差齐采用t值,若方差不齐采用t’值; 非正态分布的计量资料以)[M(Q1, Q3)]表示,组间比较采用Mann-Whitney U检验。计数资料以例数(%)表示,组间比较采用Pearson χ2检验。本研究将入选患者按7∶3随机分为训练集和内部验证集,通过单因素Logistic回归分析方法筛选P<0.05的变量纳入多因素Logistic回归模型得出独立影响因素,绘制各独立影响因素的受试者工作特征曲线(receiver operating characteristic, ROC),计算ROC曲线下面积(area under the curve, AUC)及敏感度、特异度、最佳截断值等评价指标。基于各独立影响因素构建列线图预测模型,通过1 000次Bootstrap法构建校正曲线评估实际概率与预测概率的一致性,构建决策曲线分析(decision curve analysis, DCA)评估不同阈值概率下的临床净获益,应用DeLong非参数检验比较列线图预测模型与各独立影响因素AUC的预测效能差异,并在内部验证集中进一步验证列线图预测效能。应用shiny及相关包完成交互式网络动态列线图映射。以P<0.05为差异有统计学意义。
2 结果 2.1 基线资料比较依据纳入排除标准,本研究最终纳入276例PCABI患者,其中预后良好组194例(70.3%),预后不良组82例(29.7%)。按7∶3随机分为训练集(n=196)与内部验证集(n=80),如表 1所示,训练集与内部验证集患者基线资料比较,差异无统计学意义(均P>0.05)。训练集中预后良好组138例(70.4%),预后不良组58例(29.6%),如表 2所示,训练集预后良好组与预后不良组患者基线资料比较,年龄、APACHE Ⅱ评分、初始可除颤心律(赋值:初始可除颤心律为1,否则为0)、电除颤(赋值:电除颤为1,否则为0)、复苏时间、乳酸差异有统计学意义(均P<0.05),其余指标间差异无统计学意义(均P>0.05)。
| 指标 | 训练集(n=196) | 内部验证集(n=80) | 统计值 | P值 |
| PCABI预后良好a | 138(70.4) | 56(70.0) | 0.005 | 0.946 |
| 一般情况 | ||||
| 年龄(岁)b | 61(52, 70) | 60(50, 70) | 1.006 | 0.314 |
| 男性a | 121(61.7) | 45(56.3) | 0.713 | 0.398 |
| BMI≥25.0(kg/m2)a | 40(20.4) | 14(17.5) | 0.305 | 0.581 |
| 既往史a | ||||
| 冠心病 | 119(60.7) | 46(57.5) | 0.244 | 0.621 |
| 高血压 | 157(80.1) | 65(81.3) | 0.048 | 0.827 |
| 糖尿病 | 89(45.4) | 37(46.3) | 0.016 | 0.899 |
| 吸烟史 | 138(70.4) | 53(66.3) | 0.461 | 0.497 |
| 饮酒史 | 120(61.2) | 46(57.5) | 0.329 | 0.566 |
| CA家族史 | 36(18.4) | 21(26.3) | 2.154 | 0.142 |
| 心肺复苏及治疗参数 | ||||
| 初始可除颤心律a | 85(43.4) | 33(41.3) | 0.104 | 0.747 |
| 电除颤a | 119(60.7) | 46(57.5) | 0.244 | 0.621 |
| 复苏时间(min)b | 5(4, 7) | 5(4, 7) | 0.715 | 0.474 |
| 肾上腺素剂量(mg)b | 5(4, 5) | 4(4, 5) | 1.826 | 0.068 |
| 机械通气a | 121(61.7) | 50(62.5) | 0.014 | 0.905 |
| 入院后首次生命体征 | ||||
| 心率(次/min)b | 88(73, 108) | 87(76, 110) | 0.619 | 0.536 |
| 收缩压(mmHg)b | 123(101, 139) | 124(110, 140) | 1.422 | 0.155 |
| 舒张压(mmHg)b | 69(59, 83) | 72(62, 81) | 1.004 | 0.315 |
| 平均动脉压(mmHg)b | 87(74, 100) | 88(81, 100) | 1.172 | 0.241 |
| 呼吸频率(次/min)c | 20.04±6.78 | 19.81±5.54 | 0.261 | 0.794 |
| SpO2(%)b | 99(94, 100) | 98(95, 100) | 1.030 | 0.303 |
| 入院后首次一般实验室检查 | ||||
| 白细胞(×109/L)b | 12.60(8.13, 17.68) | 12.85(8.30, 17.90) | 0.063 | 0.950 |
| 血红蛋白(g/L)c | 11.34±2.37 | 11.15±2.21 | 0.627 | 0.531 |
| 血小板(×109/L)b | 192(150, 279) | 206(161, 254) | 0.669 | 0.503 |
| 血钠(mmol/L)b | 139(136, 142) | 140(137, 142) | 1.358 | 0.175 |
| 血钾(mmol/L)c | 4.17±0.61 | 4.27±0.61 | 1.250 | 0.212 |
| 血糖(mmol/L)b | 8.94(6.69, 12.32) | 9.28(5.90, 13.69) | 0.227 | 0.821 |
| pH值b | 7.32(7.20, 7.41) | 7.34(7.23, 7.42) | 0.725 | 0.468 |
| 乳酸(mmol/L)b | 2.50(1.60, 4.25) | 2.85(1.80, 4.43) | 0.964 | 0.335 |
| 尿素氮(mmol/L)b | 6.11(4.72, 8.89) | 6.94(5.00, 11.11) | 1.656 | 0.098 |
| 肌酐(μmol/L)b | 97.24(70.72, 148.07) | 106.08(79.56, 159.12) | 1.091 | 0.275 |
| 胆固醇(mmol/L)b | 4.30(4.03, 4.70) | 4.30(4.10, 4.70) | 0.281 | 0.779 |
| 甘油三酯(mmol/L)b | 1.65(1.40, 2.00) | 1.60(1.43, 1.90) | 0.701 | 0.483 |
| 入院24 h内重症评分最差值b | ||||
| APACHE Ⅱ评分 | 20(17, 23) | 20(17, 23) | 0.160 | 0.873 |
| SOFA评分 | 10(7, 13) | 10(7, 12) | 0.012 | 0.991 |
| 注:PCABI为心脏骤停后脑损伤,BMI为身体质量指数,CA为心脏骤停,SpO2为经皮动脉血氧饱和度,APACHEⅡ评分为急性生理与慢性健康评分Ⅱ,SOFA评分为序贯器官衰竭评分;a为(例,%),b为[M(Q1, Q3)],c为x±s | ||||
| 指标 | 预后良好组(n=138) | 预后不良组(n=58) | 统计值 | P值 |
| 一般情况 | ||||
| 年龄(岁)a | 60(50, 67) | 69(61, 78) | 4.340 | <0.001 |
| 男性b | 84(60.9) | 37(63.8) | 0.148 | 0.701 |
| BMI≥25.0(kg/m2)b | 27(19.6) | 13(22.4) | 0.204 | 0.652 |
| 既往史b | ||||
| 冠心病 | 78(56.5) | 41(70.7) | 3.437 | 0.064 |
| 高血压 | 113(81.9) | 44(75.9) | 0.929 | 0.335 |
| 糖尿病 | 59(42.8) | 30(51.7) | 1.326 | 0.250 |
| 吸烟史 | 96(69.6) | 42(72.4) | 0.159 | 0.690 |
| 饮酒史 | 88(63.8) | 32(55.2) | 1.271 | 0.260 |
| CA家族史 | 25(18.1) | 11(19.0) | 0.020 | 0.888 |
| 心肺复苏及治疗参数 | ||||
| 初始可除颤心律b | 79(57.2) | 6(10.3) | 36.576 | <0.001 |
| 电除颤b | 106(76.8) | 13(22.4) | 50.663 | <0.001 |
| 复苏时间(min)a | 5(4, 5) | 5(4, 6) | 5.582 | <0.001 |
| 肾上腺素剂量(mg)a | 2(1, 2) | 5(5, 6) | 1.137 | 0.256 |
| 机械通气b | 82(59.4) | 39(67.2) | 1.057 | 0.304 |
| 入院后首次生命体征 | ||||
| 心率(次/min)a | 89(74, 106) | 88(71, 112) | 0.160 | 0.873 |
| 收缩压(mmHg)a | 123(103, 139) | 116(99, 138) | 0.901 | 0.368 |
| 舒张压(mmHg)a | 69(59, 80) | 71(58, 94) | 1.526 | 0.127 |
| 平均动脉压(mmHg)a | 86(75, 98) | 88(68, 114) | 0.688 | 0.491 |
| 呼吸频率(次/min)c | 20.12±6.26 | 19.84±7.93 | 0.232 | 0.817 |
| SpO2(%)a | 99(94, 100) | 99(94, 100) | 0.275 | 0.783 |
| 入院后首次一般实验室检查 | ||||
| 白细胞(×109/L)a | 12.60(8.08, 16.60) | 12.75(8.73, 18.70) | 0.822 | 0.411 |
| 血红蛋白(g/L)c | 11.51±2.03 | 10.95±3.01 | 1.308 | 0.195 |
| 血小板(×109/L)a | 193(151, 281) | 192(140, 279) | 0.177 | 0.860 |
| 血钠(mmol/L)a | 139(136, 141) | 140(137, 143) | 1.602 | 0.109 |
| 血钾(mmol/L)c | 4.19±0.62 | 4.12±0.61 | 0.704 | 0.482 |
| 血糖(mmol/L)a | 8.72(6.61, 12.28) | 9.58(7.40, 13.92) | 1.345 | 0.179 |
| pH值a | 7.32(7.22, 7.41) | 7.30(7.20, 7.40) | 0.664 | 0.507 |
| 乳酸(mmol/L)a | 2.30(1.58, 3.50) | 3.70(2.08, 6.00) | 3.403 | 0.001 |
| 尿素氮(mmol/L)a | 5.83(4.65, 8.89) | 6.25(4.72, 8.96) | 0.133 | 0.895 |
| 肌酐(μmol/L)a | 97.24(70.72, 143.65) | 106.08(70.72, 150.28) | 0.126 | 0.900 |
| 胆固醇(mmol/L)a | 4.20(4.10, 4.70) | 4.40(4.00, 4.80) | 0.956 | 0.339 |
| 甘油三酯(mmol/L)a | 1.60(1.40, 2.03) | 1.70(1.50, 1.90) | 0.317 | 0.751 |
| 入院24 h内重症评分最差值a | ||||
| APACHEⅡ评分 | 19(16, 22) | 25(20, 25) | 7.137 | <0.001 |
| SOFA评分 | 10(7, 12) | 13(11, 14) | 1.959 | 0.050 |
| 注:PCABI为心脏骤停后脑损伤,CA为心脏骤停,BMI为身体质量指数,APACHEⅡ评分为急性生理与慢性健康评分Ⅱ,SOFA评分为序贯器官衰竭评分,SpO2为经皮动脉血氧饱和度;a为[M(Q1, Q3)],b为(例,%),c为x±s | ||||
通过单因素、多因素logistic回归分析(表 3),PCABI不良神经预后发生风险的Logistic回归模型概率值为:logit(P)=-21.021+0.069×年龄+0.558×APACHE Ⅱ评分-1.954×初始可除颤心律-1.479×电除颤+0.749×复苏时间+0.330×乳酸。其中,年龄、APACHE Ⅱ评分、复苏时间和乳酸为阳性事件的促进因素,初始可除颤心律、电除颤为阻碍因素。为了评估多重共线性问题,计算各自变量的方差膨胀因子(variance inflation factor, VIF),结果显示所有变量的VIF均小于5,提示多重共线性程度较低,表明这些变量均可纳入最终模型。
| 变量 | 单因素Logistic回归 | 多因素Logistic回归 | |||||
| β值 | OR值(95%CI) | P值 | β值 | OR值(95%CI) | P值 | ||
| 年龄 | 0.060 | 1.062(1.031~1.093) | <0.001 | 0.069 | 1.071(1.021~1.124) | 0.005 | |
| APACHE Ⅱ评分 | 0.415 | 1.515(1.330~1.725) | <0.001 | 0.558 | 1.746(1.393~2.190) | <0.001 | |
| 初始可除颤心律 | -2.415 | 0.086(0.035~0.214) | <0.001 | -1.954 | 0.142(0.025~0.819) | 0.029 | |
| 电除颤 | -2.439 | 0.087(0.042~0.181) | <0.001 | -1.479 | 0.228(0.060~0.869) | 0.030 | |
| 复苏时间 | 0.474 | 1.606(1.346~1.915) | <0.001 | 0.749 | 2.116(1.487~3.010) | <0.001 | |
| 乳酸 | 0.300 | 1.350(1.157~1.575) | <0.001 | 0.330 | 1.392(1.005~1.927) | 0.047 | |
| 注:APACHE Ⅱ评分为急性生理与慢性健康评分Ⅱ | |||||||
通过对PCABI患者不良神经预后各独立影响因素分别构建ROC曲线,并计算相关指标,评价各影响因素预测PCABI患者不良神经预后发生概率的价值,如表 4所示。其中,APACHE Ⅱ评分预测价值最高(AUC=0.822,95%CI: 0.751~0.893),最佳截断值为24分。
| 影响因素 | AUC | 95%CI | 敏感度(%) | 特异度(%) | 约登指数 | 最佳截断值 |
| 年龄 | 0.696 | (0.616,0.777) | 69.0 | 62.3 | 0.313 | 62.50 |
| APACHE Ⅱ评分 | 0.822 | (0.751,0.893) | 56.9 | 100.0 | 0.569 | 24.00 |
| 初始可除颤心律 | 0.735 | (0.663,0.806) | 100.0 | 0.0 | 0.000 | - |
| 电除颤 | 0.772 | (0.698,0.846) | 100.0 | 0.0 | 0.000 | - |
| 复苏时间 | 0.750 | (0.671,0.829) | 56.9 | 86.2 | 0.431 | 6.50 |
| 乳酸 | 0.654 | (0.566,0.743) | 48.3 | 83.3 | 0.316 | 4.05 |
| 注:APACHEⅡ评分为急性生理与慢性健康评分Ⅱ,-表示无相关数据 | ||||||
基于上述PCABI患者不良神经预后独立影响因素构建列线图,见图 1。根据每一项指标,垂直画一条线到评分轴上,从而得到相应分值,最后将分值相加得到总分,总分向下的垂直线对应PCABI患者不良神经预后发生概率。通过构建列线图预测模型ROC曲线,训练集与内部验证集的AUC分别为0.965(95%CI:0.939~0.989)和0.987(95%CI:0.967~1.000),如图 2。列线图预测模型同各独立影响因素相比,具有更好的阳性结局预测效能(P<0.001),见表 5。训练集的最大约登指数为0.832,所对应的敏感度与特异度分别为88.4%和94.8%。进一步完成校正曲线显示,列线图模型训练集(图 3A)与内部验证集(图 3B)预测概率与实际概率具有较好的一致性。同时,DCA曲线显示列线图模型训练集(图 4A)与内部验证集(图 4B)均具有良好的临床净获益。
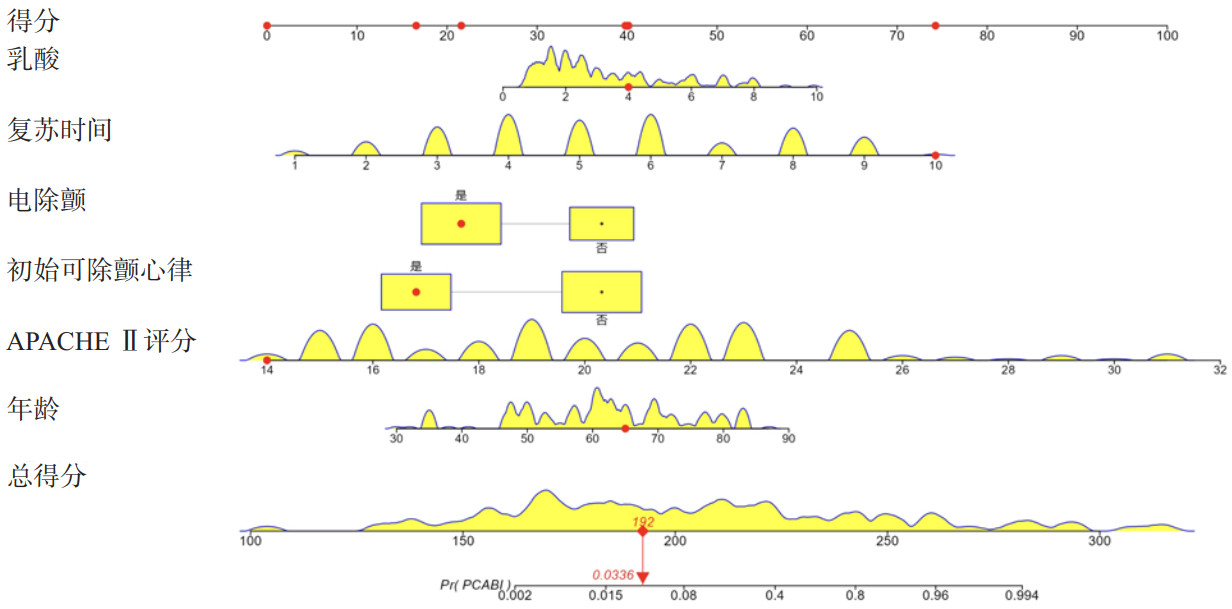
|
| 图 1 PCABI患者不良神经预后列线图预测模型 Fig 1 Nomogram prediction model for poor neurological prognosis in patients with PCABI |
|
|
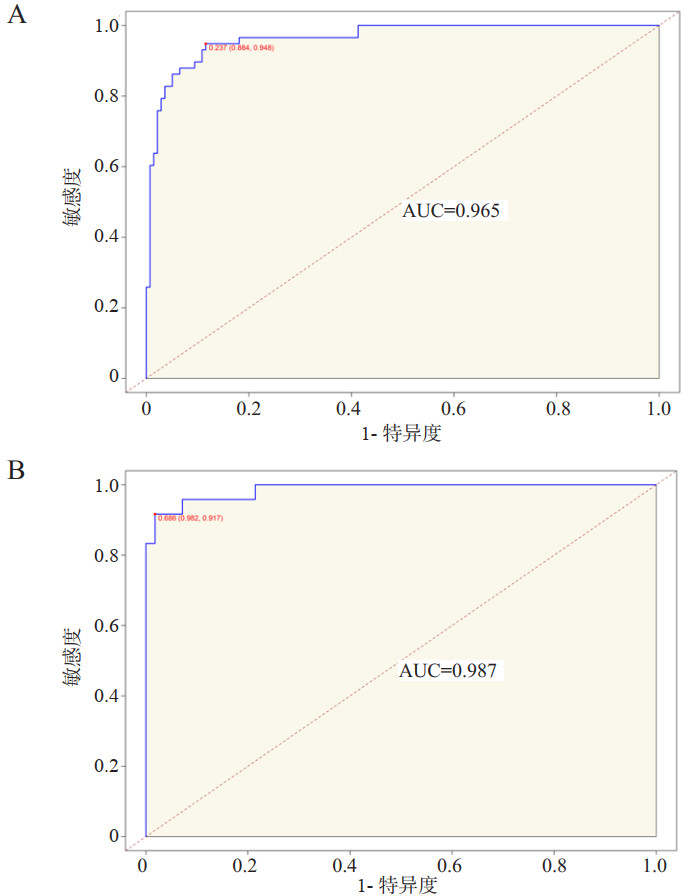
|
| 注:A为训练集中列线图ROC曲线;B为内部验证集中列线图ROC曲线 图 2 PCABI患者不良神经预后列线图预测模型ROC曲线 Fig 2 ROC curves of nomogram prediction model for poor neurological prognosis in patients with PCABI |
|
|
| 变量 | SE | AUC差值 | 95%CI | Z值 | P值 |
| 列线图~年龄 | 0.040 | 0.268 | (0.190, 0.346) | 6.728 | <0.001 |
| 列线图~APACHE Ⅱ评分 | 0.033 | 0.143 | (0.078, 0.208) | 4.330 | <0.001 |
| 列线图~初始可除颤心律 | 0.030 | 0.230 | (0.172, 0.288) | 7.769 | <0.001 |
| 列线图~电除颤 | 0.032 | 0.193 | (0.129, 0.257) | 5.897 | <0.001 |
| 列线图~复苏时间 | 0.039 | 0.214 | (0.139, 0.290) | 5.538 | <0.001 |
| 列线图~乳酸 | 0.043 | 0.310 | (0.226, 0.395) | 7.192 | <0.001 |
| 注:APACHEⅡ评分为急性生理与慢性健康评分Ⅱ | |||||
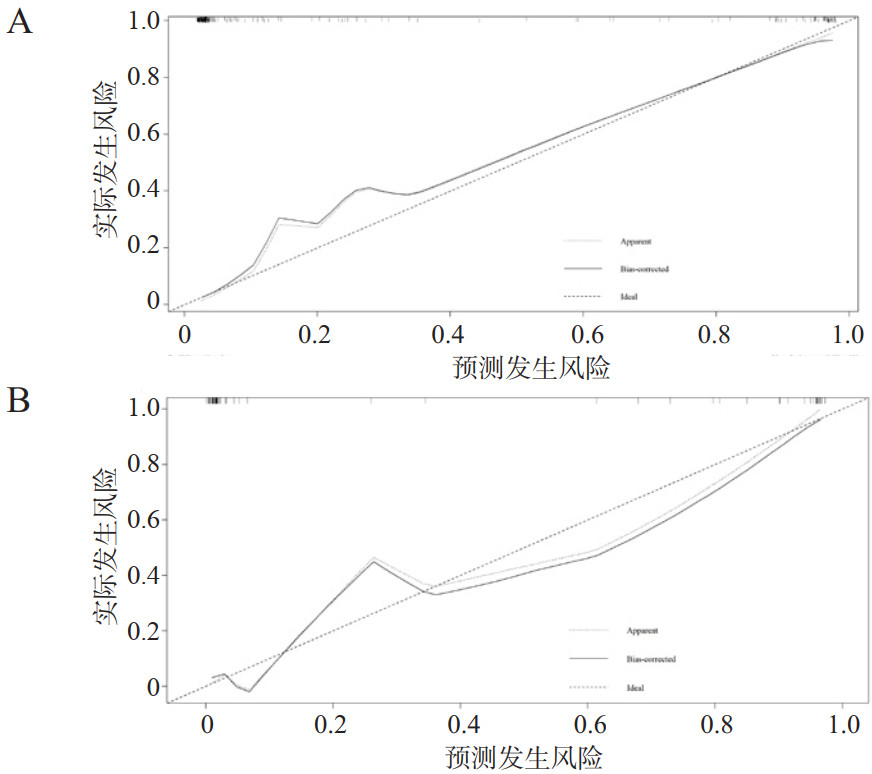
|
| 注:A为训练集中列线图校准曲线;B为内部验证集中列线图校准曲线 图 3 PCABI患者不良神经预后列线图预测模型校准曲线 Fig 3 Calibration curves of nomogram prediction model for poor neurological prognosis in patients with PCABI |
|
|
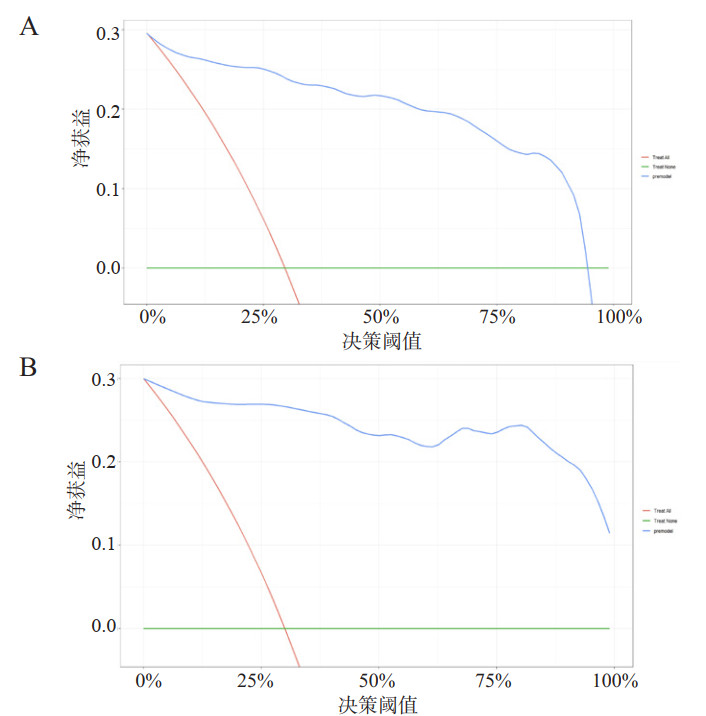
|
| 注:A为训练集中列线图DCA曲线;B为内部验证集中列线图DCA曲线 图 4 PCABI患者不良神经预后列线图预测模型DCA曲线 Fig 4 DCA curves of nomogram prediction model for poor neurological prognosis in patients with PCABI |
|
|
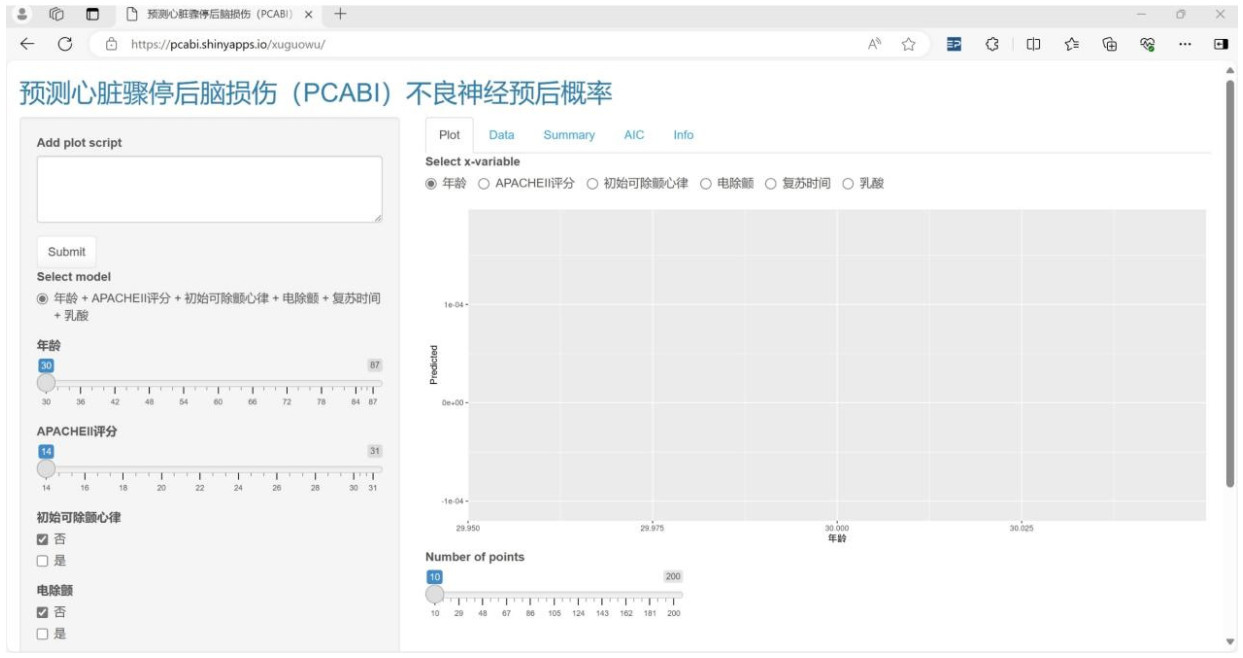
为便于临床应用,以上述列线图模型为基础,通过加载shiny包、shinyPredict包及shinythemes包构建动态列线图,并进一步加载rsconnect包,将该模型映射至网页(https://pcabi.shinyapps.io/xuguowu/),使用户可实时通过web版交互界面获取预测结果。实际操作中在web界面选定各影响因素数值,点击“Data”即可获得PCABI患者不良神经预后发生概率。见图 5。
|
| 图 5 PCABI患者不良神经预后交互式网络动态列线图 Fig 5 Interactive network dynamic nomogram prediction model for poor neurological prognosis in patients with PCABI |
|
|
本研究共纳入276例PCABI患者,其中预后不良组82例,发生概率为29.7%,与本课题组既往研究[13]及相关文献报道结果[14]一致。通过Logistic回归分析发现,初始心脏节律为可除颤心律(OR=0.142,95%CI: 0.025~0.819)及电除颤(OR=0.228,95%CI: 0.060~0.869)的应用对CA后神经功能预后良好具有保护作用,而更高的年龄(OR=1.071,95%CI: 1.021~1.124)、APACHEⅡ评分(OR=1.746,95%CI: 1.393~2.190)和乳酸水平(OR=1.392,95%CI: 1.005~1.927)以及更长的复苏时间(OR=2.116,95%CI: 1.487~3.010)可能增加不良神经预后的风险。在此基础上构建的列线图预测模型相比各独立影响因素,预测精度更高,并展现出稳健的鲁棒性与广泛的临床适用性。与现有模型相比,本研究进一步利用网络映射方法开发了交互式动态列线图,为临床实践提供了更友好的用户界面、更简便的操作方法及更可靠的预测性能[10-12]。
第七次全国人口普查公报报告我国65岁及以上人口逾1.9亿人,占13.50%,较前上升4.63个百分点,反映出我国人口结构正呈现加速老龄化趋势。同时,国民平均预期寿命进一步提高,由高龄引发的一系列医学问题日益凸显。本研究发现,年龄每增加一岁,PCABI患者发生不良神经预后的风险增加0.071倍,该结果与Zhang等[10]的研究结果一致(OR=2.614,95%CI: 1.501~4.552,P=0.001);Mayampurath等[15]通过比较多种机器学习模型,发现年龄是预测PCABI不良神经预后最重要的变量之一,且年龄较大组发生不良神经预后的风险显著升高(P<0.001)。此外,在动物实验研究中,大鼠CA复苏模型显示,高龄大鼠的海马CA1神经元计数和脑线粒体呼吸控制比明显降低,对缺血-再灌注损伤的易感性显著增加,与低龄大鼠相比,高龄大鼠更易发生神经损伤,且损伤程度更重,这可能为年龄对PCABI预后的影响提供了病理生理学机制的解释[16]。
CPR作为影响CA患者存活的重要因素已被广泛认可[17]。本研究发现,复苏相关指标——初始可除颤心律、电除颤及复苏时间,在CA患者的神经预后预测中具有重要价值。通过AUC、敏感度、特异度等综合评估,结果表明列线图模型不仅具有更优的预测效能,同时在区分假阳性与假阴性患者方面表现出更高的辨别能力。Vanat等[18]通过回顾性分析2家医学中心499例CA后昏迷患者的数据,发现初始心律为可除颤心律及较短的复苏时间均与更好的神经预后显著相关(均P<0.001),这与本研究结果一致。Wimmer等[19]的研究亦得出了类似的结论。此外,在初始可除颤心律患者中,早期电除颤可更有效促进ROSC并减轻CA后脑缺血-再灌注损伤[20],本研究结果同样支持这一观点。近期,Allen等[21]提出“时间就是大脑”的概念,强调PCABI具有显著的时间依赖性,并建议根据PCABI的不同阶段实施早期精准干预及动态调整策略,这也进一步对早期高质量CPR提出了更高要求。
APACHEⅡ评分和乳酸是当前评估危重症患者病情严重程度的常用临床指标。本研究发现,在所有独立影响因素中,APACHEⅡ评分的预测价值最高(AUC=0.822,95%CI: 0.751~0.893),并且在列线图预测模型中也展现了重要的预测权重。近期,Ding等[12]的研究发现,APACHE Ⅱ评分越高,CA后90 d发生不良神经预后的风险越大(OR=1.07,95%CI: 1.01~1.15,P=0.029)。Choi等[22]通过监测ROSC后不同时间点的乳酸水平,发现早期血乳酸水平,尤其是24 h血乳酸水平(调整OR=1.36,95%CI: 1.15~1.60,P<0.001)是院外CA 6个月不良神经预后的独立预测因子。Dell'Anna等[23]也发现,高入院乳酸水平与CA后3个月的不良神经预后独立相关(OR=1.18,95%CI: 1.08~1.30,P<0.001),这一结果与本研究一致(OR=1.392,95%CI: 1.005~1.927,P=0.047)。此外,近年来关于乳酸在急性脑损伤中的神经保护作用提供了新的研究方向,可能为PCABI患者的预后评估与治疗提供新的契机[24-25]。
本研究存在一定的局限性:(1)本研究为回顾性研究,数据同质性无法完全保证,可能存在信息偏倚;(2)本研究为单中心研究,存在地域及院际差异的可能性,且缺乏外部验证队列,未来需要进一步完善相关研究;(3)本研究的纳排标准较为严格,纳入患者中可逆性病因比例较高,可能存在选择偏倚或测量偏倚;(4)本研究样本量较少,存在一定的局限性,因此需要通过大规模、多中心、前瞻性的研究进一步验证结果的准确性。
综上所述,本研究通过分析CA后早期相关资料,应用列线图方法构建了PCABI不良神经预后预测模型,并与各独立影响因素进行了比较。结果显示,列线图模型具有更高的预测效能、敏感度和特异度。同时,通过网络映射形成的交互式动态列线图为临床实际应用提供了更多便利,帮助临床医生更早识别PCABI患者的不良神经预后,从而为该类患者治疗策略的制定与调整提供重要的指导性意见。
利益冲突 所有作者声明无利益冲突。
作者贡献声明 续国武:研究设计、数据收集、论文撰写;王晋祥:研究设计、论文修改、经费支持;靳衡:统计学指导、论文修改;王力军、余慕明:分析与解释数据
| [1] | Sandroni C, Cronberg T, Sekhon M. Brain injury after cardiac arrest: pathophysiology, treatment, and prognosis[J]. Intensive Care Med, 2021, 47(12): 1393-1414. DOI:10.1007/s00134-021-06548-2 |
| [2] | 中华医学会急诊医学分会, 中国医药教育协会急诊专业委员会. 中国心脏骤停中心建设专家共识[J]. 中华急诊医学杂志, 2023, 32(10): 1296-1303. DOI:10.3760/cma.j.issn.1671-0282.2023.10.003 |
| [3] | 中华医学会急诊医学分会复苏学组, 中国医药教育协会急诊专业委员会, 成人心脏骤停后综合征诊断和治疗中国急诊专家共识组. 成人心脏骤停后综合征诊断和治疗中国急诊专家共识[J]. 中华急诊医学杂志, 2021, 30(7): 799-808. DOI:10.3760/cma.j.issn.1671-0282.2021.07.002 |
| [4] | 心肺复苏后昏迷患者早期神经功能预后评估专家共识组. 心肺复苏后昏迷患者早期神经功能预后评估专家共识[J]. 中华急诊医学杂志, 2019, 28(2): 156-162. DOI:10.3760/cma.j.issn.1671-0282.2019.02.006 |
| [5] | Perkins GD, Callaway CW, Haywood K, et al. Brain injury after cardiac arrest[J]. Lancet, 2021, 398(10307): 1269-1278. DOI:10.1016/S0140-6736(21)00953-3 |
| [6] | Geocadin RG, Callaway CW, Fink EL, et al. Standards for studies of neurological prognostication in comatose survivors of cardiac arrest: a scientific statement from the American Heart Association[J]. Circulation, 2019, 140(9): e517-e542. DOI:10.1161/CIR.0000000000000702 |
| [7] | Henson T, Rawanduzy C, Salazar M, et al. Outcome and prognostication after cardiac arrest[J]. Ann N Y Acad Sci, 2022, 1508(1): 23-34. DOI:10.1111/nyas.14699 |
| [8] | Nolan JP, Sandroni C, Böttiger BW, et al. European resuscitation council and European society of intensive care medicine guidelines 2021: post-resuscitation care[J]. Intensive Care Med, 2021, 47(4): 369-421. DOI:10.1007/s00134-021-06368-4 |
| [9] | 苏俊文, 樊麦英, 曹彦, 等. 心肺复苏后人工智能模式下多模态神经功能预后预测[J]. 中华急诊医学杂志, 2024, 33(11): 1493-1499. DOI:10.3760/cma.j.issn.1671-0282.2024.11.004 |
| [10] | Zhang XR, Zheng XW, Dai ZS, et al. The development and validation of a nomogram to determine neurological outcomes in cardiac arrest patients[J]. BMC Anesthesiol, 2023, 23(1): 289. DOI:10.1186/s12871-023-02251-5 |
| [11] | Li Z, Xing JH. A model for predicting return of spontaneous circulation and neurological outcomes in adults after in-hospital cardiac arrest: development and evaluation[J]. Front Neurol, 2023, 14: 1323721. DOI:10.3389/fneur.2023.1323721 |
| [12] | Ding GQ, Kuang AL, Zhou ZB, et al. Development of prognostic models for predicting 90-day neurological function and mortality after cardiac arrest[J]. Am J Emerg Med, 2024, 79: 172-182. DOI:10.1016/j.ajem.2024.02.022 |
| [13] | 续国武, 王晋祥, 靳衡. 早期多指标监测预测心脏骤停后脑损伤患者神经功能预后的价值[J]. 中华急诊医学杂志, 2023, 32(12): 1674-1679. DOI:10.3760/cma.j.issn.1671-0282.2023.12.017 |
| [14] | Jeon SB, Lee H, Park B, et al. Neurological and clinical status from early time point to long-term follow-up after in-hospital cardiac arrest[J]. Resuscitation, 2021, 162: 334-342. DOI:10.1016/j.resuscitation.2021.01.011 |
| [15] | Mayampurath A, Hagopian R, Venable L, et al. Comparison of machine learning methods for predicting outcomes after in-hospital cardiac arrest[J]. Crit Care Med, 2022, 50(2): e162-e172. DOI:10.1097/CCM.0000000000005286 |
| [16] | Xu K, Puchowicz MA, LaManna JC. Aging effect on post-recovery hypofusion and mortality following cardiac arrest and resuscitation in rats[J]. Adv Exp Med Biol, 2016, 876: 265-270. DOI:10.1007/978-1-4939-3023-4_33 |
| [17] | 米玉红, 唐子人, 张馨予. 心肺复苏中基础生命支持的核心环节及原因剖析[J]. 中华急诊医学杂志, 2025, 34(2): 148-157. DOI:10.3760/cma.j.issn.1671-0282.2025.02.004 |
| [18] | Vanat A, Lee JW, Elkhider H, et al. Multimodal prediction of favorable outcome after cardiac arrest: a cohort study[J]. Crit Care Med, 2023, 51(6): 706-716. DOI:10.1097/CCM.0000000000005841 |
| [19] | Wimmer H, Stensønes SH, Benth JŠ, et al. Outcome prediction in comatose cardiac arrest patients with initial shockable and non-shockable rhythms[J]. Acta Anaesthesiol Scand, 2024, 68(2): 263-273. DOI:10.1111/aas.14337 |
| [20] | Angelos MG, Menegazzi JJ, Callaway CW. Bench to bedside: resuscitation from prolonged ventricular fibrillation[J]. Acad Emerg Med, 2001, 8(9): 909-924. DOI:10.1111/j.1553-2712.2001.tb01155.x |
| [21] | Allen CP, Bird JD, Sekhon MS. The dynamic pathophysiology of post cardiac arrest brain injury: "time is brain"[J]. Curr Opin Crit Care, 2025, 31(2): 123-130. DOI:10.1097/MCC.0000000000001246 |
| [22] | Choi SY, Oh SH, Park KN, et al. Association between early lactate-related variables and 6-month neurological outcome in out-of-hospital cardiac arrest patients[J]. Am J Emerg Med, 2024, 78: 62-68. DOI:10.1016/j.ajem.2024.01.005 |
| [23] | Dell'Anna AM, Sandroni C, Lamanna I, et al. Prognostic implications of blood lactate concentrations after cardiac arrest: a retrospective study[J]. Ann Intensive Care, 2017, 7(1): 101. DOI:10.1186/s13613-017-0321-2 |
| [24] | Deng QT, Wu CY, Liu TC, et al. Exogenous lactate administration: a potential novel therapeutic approach for neonatal hypoxia-ischemia[J]. Exp Neurol, 2023, 367: 114450. DOI:10.1016/j.expneurol.2023.114450 |
| [25] | Plourde G, Roumes H, Suissa L, et al. Neuroprotective effects of lactate and ketone bodies in acute brain injury[J]. J Cereb Blood Flow Metab, 2024, 44(7): 1078-1088. DOI:10.1177/0271678X241245486 |
 2025, Vol. 34
2025, Vol. 34




