急性胰腺炎(acute pancreatitis, AP)是一种因胆结石、酗酒,创伤等致病因素引起的炎症反应[1]。而部分AP因持续的胰腺组织自我消化性损伤可继发全身炎症反应综合征进而发展为重症急性胰腺炎(sever acute pancreatitis, SAP)[2]。急性肺损伤(acute lung injury, ALI)作为SAP最常见的全身性并发症,以进行性低氧血症和呼吸窘迫为主要表现,严重者可发展为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)危及生命[3]。
自噬(autophagy)是将细胞物质运输到溶酶体降解的过程,是机体对外部各种有害刺激做出的防御反应[4]。自噬过程的动态变化参与了胰蛋白酶原的活化过程,自噬程度与SAP的预后密切相关[5]。相关研究表明过度或异常的自噬可能导致内环境紊乱、细胞死亡和炎症反应的加剧,促进SAP病情进展并进一步诱发SAP-ALI的发生。
成纤维细胞生长因子21(fibroblast growth factor 21, FGF21)作为一种由肝脏生成的细胞代谢调节因子,在人体的生长、发育、修复等多种生理过程中发挥着重要作用[6]。相关研究表明FGF21能够通过调控细胞自噬发挥抑制炎症、组织修复的作用[7]。既往关于FGF21的研究集中在肝损伤、心血管疾病、肿瘤、神经炎症等疾病[8-10]。但是最新研究表明FGF21在ALI中同样能够起到保护作用[11],而其具体机制仍不明确且目前尚未有文章报道FGF21在SAP-ALI中的作用。根据现有研究,本团队推测FGF21可能通过上调自噬水平从而对SAP-ALI起到保护作用,改善预后。
1 材料与方法 1.1 实验动物健康清洁雄性SD大鼠24只(200~250 g,约8周龄),购自中国农业科学院兰州兽医研究所,在兰州大学第二医院萃英实验动物中心室温(23±2)℃下维持12 h的暗/光循环,用标准鼠食和自来水饲养大鼠。动物护理和所有实验程序均参照《实验动物管理条例》。本实验经兰州大学第二医院伦理委员会批准(批准号:D2020-77)。
1.2 实验试剂及仪器本实验主要试剂及使用仪器如下:牛黄胆酸钠(上海源叶,S26985),FGF21(ABMOLE, M10048),3-MA(Selleck,S2767),急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)试剂盒(上海江莱,JLW10484),FGF21试剂盒(上海江莱,JL20926),淀粉酶(amylase, AMY)试剂盒(南京建成,C016-1-1),抗-FGF21(Abcam, ab171941),抗-LC3(BOSTER,BM4827)、P62(BIOSS,bs-55207R),β-actin(Servicebio,GB15001)。主要仪器:全景组织细胞定量分析系统(TissueGnostics Asia Pacific Limited,TissueFAXS Plus),全自动化学发光图像处理系统(上海天能,Tanon 5200 Multi),BioTek酶标仪(美国伯腾仪器有限公司,BioTek)。
1.3 SAP大鼠模型及分组用3.5%水合氯醛溶液以1 mL/100 g的剂量腹腔注射麻醉,待完全麻醉后固定、备皮、碘伏消毒、铺无菌洞巾,沿着大鼠腹部正中线,打开腹腔。找到肝脏后用镊子轻轻提起,充分暴露胰腺和十二指肠,将二者分离,找到十二指肠乳头处,用1 mL注射器穿刺乳头处标记。左手通过细线控制十二指肠乳头,右手用4号头皮针从穿刺处进入十二指肠,在进入后逆行穿刺进入胰管,随后缓慢注射牛黄胆酸钠(0.1 mL/100g)建立大鼠SAP模型。
SAP模型效果评估:造模24 h后采集标本,通过苏木精-伊红(HE)染色观察胰腺及肺组织病理损伤程度,按照SAP模型评分标准[12]行损伤评分;通过生化试剂盒检测血清AMY,ELISA检测血浆TNF-α水平判断造模是否成功。
将24只健康、洁净的雄性SD大鼠随机(随机数字法)分为4组:对照组(Control组)、SAP组、FGF21干预组(SAP+FGF21组)、自噬抑制剂组(SAP+FGF21+3-MA组),6只/组。其中,Control组采用主胰管逆行注射生理盐水1 mL/kg后关腹;SAP组沿胃大弯、十二指肠大乳头处4号头皮针向胰胆管内逆行注射3.5% 牛黄胆酸钠1 mL/kg建立模型;SAP+FGF21组在术前1 h腹腔注射FGF21 10 mg/kg;SAP+FGF21+3-MA组在术前1 h分一次腹腔注射FGF21 10 mg/kg、3-MA 20 mg/kg。造模24 h后,腹腔注射5%戊巴比妥50 mg/kg麻醉,右心室采血、处死、采集胰腺及左肺组织。
1.4 胰腺及肺组织HE染色将所取胰腺及肺组织在4%多聚甲醛中固定48 h,用递增梯度乙醇溶液脱水,石蜡包埋,4 μm厚切片。切片在二甲苯中脱蜡两次,20 min,通过降级乙醇溶液复水,每次5 min,并在去离子水中冲洗5 min。切片HE染色。在TissueFAXS Plus明场扫描组织全景,观察胰腺和肺的病理变化。随后,通过胰腺组织的水肿、炎性细胞浸润、腺泡细胞的坏死和空泡这4项表现进行胰腺病理损伤评分[13];采用Smith评分[14]通过对肺水肿、肺泡以及间质炎症、肺泡及间质出血的情况评价进行肺组织病理损伤评分。评分由两名研究者根据标准方案独立进行,差异由第三名研究者裁定。
1.5 血清AMY活性及血浆TNF-α、FGF21水平测定将大鼠血液标本分次离心以收集血清及血浆样本。生化试剂盒测定血清AMY活性,酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测血浆TNF-α、FGF21水平。严格按照生化试剂盒以及ELISA试剂盒的操作说明进行检测。
1.6 Western blot测自噬相关蛋白的表达首先取之前采集的肺组织提取肺组织总蛋白,BCA法进行蛋白浓度测定。然后分别12%浓缩胶和不同浓度的分离胶,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离不同相对分子质量大小的蛋白质,电泳后转膜,在室温下,用5%脱脂牛奶封闭条带1 h,回收条带,分别与LC3、p62、β-actin等一抗在4 ℃冰箱中孵育过夜。回收条带与相应种属的二抗在室温孵育1 h。最后加入化学发光底物,化学发光检测仪检测蛋白表达,曝光成像。
1.7 肺组织透射电镜观察自噬小体将小块肺组织放在载玻片上,加入2.5%的戊二醛。随后,将载玻片轻轻按压在另一载玻片上以去除气泡。新鲜肺组织用2.5%戊二醛预固定2 h,用PBS冲洗2次,再用0.01 g/mL O4-O4固定1 h,固定后用递增的丙酮溶液脱水,用环氧树脂包埋。超薄切片用醋酸铀酰和柠檬酸铅染色,在透射电子显微镜下观察。
1.8 免疫荧光测肺组织中FGF21的表达将新鲜大鼠肺组织在4%多聚甲醛中固定后,石蜡包埋切片,之后严格遵守制造商说明进后续操作步骤。封片后将切片置于TissueFAXS Plus荧光扫描模式下观察并采集图像。观察肺组织中FGF21的荧光密度。
1.9 统计学方法所有数据均采用GraphPad Prism 8.0软件进行分析。正态分布的数据资料以均数±标准差(x±s)表示,单一时间点两组间比较采用成组t检验,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
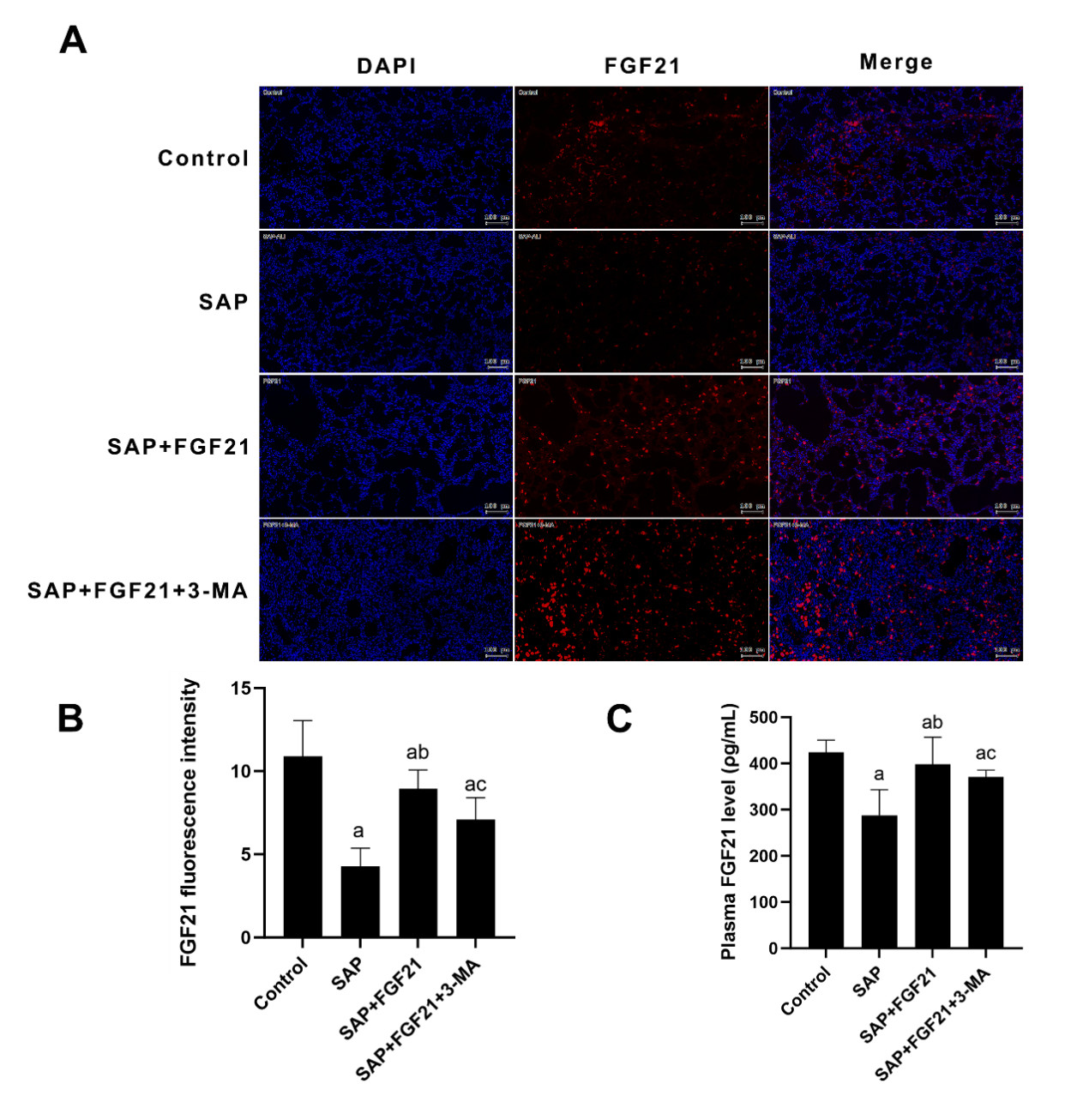
2 结果 2.1 各组大鼠血浆和肺组织FGF21水平为明确各组大鼠FGF21表达水平,本实验通过ELISA测定各组大鼠血浆FGF21含量以及免疫荧光检测各组大鼠肺组织FGF21表达。结果如图 1所示:与Control组相比,SAP组血浆及肺组织FGF21水平明显下降[(424.40±26.14) ρg/mL vs. (287.90±55.46) pg/mL,0.001;(10.900±2.148)vs.(4.280±1.085),P<0.001];与SAP组相比,SAP+FGF21组血浆及肺组织FGF21水平明显升高[(287.90±55.46) pg/mL vs. (398.20±58.47) pg/mL,P<0.01;(4.281±1.085) vs. (8.945±1.127),P<0.001];SAP+FGF21组与SAP+FGF21+3-MA两组间差异无统计学意义。
|
| 注:A为免疫荧光染色检测大鼠肺组织FGF21表达水平(×200倍,比例尺100 μm);B为FGF21免疫荧光定量分析;C为各组大鼠血浆FGF21水平比较;SAP组与Control组相比,aP<0.001;SAP+FGF21组与SAP组相比,bP<0.01;SAP+FGF21+3-MA组肺与SAP组相比,cP<0.05 图 1 各组大鼠血浆和肺组织FGF21表达水平 Fig 1 FGF21 expression levels in plasma and lung tissue of rats in each group |
|
|
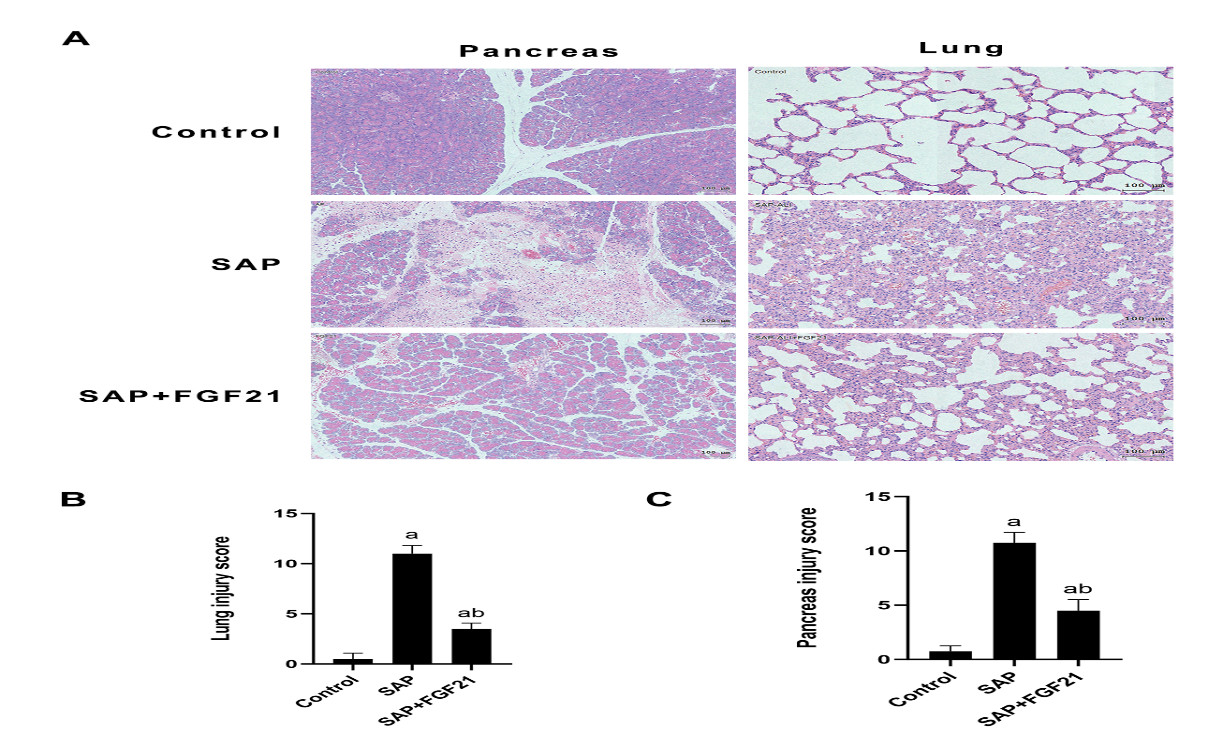
显微镜下分别观察各组大鼠胰腺及肺组织切片如图 2所示。Control组胰腺组织结构明确,腺泡、胰岛清晰可见;SAP组可见明显间质组织水肿,大片坏死,间质内炎性细胞浸润伴出血明显;SAP+FGF21组可见经FGF21干预,胰腺组织病理损伤较SAP组明显减轻。Control组肺组织镜下可见肺泡结构完整,支气管内壁及间质无炎性细胞浸润;SAP组肺组织可见肺泡间隔增厚,肺泡破损,肺泡内充满水肿液,伴随大量炎性细胞浸润;SAP+FGF21组可见经FGF21干预,肺组织病理损伤较SAP组明显缓解。通过病理损伤评分量化胰腺及肺损伤严重程度,SAP组胰腺及肺组织损伤评分高于Control组(P<0.001);SAP+FGF21组胰腺及肺组织病理学评分低于SAP组(P<0.001)。
|
| 注:A为各组大鼠胰腺及肺组织HE染色(×200倍,比例尺100 μm);B为各组大鼠胰腺组织病理损伤评分;C为各组大鼠肺组织病理损伤评分;SAP组与Control组相比,aP<0.001;SAP+FGF21组与SAP组相比,bP<0.001 图 2 FGF21对SAP大鼠胰腺及肺组织病理损伤的影响 Fig 2 Effect of FGF21 on pathological injury of pancreas and lung tissue in SAP rats |
|
|
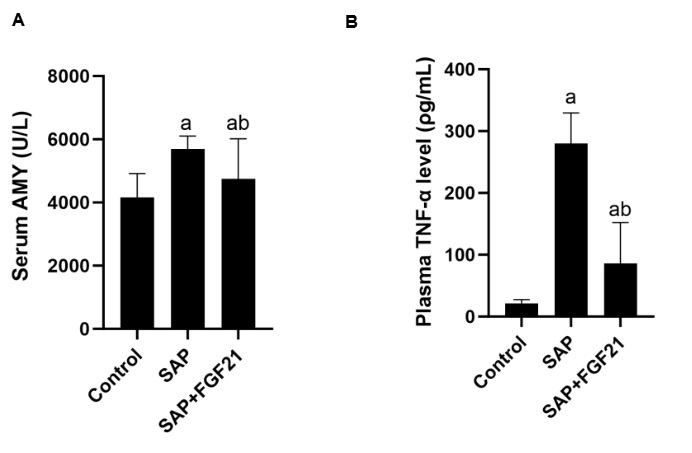
各组大鼠血清AMY及血浆TNF-α水平对比如图 3所示。与Control组相比,SAP组大鼠血清AMY、血浆TNF-α水平明显升高[(21.35±6.27) pg/mL vs. (280.10±49.36) pg/mL,P<0.001];而经FGF21干预后AMY活性、血浆TNF-α水平较SAP组显著降低[(280.10±49.36) pg/mL vs. (86.32±66.00) pg/mL,P<0.001]。
|
| 注:A为各组大鼠血清AMY水平;B为各组大鼠血浆TNF-α水平;SAP组与Control组相比,aP<0.001;SAP+FGF21组与SAP组相比,bP<0.01 图 3 FGF21对大鼠血清AMY活性及血浆TNF-α水平的影响 Fig 3 Effects of FGF21 on serum AMY activity and plasma TNF-α levels in rats |
|
|
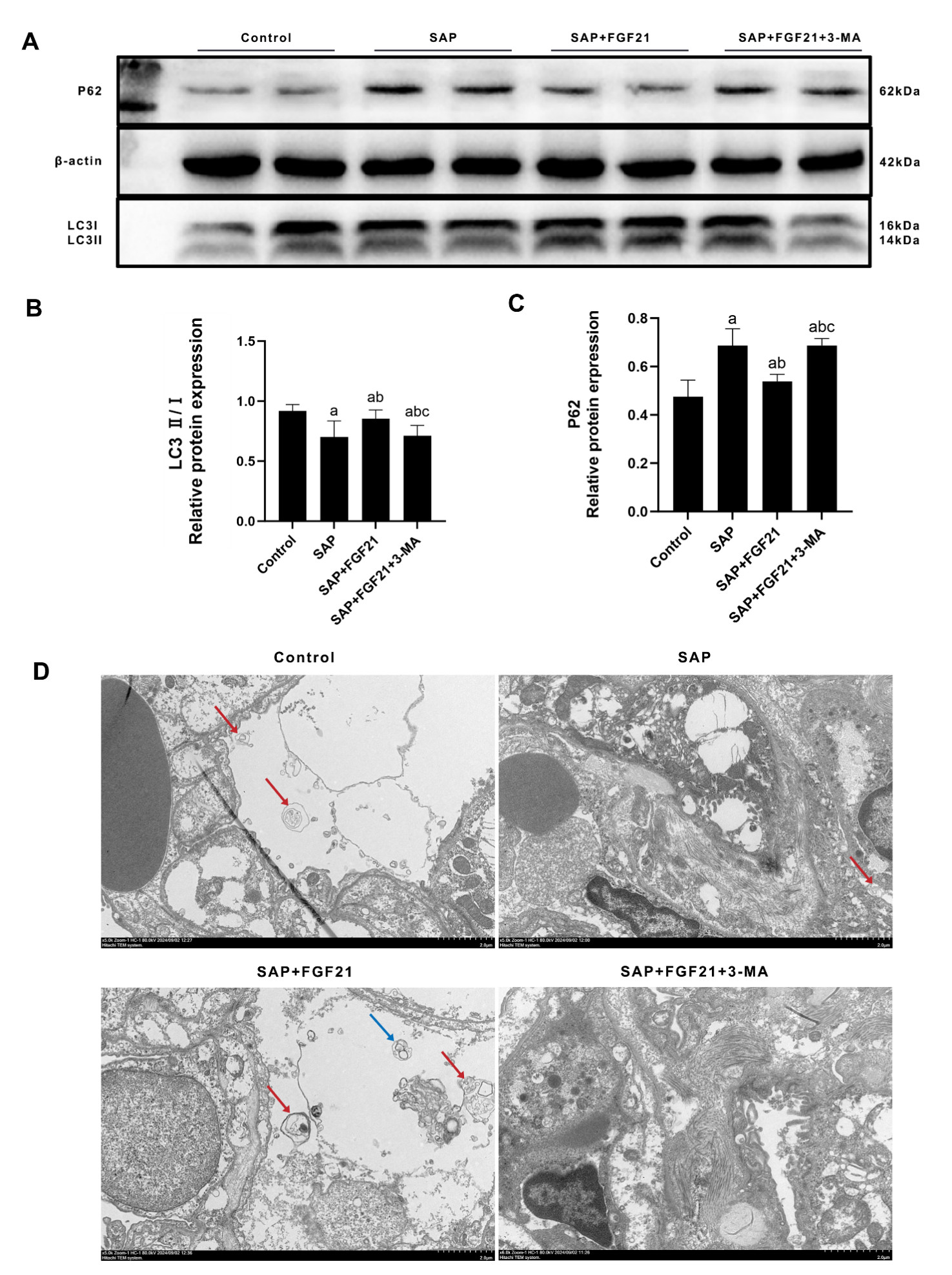
各组大鼠肺组织肺组织自噬水平如图 4所示。与Control组相比,SAP组肺组织中LC3Ⅱ/Ⅰ水平下调[(0.912±0.052) vs. (0.700±0.135),P<0.001],P62蛋白水平上调[(0.475±0.068) vs. (0.687±0.070),P<0.001];与SAP组相比,SAP+FGF21组肺组织中LC3Ⅱ/Ⅰ水平上调[(0.700±0.135) vs. (0.853±0.073),P<0.01],P62蛋白水平下调[(0.687±0.070) vs. (0.538±0.030),P<0.01];与SAP+FGF21组相比,SAP+FGF21+3-MA组肺组织中LC3Ⅱ/Ⅰ水平下调[(0.853±0.074) vs. (0.712±0.086),P<0.05],P62蛋白表达水平上调[(0.538±0.030) vs. (0.687±0.030),P<0.01]。
|
| 注:A为Western Blot检测自噬相关蛋白水平;B为LC3Ⅱ/Ⅰ定量分析;C为P62定量分析;D为透射电镜下各组大鼠肺组织表现(红色箭头为自噬小体,蓝色箭头为自噬溶酶体);SAP组与Control组相比,aP<0.001;SAP+FGF21组SAP组相比,bP<0.01;SAP+FGF21+3-MA组与SAP+FGF21组相比,cP<0.05 图 4 FGF21对大鼠肺组织自噬水平的影响。 Fig 4 Effect of FGF21 on autophagy level in rat lung tissue. |
|
|
电镜下观察Control组肺组织可见多个结构清晰的自噬小体,线粒体电子密度致密,未见明显肿胀或嵴断裂等表现;与Control组相比,SAP组肺组织可见部分自噬小体,无自噬溶酶体,线粒体电子密度明显降低、部分存在嵴断裂;与SAP组相比,SAP+FGF21组肺组织可见自噬小体及自噬溶酶体,部分线粒体点击密度降低,未见明显嵴断裂;与SAP+FGF21组相比,SAP+FGF21+3-MA组肺组织未见自噬小体及自噬溶酶体,细胞核形态不规则,线粒体嵴消失。
2.5 自噬阻断后减弱FGF21对SAP大鼠胰腺及肺组织损伤的保护作用如图 5所示,与SAP组相比,SAP+FGF21组大鼠胰腺组织病理炎症损伤减轻;与SAP+FGF21组相比,SAP+FGF21+3-MA组可见在予以自噬抑制剂后大鼠胰腺组织炎症细胞浸润明显,大量腺泡细胞坏死。与SAP组相比,SAP+FGF21组大鼠肺组织病理炎症损伤减轻;与SAP+FGF21组相比,SAP+FGF21+3-MA组可见在予以自噬抑制剂后大鼠肺组织炎症细胞浸润及肺泡破损明显。通过病理损伤评分量化胰腺及肺损伤严重程度,SAP +FGF21组的胰腺及肺组织病理学评分明显低于SAP组;SAP+FGF21+3-MA组的胰腺及肺组织病理学评分明显高于SAP+FGF21组(P<0.001)。
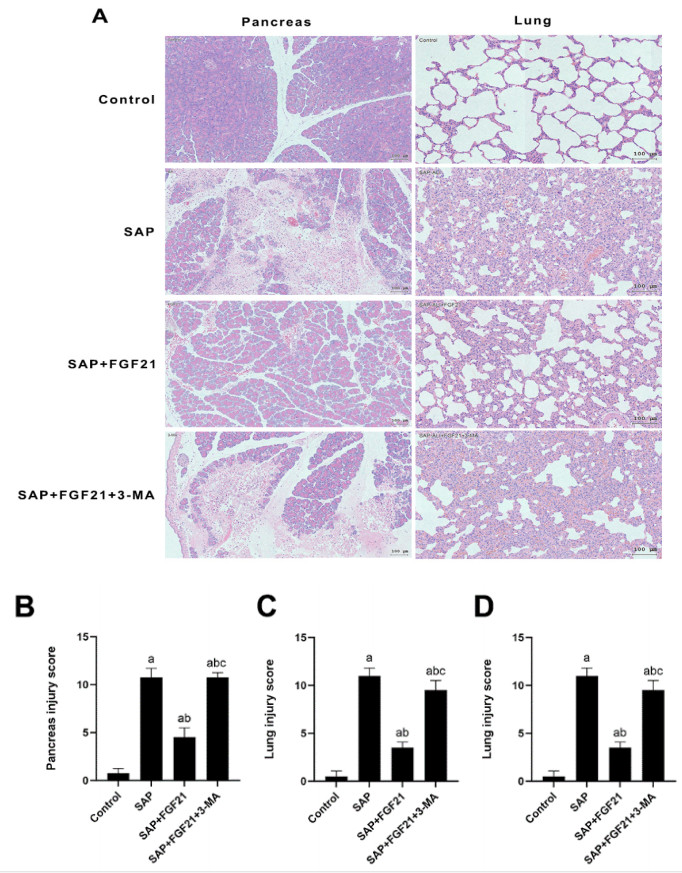
|
| 注:A为各组大鼠胰腺组织和肺组织HE染色(×200倍,比例尺100 μm);B为各组大鼠胰腺组织病理损伤评分;C为各组大鼠肺组织病理损伤评分;D为各组大鼠血浆TNF-α水平比较;SAP组与Control组相比,aP<0.001;SAP+FGF21组与SAP组相比,bP<0.001;SAP+FGF21+3-MA组与SAP+FGF21组相比,cP<0.001 图 5 3-MA抑制细胞自噬后减弱了FGF21对SAP大鼠胰腺及肺组织损伤的保护作用 Fig 5 Inhibition of autophagy by 3-MA attenuated the protective effect of FGF21 on pancreatic and lung tissue injury in SAP rats |
|
|
与SAP组相比,SAP+FGF21组大鼠血浆中的TNF-α水平明显下降[(280.10±49.36) pg/mL vs. (86.32±66.00) pg/mL,P<0.001];与SAP+FGF21组相比,SAP+FGF21+3-MA组在自噬水平下降的情况下大鼠血浆中的TNF-α水平明显上升[(86.32±66.00) pg/mL vs. (212.90±11.56) pg/mL,P<0.05]。
3 讨论本研究结果表明,FGF21可能通过抑制炎症反应、提高自噬水平,从而减轻了大鼠胰腺及肺组织病理损伤;而当自噬抑制剂3-MA阻断自噬后,FGF21的上述功能被削弱,所以FGF21对SAP-ALI的保护作用可能与激活并提升细胞自噬水平相关。
如前所述,FGF21是作用于由传统FGF受体FGFR1c和专性共受体组成的异聚细胞表面受体复合物。近些年研究证实,FGF21在多个靶器官中具有不同的代谢功能,如在脓毒症、脂肪的代谢、心肌炎、糖尿病、AP等多个疾病的发病机制中均发挥着重要的作用[15-18]。但关于FGF21治疗SAP-ALI研究尚未有报道,故根据已有的理论支持及实验证实,本研究假设FGF21对SAP-ALI有保护作用。
为证实这一假设,本研究采用主胰胆管内逆行注射3.5%牛黄胆酸钠的SAP传统造模方式,24 h后处死,采血、采取胰腺及肺组织,检测发现肺组织中FGF21的表达显著下降;肺组织可见肺间质水肿、大量肺泡塌陷、明显炎性细胞浸润、血清AMY、TNF-α显著升高,以上结果均可说明该造模方式可引起SAP-ALI。且发生SAP-ALI时,FGF21表达水平下降。而与模型组相比,经FGF21干预后,大鼠血清AMY、TNF-α明显下降,胰腺及肺组织病理损伤明显缓解。这些研究结果FGF21确实对SAP-ALI肺组织损伤具有保护作用,但其具体机制尚不明确。
自噬作为细胞内降解过程的重要部分,吞噬自身细胞质蛋白或细胞器并将其包被成囊泡,与溶酶体融合形成自噬溶酶体,并降解溶酶体内容物,从而满足细胞代谢需要和某些细胞器更新的过程,而关于自噬在SAP中作用机制的研究同样日益增多[19]。而ALI作为SAP最严重且最常见的并发症,约1/3的SAP患者会发展为ALI[20]。因此近些年关于自噬对SAP-ALI影响的研究同样受到关注。相关研究表明细菌移位可能会通过抑制自噬的发生从而加重SAP-ALI的炎症反应及组织损伤[21]。然而另外也有研究发现,抑制过度自噬能够减轻SAP-ALI中的炎症反应[22]。FGF21与自噬均与机体能量水平相关,因此FGF21对自噬过程同样具有调控作用。研究表明通过禁食能够诱导FGF21通过相关组蛋白的去甲基化上调自噬水平,加快脂肪降解[23]。而在脓毒症引起的肝损伤中,FGF21能够通过促进巨噬细胞的自噬从而抑制巨噬细胞极化从而抑制炎症反应[24]。研究表明FGF21能够通过抑制PI3K-AKT-mTOR信号通路上调自噬水平改善特发性肺纤维化[25]。此外FGF21对自噬的调控作用在肿瘤、皮肤损伤、神经性疾病等疾病中同样发挥着重要的作用[26-28]。因此推测FGF21对SAP-ALI的保护作用可能是通过调控自噬水平实现的。
本实验通过自噬相关蛋白的检测比较不同组间的自噬水平。结果表明,与Control组相比,SAP组肺组织中LC3Ⅱ/Ⅰ表达下调,P62蛋白表达上调,自噬溶酶体及自噬小体较少;与SAP组相比,SAP+FGF21组肺组织中LC3Ⅱ/Ⅰ表达上调,P62蛋白表达下调,可见较多自噬小体及自噬溶酶体。而当应用3-MA阻断自噬后,即使经FGF21干预使得肺组织FGF21水平升高,血清TNF-α水平并没有降低趋势,同时胰腺及肺组织病理损伤也没有得到明显改善。以上结果表明FGF21可能通过提高自噬水平对SAP-ALI起到保护作用。
但以上研究仅在动物模型中进行了初步的探讨,缺乏体外实验的证据,FGF21调节自噬的具体通路仍需进一步探索并研究。此外FGF21作为一种由肝脏分泌的激素,其如何从肝脏到达胰腺及肺组织发挥作用尚不清晰;而其作用靶点的位置也未进一步证实。
利益冲突 所有作者声明无利益冲突
作者贡献声明 曹成龙:实验操作、文章撰写;张玲、马向丽:数据统计分析、作图;刘世显、刘贻晶: 数据整理;李培武:实验设计、论文审阅
| [1] | van den Berg FF, Boermeester MA. Update on the management of acute pancreatitis[J]. Curr Opin Crit Care, 2023, 29(2): 145-151. DOI:10.1097/MCC.0000000000001017 |
| [2] | Heckler M, Hackert T, Hu K, et al. Severe acute pancreatitis: surgical indications and treatment[J]. Langenbecks Arch Surg, 2021, 406(3): 521-535. DOI:10.1007/s00423-020-01944-6 |
| [3] | Owusu L, Xu CM, Chen HL, et al. Gamma-enolase predicts lung damage in severe acute pancreatitis-induced acute lung injury[J]. J Mol Histol, 2018, 49(4): 347-356. DOI:10.1007/s10735-018-9774-3 |
| [4] | Menzies FM, Fleming A, Caricasole A, et al. Autophagy and neurodegeneration: pathogenic mechanisms and therapeutic opportunities[J]. Neuron, 2017, 93(5): 1015-1034. DOI:10.1016/j.neuron.2017.01.022 |
| [5] | Gukovsky I, Pandol SJ, Mareninova OA, et al. Impaired autophagy and organellar dysfunction in pancreatitis[J]. J Gastroenterol Hepatol, 2012, 27(Suppl 2): 27-32. DOI:10.1111/j.1440-1746.2011.07004.x |
| [6] | Chui ZSW, Shen Q, Xu AM. Current status and future perspectives of FGF21 analogues in clinical trials[J]. Trends Endocrinol Metab, 2024, 35(5): 371-384. DOI:10.1016/j.tem.2024.02.001 |
| [7] | Trusz GJ. Fibroblast growth factor 21[J]. Differentiation, 2024, 139: 100793. DOI:10.1016/j.diff.2024.100793 |
| [8] | Kim J, Lee S, Lee MS. Suppressive effect of autocrine FGF21 on autophagy-deficient hepatic tumorigenesis[J]. Front Oncol, 2022, 12: 832804. DOI:10.3389/fonc.2022.832804 |
| [9] | Chen FF, Zhan JY, Yan XQ, et al. FGF21 alleviates microvascular damage following limb ischemia/reperfusion injury by TFEB-mediated autophagy enhancement and anti-oxidative response[J]. Signal Transduct Target Ther, 2022, 7(1): 349. DOI:10.1038/s41392-022-01172-y |
| [10] | Chen L, Gao M, Ong SB, et al. Functions of FGF21 and its role in cardiac hypertrophy[J]. J Adv Res, 2025: S2090-1232(25)00148-1. DOI:10.1016/j.jare.2025.03.007 |
| [11] | Huang ZW, Li XZ, Yu DD, et al. Efferocytosis-inspired biomimetic nanoplatform for targeted acute lung injury therapy[J]. Adv Healthc Mater, 2024, 13(13): e2304304. DOI:10.1002/adhm.202304304 |
| [12] | 许春芳, 蒋文平, 蔡衍郎, 等. 牛胆酸钠诱导大鼠急性胰腺炎系列模型的研究[J]. 新消化病学杂志, 1995(3): 139-141. |
| [13] | Wildi S, Kleeff J, Mayerle J, et al. Suppression of transforming growth factor beta signalling aborts caerulein induced pancreatitis and eliminates restricted stimulation at high caerulein concentrations[J]. Gut, 2007, 56(5): 685-692. DOI:10.1136/gut.2006.105833 |
| [14] | Eltzschig HK, Bratton DL, Colgan SP. Targeting hypoxia signalling for the treatment of ischaemic and inflammatory diseases[J]. Nat Rev Drug Discov, 2014, 13(11): 852-869. DOI:10.1038/nrd4422 |
| [15] | Gariani K, Drifte G, Dunn-Siegrist I, et al. Increased FGF21 plasma levels in humans with sepsis and SIRS[J]. Endocr Connect, 2013, 2(3): 146-153. DOI:10.1530/EC-13-0040 |
| [16] | Gaich G, Chien JY, Fu HD, et al. The effects of LY2405319, an FGF21 analog, in obese human subjects with type 2 diabetes[J]. Cell Metab, 2013, 18(3): 333-340. DOI:10.1016/j.cmet.2013.08.005 |
| [17] | Struik D, Dommerholt MB, Jonker JW. Fibroblast growth factors in control of lipid metabolism: from biological function to clinical application[J]. Curr Opin Lipidol, 2019, 30(3): 235-243. DOI:10.1097/MOL.0000000000000599 |
| [18] | Fu ZJ, Wang ZX, Liu CH, et al. Fibroblast growth factor 21 protects photoreceptor function in type 1 diabetic mice[J]. Diabetes, 2018, 67(5): 974-985. DOI:10.2337/db17-0830 |
| [19] | Ding WX, Ma XW, Kim S, et al. Recent insights about autophagy in pancreatitis[J]. eGastroenterology, 2024, 2(2): e100057. DOI:10.1136/egastro-2023-100057 |
| [20] | Pastor CM, Matthay MA, Frossard JL. Pancreatitis-associated acute lung injury: new insights[J]. Chest, 2003, 124(6): 2341-2351. DOI:10.1378/chest.124.6.2341 |
| [21] | Wang HL, Li C, Jiang YJ, et al. Effects of bacterial translocation and autophagy on acute lung injury induced by severe acute pancreatitis[J]. Gastroenterol Res Pract, 2020, 2020: 8953453. DOI:10.1155/2020/8953453 |
| [22] | Kong LM, Deng J, Zhou X, et al. Sitagliptin activates the p62-Keap1-Nrf2 signalling pathway to alleviate oxidative stress and excessive autophagy in severe acute pancreatitis-related acute lung injury[J]. Cell Death Dis, 2021, 12(10): 928. DOI:10.1038/s41419-021-04227-0 |
| [23] | Byun S, Seok S, Kim YC, et al. Fasting-induced FGF21 signaling activates hepatic autophagy and lipid degradation via JMJD3 histone demethylase[J]. Nat Commun, 2020, 11(1): 807. DOI:10.1038/s41467-020-14384-z |
| [24] | Zhu JJ, Jin ZX, Wang J, et al. FGF21 ameliorates septic liver injury by restraining proinflammatory macrophages activation through the autophagy/HIF-1α axis[J]. J Adv Res, 2025, 69: 477-494. DOI:10.1016/j.jare.2024.04.004 |
| [25] | Qi JY, Wu YY, Guo ZM, et al. Fibroblast growth factor 21 alleviates idiopathic pulmonary fibrosis by inhibiting PI3K-AKT-mTOR signaling and stimulating autophagy[J]. Int J Biol Macromol, 2024, 273(Pt 1): 132896. DOI:10.1016/j.ijbiomac.2024.132896 |
| [26] | Dai H, Hu WJ, Zhang LY, et al. FGF21 facilitates autophagy in prostate cancer cells by inhibiting the PI3K-Akt-mTOR signaling pathway[J]. Cell Death Dis, 2021, 12(4): 303. DOI:10.1038/s41419-021-03588-w |
| [27] | Shen W, Yang MD, Chen H, et al. FGF21-mediated autophagy: Remodeling the homeostasis in response to stress in liver diseases[J]. Genes Dis, 2024, 11(3): 101027. DOI:10.1016/j.gendis.2023.05.019 |
| [28] | Ma Y, Liu ZQ, Deng LL, et al. FGF21 attenuates neuroinflammation following subarachnoid hemorrhage through promoting mitophagy and inhibiting the cGAS-STING pathway[J]. J Transl Med, 2024, 22(1): 436. DOI:10.1186/s12967-024-05239-y |
 2025, Vol. 34
2025, Vol. 34




