脓毒症是感染导致宿主反应失调,进而发生危及生命的器官功能障碍,是一种极其严重的临床症候群[1]。脓毒症患者往往存在不同程度的凝血功能障碍,早期大多呈高凝状态,弥漫性微血管内血栓形成可导致微循环障碍,组织缺血缺氧,进而发生多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS),因此凝血活化是脓毒症发展成MODS的始动因素[2]。
近年研究表明损伤相关分子模式(damage-associated molecular pattern, DAMP)在脓毒症凝血活化过程中起关键性作用,尤其是组蛋白作为一种重要的DAMP分子,受到广泛关注。组蛋白是所有真核生物都表达的结构性蛋白,正常情况下,细胞外组蛋白浓度很低,然而当发生细胞坏死和凋亡时,细胞外组蛋白浓度明显增高[3],组蛋白是脓毒症发生和发展过程中的重要介质之一[4]。血管生成素(angiopoietin, Ang)是一类内皮特异性促血管新生因子家族。Ang与其受体酪氨酸激酶受体2(tyrosine kinase receptor 2, Tie2)结合,在调节血管稳态、血管生成以及炎症反应中发挥重要作用[5]。普通肝素(unfractionated heparin, UFH)不仅有抗凝作用,还可以通过降低血管通透性、保护内皮细胞以及减轻炎症反应等对机体发挥保护作用[6],但具体作用机制仍未十分清楚。因此,本研究的目的在于探讨组蛋白对凝血功能的影响以及Ang/Tie2信号轴的参与,并深入研究UFH的保护作用及其机制,为脓毒症治疗提供更科学的理论依据。
1 材料与方法 1.1 实验动物选用24只8~12周龄的雄性C57BL/6小鼠,按照12 h昼夜节律,予以正常饮食适应性喂养3~7 d。小鼠均采购于长生生物技术有限公司,饲养于动物中心,符合国际动物伦理道德准则和行为规范,经伦理委员会批准(伦理审批号:2022-57-2),并遵守动物饲养规定。
1.2 实验材料组蛋白购自德国Merck公司;免疫组化试剂盒购自中国福建福州迈新生物技术开发有限公司;ELISA试剂盒均购自中国上海酶联生物科技有限公司;PCR引物购自中国武汉赛维尔科技有限公司;Steady pure通用型RNA提取试剂盒、Evo M-MLV反转录试剂预混液、荧光定量qPCR试剂盒均购自中国湖南艾科瑞生物工程有限公司;RIPA裂解液、蛋白酶抑制剂、磷酸酶抑制剂、BCA定量试剂盒均采购于中国上海碧云天生物技术股份有限公司;配胶试剂盒购自中国武汉赛维尔生物科技有限公司;Marker购自北京兰杰柯科技有限公司旗下品牌biosharp;PVDF膜购自德国Merck公司;兔抗3-磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)抗体购自中国武汉赛维尔生物科技有限公司;山羊抗Ang-1抗体购自美国R & DSystem公司;兔抗Ang-2抗体、兔抗pTie2抗体、兔抗纤维蛋白原(fibrinogen, FIB)抗体、兔抗组织因子(tissue factor, TF)抗体均购自美国Abcam公司;HRP山羊抗兔二抗购自中国武汉赛维尔生物科技有限公司。实验仪器包括数字切片扫描仪(中国山东志盈医学科技有限公司),酶标仪(美国BioTeck公司),逆转录仪、荧光定量PCR仪(美国Thermo Scientific公司),化学发光成像仪(中国上海天能科技有限公司)。
1.3 分组及干预措施24只小鼠按随机数字法分为对照组(Control组)、组蛋白组(Histone组)、组蛋白+UFH组(Histone+UFH组),每组8只,Histone组及Histone+UFH组均予以尾静脉注射组蛋白50 mg/kg,1 h后Histone+UFH组再予以尾静脉注射UFH 400 U/kg,Control组均予等体积生理盐水。组蛋白及UFH的给药剂量参照文献调研及先前研究结果[7-8]。造模4 h后取材,采用2%异氟烷深度麻醉,消毒后逐层开腹,剪开膈肌暴露心脏下缘,心尖穿刺收集血液样本,血液离心后取血浆用于ELISA。采用心脏灌流后取肺组织。
1.4 肺组织病理学观察新鲜肺组织于4%多聚甲醛固定24 h,经脱水、透明、浸蜡和包埋制成石蜡块,石蜡切片制成3 μm切片,行HE染色,予中性树胶封片。光镜下观察急性肺损伤的严重程度,并根据Smith评分准则进行评分[9]。
1.5 肺湿干比及肺水含量百分比取新鲜肺组织,称量肺叶重量即为湿重,将其烘干72 h后肺叶重量即为干重。计算肺湿/干比及肺水含量百分比评价肺水肿的严重程度:湿/干=湿重/干重;肺水含量百分比=(湿重–干重)/湿重×100%。
1.6 免疫组织化学将石蜡切片制成5 μm切片,经脱蜡、水化、抗原修复、50 μL 10%山羊血清常温封闭,加入兔抗FIB抗体(以1∶4 000稀释)孵育过夜。TBST清洗3次后再加入生物素标记的羊抗小鼠/兔二抗原液室温孵育20 min,DAB显色、复染细胞核、脱水透明,最后镜下观察肺FIB的表达情况。
1.7 ELISA检测将小鼠血液置于4 ℃离心机下3 000 r/min离心20 min,收集上清液,实验按照ELISA试剂盒指示操作,使用酶标仪在450 mm波长处读取各孔OD值,根据标准曲线计算样品在血浆中的浓度。
1.8 qRT-PCR检测按照Trizol试剂盒说明书提取RNA,进行RNA纯度鉴定,按反转录试剂说明书将所提RNA反转录成cDNA。运用PCR扩增仪进行qRT-PCR反应,反应条件为:预变性95 ℃ 30 s,变性95 ℃ 5 s,退热60 ℃30s循环40次,最终得到各孔的CT值,用2-ΔΔCT计算mRNA的相对表达量。选用GAPDH作为内参,引物设计由武汉赛维尔科技有限公司完成,引物序列见表 1。
| 指标 | 引物序列 |
| GAPDH | 正向:5’- GGTTGTCTCCTGCGACTTCA-3’ |
| 反向:5’- TGGTCCAGGGTTTCTTACTCC-3’ | |
| TF | 正向:5’- TACCTTACCGAGACACAAACCT-3’ |
| 反向:5’- CTTTCCCGTGCTTGAGCCTT-3’ | |
| FIB | 正向:5’- GTACGTGGCCCAACAGTTGT-3’ |
| 反向:5’- AAGGGCATTTGTGGTTCCAGT-3’ | |
| PAI-1 | 正向:5’- GGCCTCCAAAGACCGGAAT-3’ |
| 反向:5’- ACAAAGATGGCATCCGCAGTA-3’ | |
| Ang-1 | 正向:5’- GAAGATGGAAGCCTGGATT-3’ |
| 反向:5’- TACTGCCTCTGACTGGTTA-3’ | |
| Tie2 | 正向:5’- AATGGCTCCTTCATCCACTCAG-3’ |
| 反向:5’- GCTTCACATCTCCGAACAATCA-3’ | |
| Ang-2 | 正向:5’- CAACAACTCGCTCCTTCA-3’ |
| 反向:5’- CCACACTGCCATCTTCTC-3’ | |
| 注:GAPDH为甘油醛-3-磷酸脱氢酶,TF为组织因子,FIB为纤维蛋白原,PAI-1为纤溶酶原激活物抑制剂-1,Ang为血管生成素,Tie2为酪氨酸激酶受体2 | |
使用RIPA裂解液分解组织获组织蛋白,BCA法测定蛋白浓度。将蛋白加热变性后,将等量的蛋白加到十二烷基硫酸钠-聚丙烯酰胺凝胶上,恒压使蛋白电泳分离。恒流将胶上的蛋白转移至聚偏二氟乙烯(polyvinyl-idene fluoride, PVDF)膜上,室温下用5%脱脂牛奶室温封闭2 h。加入Ⅰ抗(以1∶1 000稀释),4℃孵育过夜。TBST洗膜3次,加入HRP标记的二抗(以1∶500稀释)室温孵育2 h。再次TBST洗膜后,ECL化学液显示PVDF膜上的蛋白带。使用Image J软件分析蛋白表达量。
1.10 统计学方法采用SPSS 26.0软件进行数据的统计学分析。所有的数据均需符合正态分布,通过均数±标准差(x±s)进行结果描述。采用单因素方差分析进行单因素多组样本比较,并进一步使用LSD-t检验进行组间两两比较。以P<0.05为差异有统计学意义。
2 结果 2.1 UFH对组蛋白诱导的肺损伤的影响为评价小鼠肺损伤程度,HE染色后光镜下观察肺组织病理生理学改变:Control组肺泡结构清晰完整,无炎症细胞浸润,无充血和水肿;Histone组肺泡大小不一、结构紊乱,肺泡内充血、水肿,肺泡壁增厚,肺泡内见纤维蛋白沉积,与对照组相比,肺组织病理学评分显著升高(P<0.001);Histone+UFH组结构完整,肺泡壁少量炎性细胞浸润,局部肺泡间隔增厚,与组蛋白组相比,肺组织病理学评分显著降低(P<0.001)(图 1)。HE染色结果提示组蛋白能导致小鼠发生明显的急性肺损伤,而UFH能有效减轻组蛋白造成的肺损伤。
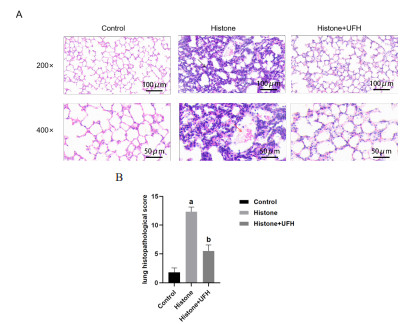
|
| 注:A为各组HE染色结果图,黑色箭头为肺泡壁炎性细胞浸润,红色箭头为纤维蛋白沉积;B为病理学评分比较;每组n=8,Histone组与Control组相比,aP<0.001;Histone组与Histone+UFH组相比,bP<0.001 图 1 各组肺组织病理学改变及病理学评分 Fig 1 Pathological changes and pathological scores of lung tissues in each group |
|
|
为检测肺水肿程度,称量肺湿重及干重并计算湿重/干重及肺水含量百分比,结果提示,Histone组肺的湿重/干重及肺水含量百分比较Control组明显增高[湿重/干重:(6.95±0.41) vs. (4.08±0.51),P<0.001],证明组蛋白导致小鼠发生肺水肿;而Histone+UFH组肺的湿重/干重及肺水含量百分比较Histone组有所下降[湿重/干重:(5.00±0.15) vs. (6.95±0.41),P<0.01],说明UFH减轻肺水肿严重程度。见图 2。
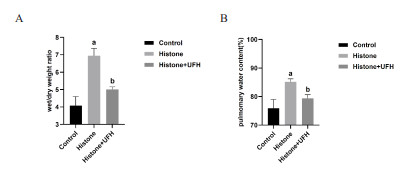
|
| 注:A为各组肺湿重/干重;B为各组肺水含量百分比;每组n=8,Histone组与Control组相比,aP<0.001;Histone组与Histone+UFH组相比,bP<0.01 图 2 各组小鼠肺湿重/干重及肺水含量比较 Fig 2 Comparison of lung wet weight/dry weight ratios and lung water content among groups of mice |
|
|
采用免疫组织化学测量肺组织FIB的表达情况,Histone组见血管内血栓形成,肺泡及微血管内见褐色纤维蛋白原沉积,UFH干预后纤维蛋白原表达减少,无血栓形成,这说明UFH减轻组蛋白造成的凝血活化。见图 3。

|
| 注:各组免疫组化染色结果图,黑色箭头为纤维蛋白原沉积 图 3 各组纤维蛋白原表达 Fig 3 Expression of pulmonary fibrinogen in mice in each group |
|
|
TAT反应体内凝血酶的生成,PAI-1及D-D反应纤溶情况。测量小鼠血浆TAT、PAI-1、D-D表达水平,结果提示,与Control组比较,Histone组小鼠血浆中TAT、PAI-1、D-D表达水平明显升高[(23.48±3.97) pg/mL vs. (51.98±5.52) pg/mL,(68.75±3.68) pg/mL vs. (118.50±11.23) pg/mL,(775.30±314.80) pg/mL vs. (1 179.00±149.70) pg/mL;均P<0.001],证明组蛋白诱导凝血活化,纤溶发生抑制。而Histone+UFH组与Histone组比较,小鼠血浆中TAT、PAI-1、D-D表达水平有所下降[(38.20±8.23) pg/mL vs. (51.98±5.52) pg/mL,(90.15±8.08) pg/mL vs. (118.50±11.23) pg/mL,(892.20±63.91) pg/mL vs. (1 179.00±149.70) pg/mL;均P<0.05],见图 4,说明UFH减轻组蛋白诱导的凝血活化。
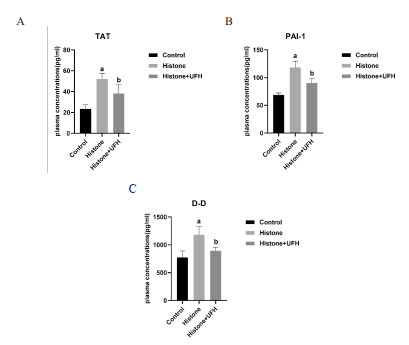
|
| 注:A为TAT血浆浓度;B为PAI-1血浆浓度;C为D-D血浆浓度;每组n=8,Histone组与Control组相比,aP<0.001;Histone组与Histone+UFH组相比,bP<0.05 图 4 小鼠血浆TAT、PAI-1、D-D浓度 Fig 4 Concentrations of TAT, PAI-1, and D-D in the plasma of mice in each group |
|
|
上述研究已经证实组蛋白可以造成肺组织急性肺损伤、凝血活化,为进一步证实组蛋白对肺组织凝血活化影响的机制,通过qRT-PCR检测小鼠肺组织各指标的mRNA表达水平。结果显示,与Control组比较,Histone组TF、FIB、PAI-1的mRNA表达水平较高[(1.00±0.01) vs. (11.61±0.24),(1.01±0.18) vs. (77.14±13.69),(1.00±0.11) vs. (48.98±1.81);均P<0.0001],UFH治疗后TF、FIB、PAI-1的mRNA表达水平明显下降,[(3.01±0.09) vs. (11.61±0.24),(32.41±3.19) vs. (77.14±13.69),(35.57±4.00) vs. (48.98±1.81),均P<0.01],见图 5A~C,进一步说明了组蛋白造成了小鼠肺组织的凝血活化,UFH有效缓解这种改变。与Control组比较,Histone组Ang-1、Tie2的mRNA表达水平明显下降[(1.00±0.04) vs. (0.09±0.01),(1.17±0.04) vs. (0.22±0.02),均P<0.001],见图 5D~E,Ang-2的mRNA表达水平升高[(1±0.04) vs. (1.61±0.05),P<0.001],见图 5F,而UFH减少组蛋白导致的各指标表达的影响,说明组蛋白诱导的凝血活化可能与Ang/Tie2信号通路相关,而UFH对小鼠的保护作用可能是通过Ang/Tie2信号轴实现的。
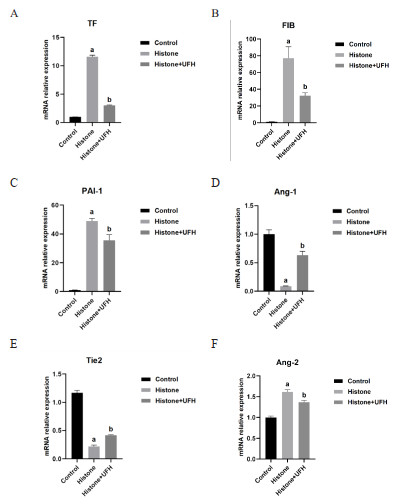
|
| 注:每组n=8,Histone组与Control组相比,aP<0.001;Histone组与Histone+UFH组相比,bP<0.01 图 5 小鼠肺组织各指标mRNA相对表达量 Fig 5 Relative mRNA expression levels of each parameterin the lung tissues of mice in each group |
|
|
为进一证实组蛋白对小鼠凝血功能的影响及作用机制,采用Western blot检测肺组织TF、FIB、Ang-1、Ang-2、pTie2蛋白表达水平。与Control组比较,Histone组肺组织TF、FIB、Ang-2的蛋白表达水平增加[(0.44±0.10) vs. (0.86±0.08),1 vs. (3.56±0.57),1 vs. (1.53±0.07),均P<0.01],见图 6 A~C。而Ang-1、pTie2的蛋白表达水平明显减少[1 vs. (0.41±0.15),1 vs. (0.52±0.14),均P<0.01],见图 6 D~E,UFH有效减轻这种改变,与mRNA的表达水平变化一致,进一步说明组蛋白诱导的凝血活化可能跟与Ang/Tie2信号通路相关,而UFH对小鼠的保护作用可能是通过Ang/Tie2信号轴实现的。
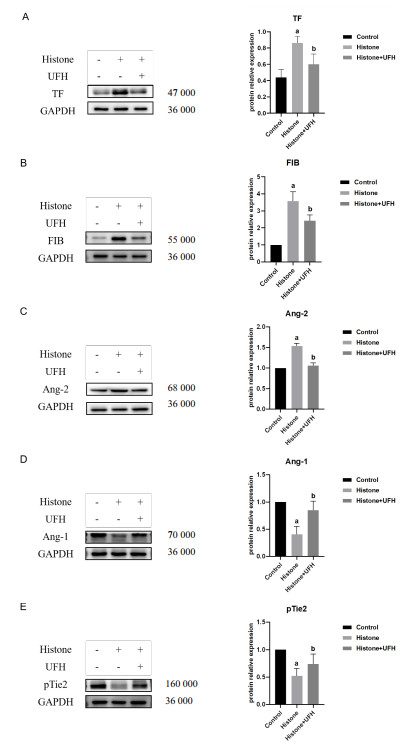
|
| 注:n=8,Histone组与Control组相比,aP<0.01;Histone组与Histone + UFH组相比,bP<0.05 图 6 各指标的蛋白条带及蛋白相对表达量 Fig 6 Protein bands and relative expression levels of each parameter |
|
|
基于组蛋白是脓毒症的发生和发展的重要介质之一[4, 10-11],本实验通过尾静脉注射组蛋白,发现组蛋白造成小鼠急性肺损伤及凝血活化,而UFH能有效缓解这种改变。同时,组蛋白还影响Ang及Tie2 mRNA及蛋白表达,提示组蛋白可能通过Ang/Tie2通路发挥毒性作用,UFH可能通过Ang/Tie2信号轴减轻组蛋白造成的肺损伤和凝血活化。
脓毒症患者往往存在不同程度的凝血功能障碍,严重时进展为DIC,弥漫性微血管内血栓形成可导致微循环障碍,组织缺血缺氧,进而发生MODS[2]。越来越多的证据表明,细胞外组蛋白与凝血的发生有着密切的联系[12-14]。循环H3水平与脓毒症患者的病死率相关、与抗凝血酶水平呈负相关[15];H3是确定脓毒症患者高死亡风险凝血障碍的潜在标志物[16]。本实验通过小鼠尾静脉注射组蛋白,结果显示组蛋白造成小鼠肺损伤,表现为肺水肿、炎性细胞浸润、肺泡结构破坏。此外,免疫组织化学结果发现,Histone组肺泡内及微血管内FIB的表达增高,部分血管出现内皮下纤维蛋白原沉积、管腔内有血栓形成。同时,ELISA、qRT-PCR、Western blot显示血浆和组织中凝血标志物水平升高,均证明组蛋白诱导小鼠凝血活化、血栓形成。而Histone+UFH组,组蛋白诱导的改变明显改善,说明UFH可以减轻组蛋白诱导的肺损伤和凝血活化。
内皮细胞的功能障碍是脓毒症发生DIC的重要机制。Ang/Tie2作为稳定新生内皮血管的信号轴,参与调节内皮细胞功能,其信号轴标志物的变化是脓毒症凝血功能障碍的发生的早期事件[17]。Ang是Tie2的配体,Ang-1与Tie2受体结合使其发生磷酸化,血管处于静止状态[18]。机体感染时,从内皮细胞储存的Ang-2可以竞争性地抑制Ang-1与Tie2的结合,使Tie2受体处于去磷酸化状态,并扰乱内皮细胞的稳定[19-20]。在LPS造模的脓毒症小鼠中,Ang-1可以使内皮细胞处于静止状态,从而减轻脓毒症诱导的急性肺损伤[21];Ang-2在COVID-19相关高凝状态中起着重要作用,Ang-2抑制剂可能有效缓解严重COVID-19感染导致的高凝状态[22]。本实验结果显示,组蛋白诱导Ang/Tie2轴的改变,表现为组蛋白组Ang-2的mRNA和蛋白表达水平升高,而维持内皮稳定因子Ang-1和pTie2的表达有所减少,这表明组蛋白可能通过影响Ang/Tie2通路,破坏内皮细胞的完整性使得血管通透性增加,促进凝血活化和血栓形成。
UFH作为一种抗凝剂在临床上广泛应用。研究发现UFH除了有抗凝作用外,还可以通过与肝素结合蛋白结合、作用于NF-κB、参与选择素介导的粘附反应等发挥抗炎作用[23]。本实验采用组蛋白造模后1 h,再予以UFH治疗,相比于既往实验方式来看,更符合临床实际。结果显示,UFH有效减轻组蛋白造成的肺损伤和凝血活化,同时UFH减轻组蛋白造成的Ang-1、pTie2 mRNA和蛋白表达水平下调和Ang-2 mRNA和蛋白表达水平上调。提示UFH对组蛋白造成的毒性作用具有保护作用,这种保护作用可能是通过Ang/Tie2通路发挥的作用。
本研究仍存在一定的局限性:首先,UFH减轻组蛋白的毒性作用及Ang/Tie2通路的参与,没有加用抑制剂或激动剂干扰进一步证实;其次,Ang/Tie2通路对血管内皮细胞功能的调节作用,以及组蛋白活化凝血后对其他器官功能的影响,仍需后续进一步深入研究。
综上所述,本实验证明了组蛋白造成小鼠肺损伤、肺水肿和凝血活化,UFH可能通过Ang/Tie2信号轴减轻组蛋白造成的肺损伤和凝血活化。
利益冲突 所有作者声明无利益冲突
作者贡献声明 刘丹燕:实验设计、实验操作、数据分析、论文撰写;迟雅文:研究设计、论文修改;迟雅文、尹佳:实验操作、数据收集及整理;李旭:实验设计、论文修改、支持性贡献
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Silk E, Zhao HL, Weng H, et al. The role of extracellular histone in organ injury[J]. Cell Death Dis, 2017, 8(5): e2812. DOI:10.1038/cddis.2017.52 |
| [3] | de Jong PR, González-Navajas JM, Jansen NJG. The digestive tract as the origin of systemic inflammation[J]. Crit Care, 2016, 20(1): 279. DOI:10.1186/s13054-016-1458-3 |
| [4] | Xu J, Zhang XM, Pelayo R, et al. Extracellular histones are major mediators of death in sepsis[J]. Nat Med, 2009, 15(11): 1318-1321. DOI:10.1038/nm.2053 |
| [5] | Fiedler U, Augustin HG. Angiopoietins: a link between angiogenesis and inflammation[J]. Trends Immunol, 2006, 27(12): 552-558. DOI:10.1016/j.it.2006.10.004 |
| [6] | Wang PP, Chi LL, Zhang ZQ, et al. Heparin: an old drug for new clinical applications[J]. Carbohydr Polym, 2022, 295: 119818. DOI:10.1016/j.carbpol.2022.119818 |
| [7] | Li L, Yu SH, Fu SF, et al. Unfractionated heparin inhibits histone-mediated coagulation activation and thrombosis in mice[J]. Thromb Res, 2020, 193: 122-129. DOI:10.1016/j.thromres.2020.06.007 |
| [8] | Fu SF, Yu SH, Zhao YL, et al. Unfractionated heparin attenuated histone-induced pulmonary syndecan-1 degradation in mice: a preliminary study on the roles of heparinase pathway[J]. Inflammation, 2022, 45(2): 712-724. DOI:10.1007/s10753-021-01578-w |
| [9] | Matute-Bello G, Downey G, Moore BB, et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals[J]. Am J Respir Cell Mol Biol, 2011, 44(5): 725-738. DOI:10.1165/rcmb.2009-0210ST |
| [10] | Zhang XJ, Li X. The role of histones and heparin in sepsis: a review[J]. J Intensive Care Med, 2022, 37(3): 319-326. DOI:10.1177/0885066621992320 |
| [11] | Li YP, Wan DY, Luo XY, et al. Circulating histones in sepsis: potential outcome predictors and therapeutic targets[J]. Front Immunol, 2021, 12: 650184. DOI:10.3389/fimmu.2021.650184 |
| [12] | Giglio RV, Ligi D, Della Franca C, et al. Thrombocytopenia and hyperinflammation are induced by extracellular histones circulating in blood[J]. Clin Chem Lab Med, 2023, 61(12): e239-e243. DOI:10.1515/cclm-2023-0590 |
| [13] | Zhang Y, Wu CQ, Li L, et al. Extracellular histones trigger disseminated intravascular coagulation by lytic cell death[J]. Int J Mol Sci, 2022, 23(12): 6800. DOI:10.3390/ijms23126800 |
| [14] | Locke M, Longstaff C. Extracellular histones inhibit fibrinolysis through noncovalent and covalent interactions with fibrin[J]. Thromb Haemost, 2021, 121(4): 464-476. DOI:10.1055/s-0040-1718760 |
| [15] | Wildhagen KCAA, Wiewel MA, Schultz MJ, et al. Extracellular histone H3 levels are inversely correlated with antithrombin levels and platelet counts and are associated with mortality in sepsis patients[J]. Thromb Res, 2015, 136(3): 542-547. DOI:10.1016/j.thromres.2015.06.035 |
| [16] | Ito T, Totoki T, Yokoyama Y, et al. Serum histone H3 levels and platelet counts are potential markers for coagulopathy with high risk of death in septic patients: a single-center observational study[J]. J Intensive Care, 2019, 7: 63. DOI:10.1186/s40560-019-0420-2 |
| [17] | Higgins SJ, De Ceunynck K, Kellum JA, et al. Tie2 protects the vasculature against thrombus formation in systemic inflammation[J]. J Clin Invest, 2018, 128(4): 1471-1484. DOI:10.1172/JCI97488 |
| [18] | Brindle NPJ, Saharinen P, Alitalo K. Signaling and functions of angiopoietin-1 in vascular protection[J]. Circ Res, 2006, 98(8): 1014-1023. DOI:10.1161/01.RES.0000218275.54089.12 |
| [19] | Scharpfenecker M, Fiedler U, Reiss Y, et al. The Tie-2 ligand angiopoietin-2 destabilizes quiescent endothelium through an internal autocrine loop mechanism[J]. J Cell Sci, 2005, 118(Pt 4): 771-780. DOI:10.1242/jcs.01653 |
| [20] | Kim M, Allen B, Korhonen EA, et al. Opposing actions of angiopoietin-2 on Tie2 signaling and FOXO1 activation[J]. J Clin Invest, 2016, 126(9): 3511-3525. DOI:10.1172/JCI84871 |
| [21] | Salimi U, Menden HL, Mabry SM, et al. Angiopoietin-1 protects against endotoxin-induced neonatal lung injury and alveolar simplification in mice[J]. Pediatr Res, 2022, 91(6): 1405-1415. DOI:10.1038/s41390-021-01544-0 |
| [22] | Hultström M, Fromell K, Larsson A, et al. Angiopoietin-2 inhibition of thrombomodulin-mediated anticoagulation-a novel mechanism that may contribute to hypercoagulation in critically ill COVID-19 patients[J]. Biomedicines, 2022, 10(6): 1333. DOI:10.3390/biomedicines10061333 |
| [23] | Yu SH, Chi YW, Ma XC, et al. Heparin in sepsis: current clinical findings and possible mechanisms[J]. Front Immunol, 2024, 15: 1495260. DOI:10.3389/fimmu.2024.1495260 |
 2025, Vol. 34
2025, Vol. 34




