2. 福建省急诊医学重点实验室,福州 350001;
3. 晋江市医院晋南分院急诊内科,晋江 362200
2. Fujian Provincial Key Laboratory of Emergency Medicine, Fuzhou 350001, China;
3. Department of Emergency, Jinjiang Municipal Hospital Jinnan Branch, Jinjiang 362200, China
急性肺损伤(acute lung injury,ALI)是一种由各种致病因素包括感染、中毒、射线和化学物质直接损伤肺组织,或由其他器官和(或)全身性疾病如急性重症胰腺炎、自身免疫性病、脓毒症等累及肺部所致的临床综合征[1]。特点是出现弥漫性肺泡上皮细胞损伤、透明膜形成、肺泡腔内渗出,导致肺水肿、顺应性下降、通气/血流比例失调、进行性低氧血症,严重者出现急性呼吸窘迫综合征,最终因进行性低氧血症而死亡[1-2]。ALI患者约占全球重症监护病房入院总数的10%,造成严重的社会经济负担,是推进健康中国建设亟待解决的重要健康问题[3]。ALI的病理生理机制异常复杂,目前尚未完全阐明,涉及炎症、氧化应激、免疫功能失调等多个方面,临床上尚缺乏“特效药”,主要采取呼吸支持、糖皮质激素抗炎、免疫调节等措施,但这些措施不仅疗效有限、费用高昂,且会出现呼吸机相关性肺炎、机会性感染、消化性溃疡等一系列并发症[1-3]。近年来,多种中药复方制剂如宣白承气汤、玉屏风散等在动物模型上均显示出对ALI的治疗作用,相比于西药,中药复方制剂具有取材方便、经济、不良反应小等诸多优点,用于治疗ALI具有广阔前景[4-5]。
参苏饮(Shen-su-yin,SSY)出自宋代的《太平惠民和剂局方》,由人参、紫苏叶、葛根等13味中药组成,具有宣肺化痰、益气解表、理气通腑之功效,用于治疗普通感冒、支气管炎等呼吸系统疾病具有悠久历史[6-7];现代医学研究显示其具有抗炎、抗过敏、抗哮喘、免疫调节等多种药理学活性[6-8]。
综合考虑ALI的发病机制和SSY的药理特点,我们有理由推断SSY能够改善ALI的疾病状态;但迄今为止,SSY对ALI的作用及机制却鲜有报道。基于此,本研究拟运用超高效液相色谱-四极杆-静电场轨道阱质谱对SSY进行非靶向代谢组学分析,结合网络药理学和实验验证探索SSY对ALI的作用及机制,为中医药治疗ALI开拓新思路。
1 材料与方法 1.1 实验仪器Q Exactive Focus高分辨质谱仪(配有Xcalibur控制软件)、Vanquish超高效液相色谱仪和Heraeus Fresco17离心机均购自美国Thermo Fisher Scientific公司;ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7μm)色谱柱购自美国Waters公司。KH-TS脱水机和KH-BL包埋机均购自湖北孝感阔海医疗科技有限公司;RM-2235切片机和DMi8倒置荧光显微镜均购自德国Leica公司。iMark酶标仪、PowerPacTM Basic电泳仪和Gel Doc XR+凝胶成像系统均购自美国Bio-Rad公司。BSA124S-CW天平购自德国Sartorius公司。JXFSTPRP-24研磨仪购自上海净信科技有限公司。
1.2 中药与试剂13味中药均由本院中药房提供并由本院专职中药师鉴定。甲醇(CNW Technologies,德国);乙腈(CNW Technologies,德国);甲酸(Sigma-Aldrich,美国);L-2-氯苯丙氨酸(内标)(纯度≥98%;上海恒柏生物科技有限公司)。脂多糖(lipopolysaccharide,LPS)(Sigma-Aldrich,美国);醋酸地塞米松(Dexamethasone,DXM)片(国药准字H37021898,济宁市辰欣药业股份有限公司);Wright–Giemsa染色试剂盒(南京建成生物工程研究所有限公司)。酶联免疫吸附试验试剂盒[肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1β和IL-6]购自美国abcam公司;8-羟基-2-脱氧鸟苷(8-hydroxy-2-deoxyguanosine,8-OHdG)、丙二醛(malondialdehyde,MDA)、蛋白质羰基(protein carbonyl,PC)和总抗氧化能力(total antioxidant capacity,TAOC)检测试剂盒均购自美国abcam公司;抗-蛋白激酶B(protein kinase B,AKT)1和抗-p-AKT1(Ser473)抗体均购自美国abcam公司。抗-磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)p85α和抗-p-PI3K p85α(Tyr607)抗体均购自溧阳Affinity Biosciences公司。抗-糖原合成酶激酶(glycogen synthase kinase,GSK)3β、抗-p-GSK3β(Ser9)、抗-核转录因子红系2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)、抗-IκBα、抗-p-IκBα(Ser32)、抗-核因子(nuclear factor,NF)-κB p65和抗-p-NF-κB p65(Ser536)抗体均购自美国Cell Signaling Technology公司。抗-β-Actin(Santa Cruz Biotechnology,美国);蛋白浓度测定试剂盒(二喹啉甲酸检测法)(Thermo Fisher Scientific,美国);辣根过氧化物酶标记的山羊抗小鼠IgG和山羊抗兔IgG均购自厦门泰京生物技术有限公司。
1.3 实验动物48只6周龄Sprague-Dawley大鼠,体重190~230 g,购自北京斯贝福生物技术有限公司,实验动物生产许可证号:SCXK(京)2019-0010,饲养于本院动物房,研究经本院实验动物福利伦理委员会审查通过,批号:IACUC-FPH-PZ-20231008[0007]。
1.4 制备SSY根据《太平惠民和剂局方》中原方比例配齐中药饮片(见附表1),清洗、剁碎、混合、浸泡后水煎(100℃,30 min)两次合并煎液,过滤后将滤液蒸发浓缩至相当于5.0 g生药材/mL SSY。
1.5 基于超高效液相色谱-四极杆-静电场轨道阱质谱技术的非靶向代谢组学分析 1.5.1 代谢物提取制备SSY冻干样本后将其研粉;称取100 mg研粉,加入500 μL提取液(甲醇: 水=4:1,内标浓度:10 μg/mL);涡旋(30 s)、匀浆(45 Hz,4 min)、冰水浴超声(1 h)、静置(-40℃,1 h)后离心(4℃,13 800×g,15 min);吸取上清液经微孔滤膜(0.22 μm)过滤后-80℃冻存备用。
1.5.2 超高效液相色谱-四极杆-静电场轨道阱质谱检测与分析(1)色谱条件流动相:A(水):B(乙腈),A相和B相均含0.1%甲酸。梯度洗脱(见附表2);进样体积:5 μL;柱温:40℃;进样室温度:4℃。
(2)质谱条件离子源为电喷雾电离,正负离子模式交替扫描,质量范围:100-1500,质谱分辨率:70000,二级质谱分辨率:17500,裂解电压:15/30/45 eV,鞘气流率:30 Arb,辅助气流率:10 Arb,毛细管温度:350℃,喷雾电压:5.5 kV(正离子模式) 或-4.0 kV(负离子模式)。
(3)数据采集、化合物定性在控制软件Xcalibur控制下进行一级、二级质谱数据采集。将原始数据导入XCMS软件,进行保留时间校正、峰处理等操作,最后利用公司自建的BiotreeDB V3.0数据库和相应的裂解规律匹配法进行化合物定性。
以上(1)、(2)项关于SSY的检测与分析均由上海百趣生物医学科技有限公司提供。
1.5.3 活性化合物筛选通过中药系统药理学分析平台(https://old.tcmsp-e.com/tcmsp.php),以口服生物利用度≥0.30和类药性≥0.18为条件从检出的化合物中筛选出“活性化合物”[4, 9]。
1.6 网络药理学分析 1.6.1 SSY活性化合物靶点筛选通过SwissTargetPrediction(http://www.swisstargetprediction.ch/)数据库预测活性化合物的靶点,未查询到相应靶点的成分(Aloe emodin、Cynaropicrin、Dubinidine),用TargetNet(http://targetnet.scbdd.com/)数据库作为补充,删除重复靶点,用UniProt(https://www.uniprot.org/)数据库对靶点名称标准化。
1.6.2 疾病靶点筛选以“acute lung injury”为关键词,在GeneCards(https://www.genecards.org/)(以相关性分数≥10作为筛选标准)和OMIM(https://omim.org/)数据库查询、汇总、去除重复项后获得疾病靶点。
1.6.3 蛋白质-蛋白质相互作用网络构建及核心靶点筛选将活性化合物靶点与疾病靶点导入到Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制韦恩图,得到“交集靶点”。将交集靶点导入STRING(https://cn.string-db.org/)平台,设置蛋白种类为“智人”,“最低要求的相互作用得分”为“0.400”,生成蛋白质-蛋白质相互作用网络;将结果导入Cytoscape 3.7.1中对蛋白质-蛋白质相互作用网络进行拓扑分析并绘制同心圆。以大于节点“度值”的中位数2倍且大于“介数中心性值”和“接近中心性值”的中位数1倍为标准,筛选出“核心靶点”[9]。将核心靶点导入STRING平台和Cytoscape 3.7.1中进行拓扑分析并绘制同心圆,取度值前10位的靶点作为“关键核心靶点”。
1.6.4 “活性化合物-核心靶点”网络构建和核心化合物筛选在Cytoscape 3.7.1中构建“活性化合物-核心靶点”网络并进行拓扑分析,取度值前10位的活性化合物作为“核心化合物”[9]。
1.6.5 基因本体和京都基因与基因组百科全书通路富集分析用DAVID(https://david.ncifcrf.gov/)数据库对核心靶点进行基因本体(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集,分析生物过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF)和通路的富集情况,以错误发现率(false discovery rate,FDR)<0.05为筛选标准,并通过微生信平台(https://www.bioinformatics.com.cn/)对结果进行可视化。
1.6.6 分子对接通过PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库下载SSY核心化合物三维结构的SDF格式文件。用PDB(https://www.rcsb.org/)数据库获取关键核心靶点的结构。最后用Autodock软件进行分子对接并计算结合能,通过微生信平台绘制结合能的矩阵热图,用PyMOL软件对部分对接结果进行可视化[10-11]。
1.7 动物实验 1.7.1 分组与给药大鼠适应性饲养1周后用随机数字表法随机均分为4组(n=12/组):健康对照组(Ctrl组)、LPS诱导的ALI组(ALI组)、ALI+SSY组和ALI+DXM组。除Ctrl组外,其余4组大鼠均一次性经尾静脉注射8.0 mg/kg LPS[4],Ctrl组予等体积生理盐水。随后,ALI+SSY组立即经灌胃予人体等效剂量的SSY(15.6 mL/kg)[12],ALI+DXM组用相同方法予5 mg/kg DXM[13],而Ctrl和ALI组予等体积去离子水。
1.7.2 标本收集干预24 h后,以1%戊巴比妥钠(40 mg/kg)麻醉大鼠,测定呼吸频率(respiratory rate,RR),经股动脉采血行血气分析和乳酸(lactate,Lac)测定。放血法处死大鼠,迅速开胸分离出气管和肺组织,右肺中叶用滤纸吸干表面水分后称量湿重,随后置于烘箱(55℃,60 h)烘干后称量干重, 计算湿/干重(wet/dry weight,W/D)比值;用生理盐水进行左肺灌洗(2 mL×3次),回收并合并支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)后离心(4℃,200 g,10 min),收集上清液和沉渣备用。其余肺组织冻存于-80℃冰箱或固定于10%中性福尔马林缓冲液备用。
1.7.3 BALF和肺组织匀浆检测按照说明书,使用相应的试剂盒检测BALF上清液中蛋白浓度及IL-6、TNF-α、IL-1β水平。用1 mL生理盐水重悬BALF沉渣,计数白细胞(white blood cell,WBC),然后再次离心(4℃,200 g,10 min),将沉渣固定于载玻片,用Wright–Giemsa染色后计数中性粒细胞(neutrophil,Neu)。将冻存的肺组织匀浆后离心(4℃,5 000 g, 10 min),收集上清液,用相应的检测试剂盒按照说明书测定MDA、PC、8-OHdG和TAOC水平。
1.7.4 肺组织病理分析固定后的肺组织经石蜡包埋、切片(4 µm)、脱蜡、HE染色、脱水、透明、封片后用光学显微镜观察,按以下标准评估“急性肺损伤评分”:0分,正常;1分、2分、3分、4分、5分、6分、7分、8分和9分分别为损伤≤10%、20%、30%、40%、50%、60%、70%、80%和90%显微镜视野;10分,弥漫性损伤。
1.7.5 蛋白免疫印迹提取冻存的肺组织总蛋白并测定浓度;100℃(10 min)变性蛋白;电泳分离样品后转膜,电转后的膜先用5%脱脂奶粉室温封闭1 h后再用一抗[抗-p-PI3K p85α(Tyr607),1∶750;抗-p-AKT1(S473),1∶2 000;余均为1∶1 000]孵育(4℃)过夜。次日洗膜后加入辣根过氧化物酶标记的山羊抗兔(或小鼠)IgG(均为1∶5 000)室温孵育2 h,再次洗膜后用凝胶成像系统进行成像和分析。
1.8 统计学方法用SPSS 19.0软件对数据进行统计分析。计量资料分别用Shapiro-Wilk法和levene法进行正态性和方差齐性检验。符合正态分布的资料以均数±标准差(x±s)表示,组间差异性比较采用单因素方差分析(方差齐)或Welch检验(方差不齐),多重比较采用Bonferroni(方差齐)或Tamhane's T2(方差不齐)检验。非正态分布的计量资料以中位数(四分位数)[M(Q1,Q3)]表示,分别采用Kruskal-Wallis H和Bonferroni检验进行组间差异性比较和多重比较。以P<0.05为差异有统计学意义。
2 结果 2.1 SSY化合物识别和活性化合物筛选超高效液相色谱-四极杆-静电场轨道阱质谱检测的总离子流图见附图1,共识别出415种化合物,详见附表3。筛选出66种活性化合物,其中正离子模式36种,负离子模式30种,见附表4。
2.2 网络药理学分析 2.2.1 活性化合物靶点和疾病靶点筛选、蛋白质-蛋白质相互作用网络构建及核心靶点筛选共预测到781个活性化合物靶点和1 920个疾病靶点。韦恩图显示有337个交集靶点(见附图2A)。交集靶点的蛋白质-蛋白质相互作用网络有337个节点和8 536条边,节点的平均度值为50.7;按度值<34、34≤度值<59、59≤度值<93、93≤度值<160和度值≥160绘制同心圆(见附图2B)。共筛选出50个核心靶点,按度值<45、45≤度值<49和度值≥49绘制同心圆(见附图2C);度值前10的关键核心靶点信息见表 1。
| 靶点名称 | 度值 | 接近中心性值 | 介数中心性值 |
| STAT3 | 49 | 1 | 0.00394598 |
| CASP3 | 49 | 1 | 0.00394598 |
| AKT1 | 49 | 1 | 0.00394598 |
| GAPDH | 49 | 1 | 0.00394598 |
| ESR1 | 49 | 1 | 0.00394598 |
| BCL2 | 49 | 1 | 0.00394598 |
| SRC | 49 | 1 | 0.00394598 |
| CTNNB1 | 49 | 1 | 0.00394598 |
| EGFR | 48 | 0.98 | 0.00367382 |
| CCND1 | 48 | 0.98 | 0.00354333 |
活性化合物-核心靶点网络中共有50个核心靶点的节点,由于在66个活性化合物中Isovitexin、Poncirin为未对应到核心靶点的“游离节点”,故仅显示了64个节点,见附图2D;度值前10的核心化合物信息详见表 2。
| 核心化合物 | 度值 | 接近中心性值 | 介数中心性值 |
| Licochalcone B | 16 | 0.448413 | 0.051231 |
| Diosmetin | 15 | 0.444882 | 0.012290 |
| Isosinensetin | 15 | 0.437985 | 0.020583 |
| Baicalein | 14 | 0.441406 | 0.026197 |
| Acacetin | 14 | 0.441406 | 0.010690 |
| Hydroxygenkwanin | 14 | 0.437985 | 0.009876 |
| Artemetin | 14 | 0.434615 | 0.009583 |
| Praeruptorin C | 14 | 0.428030 | 0.031065 |
| Naringenin | 14 | 0.428030 | 0.019707 |
| Boldine | 13 | 0.434615 | 0.019764 |
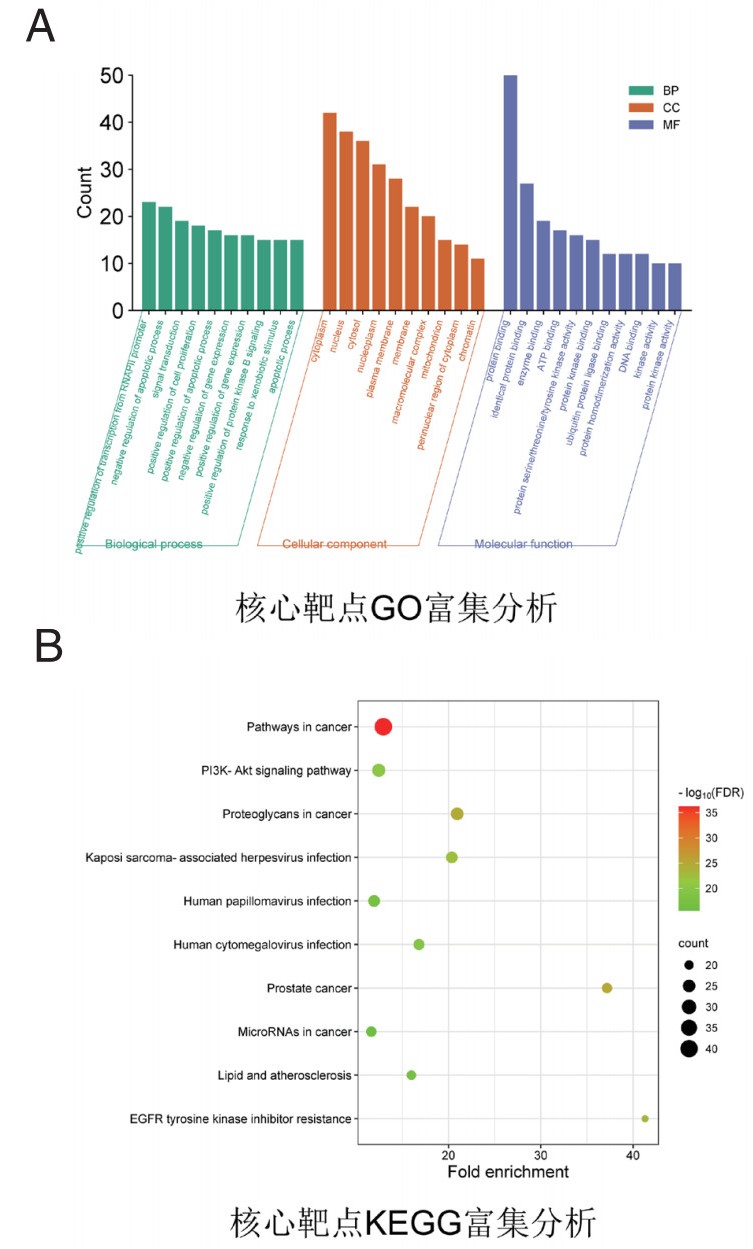
GO富集到RNA聚合酶Ⅱ启动子转录正调控、凋亡过程负调控等生物过程285条,细胞质、细胞核等细胞组分32条,蛋白结合、酶结合等分子功能51条,各部分均取“数目”前10的条目绘制柱状图,详见图 1A。KEGG富集到癌症通路、PI3K-AKT信号传导等通路148条,用数目前10的通路绘制气泡图,见图 1B。
|
| 注:BP,生物过程;CC,细胞组分;MF,分子功能;Count,数目;FDR,错误发现率;GO,基因本体;KEGG,京都基因与基因组百科全书 图 1 核心靶点GO和KEGG富集分析 Fig 1 GO and KEGG enrichment analyses of hub targets |
|
|
各核心化合物和关键核心靶点的结合能均小于-5 kcal/mol,见附图2;对部分结合能小于-7 kcal/mol的对接进行可视化,见附图3。
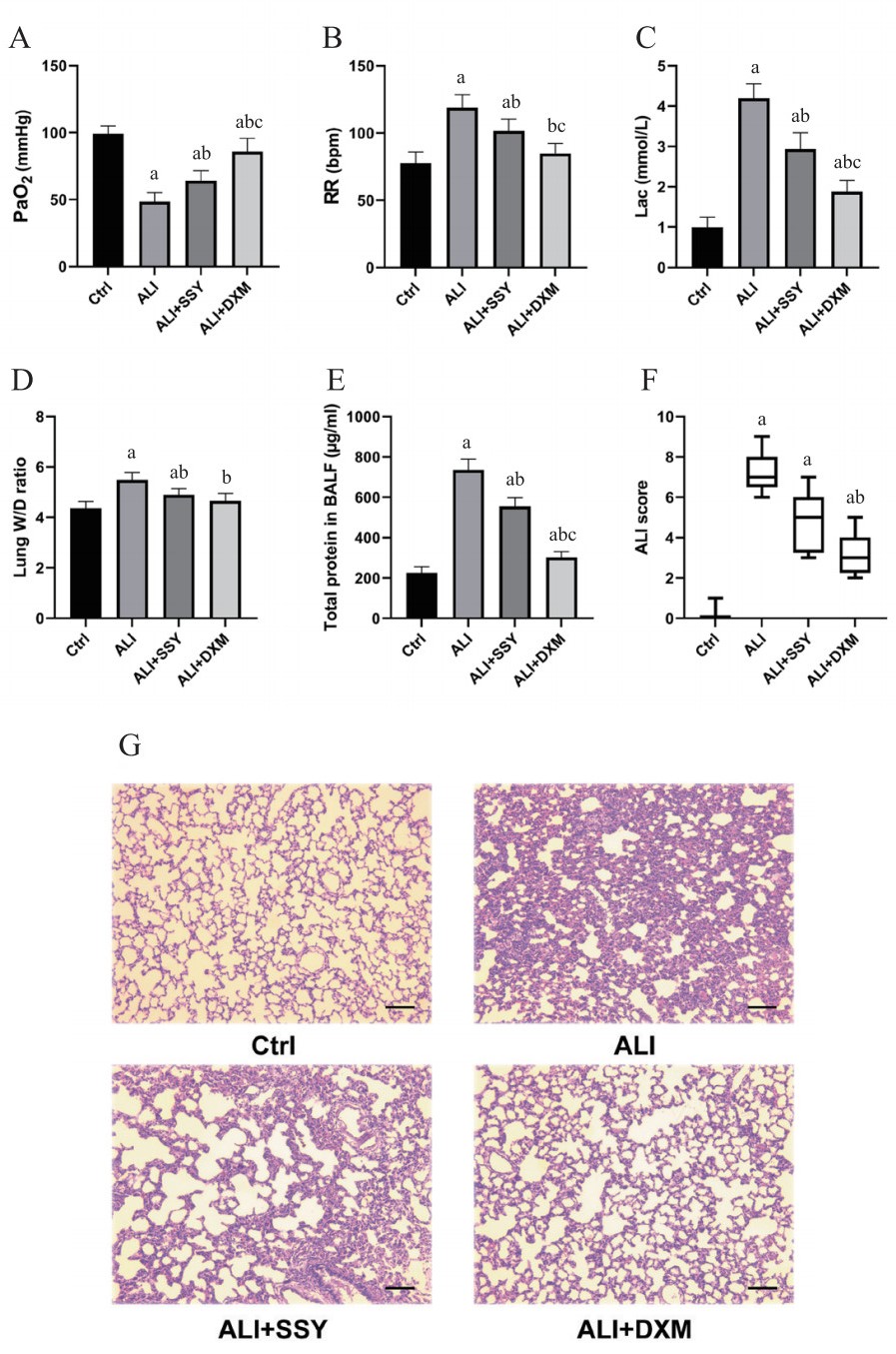
2.3 大鼠一般状况、动脉血氧分压、RR、Lac、BALF蛋白浓度、肺W/D比值及组织病理分析造模24 h后,ALI组大鼠死亡3只,其余3组大鼠均无死亡。Ctrl组大鼠精神正常、活动自如、毛色鲜亮,无明显气喘;ALI组大鼠精神萎靡、活动迟缓、毛色晦暗,气喘明显;ALI+SSY和ALI+DXM组大鼠亦出现精神变差、活动减少、毛色光泽度下降及气喘,但程度均较ALI组大鼠减轻。与Ctrl组相比,ALI、ALI+SSY和ALI+DXM组大鼠的动脉血氧分压(arterial partial pressure of oxygen,PaO2)水平均显著下降(均P < 0.01),且Lac、BALF蛋白浓度和急性肺损伤评分均显著增高(急性肺损伤评分,Ctrl组vs. ALI+DXM组,P < 0.05;余均P < 0.01),ALI和ALI+SSY组的RR和肺W/D比值均显著增高(均P < 0.01),而ALI+DXM组的RR和肺W/D比值虽然均有升高趋势,但差异均无统计学意义(均P > 0.05)。与ALI组相比,ALI+SSY和ALI+DXM组大鼠的PaO2水平均显著升高(均P < 0.01),RR、Lac、肺W/D比值和BALF蛋白浓度均显著下降(均P < 0.01),ALI+DXM组的急性肺损伤评分显著下降(P < 0.01),而ALI+SSY组的急性肺损伤评分有下降趋势,但差异无统计学意义(P > 0.05)。与SSY组相比,ALI+DXM组大鼠的PaO2水平进一步升高,RR、Lac和BALF蛋白浓度均进一步下降,差异均有统计学意义(均P < 0.01),肺W/D比值及急性肺损伤评分均有下降趋势,但差异均无统计学意义(均P > 0.05)。见图 2。
|
| 注:PaO2,动脉血氧分压;RR,呼吸频率;Lac,乳酸;W/D ratio,湿/干重比值;BALF,支气管肺泡灌洗液;ALI score,急性肺损伤评分;Ctrl,对照;ALI,急性肺损伤;SSY,参苏饮;DXM,地塞米松。G为HE染色,放大倍数:200×,标尺长度为100 µm。ALI组n=9,其余组n=12;vs. Ctrl,aP < 0.05;vs. ALI,bP < 0.05;vs. ALI+SSY,cP < 0.05 图 2 大鼠呼吸指标及肺组织病理分析 Fig 2 Analyses of respiratory indexes and lung histopathology in rats |
|
|
ALI、ALI+SSY和ALI+DXM组大鼠BALF的WBC、Neu、IL-6、IL-1β和TNF-α水平以及肺组织匀浆的MDA、PC和8-OHdG水平较Ctrl组均显著增高(MDA,Ctrl组vs. ALI+DXM组,P < 0.05;余均P < 0.01);ALI+SSY和ALI+DXM组大鼠的上述指标较ALI组均显著下降(均P < 0.01);ALI+DXM组大鼠的上述指标较ALI+SSY组均进一步显著下降(MDA,ALI+SSY组vs. ALI+DXM组,P < 0.05;余均P < 0.01)。与Ctrl组相比,其余3组大鼠肺组织匀浆的TAOC均显著下降(均P < 0.01);与ALI组相比,ALI+SSY和ALI+DXM组大鼠的TAOC均显著升高(均P < 0.01);与ALI+SSY组相比,ALI+DXM组大鼠的TOAC进一步升高,差异有统计学意义(P < 0.01)。见附图4。
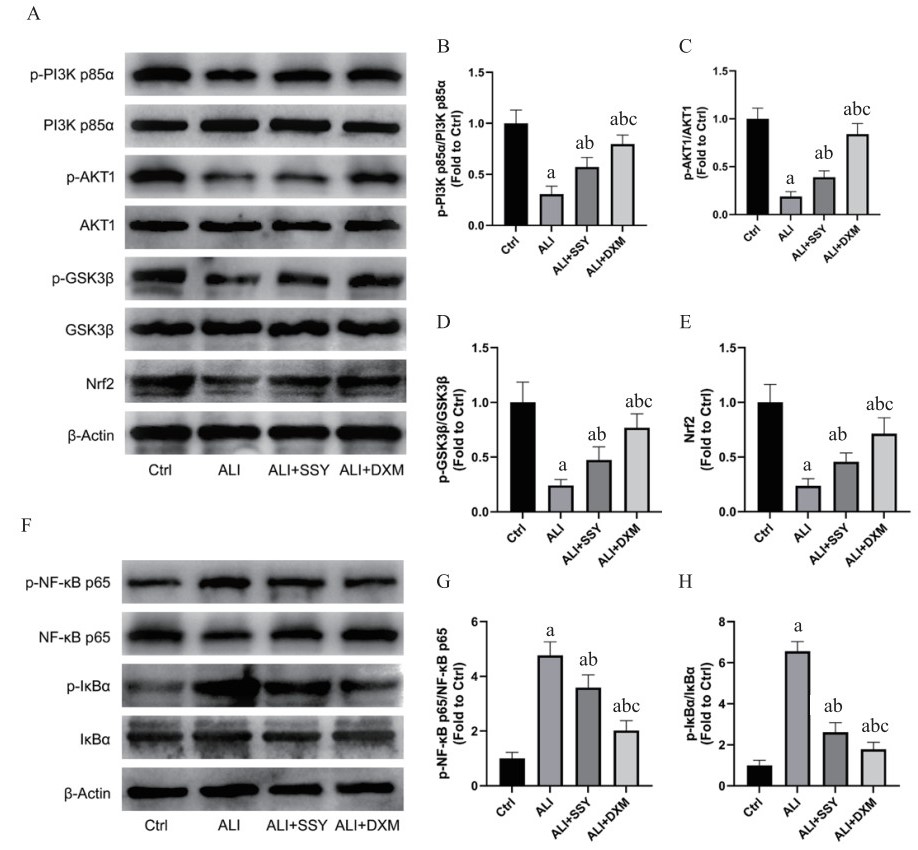
2.5 PI3K-AKT-GSK3β-Nrf2/NF-κB信号通路分析与Ctrl组相比,其余3组大鼠的PI3K p85α、AKT1和GSK3β磷酸化水平以及Nrf2表达水平均显著下降(p-PI3K p85α/PI3K p85α、p-AKT1/AKT1和p-GSK3β/GSK3β,Ctrl组vs. ALI+DXM组,P < 0.05;余均P < 0.01);与ALI组相比,ALI+SSY和ALI+DXM组大鼠的上述指标均显著升高(p-GSK3β/GSK3β和Nrf2,ALI组vs. ALI+SSY组,P < 0.05;余均P < 0.01);与ALI+SSY组相比,ALI+DXM组大鼠的上述指标均进一步显著升高(Nrf2,ALI+SSY组vs. ALI+DXM组,P < 0.05;余均P < 0.01)。ALI、ALI+SSY和ALI+DXM组大鼠的NF-κB p65和IκBα磷酸化水平较Ctrl组均显著升高(p-IκBα/IκBα,Ctrl组vs. ALI+DXM组,P < 0.05;余均P < 0.01);ALI+SSY和ALI+DXM组大鼠的上述指标较ALI组均显著下降(均P < 0.01);ALI+DXM组大鼠的上述指标较ALI+SSY组均进一步下降,差异均有统计学意义(均P < 0.01)。见图 3。
|
| 注:Ctrl,对照;ALI,急性肺损伤;SSY,参苏饮;DXM,地塞米松。n=6/组;avs. Ctrl,P < 0.05;bvs. ALI,P < 0.05;cvs. ALI+SSY,P < 0.05 图 3 免疫印迹分析 Fig 3 Western-blotting analysis |
|
|
SSY是一种经典中药复方,其成分多、药理作用复杂,基于超高效液相色谱-四极杆-静电场轨道阱质谱的非靶向代谢组学具有分辨率高、质量精度高、质量范围广等优点,是定性检测中药复方成分的有效工具[14];本研究从SSY中检出多达415种化合物,较全面的揭示其成分构成,这是后续研究的基础。一般认为,在中药众多成分当中满足类药性≥0.18和口服生物利用度≥0.30的化合物可能在疾病的治疗过程中发挥主要作用,前者表示化合物开发为“药物”的可能性,后者提示了化合物口服后能被人体吸收的量[4, 9],本研究筛选出多达66种活性化合物,提示了SSY的复杂药理作用。
近年来,网络药理学已广泛用于预测中药与疾病间的复杂药理学关系[4, 10-11, 13]。本研究对活性化合物与ALI的交集靶点进行分析,发现交集靶点分别占活性化合物靶点总数的43.1%(337/781)和ALI靶点总数的17.6%(337/1920),提示SSY可能对ALI有治疗作用。一般而言,网络拓扑参数(包括度值、接近中心性值和介数中心性值等)的数值越大提示该节点发挥的作用可能越关键,其中又以度值最为重要[15],根据此理论基础并参考文献报道的方法筛选出核心靶点和核心化合物[9]。核心靶点的KEGG富集分析提示PI3K-AKT信号传导可能是SSY调控ALI的关键,该通路是炎症、氧化应激、细胞凋亡、肿瘤等多种信号传导的“枢纽”,在其下游有GSK3β、Nrf2、NF-κB等众多信号分子参与,涉及基因转录调控、细胞凋亡调控等生物学过程,符合本研究GO富集分析的结果[16-18]。关键核心靶点分析显示除ESR1、SRC、CTNNB1、EGFR、CCND1等主要参与肿瘤调控的靶点外[18],其余的STAT3、CASP3、AKT1、GAPDH和Bcl-2均是参与炎症、氧化应激和细胞凋亡信号通路的关键靶点[16-18];另外,关键核心靶点与核心化合物的结合能均小于-5 kcal/mol,提示结合活性较强[10]。总之,上述网络药理学分析结果预测SSY可能通过以PI3K-AKT为枢纽的信号通路调控ALI。
LPS是革兰氏阴性菌细胞壁的一种特有成分,能够与靶细胞的Toll样受体结合,活化免疫系统而诱导炎症反应,广泛用于建立动物炎症模型[19];本研究显示大鼠在LPS诱导后出现炎症指标增高、肺组织损伤,符合文献报道的LPS诱导的ALI动物模型特点[5, 13, 20]。本研究发现SSY能够提高ALI大鼠的PaO2,降低RR和Lac水平,改善肺水肿和组织病理变化,提示氧合功能、组织缺氧和肺部病变得到改善。进一步分析显示在SSY干预后,ALI大鼠BALF的WBC、Neu和炎症因子水平下降,说明有效的抑制了炎症反应。PC、8-OHdG和MDA分别反应了氧化应激对蛋白质、核酸和脂质的损害,是综合反应组织氧化应激水平的指标[21-23],本研究显示SSY能提高TAOC并降低PC、8-OHdG和MDA水平,说明有效的改善了ALI大鼠的氧化应激。研究显示,许多膳食植物化合物可以激活Nrf2的上游因子(如PI3K、GSK3),活化Nrf2信号通路,促进抗氧化酶和抗氧化蛋白表达,提高机体的抗氧化活性,还能抑制NF-κB信号通路,降低炎症水平[17]。SSY配方中多种中药如紫苏叶、茯苓、大枣等均是常见的膳食植物,本研究发现SSY能够活化Nrf2的上游因子PI3K、AKT1和GSK3β并抑制NF-κB通路,提高抗氧化能力并减少炎症因子表达,发挥抗氧化应激和抗炎作用而改善ALI;本研究的结果符合上述文献报道的观点。
本研究主要的局限性在于大鼠模型不能完全模拟人类疾病状态,得出的结论尚需进一步的循证医学证据支持。另外,本研究直接体外定性检测SSY,用SSY灌胃后的入血成分尚不清楚,尚需后续的基于血清代谢组学的中药入血成分研究进一步阐明。
总之,本研究运用基于超高效液相色谱-四极杆-静电场轨道阱质谱的非靶向代谢组学分析SSY的成分并筛选出活性化合物,再结合网络药理学预测PI3K-AKT信号传导可能是SSY对ALI作用的关键,最后通过用SSY干预ALI大鼠进行实验验证,表明SSY能够通过调控PI3K-AKT-GSK3β-Nrf2/NF-κB信号通路抑制ALI大鼠的氧化应激和炎症,减轻肺组织病变,改善氧合功能。
本文附表请登陆中华急诊网(www.cem.org.cn)浏览(Html格式全文)
利益冲突 所有作者均声明无利益冲突
作者贡献声明 郑武洪:研究设计、实验操作、论文撰写;朱凌云、肖鹏:实验操作、数据收集及整理;何宗存、周海珺:数据收集及整理、统计学分析;陈锋:指导研究;林飞:实验操作、论文修改;柯俊:研究设计、论文修改
| [1] | Long ME, Mallampalli RK, Horowitz JC. Pathogenesis of pneumonia and acute lung injury[J]. Clin Sci, 2022, 136(10): 747-769. DOI:10.1042/CS20210879 |
| [2] | Bos LDJ, Ware LB. Acute respiratory distress syndrome: causes, pathophysiology, and phenotypes[J]. Lancet, 2022, 400(10358): 1145-1156. DOI:10.1016/S0140-6736(22)01485-4 |
| [3] | Fan E, Brodie D, Slutsky AS. Acute respiratory distress syndrome: advances in diagnosis and treatment[J]. JAMA, 2018, 319(7): 698-710. DOI:10.1001/jama.2017.21907 |
| [4] | Zhu HH, Wang S, Shan C, et al. Mechanism of protective effect of Xuan-Bai-Cheng-qi decoction on LPS-induced acute lung injury based on an integrated network pharmacology and RNA-sequencing approach[J]. Respir Res, 2021, 22(1): 188. DOI:10.1186/s12931-021-01781-1 |
| [5] | Wang Y, Wang YC, Ma J, et al. YuPingFengSan ameliorates LPS-induced acute lung injury and gut barrier dysfunction in mice[J]. J Ethnopharmacol, 2023, 312: 116452. DOI:10.1016/j.jep.2023.116452 |
| [6] | Kim H, Choi JY, Hong MN, et al. Traditional medicine for the treatment of common cold in Korean adults: a nationwide population-based study[J]. Integr Med Res, 2021, 10(1): 100458. DOI:10.1016/j.imr.2020.100458 |
| [7] | Kim MH, Lee SH, Jin SC, et al. Anti-inflammatory effects of Samsoeum, a Korean medicine for health insurance, on chronic bronchitis caused by lipopolysaccharide in rats[J]. Food Funct, 2020, 11(8): 6866-6874. DOI:10.1039/d0fo01171a |
| [8] | Jeon WY, Shin IS, Shin HK, et al. Samsoeum water extract attenuates allergic airway inflammation via modulation of Th1/Th2 cytokines and decrease of iNOS expression in asthmatic mice[J]. BMC Complement Altern Med, 2015, 15: 47. DOI:10.1186/s12906-015-0561-3 |
| [9] | Duan ZL, Wang YJ, Lu ZH, et al. Wumei Wan attenuates angiogenesis and inflammation by modulating RAGE signaling pathway in IBD: network pharmacology analysis and experimental evidence[J]. Phytomedicine, 2023, 111: 154658. DOI:10.1016/j.phymed.2023.154658 |
| [10] | Ding WC, Zhang W, Chen J, et al. Protective mechanism of quercetin in alleviating sepsis-related acute respiratory distress syndrome based on network pharmacology and in vitro experiments[J]. World J Emerg Med, 2024, 15(2): 111-120. DOI:10.5847/wjem.j.1920-8642.2024.030 |
| [11] | Zhou W, Fan MY, Li X, et al. Molecular mechanism of Xuebijing in treating pyogenic liver abscess complicated with sepsis[J]. World J Emerg Med, 2024, 15(1): 35-40. DOI:10.5847/wjem.j.1920-8642.2024.016 |
| [12] | Nair AB, Jacob S. A simple practice guide for dose conversion between animals and human[J]. J Basic Clin Pharm, 2016, 7(2): 27-31. DOI:10.4103/0976-0105.177703 |
| [13] | Liu C, Yin ZG, Feng TT, et al. An integrated network pharmacology and RNA-Seq approach for exploring the preventive effect of Lonicerae japonicae Flos on LPS-induced acute lung injury[J]. J Ethnopharmacol, 2021, 264: 113364. DOI:10.1016/j.jep.2020.113364 |
| [14] | Bai X, Zhu CY, Chen JY, et al. Recent progress on mass spectrum based approaches for absorption, distribution, Metabolism, and excretion characterization of traditional Chinese medicine[J]. Curr Drug Metab, 2022, 23(2): 99-112. DOI:10.2174/1389200223666220211093548 |
| [15] | Tang Y, Li M, Wang JX, et al. CytoNCA: a cytoscape plugin for centrality analysis and evaluation of protein interaction networks[J]. Biosystems, 2015, 127: 67-72. DOI:10.1016/j.biosystems.2014.11.005 |
| [16] | Cui ZF, Zhao XT, Amevor FK, et al. Therapeutic application of quercetin in aging-related diseases: SIRT1 as a potential mechanism[J]. Front Immunol, 2022, 13: 943321. DOI:10.3389/fimmu.2022.943321 |
| [17] | Wu SJ, Liao XY, Zhu ZJ, et al. Antioxidant and anti-inflammation effects of dietary phytochemicals: the Nrf2/NF-κB signalling pathway and upstream factors of Nrf2[J]. Phytochemistry, 2022, 204: 113429. DOI:10.1016/j.phytochem.2022.113429 |
| [18] | He Y, Sun MM, Zhang GG, et al. Targeting PI3K/Akt signal transduction for cancer therapy[J]. Signal Transduct Target Ther, 2021, 6(1): 425. DOI:10.1038/s41392-021-00828-5 |
| [19] | di Lorenzo F, Duda KA, Lanzetta R, et al. A journey from structure to function of bacterial lipopolysaccharides[J]. Chem Rev, 2022, 122(20): 15767-15821. DOI:10.1021/acs.chemrev.0c01321 |
| [20] | 刘博昊, 何如愿, 熊锐, 等. 罗汉果醇对脂多糖诱导急性肺损伤的作用及机制研究[J]. 中华急诊医学杂志, 2022, 31(6): 777-782. DOI:10.3760/cma.j.issn.1671-0282.2022.06.014 |
| [21] | Danieli MG, Antonelli E, Piga MA, et al. Oxidative stress, mitochondrial dysfunction, and respiratory chain enzyme defects in inflammatory myopathies[J]. Autoimmun Rev, 2023, 22(5): 103308. DOI:10.1016/j.autrev.2023.103308 |
| [22] | 娄满, 王维维, 高春燕, 等. 8-羟基-2-脱氧鸟苷水平与高血压患者血压控制程度及靶器官损害的相关性[J]. 中华高血压杂志, 2022, 30(7): 676-679. DOI:10.16439/j.issn.1673-7245.2022.07.014 |
| [23] | 徐标, 李鸣, 王继武, 等. 盐酸纳美芬缺血后处理通过AMPK/Nrf2/HO-1途径减轻大鼠肺缺血-再灌注损伤的时效性研究[J]. 中华急诊医学杂志, 2023, 32(12): 1686-1692. DOI:10.3760/cma.j.issn.1671-0282.2023.12.019 |
 2025, Vol. 34
2025, Vol. 34




