2. 浙江大学医学院附属邵逸夫医院急诊科,杭州 310016
多杀巴斯德菌(Pasteurella multocida)是一种需氧或兼厌氧的革兰阴性杆菌,属于巴氏杆菌科[1]。它是一种机会性致病菌,通常在动物之间传播,人类感染多杀巴斯德菌的情况较少见,但也可能发生。感染通常发生在与动物密切接触后,如被猫、犬等咬伤或接触病畜的尸体等[2]。该感染的特点是发病快速和炎症反应明显,在特殊的情况下可表现为严重的全身性感染[3]。本研究经龙游县人民医院伦理委员会审批(批号:2024107),患者家属签署知情同意书,介绍1例因多杀巴斯德菌感染致心室颤动、心源性猝死的患者,总结汇报其临床特点以及诊疗经过。
1 病历摘要患者,男,71岁。主诉“发热咳痰6 d,加重伴呼吸困难6 h”于2024-02-18来院急诊。患者于6 d前出现发热(最高体温未监测),伴畏寒,无明显寒战。有咳嗽,咳白色黏痰。当时无胸闷、胸痛,无腹痛、腹泻、尿频、尿急等伴随症状,夜间可平卧,未就诊。6 h前病情加重,自觉显著呼吸困难,咳粉红色黏痰,家属陪同下急诊就诊。
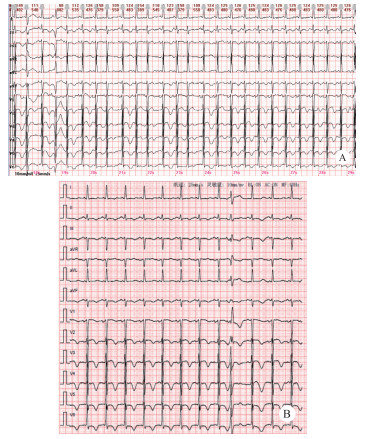
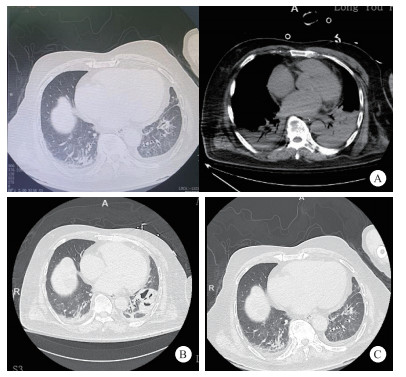
体格检查:体温38.8℃,脉搏101次/min,呼吸35次/min,血压177/57 mmHg(1 mmHg=0.133 kPa),SpO2 90%。神志清,急性病容,呼吸浅快,双肺呼吸音粗,可闻及湿啰音,心律齐,双下肢中度凹陷性水肿。既往高血压病史,不规律服药。否认冠心病、糖尿病等基础疾病。家中饲养宠物犬(5年)。结合患者临床表现特点,诊断考虑脓毒症、急性左心衰,予心电监护,无创呼吸机辅助通气。首次心电图提示频发多源性房早,时呈成对、短阵房速,部分伴室内差异性传导,频发室早,T波改变(图 1-A)。血气分析提示严重失代偿性代谢性酸中毒,血乳酸显著升高(pH 7.022,乳酸13.1 mmol/L)。约15 min后,患者突发意识丧失、口唇发绀,心电监护提示室颤,予胸外按压、电除颤,同时气管插管、机械通气。后患者转复窦律,复查心电图如图 1-B所示。抢救过程中患者再次室颤,予紧急电除颤后转复窦律,经充分镇静、镇痛,呼吸机支持,病情逐渐趋于稳定。完善床旁心脏超声:提示左室增大,左心收缩功能显著下降,射血分数30%。实验室检查提示:肌钙蛋白I 0.345 μg/L(参考值< 0.01 μg/L),血白细胞计数10.8×109/L,中性粒比例94.0%,C反应蛋白32.50 mg/L,肌酸激酶438 U/L,肌酸激酶同工酶3.83 U/L,D-二聚体1.27 mg/L,前降钙素原94.42 ng/mL,NT-proBNP 2 917.70 pg/mL。甲/乙流、新冠相关检测结果均阴性。胸部CT(图 2A)提示两下肺渗出,部分实变。
|
| 注:A多源性房性早搏伴频发室性早搏;B前间壁ST段抬高0.15 mv,高侧壁、广泛前壁T波倒置 图 1 A:入急诊首次心电图;B:电除颤后心电图 |
|
|
|
| 注:A为入院当日(2024-02-18)双肺下叶斑片状渗出影(白色箭头);B为治疗第8天(2024-02-26)左下肺空洞形成(黑色箭头);C为治疗第31天(2024-03-19)病灶吸收伴纤维条索影(黑色箭头) 图 2 胸部CT动态演变 |
|
|
患者病情稍稳定后拟脓毒症、脓毒性心肌病、心室颤动转ICU进一步治疗。初予经验性头孢哌酮钠舒巴坦(2:1,3.0 g q12 h ivgtt)抗感染, 去甲肾上腺素联合肾上腺素抗休克,维持内环境稳定,间断气管镜下吸痰等处理。次日出现少尿,血肌酐升高,予连续性肾脏替代治疗(continuous renal replacement therapy, CRRT)。后肺泡灌洗液及血液宏基因组二代测序(metagenomic next-generation sequencing, mNGS)提示多杀巴斯德杆菌阳性,序列数11425,痰培养及血培养均提示血孪生球菌感染,痰真菌培养阴性,结核Xpert-MTB检测阴性,多次痰找抗酸杆菌检测阴性。根据病原学检测结果,调整抗感染方案为:头孢哌酮钠舒巴坦钠(3.0 g q12 h ivgtt)联合莫西沙星(0.4 g/d ivgtt)。2024-02-26日复查胸部CT提示左肺下叶空洞形成(图 2-B)。经积极治疗,患者感染逐渐控制,总体病情趋于稳定。2024-02-29呼吸机脱机、拔管,后转呼吸科病房,03-19复查胸部CT,提示双肺炎性渗出较前吸收,左下肺空洞较前减小(图 2C)。经多学科团队协作治疗后,患者出院时心功能分级(NYHA)Ⅱ级,6 min步行试验距离达380 m。出院诊断:脓毒症、脓毒性休克、脓毒症心肌病、脓毒症凝血功能障碍、多杀巴斯德菌感染、重症肺炎、重度成人急性呼吸窘迫综合征、心源性猝死、心室颤动、急性肾衰竭、糖尿病。3个月后随访LVEF恢复至55%,未遗留明显后遗症。
2 讨论多杀巴斯德菌(Pasteurella multocida)作为动物源性机会致病菌,人类感染多由猫、犬咬伤或密切接触引发,但导致严重心脏并发症如心室颤动及心源性猝死的病例极为罕见。本例患者因脓毒症、急性左心衰就诊,最终诊断为多杀巴斯德菌感染合并严重心脏事件,其临床过程及诊疗经验值得深入探讨。本例患者家中长期饲养宠物犬,提示动物接触史是感染的重要危险因素。多杀巴斯德菌可通过破损皮肤或呼吸道定植侵入人体,本病例未发现明确外伤史,推测感染可能源于呼吸道定植或微小皮肤损伤未被察觉。此类感染易被忽视,尤其对于老年、免疫力低下或有慢性基础疾病的高危人群,更需警惕隐匿性感染,并且严重时可合并肺脓肿、脓胸、肺空洞形成等并发症[4]。本病例病原学诊断依赖肺泡灌洗液及血液mNGS检测。多杀巴斯德菌是一种较难培养的细菌,一般需要培养基营养成分丰富才能生长良好[5],传统培养方法耗时且阳性率低,而mNGS技术通过高灵敏度测序能快速锁定病原体[6-7],为及时调整抗感染方案提供了关键依据。此外,本例合并血孪生球菌感染,提示混合感染可能加重病情,需警惕多重病原体共存的复杂性。
目前多杀巴斯德菌感染引发心室颤动的机制尚不明确,可能涉及多重因素,如直接心肌损伤、全身炎症反应以及代谢紊乱等。结合文献报道多杀巴斯德菌感染直接累及心血管系统者仅占5.3%(3/57)[8-9],其中心内膜炎[8]及心包填塞[9]各1例。有研究显示,年龄、血乳酸、白细胞介素-6(interleukin 6, IL-6)、血氧饱和度、脑利钠肽前体等是脓毒症患者发生心脏骤停的重要危险因素[10]。患者血气分析提示高乳酸、氧代谢紊乱,与Wang等[11]提出的乳酸升高、Cv-aCO2/Ca-vO2比值> 1.4提示不良预后的研究结论相符。经CRRT 72 h后,患者去甲肾上腺素用量降至0.1 μg·kg-1·min-1(降幅66.7%),LVEF提升至45%(
多杀巴斯德菌感染通常使用广谱抗菌药物治疗,并且该菌对β-内酰胺类抗生素普遍敏感,而二代及三代头孢菌素、四环素类、复方新诺明和氟喹诺酮类可作为替代治疗方案[13]。有研究指出,甲氧苄啶-磺胺甲噁唑、呋喃妥因、氟苯尼考、多西环素、头孢曲松、复方阿莫西林、头孢唑林和四环素对猫源性多杀巴斯德菌分离株最有效,疗效达91.17%~100%[14-16]。但多杀巴斯德菌能够携带质粒,这些质粒赋予其对多种抗生素的耐药性[14]。并且该菌的耐药性可能因地理来源和既往抗菌治疗暴露史而异,所以在选择抗生素时需考虑这些因素。本病例选择头孢哌酮舒巴坦联合莫西沙星的方案,治疗第8天临床肺部感染评分(CPIS)由8分降至4分,印证方案有效性。最后,兽用多杀巴斯德菌疫苗覆盖率提高,可降低人畜共患病风险[17]。
利益冲突 所有作者声明无利益冲突
作者贡献声明 陈挺:论文撰写;张雪峰、余群锋:数据收集及整理;秦绪常、郑少军:论文修改;袁灵敏:研究指导
| [1] | Giordano A, Dincman T, Clyburn BE, et al. Clinical features and outcomes of Pasteurella multocida infection[J]. Medicine (Baltimore), 2015, 94(36): e1285. DOI:10.1097/MD.0000000000001285 |
| [2] | Ujvári B, Weiczner R, Deim Z, et al. Characterization of Pasteurella multocida strains isolated from human infections[J]. Comp Immunol Microbiol Infect Dis, 2019, 63: 37-43. DOI:10.1016/j.cimid.2018.12.008 |
| [3] | Piorunek M, Brajer-Luftmann B, Walkowiak J. Pasteurella multocida infection in humans[J]. Pathogens, 2023, 12(10): 1210. DOI:10.3390/pathogens12101210 |
| [4] | Toriyama K, Mizushima R, Okuma T, et al. Bronchoscopic visualization of the inner cavity caused by Pasteurella multocida infection[J]. Heliyon, 2023, 9(8): e18588. DOI:10.1016/j.heliyon.2023.e18588 |
| [5] | 高正琴, 张强, 贺争鸣, 等. 16S rRNA序列分析在多杀巴斯德氏菌鉴定中的应用[J]. 实验动物科学, 2009, 26(6): 1-5. DOI:10.3969/j.issn.1006-6179.2009.06.001 |
| [6] | 李冰, 缪青, 金文婷, 等. 宏基因二代测序技术对厌氧菌感染精准化诊断的临床价值[J]. 中华医院感染学杂志, 2019, 29(13) 1927-1930, 1953. DOI:10.11816/cn.ni.2019-190739 |
| [7] | 韦毅萌, 袁丁, 余言午, 等. 宏基因组二代测序技术在血流感染脓毒症患者诊疗中的应用价值[J]. 中华急诊医学杂志, 2023, 32(6): 786-789. DOI:10.3760/cma.j.issn.1671-0282.2023.06.012 |
| [8] | Mikaberidz N, Li EY, Taub CC. Pasteurella multocida infective endocarditis in an immunocompetent patient complicated by rhabdomyolysis and permanent hearing loss[J]. J Cardiovasc Dis Res, 2013, 4(1): 55-57. DOI:10.1016/j.jcdr.2013.02.006 |
| [9] | Al-Allaf AK, Harvey TC, Cunnington AR. Pericardial tamponade caused by Pasteurella multocida infection after a cat bite[J]. Postgrad Med J, 2001, 77(905): 199-200. DOI:10.1136/pmj.77.905.199 |
| [10] | 丁新焕, 彭耀军, 黄晶晶, 等. 急诊科脓毒症患者心脏骤停风险预测模型构建[J]. 中华急诊医学杂志, 2023, 32(12): 1693-1698. DOI:10.3760/cma.j.issn.1671-0282.2023.12.020 |
| [11] | Wang LY, Weng L, Xu J, et al. Blood gas analysis as a surrogate for microhemodynamic monitoring in sepsis[J]. World J Emerg Med, 2023, 14(6): 421-427. DOI:10.5847/wjem.j.1920-8642.2023.093 |
| [12] | 阚丽丽, 颜培娥, 韩亮. 连续性血液净化治疗重症脓毒症合并应激性心肌病的效果[J]. 中国当代医药, 2023, 30(1): 71-75. DOI:10.3969/j.issn.1674-4721.2023.01.018 |
| [13] | Kehrenberg C, Schulze-Tanzil G, Martel JL, et al. Antimicrobial resistance in Pasteurella and Mannheimia: epidemiology and genetic basis[J]. Vet Res, 2001, 32(3/4): 323-339. DOI:10.1051/vetres:2001128 |
| [14] | Kadlec K, Brenner Michael G, Sweeney MT, et al. Molecular basis of macrolide, triamilide, and lincosamide resistance in Pasteurella multocida from bovine respiratory disease[J]. Antimicrob Agents Chemother, 2011, 55(5): 2475-2477. DOI:10.1128/AAC.00092-11 |
| [15] | Ferreira TS, Felizardo MR, Sena de Gobbi DD, et al. Virulence genes and antimicrobial resistance profiles of Pasteurella multocida strains isolated from rabbits in Brazil[J]. Scientific World Journal, 2012, 2012: 685028. DOI:10.1100/2012/685028 |
| [16] | Rigobelo EC, Blackall PJ, Maluta RP, et al. Identification and antimicrobial susceptibility patterns of Pasteurella multocida isolated from chickens and Japanese quails in Brazil[J]. Braz J Microbiol, 2013, 44(1): 161-164. DOI:10.1590/s1517-83822013000100023 |
| [17] | Domínguez-Odio A, Delgado DLC. Global commercialization and research of veterinary vaccines against Pasteurella multocida: 2015-2022 technological surveillance[J]. Vet World, 2023, 16(5): 946-956. DOI:10.14202/vetworld.2023.946-956 |
 2025, Vol. 34
2025, Vol. 34




