患者,男,32岁,因“头痛半月”于2022年5月16日至浙江大学医学院附属第二医院就诊。头颅增强MRI显示第四脑室占位,疑为室管膜瘤或脉络丛乳头状瘤,遂于5月18日入院准备手术治疗。既往体健,否认慢性病史。2022年5月21日患者于全麻下行第四脑室病损切除术,病理报告脉络丛乳头状瘤,术后转回神经外科病房。5月22日突发神志不清,急诊头颅CT示第四脑室活动性出血,枕骨大孔疝,遂急诊行右侧脑室外引流+第四脑室血凝块清除术+枕骨去骨瓣减压术,术后转入ICU,予持续右侧脑室外引流。肺CT示两下肺大片急性渗出灶,考虑吸入性肺炎,予哌拉西林他唑巴坦(4.5 g/8 h)治疗,炎症指标持续下降,神志逐渐转清,5月24日成功脱机,期间5月27日、29日两次痰培养检出耐碳青霉烯肺炎克雷伯菌(Carbapenem-resistant Klebsiella pneumoniae,CRKP)。5月30日患者再次昏迷,伴高热(最高40.7℃),血白细胞17.3×109/L,中性82.2%,C-反应蛋白(C-reactive protein,CRP)156.3 mg/L,脑室外引流液浅黄色微混,有核细胞数9×106/L、红细胞数530×106/L、葡萄糖7.03 mmol/L;肺CT无明显渗出,头颅CT见轻度脑积水、术区及两侧脑室后角积血,疑有颅内感染,遂改用美罗培南(2 g/12 h)联合利奈唑胺(0.6 g/12 h)抗菌治疗。5月31日行左侧脑室Ommaya囊外引流装置置入,并再次送脑脊液(cerebrospinal fluid,CSF)检验,有核细胞数15×106/L、红细胞数780×106/ L、葡萄糖6.63 mmol/L,无明显颅内感染征象,5月25日、30日、31日以及6月1日、2日送CSF培养均阴性,5月30日、31日和6月2日抽血标本培养也均阴性。6月1日行气管切开。期间经Ommaya囊每日外引流300-350 mL,引流液逐渐转清,体温呈下降趋势,但6月4日引流液明显减少(12 h引流量约10 mL),当天下午床边更换外引流装置,至晚上11 PM未见脑脊液引出,调整引流高度仍无液体引出,遂于6月5日拔除Ommaya囊外引流管,当日查血降钙素原(procalcitonin,PCT)升高至27.32 ng/mL(6月4日为1.13 ng/mL),全血CRP为181.6 mg/L。6月6日出现高热(最高39.8℃),查血白细胞6.5×109/L,CRP 169.7 mg/L,PCT 12.73 ng/mL;血培养危急值报告1瓶肺炎克雷伯菌生长(6月3日11PM采集的血标本),7日早上报告为CRKP,查CSF未见明显颅内感染征象。主管医生考虑CRKP血流感染,遂向抗菌管理部门提出静脉使用多黏菌素的申请。
抗菌管理部门结合患者病史、检验检查结果以及微生物标本检验情况等研判,提出:(1)6月3日采集的4瓶血培养标本至6月7日仅1瓶报告检出CRKP,其他3份一直未生长,且之前连续数次血培养结果均为阴性,因此考虑该瓶阳性生长菌株为污染;(2)患者6月5日PCT最高达27.32 ng/mL,但6日早上未更改抗菌药物情况下已降至12.73 ng/mL,下降明显,提示美罗培南抗菌治疗有效,更不考虑CRKP血流感染;(3)该菌株可能是经导管采集血标本污染所致,污染源为呼吸道或皮肤定植的CRKP,因患者自5月27日起所送痰培养中即反复检出CRKP;(4)本次发热原因为新发吸入性肺炎,因5月27日、30日及6月1日肺CT均示已吸收(图 1),6月2日主管医生查房记录患者痰液增多,双肺湿啰音增多,6月5日复查肺CT右下肺有新发渗出,6日CT见右下背段及两下肺后基底段渗出范围扩大(图 2)。综合上述情况,拒绝使用多黏菌素的申请,令主管医生做好反流误吸的相关防控措施,并停用利奈唑胺,只需保留美罗培南(减量为1.0 g/8 h)。6月9日开始体温高峰下降,炎症指标继续降低(图 2),至6月14日神志进一步改善,体温已基本正常(最高37.6℃),转出ICU。
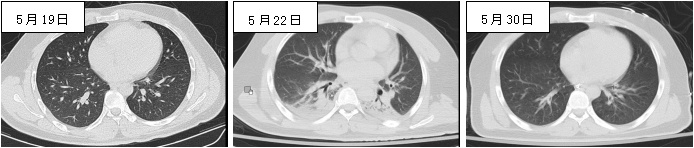
|
| 图 1 5月22日发生吸入性肺炎,5月30日完全吸收 |
|
|
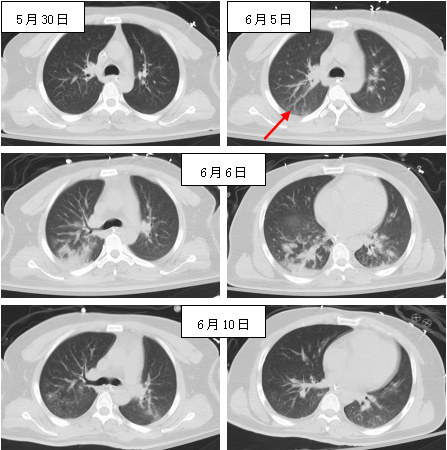
|
| 图 2 6月5日再次吸入性肺炎(箭头处),6日右肺下叶背段及两肺基底段渗出增加,6月10日基本吸收 |
|
|
转回神经外科病房后抗菌方案降阶梯为哌拉西林他唑巴坦(4.5 g/8 h)。6月15日患者神志再次转为模糊,伴发热(最高体温38.8℃),查体发现患者后枕部手术切口处有脑脊液外漏,予床边紧急缝合,弹力绷带加压包扎。当日从左脑室Ommaya囊穿刺引流出黄色浑浊CSF送检,有核细胞3 372×106/L,中性79%,Glu 1.0 mmol/L,涂片找到革兰阴性杆菌,遂重新改用美罗培南(1.0 g/8 h)抗菌治疗。6月17日最高体温38.9℃,血白细胞上升至13.9×109/L,CRP 176.7 mg/L,经Ommaya囊穿刺CSF有核细胞99 668×106/L,中性93%,Glu 0.14 mmol/L。当日抗菌管理部门追踪到6月15日送检的CSF培养检出CRKP,考虑CRKP经未闭合的切口侵入,造成颅内感染,诊断明确。遂与主管医生联系,建议腰大池置管引流,予多黏菌素B腰大池引流管及Ommaya囊局部注射(2.5 mg/次,每处,1次/d),无需静脉联合使用。多黏菌素B局部持续使用至7月12日,体温及炎症指标逐渐恢复正常(图 3)。自6月30日起多次复查脑脊液无明显异常。

|
| 注:A为体温及C-反应蛋白变化趋势;B为血白细胞及降钙素原变化趋势 图 3 5月21日-7月12日各指标变化趋势及抗菌药物使用情况 |
|
|
自2022年7月下旬起,患者反复出现脑疝,头颅CT见第四脑室狭窄闭塞,小脑半球内侧及脑干脑组织肿胀,继发幕上脑室系统积水,脑室进行性扩大,考虑脑膜黏连导致脑脊液循环不畅。先后予左脑室外引流术、左脑室-腹腔分流术、右侧脑室Ommaya囊置入术、右侧脑室-腹腔分流术,但脑疝仍时有发生,至2023年3月21日患者突发心搏呼吸骤停,经抢救无效宣告临床死亡。
2 讨论肺部感染和颅内感染是颅脑手术术后最常见的并发症,也是影响预后的最重要因素。本例患者第四脑室脉络丛乳头状瘤开颅术后因术区积血积液、脑疝行二次手术,术后因持续昏迷、切口愈合差、体温反复,一直未能转出ICU。期间痰培养虽反复检出多重耐药革兰阴性杆菌(MDR-GNB),但哌拉西林他唑巴坦、美罗培南抗菌治疗有效,肺部渗出明显吸收,提示下呼吸道分泌物检出MDR-GNB只是低致病力的定植菌或共生菌[1-2],真正的感染责任菌因敏感度好,在抗菌药物的使用的情况下难以被检出。故对于此类入住ICU的患者,切实做好误吸的综合防控是治疗的重中之重[3]。
本例患者在ICU驻留期间,血培养报告CRKP,并伴有炎症指标升高,主管医生提出使用多黏菌素的申请。抗菌管理部门依据送检的4瓶血培养标本只有1瓶采样3 d后才阳性报警,且在使用“耐药”的美罗培南下PCT已明显下降,否定了CRKP血流感染的存在。通过分析肺部影像演进情况,确定患者再次出现吸入性肺炎,建议停用利奈唑胺,单用美罗培南,此后患者体温及炎症指标的持续下降,支持抗菌管理部门的病情分析和诊治建议。在临床实践中,因血培养检出MDR-GNB而使用多黏菌素的情况较为普遍[4],但即使是血标本这类无菌标本依然存在假阳性结果的可能,这种现象并不少见,与医疗环境常驻耐药菌株通过医务人员接触静脉留置导管表面,导致经导管采集血标本受到污染有关[5]。
盲目依据培养和药敏结果选药是近年来我国多黏菌素、替加环素、头孢他啶阿维巴坦等超广谱抗菌药物及抗真菌药物使用量急剧增加的重要原因[6]。微生物检测结果若与患者感染实际情况不符,应相信患者实际情况而不是微生物检验结果,这是临床医生的基本临床思维。因为微生物标本检测结果受患者所在医疗环境、标本送检时机、先前抗菌药物使用、标本类型、标本采集方法、标本运送及时性、实验室检验质量等众多因素影响[7],检出微生物并不等于病原菌(pathogen)或感染责任菌[8]。对于每一份微生物检测报告都需要经过专业的解读,避免“见菌找药”[9],这是今后各级各类临床医生提升感染诊治能力的核心。
本例患者因切口愈合差、脑脊液外漏,导致CRKP侵入颅内引起感染。CSF培养检出CRKP加上涂片见到革兰阴性杆菌,病原学依据充分。虽然该例患者最终因脑膜黏连、脑疝死亡,但CRKP颅内感染经单独多黏菌素局部使用已彻底治愈。对于MDR-GNB颅内感染的抗菌治疗,现今推荐静脉联合局部使用多黏菌素[10-11]。然而,多黏菌素静脉给药CSF中药物浓度仅有血药浓度的5%[12],没有证据表明静脉使用多黏菌素对MDR-GNB颅内感染的有效性。本院已积累了20余例单独局部使用多黏菌素B治疗MDR-GNB颅内感染的成功病例[13],国外也有多黏菌素局部使用治疗颅内MDR-GNB感染的成功案例[14-15]。基于以上循证证据,单独局部使用多黏菌素B是合理的,不但效果确切,降低了耐药选择压力,也减少了药物费用和相关不良反应的发生。
本例患者诊治经验说明,对于MDR-GNB感染的防控,缩短ICU住院时间、注重切口和引流管的管理、切实做好反流误吸的综合防控以及接触隔离措施是关键,不应依赖抗菌药物,更不能“治菌”不治病。
利益冲突 所有作者声明无利益冲突
| [1] | Tischendorf J, de Avila RA, Safdar N. Risk of infection following colonization with carbapenem-resistant Enterobactericeae: a systematic review[J]. Am J Infect Control, 2016, 44(5): 539-543. DOI:10.1016/j.ajic.2015.12.005 |
| [2] | Huang J, Chen EZ, Qu HP, et al. Sources of multidrug-resistant Acinetobacter baumannii and its role in respiratory tract colonization and nosocomial pneumonia in intensive care unit patients[J]. Chin Med J (Engl), 2013, 126(10): 1826-1831. |
| [3] | 王选锭, 张文宏. 遏制细菌耐药发展: 感染科医师的使命与担当[J]. 中华传染病杂志, 2024, 42(5): 285-290. DOI:10.3760/cma.j.cn311365-20240307-00057 |
| [4] | Karaiskos I, Lagou S, Pontikis K, et al. The "old" and the "new" antibiotics for MDR gram-negative pathogens: for whom, when, and how[J]. Front Public Health, 2019, 7: 151. DOI:10.3389/fpubh.2019.00151 |
| [5] | Boyce JM, Nadeau J, Dumigan D, et al. Obtaining blood cultures by venipuncture versus from central lines: impact on blood culture contamination rates and potential effect on central line-associated bloodstream infection reporting[J]. Infect Control Hosp Epidemiol, 2013, 34(10): 1042-1047. DOI:10.1086/673142 |
| [6] | 宋姣姣, 王选锭. 珍惜稀缺的高档抗菌药物, 避免抗生素后时代全面来临[J]. 中华急诊医学杂志, 2020, 29(4): 443-446. DOI:10.3760/cma.j.issn.1671-0282.2020.04.001 |
| [7] | 蒋鹏, 许杰, 冯玮, 等. 临床微生物标本送检信息化管控系统的构建与应用[J]. 中华医院管理杂志, 2024, 40(5): 356-361. DOI:10.3760/cma.j.cn111325-20230914-00155 |
| [8] | Doern GV, Carroll KC, Diekema DJ, et al. Practical guidance for clinical microbiology laboratories: a comprehensive update on the problem of blood culture contamination and a discussion of methods for addressing the problem[J]. Clin Microbiol Rev, 2019, 33(1): e00009-19. DOI:10.1128/CMR.00009-19 |
| [9] | 冯玮, 王选锭. 重症感染抗菌治疗: 认知误区与改进策略[J]. 中华急诊医学杂志, 2024, 33(4): 455-459. DOI:10.3760/cma.j.issn.1671-0282.2024.04.001 |
| [10] | Tunkel AR, Hasbun R, Bhimraj A, et al. 2017 infectious diseases society of America's clinical practice guidelines for healthcare-associated ventriculitis and meningitis[J]. Clin Infect Dis, 2017, 64(6): e34-e65. DOI:10.1093/cid/ciw861 |
| [11] | Chen L, Li XY, Li DK, et al. Efficacy and safety of intraventricular polymyxin B plus continuous ventricular drainage for the treatment of intracranial infection caused by drug-resistant Acinetobacter baumannii[J]. Ann Palliat Med, 2022, 11(2): 490-497. DOI:10.21037/apm-21-3149 |
| [12] | Markantonis SL, Markou N, Fousteri M, et al. Penetration of colistin into cerebrospinal fluid[J]. Antimicrob Agents Chemother, 2009, 53(11): 4907-4910. DOI:10.1128/AAC.00345-09 |
| [13] | 张昕瑶, 刘怡帆, 王林, 等. 多黏菌素B单独局部给药治疗多重耐药革兰阴性杆菌颅内感染的疗效[J]. 中华传染病杂志, 2024, 42(8): 473-477. DOI:10.3760/cma.j.cn311365-20240514-00131 |
| [14] | Khawcharoenporn T, Apisarnthanarak A, Mundy LM. Intrathecal colistin for drug-resistant Acinetobacter baumannii central nervous system infection: a case series and systematic review[J]. Clin Microbiol Infect, 2010, 16(7): 888-894. DOI:10.1111/j.1469-0691.2009.03019.x |
| [15] | Pan SJ, Huang XF, Wang YS, et al. Efficacy of intravenous plus intrathecal/intracerebral ventricle injection of polymyxin B for post-neurosurgical intracranial infections due to MDR/XDR Acinectobacter baumannii: a retrospective cohort study[J]. Antimicrob Resist Infect Control, 2018, 7: 8. DOI:10.1186/s13756-018-0305-5 |
 2025, Vol. 34
2025, Vol. 34




