发热伴血小板减少综合征(severe fever with thrombocytopenia syndrome, SFTS)是一种主要由蜱虫叮咬引起的传染性疾病,其致病原因为发热伴血小板减少综合征病毒(SFTS virus,又称新型布尼亚病毒)感染[1]。该病毒感染患者的典型临床特征为高烧、乏力,血液检测通常显示白细胞和血小板数量急剧下降[2]。我国科学家在2009年首次发现并命名该病毒。随着诊治技术的逐年提高,SFTS的病死率近年来已从30%降低至16.2%[3]。目前对此新型传染病的发病机理以及传播途径仍有认识不足。本文报道一起重症SFTS患者在某三甲医院急诊科救治过程中发生病毒气溶胶传播致使医护人员感染及救治实例。
1 病例资料病例1为老年男性,71岁,因“发热5 d伴血小板减少1 d”于2024-06-08入院。该患者有高血压病史,口服缬沙坦和氨氯地平控制血压。既往有冠脉支架植入,术后口服阿托伐他汀和硫酸氯吡格雷。患者在农村居住,入院5 d前在湖边钓鱼,自诉被不知名昆虫叮咬后出现发热,最高体温38.7℃,有咳嗽、咳痰,无畏寒、寒战,有全身乏力,头晕、视物旋转,有呃逆,无胸闷气促。入院2 d前出现腹泻,解水样便、黑便,无腹痛。当时到当地医院就诊,查体:体温39℃,脉搏86次/min,呼吸18次/min,血压125/71 mmHg (1 mmHg=0.133 kPa)。患者神志嗜睡,反应迟钝,全身皮肤未见异常,口唇无发绀,双肺呼吸音粗,未及干湿啰音,心率86次/min,律齐,腹平软,无压痛,四肢肌力和肌张力正常,双下肢无水肿。查血常规:LYMPH 0.73×109 L-1,GR% 75.1%,EOS% 0.1%,PLT 47×109L-1,hs-CRP 12.52 mg/L。凝血常规:D-dimer 5.69 mg/L,TT 26.9 s,APTT 45.3 s。血气分析:pH 7.42,PCO2 27.3 mmHg,PO2 64.3 mmHg,K+ 3.72 mmol/L,Na+ 125.7 mmol/L,GLU 7.0 mmol/L,LAC 1.7 mmol/L,HCO3- 17.5 mmol/L,PCT 0.37 mg/L。予利巴韦林、阿比多尔抗病毒,奥马环素覆盖不典型病原体并补液治疗后,未见好转。为进一步诊治,转入某市级三甲医院急诊科治疗。
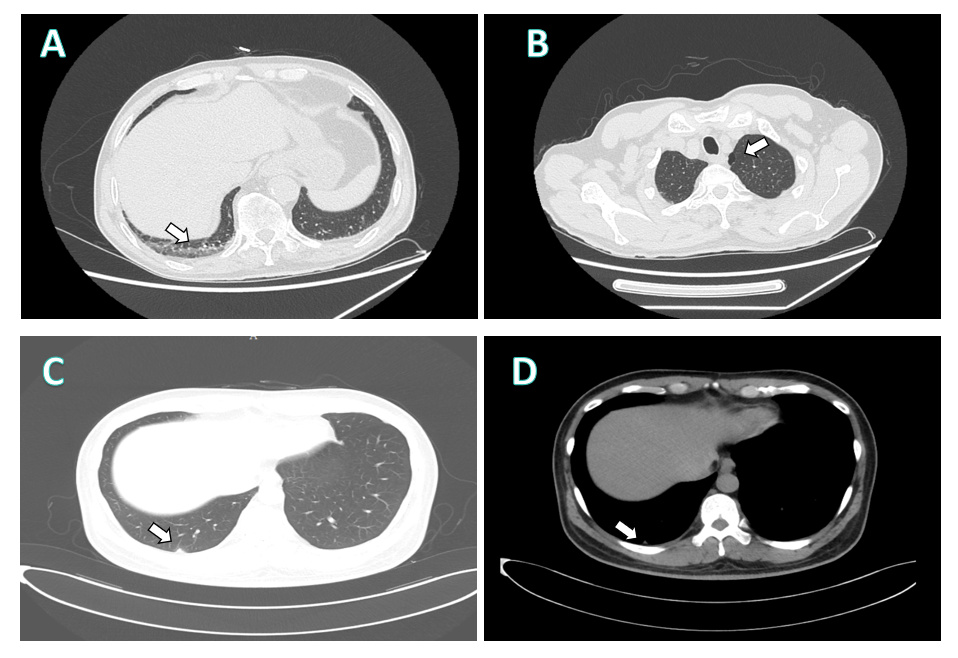
转院后,患者体温37.6℃,脉搏78次/min,呼吸24次/min,血压147/77 mmHg,精神欠佳,后背及左肩有散在出血点,其余皮肤、黏膜无瘀点、瘀斑。四肢湿冷,双下肢明显水肿。查血常规:WBC 2.1×109/L,LY% 13.6%,GR% 84.2%,MONO% 2.2%,PLT 46×109L-1,hs-CRP13.2 mg/L。肝肾功能:ALT 89 U/L,AST 191 U/L,CREA 111. 9 mmo1/L,GGT 119 U/L,CK 565.0 U/L,BUN 11.57 mmo1/L,GLU 8.59 mmo1/L,ALB 30.2 g/L,GLOB 32.9 g/L,Na+ 128.2 mmo1/L, Ca2+ 1.86 mmo1/L,LDH 691.0 U/L。凝血功能:D-dimer 7.40 mg/L,TT 31.7 s,APTT 46.1 s。胸腹部CT:两肺上叶局限性肺气肿,两肺下叶胸膜下少许片絮影(图 1),食管下段管壁增厚伴周围小淋巴结,建议胃镜检查;腹膜后及双侧腹股沟区结节样淋巴结(右侧稍大)。心脏彩超:左房室内径正常,左室壁不增厚,静息状态下各节段收缩活动减弱,左室EF为47%。急查NGS提示新型布尼亚病毒核酸阳性。SOFA评分为2分(意识改变,呼吸频率 > 22次/min)。给予监护、床边隔离,并随即进行抗病毒(法韦拉韦)、抗感染(多西环素)、升血小板、升白细胞,护胃、营养支持等对症治疗。入院2 d后患者凝血障碍加重,予补充凝血因子,输注凝血酶源复合物等治疗。肝肾功能持续恶化,入院5 d后,ALT 2 944 U/L,AST 7 500 U/L,CREA 280.1 mmo1/L。心脏、呼吸、循环均进行性衰竭,血压难以维持,经抢救无效死亡。最后诊断为:①发热伴血小板减少症(新型布尼亚病毒感染);②脓毒性休克;③多器官功能衰竭(肝脏、肾脏、呼吸、凝血);④冠状动脉粥样硬化性心脏病(PCI术后),心功能Ⅱ级。
|
| 图 1 两名病例CT检查结果。A:(病例1)右下叶胸膜下可见少许片絮影(箭头所示);B:(病例1)左肺上叶可见局限性肺气肿(箭头所示);C-D: (病例2)右肺下叶胸膜下结节,周围见少许磨玻璃影,边界欠清(箭头所示) |
|
|
病例2为中年男性,44岁,为病例1的主治医生。在抢救病例1的过程中,全程佩戴医用手套和口罩,穿戴隔离衣,但未佩戴医用护目镜。在做ECMO操作时,病例1有血液喷溅在隔离衣上,但未有直接接触。在对病例1气管插管及断开呼吸机吸痰时,有气溶胶接触的过程。病例2与病例1接触10 d后,于2024-06-18出现发热,最高体温39.5℃,极度乏力,腹泻,无胸闷胸痛,无咳嗽、咳痰,无恶心、呕吐。2024-06-24血常规:WBC 1.5×109L-1,LY% 24.6%,GR% 69.4%,PLT 91×109/L,HGB 140 g/L,CRP 1.6 mg/L。肝肾功能示:ALT 53 U/L,AST 67 U/L,GGT 46.2 U/L, CREA 94.3 mmo1/L,CK 291.4 U/L,ALB 36.6 g/L, GLOB 23.5 g/L,BUN 5.19 mmo1/L,GLU 10.36 mmo1/L,LDH 333.5 U/L, Na+ 133.3 mmo1/L, Ca2+ 2.0 mmo1/L。予玛巴洛沙韦治疗后未见明显好转。2024-06-25因“发热7 d”入院。查体:体温38.3℃,脉搏89次/min,呼吸20次/min,血压128/78 mmHg,神志清晰,面色潮红,结膜充血,全身皮肤未见异常,口唇无发绀,双肺呼吸音粗,未闻及干湿啰音,心率89次/min,律齐,腹平软,全腹无压痛反跳痛,四肢肌力张力正常,有肌肉颤动,双下肢无水肿。给予法维拉韦抗病毒,甲基强的松龙80 mg减轻炎症反应,丙种球蛋白提高免疫功能。入院1d后,查血细胞分析:WBC 7.0×109/L,LY% 12.2%,GR% 80.8%,HGB 158 g/L,HCT 45.2%,hs-CRP < 0.5 mg/L,PLT 94 ×109/L。肝肾功能:ALT 225 U/L,AST 91 U/L,CREA 72.7 mmol/L,BUN 3.72 mmol/L,CK 5 272.0 U/L,GGT 51 U/L,CK-MB 35.6 U/L,ALP 56 U/L,LDH 1 208.0 U/L,TP 68.6 g/L,ALB 36.7 g/L,GLOB 31.9 g/L,GLU 12.01 mmol/L。凝血常规:D-dimer 1.59 mg/L,INR 0.98,PT 11.30 s,APTT 43.3 s, TT 23.9 s,FIB 2.588 g/L,SF > 2 000.00 ng/mL, BDG 1 414.0 pg/mL。胸部CT提示右肺下叶胸膜下结节,周围见少许磨玻璃影,边界欠清(图 1)。给予还原型谷胱甘肽保肝,辅酶Q10营养心肌,伏立康唑抗真菌,乌司他丁抗炎症介质处理。查NGS及核酸检测均提示新型布尼亚病毒感染。立即转入隔离病房,治疗10 d后,除血清铁蛋白偏高,为1 301.41 ng/mL,其余指标均明显好转,生命体征平稳。出院诊断:①发热伴血小板减少症(新型布尼亚病毒感染);②脓毒症;③多器官功能损伤(肝脏、心肌)。本研究已通过医院伦理委员会批准。
2 讨论2010—2021年期间,我国共报告18 968例SFTS病例,发病率为每年0.11/10万,病死率为5.13%。该疾病现归为乙类传染病管理,其病例分布具有一定季节性,5~8月为高峰期。SFTS存在发病率逐年上升、病死率下降的趋势。其中,50岁以上人群发病率高,农民占86.02%,男性死亡比例略高(1.12∶1)[4]。SFTS是由SFTSV感染引起的急性传染病,目前发病机制尚未完全清楚。长角血蜱被认为是SFTSV最主要的病毒库和传播媒介,通过叮咬动物或人进行SFTSV感染[5]。SFTSV为球形病毒,直径为80~100 nm, 表面为脂质双层包膜,有糖蛋白形成的棘突,其基因组由大(L)、中(M)和小(S)3个单股负链RNA节段组成。该病毒属于布尼亚病毒目(bunyavirales),白蛉纤细病毒科(phenuiviridae),班达病毒属(bandavirus)[6]。2011年一项江苏省人与动物病毒血清流行病学调查显示,SFTSV的总抗体血清阳性率为4.24%,提示江苏省存在SFTSV的流行[7]。同时,在江苏地区收集的蜱虫、鸟类和哺乳动物样本中,均检测出SFTSV的RNA[8]。
SFTS的诊断主要以SFTSV的核酸检测和SFTSV抗体的血清学检测为主,结合患者流行病学、临床表现和实验室指标来确定[6]。SFTS患者一般在感染SFTSV后1~2周内(平均为9 d)发病,症状通常表现为急性和持续高热(38℃以上),多伴有畏寒,身体极度乏力和不适,有明显的血液学异常,包括白细胞和血小板减少以及凝血功能障碍,有出血倾向[9]。随着疾病的进展,SFTS患者可能出现恶心、呕吐、腹痛和腹泻等消化系统症状,或意识模糊、昏迷或癫痫等神经系统症状,并造成多脏器功能障碍。造成SFTS患者重症和死亡的危险因素,包括高龄、基础疾病(如高血压、糖尿病或肝功能障碍)或免疫力低下、延迟就医、血小板及白细胞数量低下、出现神经系统并发症(如意识模糊或昏迷)等[10-11]。这些因素的存在,造成不良预后并增加感染个体的病重及致死风险。
目前尚未研发出预防SFTSV感染的疫苗。临床治疗方面,尚无针对SFTSV的特效抗病毒药物,一些广谱抗病毒药物如利巴韦林或法匹拉韦,可能对SFTSV有抑制作用[12]。SFTS的治疗主要以支持性治疗为主,其目的在于有效清除病毒及调节患者免疫反应,方法包括血液净化(如血滤)、免疫治疗(如静脉免疫球蛋白注射)和使用糖皮质激素(减轻炎症反应)等,以及针对患者的并发症(如心肌炎或继发真菌感染)采用相关治疗手段。
一般来说,SFTS的发病因素与蜱虫活动密切相关,包括患者的居住环境(多为农村地区,多山地和草木,温度湿度有利于蜱虫繁殖和生活),动物饲养或接触史,蜱虫叮咬史等[13]。近期研究显示,刺猬和水貂为该病毒的动物扩增宿主,在SFTS的传播中也扮演关键角色[14-15]。因此,除了蜱虫叮咬之外,SFTSV可以通过直接接触感染动物的体液、排泄物或组织进行传播[16]。尤其需要注意的是,猫和犬作为宠物,也可能成为病毒的宿主,而人通过接触感染的动物可以发生病毒传播。已有相关报道证实,在宠物护理机构中,SFTSV可通过动物—动物[17]和动物—兽医传染[18]。这也提示SFTSV病毒传播从野外自然环境向人口密集城市扩散的趋势,这一趋势提高所有人群对病毒暴露的风险。
SFTSV的人-人传染途径,主要包括体液接触和气溶胶传播。目前报道的SFTSV疫情大多源于家庭或院内聚集感染,由直接接触患者的血液、分泌物或排泄物所引起[19-21]。除了血液之外,SFTSV已在患者的咽拭子、肛拭子和尿液中检出[22]。最近,在患者的精液中检测到SFTSV的RNA,显示其通过性传播的可能性[23]。此外,多项研究证实,非直接接触导致的SFTSV经动物传人[24]和人传人[25]感染,很可能是通过气溶胶传播发生的。韩国在2019年报道了一名抢救室医生在穿戴手套和防流体口罩的情况下,对SFTS患者实行液体复苏时,感染了SFTSV[26]。2024年4月,日本国家传染病中心通报了日本第一例SFTSV的人传人事件,一名20多岁的医生在为一名90多岁SFTS患者移除导管时,感染了SFTSV(两人的病毒基因序列检测完全一致),当时该医生佩戴口罩和手套但未佩戴防护镜[27]。因此,SFTS的人际传播主要通过接触感染者的体液,特别是在医疗环境中及家庭接触之间,除了直接接触感染源,SFTSV也可通过气溶胶传播造成感染。
动物模型已证实,SFTSV可通过口腔和眼部进行传染[28]。同时,经过严格消毒程序的SFTS患者救治室,在其广泛的环境范围内,包括医疗设备表面、床位周边等,均可检测到SFTSV的RNA[29]。一项关于SFTSV院内感染的临床研究表明,接触SFTS患者血液,在小于50厘米或超过30分钟的暴露条件下,极大增加了SFTSV人传人的风险[30]。这些研究结果,不仅显示了SFTSV病毒在特定情境下的传播力,更加强调了在高风险环境中密切接触感染源的人群应采取完备的防护措施。比如,对SFTS患者的家庭成员而言,在护送患者前往医院救治过程中,或日常护理患者或接触去世患者的遗体时,应采取对患者和本人的防护隔离措施。对疑似SFTSV感染者实行救治的医护人员,除了遵循基本防护要求之外,应严格佩戴手套、医用N95口罩和护目镜,穿好医用防护/隔离服,并在隔离病房内对SFTS患者施行救治,从而有效降低SFTS的人际传播风险。
本文报道一例典型SFTSV感染患者病例,该患者因脓毒性休克死亡, 而参与救治的医护人员出现类似症状, 被确诊为SFTSV感染引发脓毒症,最终被救治成功。本文分享SFTS的临床特征和治疗经验。虽然蜱虫叮咬是SFTS的主要传播方式,越来越多的案例显示人际传播不可忽视,尤其需要注意SFTSV可通过气溶胶进行人际传播的途径。该传播途径尚未在2023年国家卫健委最新发布的《发热伴血小板减少综合征诊疗方案》中得以强调[6]。
利益冲突 所有作者声明无利益冲突
| [1] | Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel bunyavirus in China[J]. N Engl J Med, 2011, 364(16): 1523-1532. DOI:10.1056/nejmoa1010095 |
| [2] | Li JC, Zhao J, Li H, et al. Epidemiology, clinical characteristics, and treatment of severe fever with thrombocytopenia syndrome[J]. Infect Med (Beijing), 2022, 1(1): 40-49. DOI:10.1016/j.imj.2021.10.001 |
| [3] | Li H, Lu QB, Xing B, et al. Epidemiological and clinical features of laboratory-diagnosed severe fever with thrombocytopenia syndrome in China, 2011-17: a prospective observational study[J]. Lancet Infect Dis, 2018, 18(10): 1127-1137. DOI:10.1016/S1473-3099(18)30293-7 |
| [4] | 岳玉娟, 任东升, 鲁亮. 2010—2021年中国发热伴血小板减少综合征流行病学分析[J]. 疾病监测, 2024, 39(7): 824-830. DOI:10.3784/jbjc.202307030309 |
| [5] | Zhuang L, Sun Y, Cui XM, et al. Transmission of severe fever with thrombocytopenia syndrome virus by Haemaphysalis longicornis ticks, China[J]. Emerg Infect Dis, 2018, 24(5): 868-871. DOI:10.3201/eid2405.151435 |
| [6] | 发热伴血小板减少综合征诊疗方案(2023年版). 中国感染控制杂志, 23(7): 918-920. DOI: 10.12138/j.issn.1671-9638.20245430. |
| [7] | 张文帅, 曾晓燕, 周明浩, 等. 江苏省发热伴血小板减少综合征布尼亚病毒血清流行病学调查[J]. 疾病监测, 2011, 26(9): 676-678. DOI:10.3784/j.issn.1003-9961.2011.09.003 |
| [8] | Li ZF, Bao CJ, Hu JL, et al. Ecology of the tick-borne phlebovirus causing severe fever with thrombocytopenia syndrome in an endemic area of China[J]. PLoS Negl Trop Dis, 2016, 10(4): e0004574. DOI:10.1371/journal.pntd.0004574 |
| [9] | Casel MA, Park SJ, Choi YK. Severe fever with thrombocytopenia syndrome virus: emerging novel phlebovirus and their control strategy[J]. Exp Mol Med, 2021, 53(5): 713-722. DOI:10.1038/s12276-021-00610-1 |
| [10] | Gai ZT, Zhang Y, Liang MF, et al. Clinical progress and risk factors for death in severe fever with thrombocytopenia syndrome patients[J]. J Infect Dis, 2012, 206(7): 1095-1102. DOI:10.1093/infdis/jis472 |
| [11] | Dong Y, Lin SH, Jiang L, et al. Clinical characteristics and risk factors of 267 patients having severe fever with thrombocytopenia syndrome-new epidemiological characteristics of fever with thrombocytopenia syndrome: Epidemiological characteristics of SFTS[J]. Medicine (Baltimore), 2022, 101(50): e31947. DOI:10.1097/MD.0000000000031947 |
| [12] | Zhang Y, Huang Y, Xu YH. Antiviral treatment options for severe fever with thrombocytopenia syndrome infections[J]. Infect Dis Ther, 2022, 11(5): 1805-1819. DOI:10.1007/s40121-022-00693-x |
| [13] | Ding F, Guan XH, Kang K, et al. Risk factors for bunyavirus-associated severe Fever with thrombocytopenia syndrome, China[J]. PLoS Negl Trop Dis, 2014, 8(10): e3267. DOI:10.1371/journal.pntd.0003267 |
| [14] | Zhao CY, Zhang X, Si XX, et al. Hedgehogs as amplifying hosts of severe fever with thrombocytopenia syndrome virus, China[J]. Emerg Infect Dis, 2022, 28(12): 2491-2499. DOI:10.3201/eid2812.220668 |
| [15] | Wang Y, Yang MF, Zhou H, et al. Outbreak of natural severe fever with thrombocytopenia syndrome virus infection in farmed minks, China[J]. Emerg Infect Dis, 2024, 30(6): 1299-1301. DOI:10.3201/eid3006.240283 |
| [16] | 周麟玲, 刘博, 常爱娜, 等. 新型布尼亚病毒感染68例临床特征及预后分析[J]. 中华传染病杂志, 2015, 33(2): 75-78. DOI:10.3760/cma.j.issn.1000-6680.2015.02.003 |
| [17] | Mekata H, Umeki K, Yamada K, et al. Nosocomial severe fever with thrombocytopenia syndrome in companion animals, Japan, 2022[J]. Emerg Infect Dis, 2023, 29(3): 614-617. DOI:10.3201/eid2903.220720 |
| [18] | Yamanaka A, Kirino Y, Fujimoto S, et al. Direct transmission of severe fever with thrombocytopenia syndrome virus from domestic cat to veterinary personnel[J]. Emerg Infect Dis, 2020, 26(12): 2994-2998. DOI:10.3201/eid2612.191513 |
| [19] | Jiang XL, Zhang S, Jiang M, et al. A cluster of person-to-person transmission cases caused by SFTS virus in Penglai, China[J]. Clin Microbiol Infect, 2015, 21(3): 274-279. DOI:10.1016/j.cmi.2014.10.006 |
| [20] | Yoo JR, Choi JH, Kim YR, et al. Occupational risk of severe fever with thrombocytopenia syndrome in healthcare workers[J]. Open Forum Infect Dis, 2019, 6(5): ofz210. DOI:10.1093/ofid/ofz210 |
| [21] | Gai ZT, Liang MF, Zhang Y, et al. Person-to-person transmission of severe fever with thrombocytopenia syndrome bunyavirus through blood contact[J]. Clin Infect Dis, 2012, 54(2): 249-252. DOI:10.1093/cid/cir776 |
| [22] | Hu LF, Bian TT, Chen Q, et al. Viral shedding pattern of severe fever with thrombocytopenia syndrome virus in severely ill patients: a prospective, Multicenter cohort study[J]. Heliyon, 2024, 10(13): e33611. DOI:10.1016/j.heliyon.2024.e33611 |
| [23] | Koga S, Takazono T, Ando T, et al. Severe fever with thrombocytopenia syndrome virus RNA in Semen, Japan[J]. Emerg Infect Dis, 2019, 25(11): 2127-2128. DOI:10.3201/eid2511.190061 |
| [24] | Li JZ, Wang CP, Li X, et al. Direct transmission of severe fever with thrombocytopenia syndrome virus from farm-raised fur animals to workers in Weihai, China[J]. Virol J, 2024, 21(1): 113. DOI:10.1186/s12985-024-02387-x |
| [25] | Liu T, Zhang NN, Li HW, et al. Analysis of severe fever with thrombocytopenia syndrome cluster in East China[J]. Virol J, 2023, 20(1): 199. DOI:10.1186/s12985-023-02155-3 |
| [26] | Moon J, Lee H, Jeon JH, et al. Aerosol transmission of severe fever with thrombocytopenia syndrome virus during resuscitation[J]. Infect Control Hosp Epidemiol, 2019, 40(2): 238-241. DOI:10.1017/ice.2018.330 |
| [27] | https://english.news.cn/20240324/d3f6ed59fd4748cf8d344b08a9de4fa8/c.html. |
| [28] | Zhou CM, Qi R, Qin XR, et al. Oral and ocular transmission of severe fever with thrombocytopenia syndrome virus[J]. Infect Med (Beijing), 2022, 1(1): 2-6. DOI:10.1016/j.imj.2021.12.002 |
| [29] | Ryu BH, Kim JY, Kim T, et al. Extensive severe fever with thrombocytopenia syndrome virus contamination in surrounding environment in patient rooms[J]. Clin Microbiol Infect, 2018, 24(8): 911-911911.e4. DOI:10.1016/j.cmi.2018.01.005 |
| [30] | Hu L, Li J, Zhang H, et al. Predisposing factors for person-to-person transmission of severe fever with thrombocytopenia syndrome bunyavirus[J]. J Hosp Infect, 2022, 123: 174-178. DOI:10.1016/j.jhin.2021.10.023 |
 2025, Vol. 34
2025, Vol. 34




