大脑是一个代谢十分活跃的器官,尽管其重量仅占全身体重的2%,但脑血流量(cerebral blood flow, CBF)却占心输出量的15%,脑耗氧量占全身耗氧量的20%[1],大脑高耗氧量的特点突出了保证脑血流供应的重要性,由此我们可以看出脑组织对缺血缺氧的耐受性是极差的,保证充足的脑灌注对于各类颅脑损伤的恢复以及继发性颅脑损伤的防治具有重要意义。
与外周循环不同,CBF的调节机制更加精密和复杂,这些机制包括脑自动调节、血管对血管活性刺激的反应性、神经血管耦合以及内皮依赖性反应[2]。重症监护病房中的患者常常存在脑功能异常,脑自主调节功能障碍是神经功能障碍发生的重要原因,本文主要讨论脑自动调节在危重症患者中的研究进展。
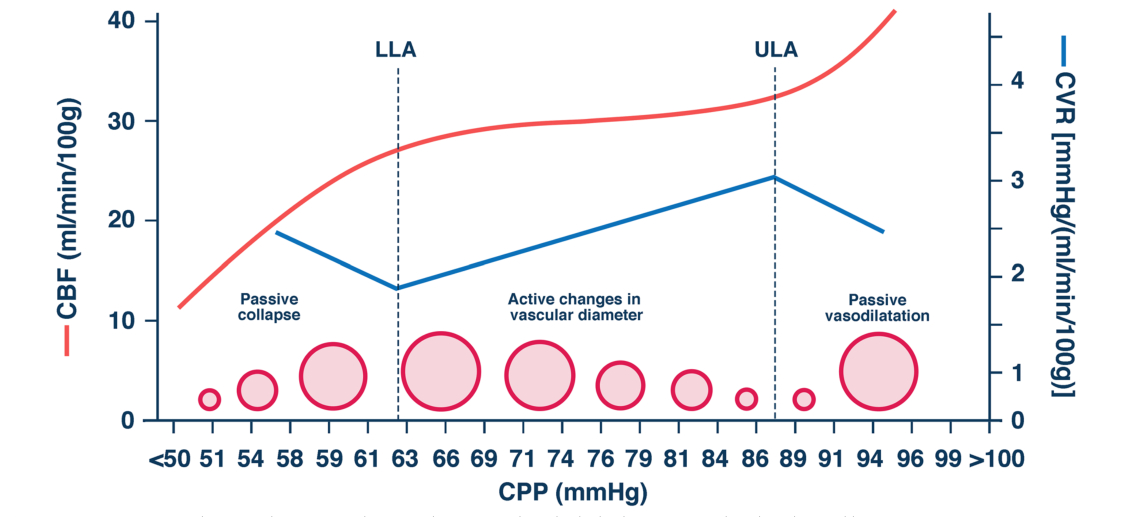
1 脑自动调节 1.1 脑自动调节的概述1959年Lassen[3]根据既往的研究数据,绘制了11组患者的CBF与血压(blood pressure, BP)的关系图,该图显示在一定的平均动脉压(mean arterial pressure, MAP)范围内(50~150 mmHg之间,1 mmHg=0.133 kPa),CBF总是处于一个相对稳定的水平,Lassen将这一发现称为“脑自动调节”(cerebral autoregulation, CA),而这条曲线被称之为“Lassen曲线”。Lassen曲线显示,CBF在血压或脑灌注压(cerebral perfusion pressure, CPP)的两个值之间基本恒定,这两个值分别被称为自动调节下限(lower limit of autoregulation, LLA)和自动调节上限(upper limit of autoregulation, ULA)。当CA受到干扰时,脑血流将完全被动的依赖血压的变化,低CPP可导致全脑缺血,而高CPP可导致脑出血、脑水肿、颅内高压,这两种情况都可以导致神经元损伤,从而引发急性的脑功能障碍[4]。
目前人们对于脑血管阻力调节的机制和位置尚未完全研究确切,获得广泛认可的CA调节机制包括以下四种:⑴肌源性因素血压升高或降低时,跨壁压改变,血管平滑肌细胞内外的Ca2+发生流动从而引起血管舒缩[6]。⑵神经源性因素人们通过干扰自主神经系统,从而验证自主神经参与CA的产生[7]。⑶代谢性因素血管周围的小分子发生改变就会刺激血管,导致血管收缩或舒张,进而调节脑血流量[8]。⑷内皮细胞因素内皮细胞能够分泌血管舒张剂调节血管张力,改变脑血流[9]。
1.2 脑自动调节的评估方法实时动态连续的脑自动调节评估工具有助于临床医生理解脑血流改变对病情变化的影响,并为以CA为导向的血流动力学管理奠定基础。要评估脑自动调节首先要区分动态脑自动调节(dynamic cerebral autoregulation, dCA)和静态脑自动调节(static cerebral autoregulation, sCA)。dCA是指BP在几秒或几分钟内快速变化时CBF的变化;sCA是指BP达到稳态时(几分钟或几小时)所测得的CBF的变化[10]。随着技术的发展,具有高时间分辨率且可以实现即时同步测量脑血流及动脉压的监测技术开始应用于临床,实现了对脑血流动力学的动态分析。
1990年Giller[11]将传递函数分析(transfer function analysis, TFA)应用于dCA,该分析方法的参数有三个:增益、相位差、一致性函数,这些参数能够全面地分析BP与CBF的动态关系。此外,近红外光谱(near infrared reflectance spectroscopy, NIRS)测量局部脑氧饱和度(regional cerebral oxygen saturation, rSO2),经颅多普勒超声(transcranial doppler ultrasound, TCD)监测血流速度,通过这两项技术,人们可以计算出反映CA的衍生指数,分别被称为脑氧合指数(cerebral oxygenation index, COX)和平均速度指数(mean velocity index, Mx),它们分别是指rSO2、脑血流速度分别与MAP之间的Pearson相关系数[12-13]。
脑组织氧分压、颅内压(intracranial pressure, ICP)、激光多普勒血流测定仪、微透析技术,这些技术需要将探头置入颅内,属于侵入性的监测手段,因此主要适用于颅脑损伤的患者。这些技术联合有创动脉压可以计算出多个自动调节指数,其中在颅脑损伤患者中应用最为广泛的是压力反应性指数(pressure reactivity index, PRx)[14]。目前评估CA方法有许多,但“金标准”尚未确立,不同的评估方法之间存在着一定的差异,Caicedo等[15]分析了用于评估CA的四种测量模型(相关性、相干性、修正相干性和传递函数),传递函数增益和相关性被认为是用于CA研究时最稳健的方法。
2003年英国剑桥大学推出了一个重症多模态监测软件(ICM+®,Cambridge Enterprise, University of Cambridge, UK),它可以对ICP、CPP、TCD、NIRS、脑自动调节指数等多种神经监测数据进行在线处理和分析,为个体化血压/灌注压的临床应用奠定了基础[16-17]。但需要指出的是,ICM+®软件目前尚未能作为医疗设备获得许可,更多的是作为研究软件应用于科研。
2 脑自动调节在危重疾病中的研究发展 2.1 脑自动调节在心脏骤停中的研究进展心脏骤停后原发性和继发性的神经损伤会导致缺血缺氧性脑病,在血流部分或完全恢复后,由于难治性低血压、CA受损引起的脑灌注不足,会导致持续或反复的脑供氧不足,引起继发性的脑损伤[18]。CA功能障碍是心脏骤停后CBF紊乱的重要机制之一,在心脏骤停后的急性期,很多患者的CA曲线可能出现缺失或右移[19],而心脏骤停早期CA受损与较差的神经功能预后相关[20-22]。一项观察性研究[23]显示,既往存在慢性高血压疾病的患者更容易在心脏骤停后出现CA受损,ULA降低以及维持CA的MAP范围缩小与心脏骤停患者不良的神经功能预后相关,因此,对心脏骤停患者进行CA监测是有必要的。值得关注的是,最近一项研究发现[24],在昏迷和通气的心脏骤停患者中,左右两侧的rSO2和COX没有差异, 这表明,在没有局灶性病变的患者中,单侧记录可能足以评估CA状态或提供MAPopt靶点。
理论上,心脏骤停后,CA受损,CPP可能会直接依赖于MAP的变化,通过提高MAP有望改善心脏骤停患者的脑氧合,但一项研究发现与较低的MAP(65~75 mmHg)相比,较高水平的MAP(80~100 mmHg)对于心脏骤停后患者的脑氧合没有影响[25]。由于缺乏随机试验的高质量数据,目前的指南没有给出心脏骤停后血压的具体目标,CA导向的个体化目标血压管理是近年来许多研究的热点。通过PRx可以计算出心脏骤停患者的最佳平均动脉压(the 0ptimal mean arterial pressure, MAPopt),Sekhon等[26]研究发现由PRx衍生的MAPopt与脑组织氧合增加有关。
心脏骤停后减轻脑损伤的其中一个关键措施就是亚低温治疗,低温治疗可以降低脑组织的代谢水平,减轻大脑的继发性损伤[27]。在一项心脏骤停的猪动物模型研究中发现,在低温治疗期间,心脏骤停患者的CA曲线左移[28],表明低温治疗能够影响CA的状态。在最近的一项纳入50例心脏骤停患者的研究[29]中,人们发现预后良好组与预后不良组在诱导性低温(33.2~34 ℃)期间Mx并无差异,但诱导性低温期间的Mx较复温后(36.6~37.4℃)低,表明亚低温治疗有利于保留患者的CA,这与Sekhon等[30]所观察到的结果相似。
2.2 脑自动调节在严重感染性疾病中的研究进展脓毒血症是由宿主对感染反应失调引起的危及生命的器官功能障碍[31]。脓毒症中最易受影响的器官之一是大脑,脓毒症相关脑病(sepsis-associated encephalopathy, SAE)是ICU中最常见的脑病类型,SAE大多表现为谵妄[32-33]。SAE的病理生理机制尚未完全清楚,循环障碍导致的CA受损可能参与了SAE的发病过程。多项研究表明大部分脓毒症患者的CA受损,并且与SAE(或脓毒症相关性谵妄)的发生独立相关[34-36]。
严重的感染极易导致休克的发生,Caldas等[37]研究发现循环休克通常与CA受损有关,并且CA受损的严重程度与多器官功能衰竭的严重程度相关。休克导致循环流向神经组织的血流量减少,CA受损难以通过调节脑血管阻力来维持脑血流量,这提示SAE可能继发于脑微循环功能障碍所致的血液供应不足。此外,即使在没有严重低血压的情况下,由于脓毒症患者CA和微循环的受损,CBF出现轻微的下降也可能会导致高级的认知功能障碍,这可能是由于脑组织存在高代谢率、高耗氧量的特点所决定的[38]。
已经有研究确定了脓毒症期间CA受损的几个潜在原因,包括一氧化氮积累、神经炎症引起的血脑屏障破坏和微循环受损[39]。此外,Lucia[40]认为脓毒症中CA的损害还可能是因为患者的实际MAP低于LLA,因为LLA在健康的和患病的人群中都有可能存在差异[41],与正常血压患者相比,慢性高血压患者的CA曲线会右移,LLA变高,这可能会导致临床所认为的“正常”的MAP实际上低于生理的LLA[42],低于LLA的MAP更容易出现低灌注的风险。当然,我们在脓毒症的循环管理中,必须要理解脓毒症是一个涉及多器官功能障碍的综合征,全身感染导致循环障碍,不同器官对于灌注的需求可能存在一些差异,目前指南推荐脓毒症患者的目标血压应≥65 mmHg以满足全身大部分器官对于灌注的需求,以CA为导向的血流动力学管理目前仍缺乏高质量的研究,未来的研究还需要关注脑与脑外器官的相互作用。
2.3 脑自动调节在创伤颅脑损伤中的研究进展外伤性脑损伤(traumatic brain injury, TBI)的临床管理侧重于预防继发性脑损伤和恢复神经功能,而中重度的颅脑损伤会破坏CA[12],这些患者的脑血流量将被动地依赖BP的改变,BP的剧烈变化极有可能会增加继发性神经功能损伤的风险。颅脑创伤后CA受损会使出现不良神经预后和死亡的风险增加[43-44],因此在TBI的治疗过程中监测CA具有重要意义。
1997年Czosnyka等[14]利用连续ICP与MAP之间的关系计算出了PRx,这是一种便捷的可床旁监测的连续性CA指标,许多研究发现PRx与中/重度TBI患者的不良预后具有较强的相关性[45-47],并且由PRx衍生的最佳灌注压(the optimal cerebral perfusion pressure, CPPopt)目前已经成为TBI最为热门的研究要点之一,相关内容在第三部分进行阐述。
在ICU的监护治疗中,尽管普遍知道大部分中重度TBI患者都难以避免CA受损,且CA的受损与这些疾病的预后相关,但目前指南的治疗对于逆转受损的CA的作用似乎是有限的,这可能与其较为复杂的分子机制有关。2023年的一项单中心临床随机交叉试验并未发现肺保护性通气对无肺损伤的TBI患者的CA有益[48],一项前瞻性研究显示短期的高氧血症似乎并不会影响PRx[49],但这一研究结果与Leonardo等的发现相反。此外,高渗盐水可能有助于降低PRx,改善脑血管反应性[50-51],这可能是ICP降低的结果,因为高颅压会驱动CA受损[52],未来需要更多的研究关注哪种治疗措施/药物有助于改善CA受损。
2.4 脑自动调节在缺血性脑卒中中的研究进展缺血性脑卒中(ischemic stroke, IS)的发生涉及多种机制,如原位血栓形成、动脉栓塞、血流动力学不稳定等,研究表明,CA受损、灌注不足和侧支循环不足可能单独或相互作用导致IS的发生[53]。脑血管储备是IS的重要预测因子,CA是维持稳定的脑血管储备的关键因素,脑血管储备减少表明小血管的舒张运动难以在脑低灌注区域维持正常的血流[54-55]。研究发现CA的受损模式在不同的IS机制中具有异质性,母动脉栓塞的患者常常出现同侧大脑半球CA受损;由低灌注、动脉到动脉栓塞或混合机制引起的IS,以及来源不明的栓塞性卒中,双侧CA均受损[56-57]。
血管内治疗(endovascular therapy, EVT)是治疗颅内大血管闭塞的重要手段,有研究发现CA与EVT治疗的IS患者预后之间存在相关性,在IS症状出现后的前7天,同侧半球和对侧半球的CA受损,症状出现24 h后同侧半球的CA与接受EVT的IS患者的临床结局独立相关[58]。对于静脉性溶栓(intravenous thrombolysis, IVT)的患者,CA也是IVT患者预后的预测因素,IS发病后1~3 d两侧和发病后7~10 d患侧CA值与IVT患者的不良结局相关,在接受IVT的轻中度卒中患者中,基于CA的Nomograms模型显著提高了对3个月不良预后的风险预测能力[59]。
3 脑自动调节导向的脑灌注治疗最佳器官灌注是避免组织缺血和过度灌注的基础,基于CA的概念,维持一个恰当的MAP/CPP以确保足够的脑灌注对于减少继发性的神经损伤具有重要意义。Czosnyka等[43]将Mx与BP/CPP之间的关系绘制成一条U型曲线,MAPopt/CPPopt定义为U型曲线最低点所对应的MAP/CPP,在这一个点脑自动调节的能力是最强的,此后基于CA衍生的MAPopt/CPPopt成为了个体化危重症监护管理的研究热点。
Kirschen等[60]研究发现在心脏骤停后的最初24 h内,MAP低于COX衍生的MAPopt-5mmHg的幅度及百分时间可能与儿童的不良神经功能预后相关,他们在成人心脏骤停的患者中也取得了相似的研究结果[21]。在创伤性颅脑损伤中,当CPP接近CPPopt时出现良好预后的可能性更大,实际CPP和CPPopt之间差距较大(> 10 mmHg)的患者更可能出现不良预后[61-63]。在脓毒症的群体中,个体之间的MAPopt存在着较大的差异,这些差异可能反映的脓毒症患者CA的紊乱[64-65],MAP偏离MAPopt与脓毒症患者的神经功能预后的研究相对较少,一个小型的回顾性研究并未发现MAPopt与谵妄发生或谵妄天数之间的关联[65]。
2014年神经重症监护学会联合欧洲重症监护医学学会发表了一份危重症监护多模式监测的国际多学科共识,共识中提到持续监测CA可能有助于将创伤性脑损伤患者的BP和CPP靶点滴定到“最佳”水平,并可能有助于预测预后[66]。但目前尚未有指南推荐将CA引导的CPPopt/MAPopt作为循环管理的靶点,原因是针对CPPopt/MAPopt的滴定治疗的安全性和有效性仍缺乏大型的高质量研究,对于这一空白,2021年Jeanette在颅脑损伤的患者中进行了一次探索,一项纳入了60例TBI患者的COGiTATE试验(the CPPopt guided therapy: assessment of target effectiveness)证实CPPopt是安全、可行的[67],但与传统的CPP/MAP目标相比,采用CPPopt作为治疗靶点能否改善临床预后、脑氧合、脑血流、脑损伤标志物以及能否减轻大脑损伤的严重程度仍有待进一步研究。
综上,本文就CA在部分常见危重疾病中的研究进展进行了回顾和综述。CA是调节脑血流的重要机制,与许多神经系统功能障碍息息相关。监测CA的目标是为了减少CBF紊乱对大脑造成的继发性损害,随着科技的发展,多模态神经功能监测使得CA的评估越发便捷,未来需进一步探寻逆转CA受损的干预方法以改善这些患者的神经功能预后。此外,基于CA概念的个体化治疗是神经重症监护治疗的一个重要发展方向,尽管我们已经取得了一部分进展,但目前仍缺乏足够证据证明CA衍生的MAPopt/CPPopt可以广泛地应用于神经危重症的患者。
利益冲突 所有作者声明无利益冲突
| [1] | Williams LR, Leggett RW. Reference values for resting blood flow to organs of man[J]. Clin Phys Physiol Meas, 1989, 10(3): 187-217. DOI:10.1088/0143-0815/10/3/001 |
| [2] | Claassen JAHR, Thijssen DHJ, Panerai RB, et al. Regulation of cerebral blood flow in humans: physiology and clinical implications of autoregulation[J]. Physiol Rev, 2021, 101(4): 1487-1559. DOI:10.1152/physrev.00022.2020 |
| [3] | Lassen NA. Cerebral blood flow and oxygen consumption in man[J]. Physiol Rev, 1959, 39(2): 183-238. DOI:10.1152/physrev.1959.39.2.183 |
| [4] | Peixoto AJ. Acute severe hypertension[J]. N Engl J Med, 2019, 381(19): 1843-1852. DOI:10.1056/nejmcp1901117 |
| [5] | Hawryluk GWJ, Citerio G, Hutchinson P, et al. Intracranial pressure: current perspectives on physiology and monitoring[J]. Intensive Care Med, 2022, 48(10): 1471-1481. DOI:10.1007/s00134-022-06786-y |
| [6] | Fog M. The relationship between the blood pressure and the tonic regulation of the pial arteries[J]. J Neurol Psychiatry, 1938, 1(3): 187-197. DOI:10.1136/jnnp.1.3.187 |
| [7] | Zhang R, Crandall CG, Levine BD. Cerebral hemodynamics during the Valsalva maneuver: insights from ganglionic blockade[J]. Stroke, 2004, 35(4): 843-847. DOI:10.1161/01.STR.0000120309.84666.AE |
| [8] | Rangel-Castilla L, Gasco J, Nauta HJW, et al. Cerebral pressure autoregulation in traumatic brain injury[J]. Neurosurg Focus, 2008, 25(4): E7. DOI:10.3171/FOC.2008.25.10.E7 |
| [9] | Golding EM, Marrelli SP, You JP, et al. Endothelium-derived hyperpolarizing factor in the brain: a new regulator of cerebral blood flow?[J]. Stroke, 2002, 33(3): 661-663. |
| [10] | Panerai RB. Assessment of cerebral pressure autoregulation in humans: a review of measurement methods[J]. Physiol Meas, 1998, 19(3): 305-338. DOI:10.1088/0967-3334/19/3/001 |
| [11] | Giller CA. The frequency-dependent behavior of cerebral autoregulation[J]. Neurosurgery, 1990, 27(3): 362-368. DOI:10.1097/00006123-199009000-00004 |
| [12] | Czosnyka M, Smielewski P, Kirkpatrick P, et al. Monitoring of cerebral autoregulation in head-injured patients[J]. Stroke, 1996, 27(10): 1829-1834. DOI:10.1161/01.str.27.10.1829 |
| [13] | Moerman AT, Vanbiervliet VM, Van Wesemael A, et al. Assessment of cerebral autoregulation patterns with near-infrared spectroscopy during pharmacological-induced pressure changes[J]. Anesthesiology, 2015, 123(2): 327-335. DOI:10.1097/ALN.0000000000000715 |
| [14] | Czosnyka M, Smielewski P, Kirkpatrick P, et al. Continuous assessment of the cerebral vasomotor reactivity in head injury[J]. Neurosurgery, 1997, 41(1): 11-17. DOI:10.1097/00006123-199707000-00005 |
| [15] | Caicedo A, Naulaers G, Lemmers P, et al. Detection of cerebral autoregulation by near-infrared spectroscopy in neonates: performance analysis of measurement methods[J]. J Biomed Opt, 2012, 17(11): 117003. DOI:10.1117/1.JBO.17.11.117003 |
| [16] | Smielewski P, Czosnyka Z, Kasprowicz M, et al. ICM+: a versatile software for assessment of CSF dynamics[J]. Acta Neurochir Suppl, 2012, 114: 75-79. DOI:10.1007/978-3-7091-0956-4_13 |
| [17] | Smielewski P, Lavinio A, Timofeev I, et al. ICM+, a flexible platform for investigations of cerebrospinal dynamics in clinical practice[J]. Acta Neurochir Suppl, 2008, 102: 145-151. DOI:10.1007/978-3-211-85578-2_30 |
| [18] | Perkins GD, Callaway CW, Haywood K, et al. Brain injury after cardiac arrest[J]. Lancet, 2021, 398(10307): 1269-1278. DOI:10.1016/S0140-6736(21)00953-3 |
| [19] | Sundgreen C, Larsen FS, Herzog TM, et al. Autoregulation of cerebral blood flow in patients resuscitated from cardiac arrest[J]. Stroke, 2001, 32(1): 128-132. DOI:10.1161/01.str.32.1.128 |
| [20] | Pham P, Bindra J, Chuan A, et al. Are changes in cerebrovascular autoregulation following cardiac arrest associated with neurological outcome? Results of a pilot study[J]. Resuscitation, 2015, 96: 192-198. DOI:10.1016/j.resuscitation.2015.08.007 |
| [21] | Kirschen MP, Majmudar T, Diaz-Arrastia R, et al. Deviations from PRx-derived optimal blood pressure are associated with mortality after cardiac arrest[J]. Resuscitation, 2022, 175: 81-87. DOI:10.1016/j.resuscitation.2022.03.003 |
| [22] | Balu R, Rajagopalan S, Baghshomali S, et al. Cerebrovascular pressure reactivity and intracranial pressure are associated with neurologic outcome after hypoxic-ischemic brain injury[J]. Resuscitation, 2021, 164: 114-121. DOI:10.1016/j.resuscitation.2021.04.023 |
| [23] | Laurikkala J, Aneman A, Peng A, et al. Association of deranged cerebrovascular reactivity with brain injury following cardiac arrest: a post-hoc analysis of the COMACARE trial[J]. Crit Care, 2021, 25(1): 350. DOI:10.1186/s13054-021-03764-6 |
| [24] | Hazenberg L, Aries M, Beqiri E, et al. Are NIRS-derived cerebral autoregulation and ABPopt values different between hemispheres in hypoxic-ischemic brain injury patients following cardiac arrest?[J]. J Clin Monit Comput, 2023, 37(5): 1427-1430. DOI:10.1007/s10877-023-01008-2 |
| [25] | Jakkula P, Pettilä V, Skrifvars MB, et al. Targeting low-normal or high-normal mean arterial pressure after cardiac arrest and resuscitation: a randomised pilot trial[J]. Intensive Care Med, 2018, 44(12): 2091-2101. DOI:10.1007/s00134-018-5446-8 |
| [26] | Sekhon MS, Gooderham P, Menon DK, et al. The burden of brain hypoxia and optimal mean arterial pressure in patients with hypoxic ischemic brain injury after cardiac arrest[J]. Crit Care Med, 2019, 47(7): 960-969. DOI:10.1097/CCM.0000000000003745 |
| [27] | Yenari MA, Han HS. Neuroprotective mechanisms of hypothermia in brain ischaemia[J]. Nat Rev Neurosci, 2012, 13(4): 267-278. DOI:10.1038/nrn3174 |
| [28] | Lee JK, Yang ZJ, Wang B, et al. Noninvasive autoregulation monitoring in a swine model of pediatric cardiac arrest[J]. Anesth Analg, 2012, 114(4): 825-836. DOI:10.1213/ANE.0b013e31824762d5 |
| [29] | Crippa IA, Vincent JL, Zama Cavicchi F, et al. Cerebral autoregulation in anoxic brain injury patients treated with targeted temperature management[J]. J Intensive Care, 2021, 9(1): 67. DOI:10.1186/s40560-021-00579-z |
| [30] | Sekhon MS, Smielewski P, Bhate TD, et al. Using the relationship between brain tissue regional saturation of oxygen and mean arterial pressure to determine the optimal mean arterial pressure in patients following cardiac arrest: a pilot proof-of-concept study[J]. Resuscitation, 2016, 106: 120-125. DOI:10.1016/j.resuscitation.2016.05.019 |
| [31] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [32] | Bleck TP, Smith MC, Pierre-Louis SJ, et al. Neurologic complications of critical medical illnesses[J]. Crit Care Med, 1993, 21(1): 98-103. DOI:10.1097/00003246-199301000-00019 |
| [33] | Esen F, Orhun G, Özcan PE, et al. Diagnosing acute brain dysfunction due to sepsis[J]. Neurol Sci, 2020, 41(1): 25-33. DOI:10.1007/s10072-019-04069-x |
| [34] | Crippa IA, Subirà C, Vincent JL, et al. Impaired cerebral autoregulation is associated with brain dysfunction in patients with sepsis[J]. Crit Care, 2018, 22(1): 327. DOI:10.1186/s13054-018-2258-8 |
| [35] | Schramm P, Klein KU, Falkenberg L, et al. Impaired cerebrovascular autoregulation in patients with severe sepsis and sepsis-associated delirium[J]. Crit Care, 2012, 16(5): R181. DOI:10.1186/cc11665 |
| [36] | Pfister D, Siegemund M, Dell-Kuster S, et al. Cerebral perfusion in sepsis-associated delirium[J]. Crit Care, 2008, 12(3): R63. DOI:10.1186/cc6891 |
| [37] | Caldas JR, Passos RH, Ramos JGR, et al. Dynamic autoregulation is impaired in circulatory shock[J]. Shock, 2020, 54(2): 183-189. DOI:10.1097/SHK.0000000000001488 |
| [38] | Bowton DL, Bertels NH, Prough DS, et al. Cerebral blood flow is reduced in patients with sepsis syndrome[J]. Crit Care Med, 1989, 17(5): 399-403. DOI:10.1097/00003246-198905000-00004 |
| [39] | Taccone FS, Su FH, De Deyne C, et al. Sepsis is associated with altered cerebral microcirculation and tissue hypoxia in experimental peritonitis[J]. Crit Care Med, 2014, 42(2): e114-22. DOI:10.1097/CCM.0b013e3182a641b8 |
| [40] | Rivera-Lara L. The role of impaired brain perfusion in septic encephalopathy[J]. Crit Care, 2019, 23(1): 54. DOI:10.1186/s13054-018-2299-z |
| [41] | Joshi B, Ono M, Brown C, et al. Predicting the limits of cerebral autoregulation during cardiopulmonary bypass[J]. Anesth Analg, 2012, 114(3): 503-510. DOI:10.1213/ANE.0b013e31823d292a |
| [42] | Asfar P, Meziani F, Hamel JF, et al. High versus low blood-pressure target in patients with septic shock[J]. N Engl J Med, 2014, 370(17): 1583-1593. DOI:10.1056/NEJMoa1312173 |
| [43] | Czosnyka M, Smielewski P, Piechnik S, et al. Cerebral autoregulation following head injury[J]. J Neurosurg, 95(5): 756-763. DOI:10.3171/jns.2001.95.5.0756 |
| [44] | Zeiler FA, Ercole A, Cabeleira M, et al. Univariate comparison of performance of different cerebrovascular reactivity indices for outcome association in adult TBI: a CENTER-TBI study[J]. Acta Neurochir (Wien), 2019, 161(6): 1217-1227. DOI:10.1007/s00701-019-03844-1 |
| [45] | Zeiler FA, Ercole A, Beqiri E, et al. Association between cerebrovascular reactivity monitoring and mortality is preserved when adjusting for baseline admission characteristics in adult traumatic brain injury: a CENTER-TBI study[J]. J Neurotrauma, 2020, 37(10): 1233-1241. DOI:10.1089/neu.2019.6808 |
| [46] | Zeiler FA, Donnelly J, Smielewski P, et al. Critical thresholds of intracranial pressure-derived continuous cerebrovascular reactivity indices for outcome prediction in noncraniectomized patients with traumatic brain injury[J]. J Neurotrauma, 2018, 35(10): 1107-1115. DOI:10.1089/neu.2017.5472 |
| [47] | Sorrentino E, Diedler J, Kasprowicz M, et al. Critical thresholds for cerebrovascular reactivity after traumatic brain injury[J]. Neurocrit Care, 2012, 16(2): 258-266. DOI:10.1007/s12028-011-9630-8 |
| [48] | Beqiri E, Smielewski P, Guérin C, et al. Neurological and respiratory effects of lung protective ventilation in acute brain injury patients without lung injury: brain vent, a single centre randomized interventional study[J]. Crit Care, 2023, 27(1): 115. DOI:10.1186/s13054-023-04383-z |
| [49] | Ciliberti P, Cardim D, Giardina A, et al. Effects of short-term hyperoxemia on cerebral autoregulation and tissue oxygenation in acute brain injured patients[J]. Front Physiol, 2023, 14: 1113386. DOI:10.3389/fphys.2023.1113386 |
| [50] | Dias C, Silva MJ, Pereira E, et al. Post-traumatic multimodal brain monitoring: response to hypertonic saline[J]. J Neurotrauma, 2014, 31(22): 1872-1880. DOI:10.1089/neu.2014.3376 |
| [51] | Zipfel J, Engel J, Hockel K, et al. Effects of hypertonic saline on intracranial pressure and cerebral autoregulation in pediatric traumatic brain injury[J]. J Neurosurg Pediatr, 2021, 28(6): 631-637. DOI:10.3171/2021.6.PEDS21143 |
| [52] | Zeiler FA, Ercole A, Cabeleira M, et al. Descriptive analysis of low versus elevated intracranial pressure on cerebral physiology in adult traumatic brain injury: a CENTER-TBI exploratory study[J]. Acta Neurochir (Wien), 2020, 162(11): 2695-2706. DOI:10.1007/s00701-020-04485-5 |
| [53] | Campbell BCV, De Silva DA, Macleod MR, et al. Ischaemic stroke[J]. Nat Rev Dis Primers, 2019, 5(1): 70. DOI:10.1038/s41572-019-0118-8 |
| [54] | Petersen NH, Silverman A, Strander SM, et al. Fixed compared with autoregulation-oriented blood pressure thresholds after mechanical thrombectomy for ischemic stroke[J]. Stroke, 2020, 51(3): 914-921. DOI:10.1161/STROKEAHA.119.026596 |
| [55] | Gupta A, Levi Chazen J, Hartman M, et al. Cerebrovascular reserve and stroke risk in patients with carotid stenosis or occlusion: a systematic review and meta-analysis[J]. Stroke, 2012, 43(11): 2884-2891. DOI:10.1161/STROKEAHA.112.663716 |
| [56] | Tian G, Ji Z, Lin ZZ, et al. Cerebral autoregulation is heterogeneous in different stroke mechanism of ischemic stroke caused by intracranial atherosclerotic stenosis[J]. Brain Behav, 2021, 11(1): e01907. DOI:10.1002/brb3.1907 |
| [57] | Ma HY, Liu J, Lv S, et al. Dynamic cerebral autoregulation in embolic stroke of undetermined source[J]. Front Physiol, 2020, 11: 557408. DOI:10.3389/fphys.2020.557408 |
| [58] | Tian G, Ji Z, Huang KB, et al. Dynamic cerebral autoregulation is an independent outcome predictor of acute ischemic stroke after endovascular therapy[J]. BMC Neurol, 2020, 20(1): 189. DOI:10.1186/s12883-020-01737-w |
| [59] | Guo ZN, Qu Y, Shen ZD, et al. Cerebral autoregulation: a reliable predictor of prognosis in patients receiving intravenous thrombolysis[J]. CNS Neurosci Ther, 2024, 30(5): e14748. DOI:10.1111/cns.14748 |
| [60] | Kirschen MP, Majmudar T, Beaulieu F, et al. Deviations from NIRS-derived optimal blood pressure are associated with worse outcomes after pediatric cardiac arrest[J]. Resuscitation, 2021, 168: 110-118. DOI:10.1016/j.resuscitation.2021.09.023 |
| [61] | Riemann L, Beqiri E, Smielewski P, et al. Low-resolution pressure reactivity index and its derived optimal cerebral perfusion pressure in adult traumatic brain injury: a CENTER-TBI study[J]. Crit Care, 2020, 24(1): 266. DOI:10.1186/s13054-020-02974-8 |
| [62] | Petkus V, Preiksaitis A, Chaleckas E, et al. Optimal cerebral perfusion pressure: targeted treatment for severe traumatic brain injury[J]. J Neurotrauma, 2020, 37(2): 389-396. DOI:10.1089/neu.2019.6551 |
| [63] | Dias C, Silva MJ, Pereira E, et al. Optimal cerebral perfusion pressure management at bedside: a single-center pilot study[J]. Neurocrit Care, 2015, 23(1): 92-102. DOI:10.1007/s12028-014-0103-8 |
| [64] | Rosenblatt K, Walker KA, Goodson C, et al. Cerebral autoregulation-guided optimal blood pressure in sepsis-associated encephalopathy: a case series[J]. J Intensive Care Med, 2020, 35(12): 1453-1464. DOI:10.1177/0885066619828293 |
| [65] | Khan JM, Shore A, Lee KFH, et al. Cerebral autoregulation-based mean arterial pressure targets and delirium in critically ill adults without brain injury: a retrospective cohort study[J]. Can J Anaesth, 2024, 71(1): 107-117. DOI:10.1007/s12630-023-02609-w |
| [66] | Le Roux P, Menon DK, Citerio G, et al. Consensus summary statement of the international multidisciplinary consensus conference on multimodality monitoring in neurocritical care: a statement for healthcare professionals from the neurocritical care society and the European society of intensive care medicine[J]. Neurocrit Care, 2014, 21(Suppl 2): S1-26. DOI:10.1007/s12028-014-0041-5 |
| [67] | Tas J, Beqiri E, van Kaam RC, et al. Targeting autoregulation-guided cerebral perfusion pressure after traumatic brain injury (COGiTATE): a feasibility randomized controlled clinical trial[J]. J Neurotrauma, 2021, 38(20): 2790-2800. DOI:10.1089/neu.2021.0197 |
 2025, Vol. 34
2025, Vol. 34