2. 浙江大学医学院附属第二医院重症医学科,杭州 310009;
3. 杭州市第九人民医院急诊科,杭州 310020;
4. 武警浙江省总队医院重症医学科,杭州 310051;
5. 多脏器衰竭预警与干预教育部重点实验室(浙江大学),杭州 310009
2. Department of Intensive Care Medicine, the Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310009, China;
3. Department of Intensive Care Medicine, the Ninth People's Hospital of Hangzhou, Hangzhou 310020, China;
4. Department of Intensive Care Medicine, Hospital of Zhejiang Province of Chinese People's Armed Police, Hangzhou 310051, China;
5. Key Laboratory of Multiple Organ Failure (Zhejiang University), Ministry of Education, Hangzhou 310009, Zhejiang, China
神经外科术后细菌性脑膜炎(post-neurosurgical bacterial meningitis, PNBM)是指神经外科手术治疗后细菌侵犯颅内和椎管内的软脑膜和脊髓膜引起的感染性炎症[1],其发病率为4.6%~25.0%[2],病死率为3.0%~33.0%[3-6]。因此,PNBM依然是神经外科术后最严重的并发症,也严重影响神经外科术后患者的预后。
针对PNBM国内外有较多研究,但主要有以下不足:①主要关注PNBM的病原菌分布以及单一病原学导致的PNBM如金黄色葡萄球菌、凝固酶阴性葡萄球菌、鲍曼不动杆菌、肺炎克雷伯等常见致病菌所引起[7-9],但同期比较不同类型病原菌引起PNBM的研究较少;②既往亦有研究对比分析革兰阳性菌(gram positive bacteria, GPB)及革兰阴性菌(gram negative bacteria, GNB)所致PNBM的临床特征[10-12],但其样本量偏小(约45~134例之间);③这些研究对病原菌耐药性未作详细描叙分析,而多重耐药及泛耐药病原体比例的增加,这些PNBM患者病死率也逐渐增高[13];另外,而GPB与GNB中多重耐药及泛耐药病原体比例不同,其对正确的经验性治疗及PNBM预后也不清楚。因此,针对GPB和GNB所致PNBM的临床特征以及预后等还不清楚,本研究拟同期对比分析这些PNBM患者的临床特征、病原学特点、药敏结果及预后,旨为临床医师进一步提高PNBM的诊治和预后提供参考。
1 资料与方法 1.1 研究对象与研究设计回顾性纳入2013年2月至2023年8月期间入住本院所有神经外科术后符合颅内感染诊断标准(脑脊液细菌培养均阳性)的患者,将这些PNBM患者分为GPB和GNB组。该研究经过医院伦理委员会批准(伦理审批号:2023-1106),鉴于为回顾性分析,伦理委员会通过免除患者知情同意申请。
排除标准:①年龄 < 18岁;②临床判断脑脊液标本污染或定植;③同一患者多次办理入院,仅纳入第一次脑脊液培养阳性时的数据;④信息缺失;⑤诊断细菌性脑膜炎前未行神经外科手术治疗。
1.2 数据收集通过查询电子病历系统收集患者数据,包括:①一般资料:如性别、年龄、基础疾病(如高血压、糖尿病等)、激素或免疫抑制剂治疗、颅内原发病诊断及手术相关信息等;②临床特征:如头疼、意识状态、发热,入院时病情严重程度评分如GCS、SOFA、APACHEⅡ评分;③实验室指标:如血常规、肝肾功能、血气分析、脑脊液常规和生化等,实验室指标收集的时间点是首次脑脊液培养阳性时留取标本当日的化验指标;④微生物数据:如培养结果、药敏及抗生素的敏感性等;⑤预后相关指标:如入住ICU、需要机械通气、感染性休克发生、不良预后以及28 d住院病死率等。
1.3 菌种鉴定及药敏测试将脑脊液标本置于BACT/ALERT3D全自动培养仪中培养(BioMerieux, 法国)中培养,使用Bruker Daltonics数据分析仪(Bruker Daltonik GMBH, 德国)进行菌种鉴定。药物敏感实验采用VIETK2(BioMerieux, 法国)系统或Kirby Bauer(Oxoid, 英国)纸片扩散法检测,参照美国临床和实验室标准化协会(CLSI)制定的标准执行。
1.4 定义神经外科术后细菌性脑膜炎,其诊断符合以下指南标准[1, 14]:①临床症状(符合至少2条):体温 > 38℃,意识改变,颅内压增高症状,脑膜刺激征;②血常规化验:白细胞 > 10×109/L,中性粒细胞占比 > 0.8;③脑脊液检查:颅内压 > 200 mmH2O;脑脊液多呈浑浊、黄色或脓性;脑脊液白细胞 > 100×106/L;中性粒细胞占比 > 0.7;脑脊液葡萄糖 < 2.2 mmol/L,和(或)脑脊液葡萄糖/血清葡萄糖 < 0.4;④影像学表现:头颅CT或MRI常提示脑弥漫性水肿、硬膜增厚强化或脑室扩张;⑤病原学结果:脑脊液微生物培养阳性。满足以上1~4条为临床诊断,满足1~5条为病原学诊断。
不良预后定义[15]:根据出院时GCS评分,分为预后良好组(GCS > 8分)和预后不良组(GCS≤8分)。
脑脊液培养考虑污染或定植判断依据[16]:①出院诊断中未提及脑脊液培养阳性相关诊断;②脑脊液阳性培养结果经相关医生评估为无意义;③不符合以上细菌性脑膜炎诊断标准。满足以上3条中任意一条考虑为脑脊液污染标本,满足以上条件同时连续2次及以上脑脊液培养检出同一细菌考虑为定植可能。
恰当的抗生素治疗[17]:指所选抗生素应是对致病病原体的体外药敏试验结果为敏感的抗生素。
1.5 统计学方法采用SPSS27.0(SPSS, IBM Corporation, Armonk, NY, US)软件行数据统计分析,呈正态分布的连续性计量资料以均数±标准差(x ± s)表示,呈非正态分布连续性计量资料则以中位数和四分位间距(interquartile range, IQR)表示。计量数据组间比较采用Studentt检验或Mann-WhitneyU检验,而计数资料使用百分比(%)表示,组间比较采用Fisher精确检验或Pearsonχ2检验。采用Kaplan-Meier生存曲线,分析GPB组及GNB组PNBM患者28 d生存率。
2 结果 2.1 人口统计学数据和临床特征本研究回顾了约11年的临床资料,从最初1630份脑脊液标本培养阳性结果中按纳入及排除标准进行筛选,最终入选401例PNBM患者;其中GPB组和GNB组分别为78例(19.5%)和323例(80.5%)(图 1)。表 1描述了这些患者的基线特征,年龄平均为56(45, 64)岁,男性占比达55.1%。在基础疾病方面,最常见的是高血压(34.9%),其次是糖尿病(7.5%)和脑血管性疾病(4.7%);有吸烟史占比25.9%,而存在饮酒史为21.2%,两组间均差异无统计学意义。与GPB组相比,GNB组其APACHE Ⅱ评分[19(16, 23) vs. 16(11, 20),P=0.003]、SOFA评分[4(2, 6) vs. 3(1, 4),P < 0.001]更高,脑出血和颅内动脉瘤术后比例更高(分别为54.8% vs. 30.8%,P < 0.001;22.3% vs. 7.7%,P =0.003),更容易出现高热(体温 > 39℃)(41.8% vs. 25.6%,P =0.009)和意识改变(79.6% vs. 61.5%,P < 0.001)。与GPB感染组相比,入住ICU治疗和机械通气比例均显著增高(分别为78.3% vs. 41.0%和78.3% vs. 35.9%,P均 < 0.001)(表 1)。
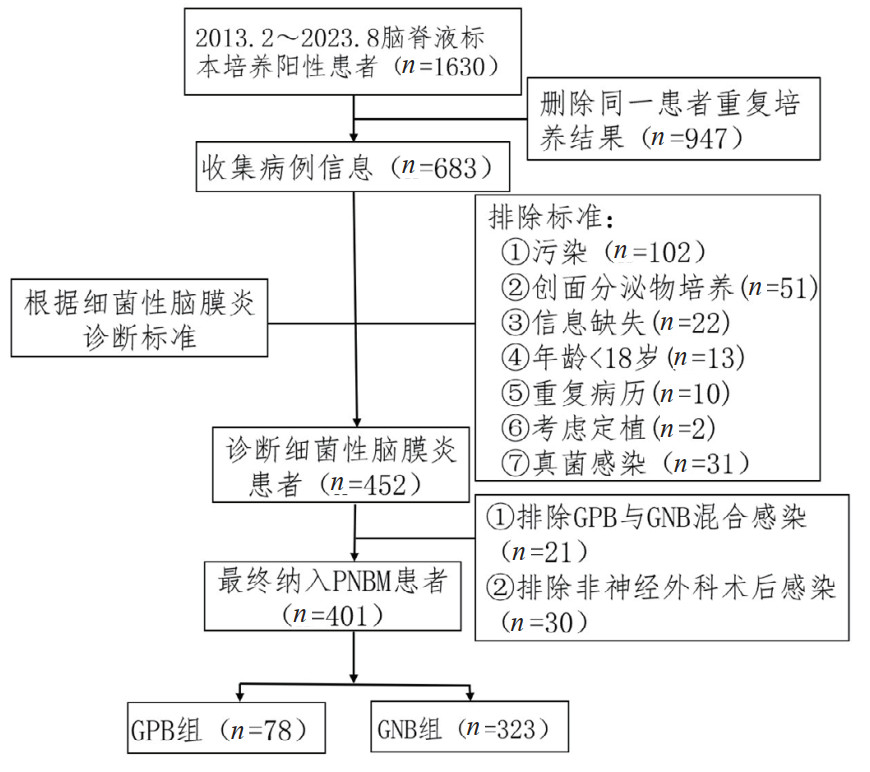
|
| 图 1 研究参与者纳入流程图 Fig 1 Flow chart of study participant inclusion |
|
|
| 特征 | 总计(n=401) | GPB组(n=78) | GNB组(n=323) | 统计值(χ2/t/Z) | P值 |
| 年龄,岁(IQR) | 56(45, 64) | 55(46, 63) | 57(44, 64) | -0.590 | 0.555 |
| 男性(n, %) | 221(55.1%) | 47(60.3%) | 174(53.9%) | 1.036 | 0.309 |
| 基础疾病(n, %) | |||||
| 高血压 | 140(34.9%) | 24(30.8%) | 116(35.9%) | 0.732 | 0.392 |
| 糖尿病 | 30(7.5%) | 5(6.4%) | 25(7.7%) | 0.165 | 0.689 |
| 呼吸系统疾病 | 6(1.5%) | 0 | 6(1.9%) | 0.481 | 0.488 |
| 心血管疾病 | 12(3.0%) | 2(2.6%) | 10(3.1%) | 0 | 1.000 |
| 脑血管性疾病 | 19(4.7%) | 4(5.1%) | 15(4.6%) | 0 | 1.000 |
| 免疫性疾病 | 6(1.5%) | 1(1.3%) | 5(1.5%) | 0 | 1.000 |
| 接受激素/免疫抑制剂治疗 | 11(2.7%) | 4(5.1%) | 7(2.2%) | 1.104 | 0.293 |
| 吸烟(n, %) | 104(25.9%) | 25(32.1%) | 79(24.5%) | 1.844 | 0.170 |
| 饮酒(n, %) | 85(21.2%) | 19(24.4%) | 66(20.4%) | 0.560 | 0.446 |
| 临床表现(n, %) | |||||
| 体温 > 39℃ | 155(38.7%) | 20(25.6%) | 135(41.8%) | 6.915 | 0.009 |
| 头疼a | 111/125(88.8%) | 29/35(82.9%) | 82/90(91.1%) | 0.996 | 0.318 |
| 意识改变 | 305(76.1%) | 48(61.5%) | 257(79.6%) | 11.214 | < 0.001 |
| 颅脑手术适应证(n, %) | |||||
| 颅内良性肿瘤 | 88(21.9%) | 22(28.2%) | 66(20.4%) | 2.215 | 0.137 |
| 脑出血 | 201(50.1%) | 24(30.8%) | 177(54.8%) | 14.511 | < 0.001 |
| 颅内动脉瘤 | 78(19.5%) | 6(7.7%) | 72(22.3%) | 8.546 | 0.003 |
| 颅脑外伤 | 73(18.2%) | 18(23.1%) | 55(17.0%) | 1.544 | 0.214 |
| 脑积水 | 124(30.9%) | 30(38.5%) | 94(29.1%) | 2.577 | 0.108 |
| 颅内恶性肿瘤 | 14(3.5%) | 3(3.8%) | 11(3.4%) | 0 | 1.000 |
| 脑梗死 | 6(1.5%) | 0 | 6(1.9%) | 0.481 | 0.488 |
| 急诊手术(n, %)b | 210/302(69.5%) | 35/57(61.4%) | 175/245(71.4%) | 2.194 | 0.139 |
| 外院术后(n, %) | 133(33.2%) | 25(32.1%) | 108(33.4%) | 0.054 | 0.816 |
| ICU治疗(n, %) | 285(71.1%) | 32(41.0%) | 253(78.3%) | 42.522 | < 0.001 |
| 机械通气(n, %) | 281(70.1%) | 28(35.9%) | 253(78.3%) | 53.941 | < 0.001 |
| 静脉营养(n, %) | 226(56.4%) | 44(56.4%) | 182(56.3%) | 0 | 0.992 |
| SOFA评分(IQR)c | 4(2, 5) | 3(1, 4) | 4(2, 6) | -3.388 | < 0.001 |
| APACHEⅡ评分d(IQR) | 18(15, 23) | 16(11, 20) | 19(16, 23) | -2.980 | 0.003 |
| 注:IQR,四分位间距;SOFA,序贯性器官衰竭评估;APACHEⅡ,急性生理学和慢性健康评价;a因原发病原因,患者无法表述是否存在头疼,致数据缺失,部分分母的出现是为了反映缺失值,共计276例;b因患者由外院转入,其是否存在急诊手术史不详,致数据缺失,部分分母的出现是为了反映缺失值,共计99例;cSOFA评分存在40个缺失值;dAPACHEⅡ评分存在105个缺失值 | |||||
与GPB感染组相比,GNB组其血红蛋白[98(84, 116) vs. 110(93, 124)g/L,P =0.001]、白蛋白(33.8±5.6 vs. 35.3±4.6 g/L,P=0.03)水平更低,而总胆红素[12.8(9.6, 18.3)μmol/L vs. 10.9(7.7, 14.4)μmol/L,P < 0.001]、谷丙转氨酶[40(23, 72)U/L vs. 26(15, 44)U/L,P < 0.001]、谷草转氨酶[32(20, 53)U/L vs. 24(16, 38)U/L,P =0.002]、降钙素原≥2 ng/mL(24.8% vs. 8.3%,P =0.028)、C反应蛋白[69.7(33.2, 157.5)mg/L vs. 43.5(14.7, 111.3)mg/L,P =0.002]均显著增高(表 2)。
| 生物指标 | 总计(n=401) | GPB组(n=78) | GNB组(n=323) | 统计值(χ2/t/Z) | P值 |
| 血常规(IQR) | |||||
| WBC(×109/L) | 10.6(7.7, 15.3) | 10.2(6.9, 13.6) | 10.6(7.8, 15.4) | -0.918 | 0.359 |
| ANC(×109/L) | 9.1(6.0, 13.5) | 8.2(4.6, 11.4) | 9.2(6.1, 13.9) | -1.961 | 0.084 |
| HB(g/L) | 101(85, 118) | 110(93, 124) | 98(84, 116) | -3.236 | 0.001 |
| PLT(×109/L) | 229(166, 305) | 245(187, 323) | 223(161, 303) | -1.597 | 0.110 |
| 肝肾功能 | |||||
| ALB(g/L)(x ± s) | 34.1±5.5 | 35.3±4.6 | 33.8±5.6 | 2.184 | 0.030 |
| ALT(U/L)(IQR) | 36(20, 67) | 26(15, 44) | 40(23, 72) | -4.077 | < 0.001 |
| AST(U/L)(IQR) | 30(19, 49) | 24(16, 38) | 32(20, 53) | -3.172 | 0.002 |
| TBIL(μmol/L)(IQR) | 12.4(9.1, 17.3) | 10.9(7.7, 14.4) | 12.8(9.6, 18.3) | -3.661 | < 0.001 |
| 血肌酐(μmol/L)(IQR) | 46(35, 60) | 48(35, 62) | 45(36, 59) | -0.848 | 0.396 |
| PCT(ng/mL)(n, %) | |||||
| ≥0.5,< 2 | 47(17.7) | 5(13.9) | 42(18.3) | 0.409 | 0.522 |
| ≥2 | 60(22.6) | 3(8.3) | 57(24.8) | 4.822 | 0.028 |
| CRP(mg/L)(IQR) | 64.9(26.1, 152) | 43.5(14.7, 111.3) | 69.7(33.2, 157.5) | -3.027 | 0.002 |
| 注:IQR,四分位数间距;mean±S.D,平均值±标准差;WBC,白细胞计数;HB,血红蛋白;ANC,中性粒细胞计数;PLT,血小板计数;AST,谷草转氨酶;ALT,谷丙转氨酶;ALB,白蛋白;TBIL,总胆红素;SCr,血肌酐;PCT,降钙素原;CRP,C-反应蛋白 | |||||
GPB与GNB导致的PNBM患者在感染初期体温、脑脊液常规、生化差异具有统计学意义(图 2)。与GPB组相比,GNB感染可表现为体温更高(中位数,38.8 vs. 38.5℃,P =0.015),其脑脊液有核细胞数(中位数,2300 vs. 310 ×106/L)、蛋白质(中位数,214.0 vs. 108.7 mg/dL)和腺苷脱氨酶(中位数,8.0 vs. 3.0 U/L)均明显升高(P均 < 0.01),而脑脊液葡萄糖浓度则明显降低(中位数,0.12 vs. 2.81 mmol/L, P < 0.01)。两组治疗后在体温及脑脊液有核细胞数方面均明显下降,脑脊液葡萄糖明显回升(P均 < 0.01)。抗生素治疗明显降低GNB组脑脊液蛋白质和腺苷脱氨酶浓度,但这些指标在GPB组中均无明显变化(图 2)。
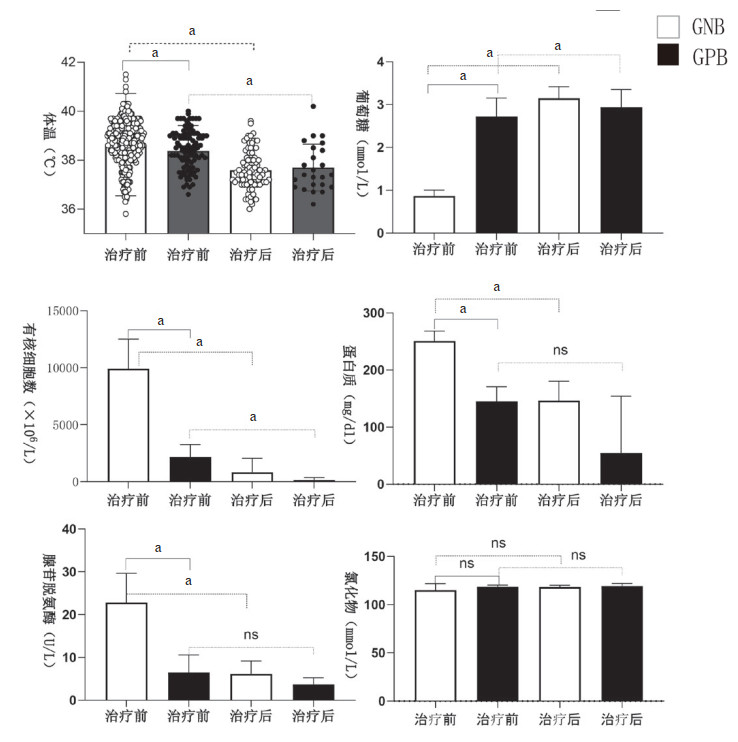
|
| 注: GNB,革兰阴性组;GPB,革兰阳性组;ns,无显著差别;aP < 0.05 图 2 革兰阳性菌与革兰阴性菌PNBM患者治疗前后体温、脑脊液常规和生化比较 Fig 2 Comparison of body temperature, cerebrospinal fluid routine, and biochemistry before and after treatment in PNBM patients with gram-positive and gram-negative bacteria |
|
|
本研究401例PNBM患者共分离出426株细菌,其中25例(6.2%)存在2种以上阴性或阳性细菌感染;其中GNB组共检出343株(80.5%),而GPB组为83株(19.5%)(图 3)。GNB组最常见的病原菌为鲍曼不动杆菌(138株,32.39%),其次为肺炎克雷伯菌(128株,30.05%)和铜绿假单胞菌(18株,4.23%);GPB组常见的病原菌为凝固酶阴性葡萄球菌(47株,11.03%),其次为金黄色葡萄球菌(12株,2.82%)(图 3)。
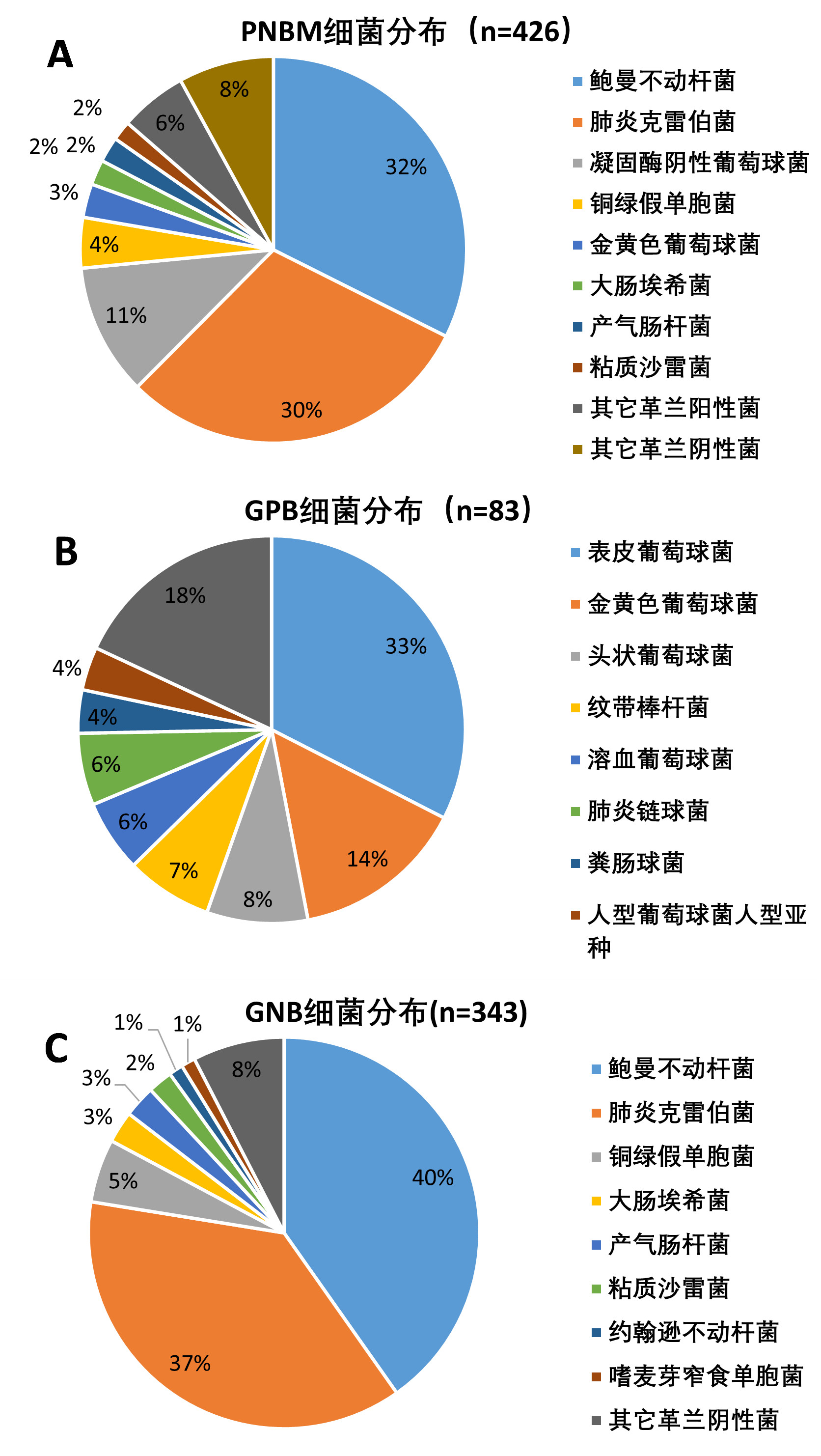
|
| 注:PNBM,神经外科术后细菌性脑膜炎;GPB,革兰阳性组;GNB,革兰阴性组; PNBM总体(n=426, A)﹑革兰阳性菌导致的PNBM(n=83, B)及革兰阴性菌导致的PNBM(n=343, C)其各自脑脊液细菌分布情况 图 3 PNBM患者脑脊液分离的细菌分布 Fig 3 Distribution of bacteria isolated from cerebrospinal fluid of PNBM patients |
|
|
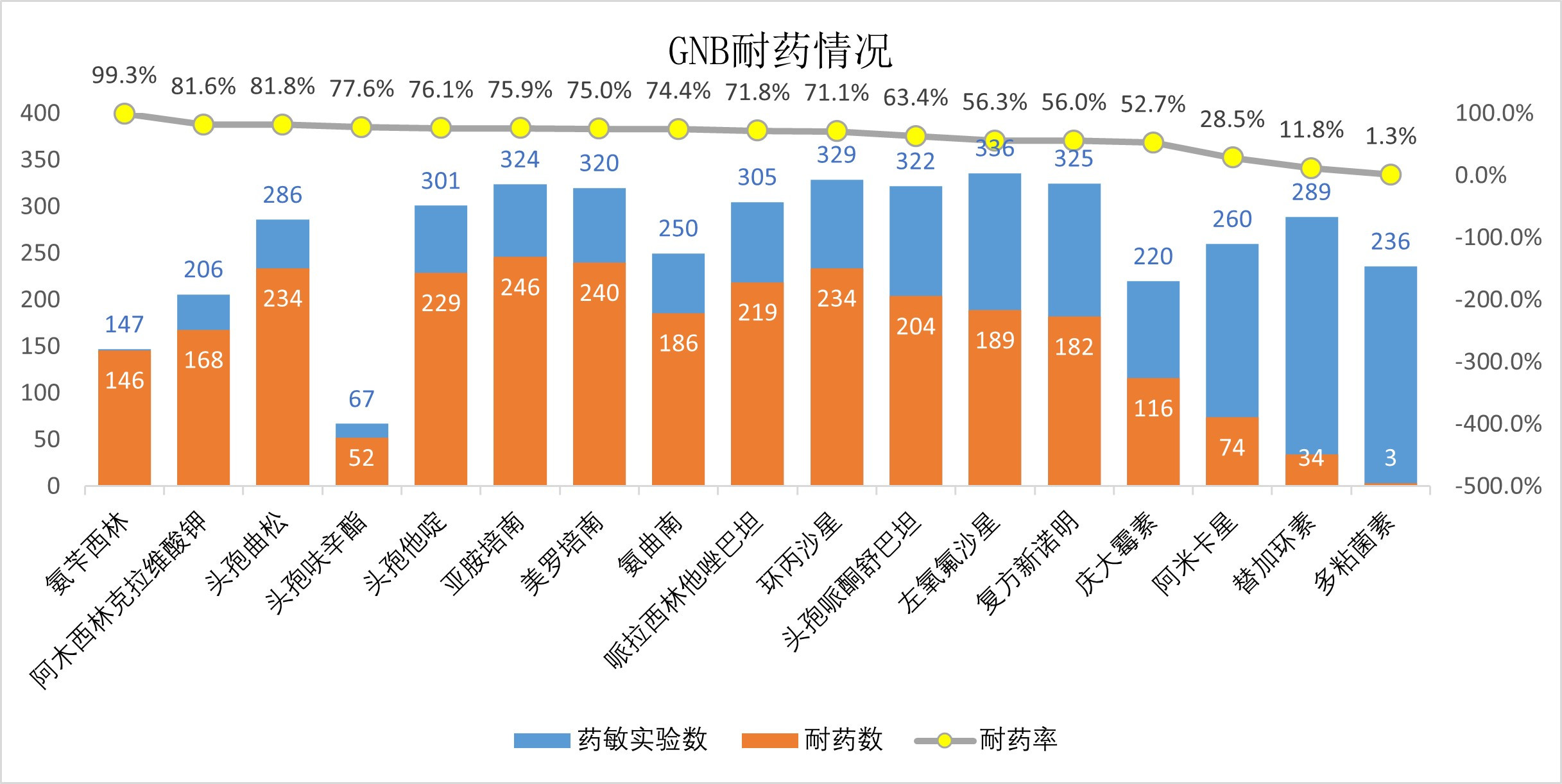
在GPB组中,耐药率最高的抗生素为苯唑西林,高达88.5%,其次为喹诺酮类抗菌药物(耐药率波动在27.9%~47.8%之间),利奈唑胺及替加环素(耐药率分别为2.7%和2.0%),而万古霉素均敏感(图 4);在GNB组中,常见抗菌药物如头孢他啶(76.1%)、头孢曲松(81.1%)、哌拉西林他唑巴坦(71.8%)、头孢哌酮舒巴坦舒巴坦(63.4%)、亚胺培南(75.9%)、美罗培南(75.9%)等均显示较高耐药性,而替加环素及多黏菌素耐药率较低,分别为11.8%及1.3%(图 5)。值得注意的是,多重耐药菌(MDR)比例在GNB组显著高于GPB组(80.5% vs. 68.7%,P =0.02),而且在GNB组中泛耐药菌(XDR)检出19株(5.5%)。
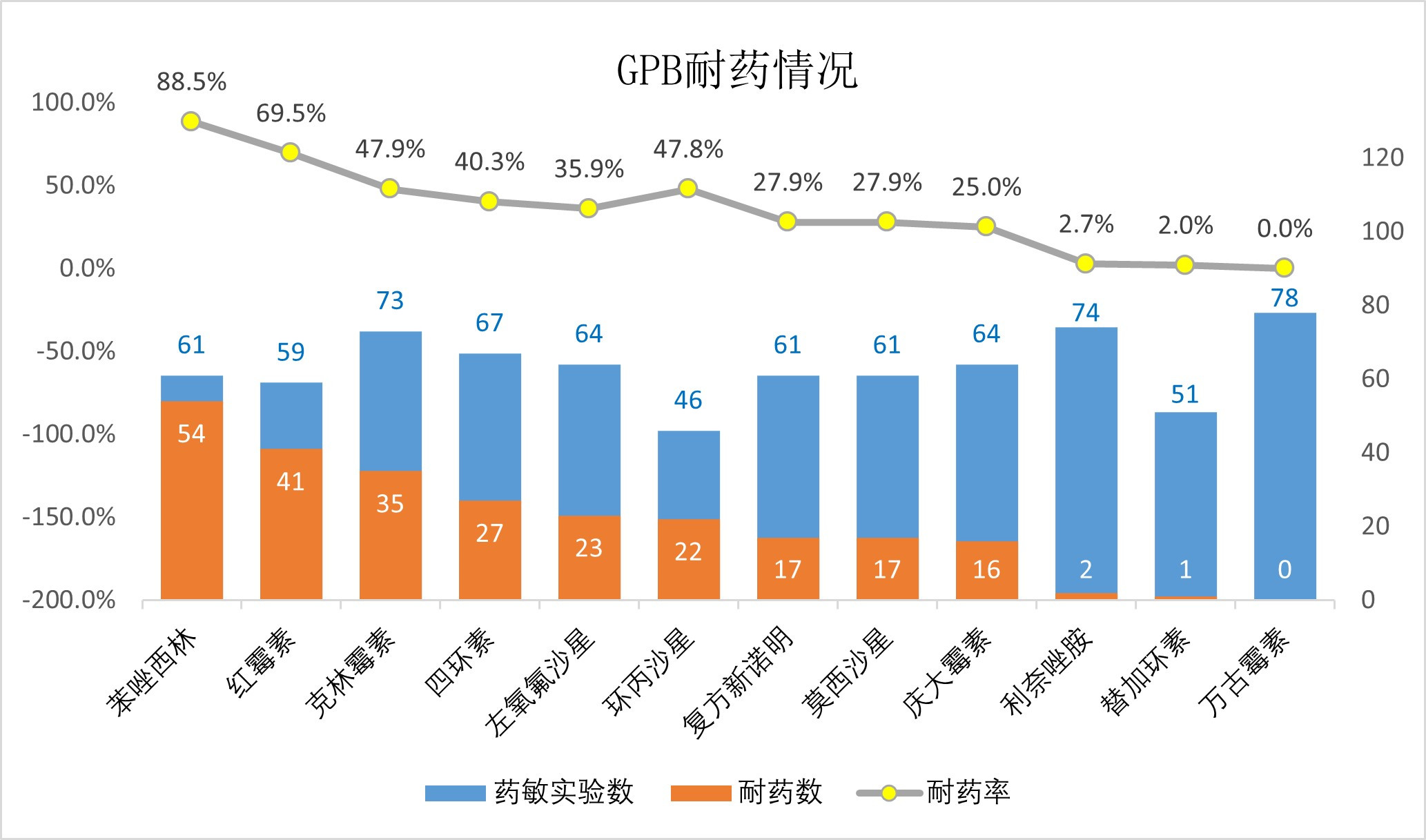
|
| 图 4 革兰阳性菌耐药情况 Fig 4 Drug resistance in Gram-positive bacteria |
|
|
|
| 图 5 革兰阴性菌耐药情况 Fig 5 Drug resistance in gram-negative bacteria |
|
|
PNBM患者治疗方面,针对GPB主要的抗生素为万古霉素及利奈唑胺,而针对GNB主要抗生素为美罗培南、替加环素和多黏菌素等。GNB组抗生素联合方案在经验性治疗时比例显著高于GPB组(83.9% vs. 67.1%,P < 0.001),而在目标性治疗时两组无统计学意义(87.9% vs. 79.7%,P=0.069)。联合治疗方案,GPB组主要为美罗培南联合万古霉素,GNB组主要为美罗培南联合多黏菌素。与GPB组相比,恰当的抗生素经验性治疗比例在GNB组中显著降低(30.3% vs. 80.0%,P < 0.001);而当目标性抗生素治疗时,两组均得到很好的恰当性治疗(73.5% vs. 80.3%,P=0.227)。
抗生素鞘内注射治疗是神经外科术后颅内感染的特有方式,本研究抗生素鞘内注射治疗患者共为120例,比例高达29.9%(120/401);其中,GPB组仅有2例(2.6%,2/78),鞘内注射抗生素为万古霉素;而在GNB组中比例高达36.5%(118/323),鞘内注射抗生素为多黏菌素及阿米卡星等。
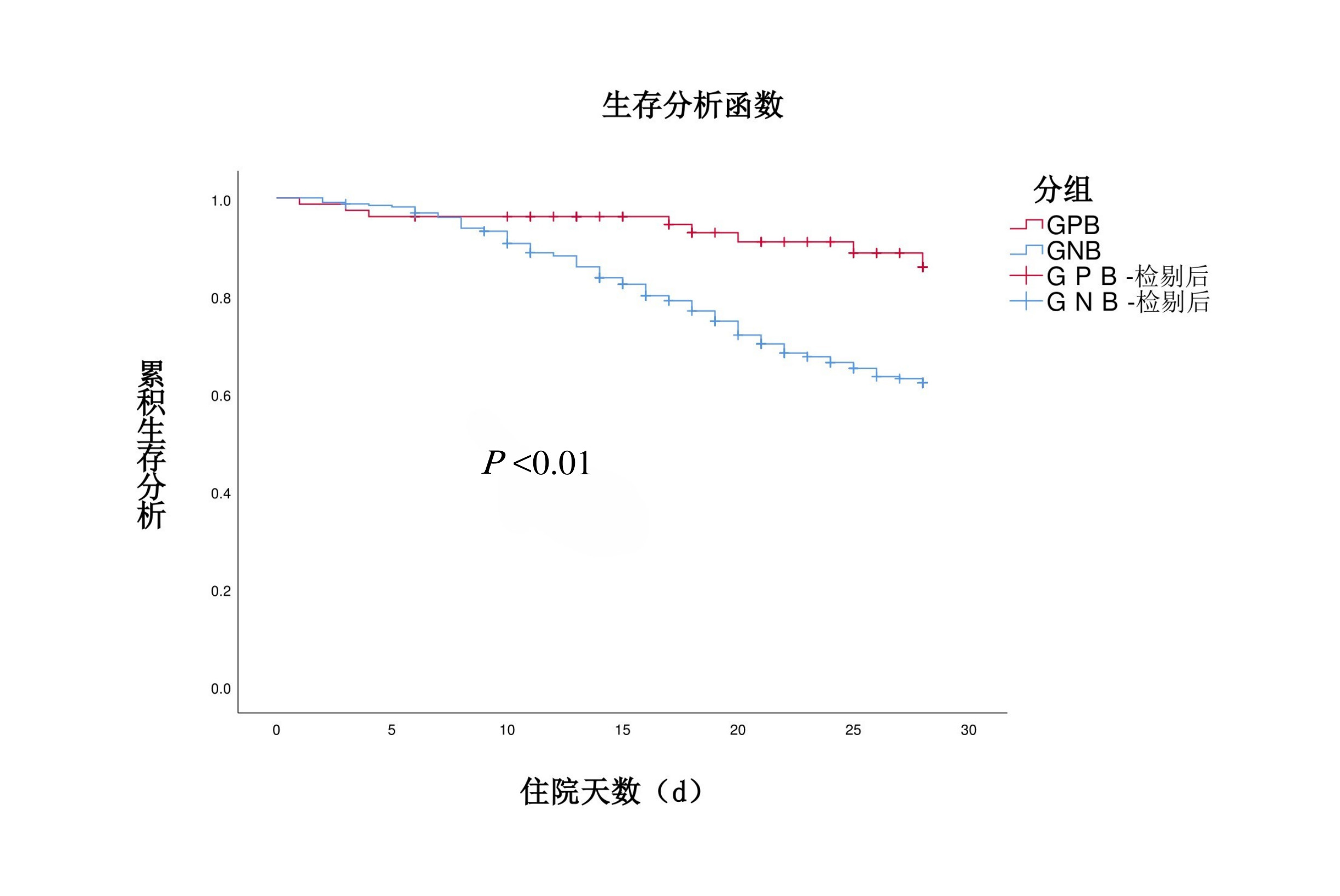
2.6 预后PNBM患者28 d住院病死率高达29.7%,不良预后发生率高达59.4%,感染性休克发生率为8.0%,ICU住院天数为[中位数(IQR), 25(16, 40)d](表 3)。与GPB组相比,GNB组ICU住院时间明显延长[17(9, 30) vs. 11.5(5.25, 22.75)d,P=0.034],感染性休克发生率(9.3% vs. 2.6%,P=0.049)、不良预后发生率(65.9 % vs. 32.1%,P < 0.001)、14 d住院病死率(13.7 % vs. 3.8%,P =0.005)、28 d住院病死率(34.4% vs. 10.3%,P < 0.001)均明显增高,而两组在总住院时间[25(16, 42) vs. 25(17, 37)d]及7 d住院病死率(4.0% vs. 3.8%)差值无统计学意义。Kaplan-Meier生存曲线发现,28 d累计生存率GNB组显著低于GPB组(65.6% vs. 89.7%,P < 0.01)(图 6)。
| 指标 | 总数(n=401) | GPB组(n=78) | GNB组(n=323) | 统计值(χ2/t/Z) | P值 |
| 总住院天数(d)(IQR) | 25(16, 40) | 25(17, 37) | 25(16, 42) | -0.659 | 0.510 |
| ICU住院天数(d)(IQR) | 16(9, 29) | 11.5(5.25, 22.75) | 17(9, 30) | -2.117 | 0.034 |
| 机械通气天数(d)(IQR) | 12.7(6.0, 25.4) | 8.8(2.7, 21.1) | 12.8(6.4, 27.1) | -1.892 | 0.058 |
| 感染性休克发生率(n, %) | 32(8.0%) | 2(2.6%) | 30(9.3%) | 3.868 | 0.049 |
| 不良预后发生率a(n, %) | 238(59.4%) | 25(32.1%) | 213(65.9%) | 29.916 | < 0.001 |
| 7 d病死率(n, %) | 16(4.0%) | 3(3.8%) | 13(4.0%) | 0.005 | 0.942 |
| 14 d病死率(n, %) | 55(13.7%) | 3(3.8%) | 55(13.7%) | 7.970 | 0.005 |
| 28 d病死率(n, %) | 119(29.7%) | 8(10.3%) | 111(34.4%) | 17.498 | < 0.001 |
| 注:IQR,四分位间距;GPB,革兰阳性菌感染;GNB,革兰阴性菌感染。a预后不良:据出院时GCS评分,分预后良好组(GCS > 8分)和预后不良组(GCS≤8分) | |||||
|
| 图 6 Kaplan-Meier评估PNBM患者28 d生存率 Fig 6 Kaplan-Meier assessment of 28-day survival in patients with PNBM |
|
|
以往研究显示GPB在PNBM中占主导地位[13, 18-20], 近年来GNB占比呈逐渐增加趋势[9, 11, 21-22]。随着神经外科围手术期预防性抗菌药物的广泛使用及抗菌涂层器械的使用,Hussein观察到病原体向GNB转移现象[23]。Yang等[9]通过回顾分析2009年1月至2018年12月上海华山医院100例颅内细菌感染患者发现GNB占比达78.05%,Camacho等[22]亦报道PNBM感染病因菌中GNB占77%。与这些研究相类似,本研究也发现GNB在PNBM中占比也高达78.49%。实际上,笔者的既往研究也发现,神经外科术后患者颅内感染病原菌中,革兰阴性菌仅鲍曼式不动杆菌和肺炎克雷伯菌就占整个颅内感染患者的52.81%[8]。为此,PNBM主要以革兰阴性菌为主,而不是既往的GPB。
PNBM最常见病原菌随着时间推移也在悄然发生变化,既往多项研究显示金黄色葡萄球菌为颅内感染最常见病原菌[13, 18-20, 24],而近来研究发现最常见病原菌已逐渐被鲍曼不动杆菌或肺炎克雷伯菌所取代[8, 9, 11, 25]。与这些研究相一致,本研究也是以鲍曼不动杆菌为首要病原菌,占比31.0%。另外,本研究中肺炎克雷伯菌占比也高达30.11%,这与Yang等[9]结果相一致,其占比高达40%以上。此外,本研究显示此两种细菌对碳青霉烯类抗菌药物耐药率均大于70%,其中耐碳青霉烯类肺炎克雷伯菌(CRKP)占肺炎克雷伯菌74.2%,耐碳青霉烯类鲍曼不动杆菌(CRAB)占鲍曼不动杆菌92.0%,这与吴振波等[25]报道CRKP、CRAB分别占72.6%及82.3%相类似。这些研究显示,在PNBM中鲍曼不动杆菌及肺炎克雷伯菌占据了主导地位,且这两种病原菌其对碳青霉烯类抗生素菌广泛耐药,提示在面对PNBM时临床医生应优先考虑这两种病原体的可能性,并根据本院相关病原体流行病学药敏结果选择合适的抗菌药物进行经验性治疗。
本研究发现GNB所致PNBM在高热、意识改变、PCT、CRP等临床症状和实验室指标方面均明显高于GPB感染组。与此类似,Zeinalizadeh等[10]发现GNB患者中PCT较GPB组升高显著。此外,王秀英等[12]发现GPB组血清PCT、脑脊液蛋白质含量均低于GPB组,脑脊液葡萄糖含量则高于对照组,均与本研究得出的结果一致。这些研究提示,GPB感染所致PNBM其症状更加突出﹑脑脊液异常变化更明显。因此,通过症状和脑脊液常规生化结果,可以初步判断PNBM是GPB感染还是GNB所致。
既往也有不少研究对比分析GPB及GNB所致PNBM患者预后情况[9-10, 12],发现GNB感染整体预后均较GPB差。王秀英等[12]报道GNB感染组病死率高于GPB感染组(16% vs. 0%),而Zeinalizadeh等[10]也报道GNB感染患者住院时间更长。与此类似,笔者发现GNB所致PNBM其28 d病死率为34.4%,远远高于GPB感染组的10.3%,这亦与Yang报道[9]的30 d病死率(约35%)相类似。这种GNB所致PNBM的高病死率,可能与以下几种因素相关:① GNB具有复杂的外膜结构﹑存在多种耐药机制相关[26],也与经验性抗菌药物选择正确率低密不可分。的确,本研究发现GNB所致PNBM患者其ICU住院天数和感染性休克发生率均较GPB感染组高;② GNB所致的脑脊液其葡萄糖更低而蛋白更高,提示局部感染更重;③ GNB其多重耐药比例也明显高于GPB,且部分出现泛耐药,这不仅导致抗生素的选择更困难,也导致初始抗生素正确率下降。尽管GNB所致PNBM患者行鞘内注射治疗,但是不能改变其预后差结局,是否采用二代宏基因测序更早诊断PNBM[27]以及更早给予鞘内注射抗生素以改善这些患者的预后值得进一步研究。
本研究仍存在以下局限性:①该研究为单中心回顾性分析,没有收集神经外科术后未发生颅内感染患者信息,无法分析导致颅内感染的高危因素,以及导致GNB及GPB颅内感染各自的危险因素;②本研究中PNBM患者由外院转入较多,入院前相关信息如颅脑手术时间、时长、颅内感染时间、脑脊液化验结果等其获得的准确性存在一定的偏差;另外,治疗前后复查脑脊液检验时间不固定,这些均可能影响结果的分析;③本研究未纳入脑脊液宏基因检测结果阳性患者,不同方法确诊PNBM患者其预后是否不一,也并不清楚。鉴于培养结果滞后于宏基因检测,推测由宏基因检测诊断的PNBM患者其能够得到更早诊断和干预,预后可能比本研究更好。因此,基于以上这些缺陷,本研究结论还需前瞻性多中心大样本研究来进一步验证。
革兰阴性菌感染主导神经外科术后细菌性脑膜炎的发生;与革兰阳性菌感染相比,其脑膜炎症状更显著、病情更严重,脑脊液变化更异常。尽管短期(7 d)病死率与革兰阳性菌感染相当,但革兰阴性菌感染导致神经外科术后细菌性脑膜炎患者中长期(14 d和28 d)病死率更高,且整体预后更差,更值得医师关注。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张呈呈和黄坚:负责数据收集及整理、统计分析、文章初稿撰写;吕世进、夏金明、崔巍和汪叶松:负责数据整理、统计学分析、数据审核;胡丽华、张根生:负责该文的立意构思、研究设计、文章修改和发表
| [1] | 中国医师协会神经外科医师分会神经重症专家委员会, 北京医学会神经外科学分会神经外科危重症学组. 神经外科中枢神经系统感染诊治中国专家共识(2021版)[J]. 中华神经外科杂志, 2021, 37(1): 2-15. DOI:10.3760/cma.j.cn112050-20200831-00480 |
| [2] | Kourbeti IS, Vakis AF, Ziakas P, et al. Infections in patients undergoing craniotomy: risk factors associated with post-craniotomy meningitis[J]. J Neurosurg, 2015, 122(5): 1113-1119. DOI:10.3171/2014.8.JNS132557 |
| [3] | Briggs S, Ellis-Pegler R, Raymond N, et al. Gram-negative bacillary meningitis after cranial surgery or trauma in adults[J]. Scand J Infect Dis, 2004, 36(3): 165-173. DOI:10.1080/00365540410027193 |
| [4] | Mancebo J, Domingo P, Blanch L, et al. Post-neurosurgical and spontaneous gram-negative bacillary meningitis in adults[J]. Scand J Infect Dis, 1986, 18(6): 533-538. DOI:10.3109/00365548609021658 |
| [5] | O'Neill E, Humphreys H, Phillips J, et al. Third-generation cephalosporin resistance among gram-negative bacilli causing meningitis in neurosurgical patients: significant challenges in ensuring effective antibiotic therapy[J]. J Antimicrob Chemother, 2006, 57(2): 356-359. DOI:10.1093/jac/dki462 |
| [6] | Parodi S, Lechner A, Osih R, et al. Nosocomial Enterobacter meningitis: risk factors, management, and treatment outcomes[J]. Clin Infect Dis, 2003, 37(2): 159-166. DOI:10.1086/375596 |
| [7] | Tian RF, Hao SY, Hou ZG, et al. The characteristics of post-neurosurgical bacterial meningitis in elective neurosurgery in 2012: a single institute study[J]. Clin Neurol Neurosurg, 2015, 139: 41-45. DOI:10.1016/j.clineuro.2015.09.002 |
| [8] | Pan SJ, Huang XF, Wang YS, et al. Correction to: efficacy of intravenous plus intrathecal/intracerebral ventricle injection of polymyxin B for post-neurosurgical intracranial infections due to MDR/XDR Acinectobacter baumannii: a retrospective cohort study[J]. Antimicrob Resist Infect Control, 2019, 8: 11. DOI:10.1186/s13756-019-0462-1 |
| [9] | Yang WJ, Wu X, Li ZQ, et al. Trends of intra-cranial bacterial infection in patients requiring emergency neurosurgery[J]. Surg Infect (Larchmt), 2020, 21(8): 677-683. DOI:10.1089/sur.2019.317 |
| [10] | Zeinalizadeh M, Yazdani R, Feizabadi MM, et al. Post-neurosurgical meningitis; gram negative bacilli vs. gram positive cocci[J]. Caspian J Intern Med, 2022, 13(3): 469-474. DOI:10.22088/cjim.13.3.469 |
| [11] | Kurtaran B, Kuscu F, Ulu A, et al. The causes of postoperative meningitis: the comparison of gram-negative and gram-positive pathogens[J]. Turk Neurosurg, 2018, 28(4): 589-596. DOI:10.5137/1019-5149.JTN.20575-17.1 |
| [12] | 王秀英, 张军, 刘磊, 等. 颅脑术后继发颅内感染细菌革兰染色特征的临床意义[J]. 中华医学杂志, 2018, 98(20): 1588-1592. DOI:10.3760/cma.j.issn.0376-2491.2018.20.012 |
| [13] | Wang KW, Chang WN, Huang CR, et al. Post-neurosurgical nosocomial bacterial meningitis in adults: microbiology, clinical features, and outcomes[J]. J Clin Neurosci, 2005, 12(6): 647-650. DOI:10.1016/j.jocn.2004.09.017 |
| [14] | Tunkel AR, Hasbun R, Bhimraj A, et al. 2017 infectious diseases society of America's clinical practice guidelines for healthcare-associated ventriculitis and meningitis[J]. Clin Infect Dis, 2017, 64(6): e34-e65. DOI:10.1093/cid/ciw861 |
| [15] | 王小刚, 高丁, 李涛, 等. 院前应用格拉斯哥昏迷分级评分评估颅脑损伤患者与预后的相关性分析[J]. 中国临床医生杂志, 2015, 43(8): 36-39. DOI:10.3969/j.issn.2095-8552.2015.08.013 |
| [16] | Zheng GH, Li SW, Zhao MH, et al. Time to positive culture can differentiate post-neurosurgical coagulase-negative staphylococci other than S epidermidis meningitis from contamination: a case-control observational study[J]. J Clin Lab Anal, 2020, 34(10): e23447. DOI:10.1002/jcla.23447 |
| [17] | 中华医学会血液学分会, 中国医师协会血液科医师分会. 中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南(2020年版)[J]. 中华血液学杂志, 2020, 41(12): 969-978. DOI:10.3760/cma.j.issn.0253-2727.2020.12.001 |
| [18] | Zhan R, Zhu Y, Shen Y, et al. Post-operative central nervous system infections after cranial surgery in China: incidence, causative agents, and risk factors in 1, 470 patients[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(5): 861-866. DOI:10.1007/s10096-013-2026-2 |
| [19] | Dashti SR, Baharvahdat H, Spetzler RF, et al. Operative intracranial infection following craniotomy[J]. Neurosurg Focus, 2008, 24(6): E10. DOI:10.3171/FOC/2008/24/6/E10 |
| [20] | McClelland S 3rd, Hall WA. Postoperative central nervous system infection: incidence and associated factors in 2111 neurosurgical procedures[J]. Clin Infect Dis, 2007, 45(1): 55-59. DOI:10.1086/518580 |
| [21] | Srinivas D, Veena Kumari HB, Somanna S, et al. The incidence of postoperative meningitis in neurosurgery: an institutional experience[J]. Neurol India, 2011, 59(2): 195-198. DOI:10.4103/0028-3886.79136 |
| [22] | Camacho EF, Boszczowski I, Basso M, et al. Infection rate and risk factors associated with infections related to external ventricular drain[J]. Infection, 2011, 39(1): 47-51. DOI:10.1007/s15010-010-0073-5 |
| [23] | Hussein K, Bitterman R, Shofty B, et al. Management of post-neurosurgical meningitis: narrative review[J]. Clin Microbiol Infect, 2017, 23(9): 621-628. DOI:10.1016/j.cmi.2017.05.013 |
| [24] | Corsini Campioli C, Castillo Almeida NE, O'Horo JC, et al. Diagnosis, management, and outcomes of brain abscess due to gram-negative versus gram-positive bacteria[J]. Int J Infect Dis, 2022, 115: 189-194. DOI:10.1016/j.ijid.2021.12.322 |
| [25] | 吴振波, 周宏伟, 陈坤. 2011—2015年神经外科患者脑脊液分离菌分布及耐药分析[J]. 中华急诊医学杂志, 2017, 26(12): 1384-1388. DOI:10.3760/cma.j.issn.1671-0282.2017.12.010 |
| [26] | Herold R, Schroten H, Schwerk C. Virulence factors of meningitis-causing bacteria: enabling brain entry across the blood-brain barrier[J]. Int J Mol Sci, 2019, 20(21): 5393. DOI:10.3390/ijms20215393 |
| [27] | 孟翠翠, 袁丁, 余言午, 等. 脑脊液二代测序在中枢神经系统感染中的病原学诊断价值[J]. 中华急诊医学杂志, 2022, 31(4): 471-476. DOI:10.3760/cma.j.issn.1671-0282.2022.04.008 |
 2025, Vol. 34
2025, Vol. 34




