急性肾损伤(acute kidney injury,AKI)是脓毒症患者常见的并发症之一[1]。约40%~60%的脓毒症患者将合并AKI,约60%以上的患者将发展为多脏器功能不全,病死率高达50%以上[2]。导致脓毒症AKI(septic AKI,SAKI)病死率高的主要因素是其发病原因不明,并且发病机制复杂,至今无统一有效治疗方案[3]。因此,深入探讨SAKI的发病机制,发现导致患者病情加重的关键因素,早期预防和干预是其诊治的重要策略。小泛素样修饰蛋白特异性肽酶2(small ubiquitin-related moditier protein specific peptidase 2,SENP2)是人体重要的泛素样修饰因子,其存在于人体的肾脏、大脑、肝脏等组织内,在人体组织细胞间传递中起着关键作用[4]。然而,SENP2在SAKI发病过程中的作用机制仍不清楚。本研究拟使用SENP2基因敲除小鼠,构建脓毒症模型,研究SENP2调控NLRP3炎症小体活化在SAKI的作用及机制,为患者的早期临床诊治提供新思路和新方向。
1 材料与方法 1.1 实验材料8-12周龄SPF级SENP2基因敲除C57BL/6小鼠20只购自中国赛业生物公司;ELISA试剂盒购自中国上海Sigma公司;兔抗SENP2蛋白抗体购自中国上海Abcam生物公司;兔多克隆NOD样受体家族核苷酸结合寡聚化结构域样受体3(NOD-like receptor family pyrin domain containing 3,NLRP3)抗体、IL-1β抗体、Caspase-1一抗、ASC一抗和GAPDH均购自中国武汉伊莱瑞特生物科技公司;电泳试剂购自中国南京建成生物;蛋白提取试剂盒购自中国上海Abcam生物公司。
1.2 动物实验和分组SPF级野生型C57BL/6小鼠20只,8~12周龄,体重16~24 g,性别不限,购自中国浙江大学动物实验中心[营业证号:SYXK(浙)2018-0016]。所有小鼠均饲养于宁波大学实验动物中心,并饲养于22~25℃室温和昼夜均12 h的环境下,饲养期间不限饮水和进食,适应喂养1~2周后实验。实验前6 h禁食和禁水。小鼠被分为4组,即野生型假手术组(wild type-Sham,WT-Sham)、野生型盲肠结扎和穿孔术组(wild type cecal ligation and perforation,WT-CLP)、SENP2基因敲除假手术组(SENP2 gene knockout sham,KO-Sham)和SENP2基因敲除盲肠结扎和穿孔术组(SENP2 gene knockout cecal ligation and perforation,KO-CLP),每组各10只小鼠。
1.3 动物模型构建使用CLP法构建脓毒症模型。具体步骤为:戊巴比妥钠(50 mg/kg)腹腔注射麻醉小鼠,腹中线做1~2 cm切口,进腹后找出盲肠,脱出腹腔后针头刺穿盲肠2次,0号缝线结扎盲肠近端,回纳后关腹,放回笼中继续饲养。当CLP术后小鼠出现精神萎靡或嗜睡、发热、少食、蜷缩、心率和呼吸频率增快等症状时,即脓毒症造模成功。当小鼠存活时间未达到预设实验终点时,尸体将做无公害处理,并另选小鼠使用相同方案重新造模进行补救。WT-Sham组和KO-Sham组小鼠仅做开关腹,不做盲肠穿孔和结扎。CLP术后24 h处死小鼠,收集血标本,6 000~8 000 r/min离心15 min,取上清液,-80℃低温冰箱存储。取小鼠肾脏,4%多聚甲醛固定右肾,用于后续的病理和免疫组织化学实验,左肾置于液氮中速冻后移入-80℃低温冰箱存储,用于后续实验。根据《全球改善肾脏病预后组织指南》标准诊断AKI,并验证CLP是否成功诱发AKI[5]。本实验所有操作均严格遵照《国际动物实验指南》,并获得宁波大学动物实验伦理委员会的批准。
1.4 肾组织病理损伤评估采用4%多聚甲醛中固定肾组织24~48 h,按照常规PBS清洗,乙醇脱水,石蜡包埋,切片,苏木精伊红(HE)染色,封片。随机选取3个视野,普通光镜观察肾损伤并评分。肾损伤半定量评分方法:按照以往经验,无损伤计0分;损伤面积 < 25%计1分;损伤面积25%~50%计2分,损伤面积50%~75%计3分;损伤面积 > 75%计4分[6]。
1.5 肾功能评估采用ELISA法测定小鼠血清肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN)、血浆中性粒细胞明胶酶相关脂蛋白(plasma neutrophil gelatinase associated lipocalin, pNGAL)和血浆肾损伤分子1(plasma kidney injury molecule 1, pKIM-1)水平,绘制标准曲线并定量指标。
1.6 炎症指标测定采用ELISA法测定小鼠血清TNF-α、IL-1β、IL-4和IL-10水平,绘制标准曲线和定量。
1.7 免疫组织化学取肾组织石蜡包块,切片,按常规PBS洗涤,乙醇脱水,甲二苯透明,滴加一抗单克隆SENP2蛋白抗体(1:800),常温过夜孵育,PBS洗涤,滴加二抗,孵育,封片。阴性对照随机选用PBS(0.01M)作为一抗染色。每张切片随选3个视野,普通光镜下观察。
1.8 蛋白印迹取新鲜肾组织,提取总蛋白,BCA鉴定浓度,分离蛋白,转移至二氟乙烯,5%脱脂奶粉封闭,加入兔多克隆NLRP3一抗(1:800)或IL-1β(1:500)或Caspase-1(1:600)或ACS(1:800)或GAPDH(1:500),常温下过夜,孵育。加入二抗(1:1 000),室温下孵育6 h,添加ECL显色。使用Gel Doc 2000成像系统观察条带,半定量测定浓度。
1.9 统计学方法使用SPSS 23.0软件进行统计分析,将符合正态分布的计量资料以均数±标准差(x±s)表达,多组间比较采用单因素方差分析One-way ANOVA进行,多组间的两两组数据的比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
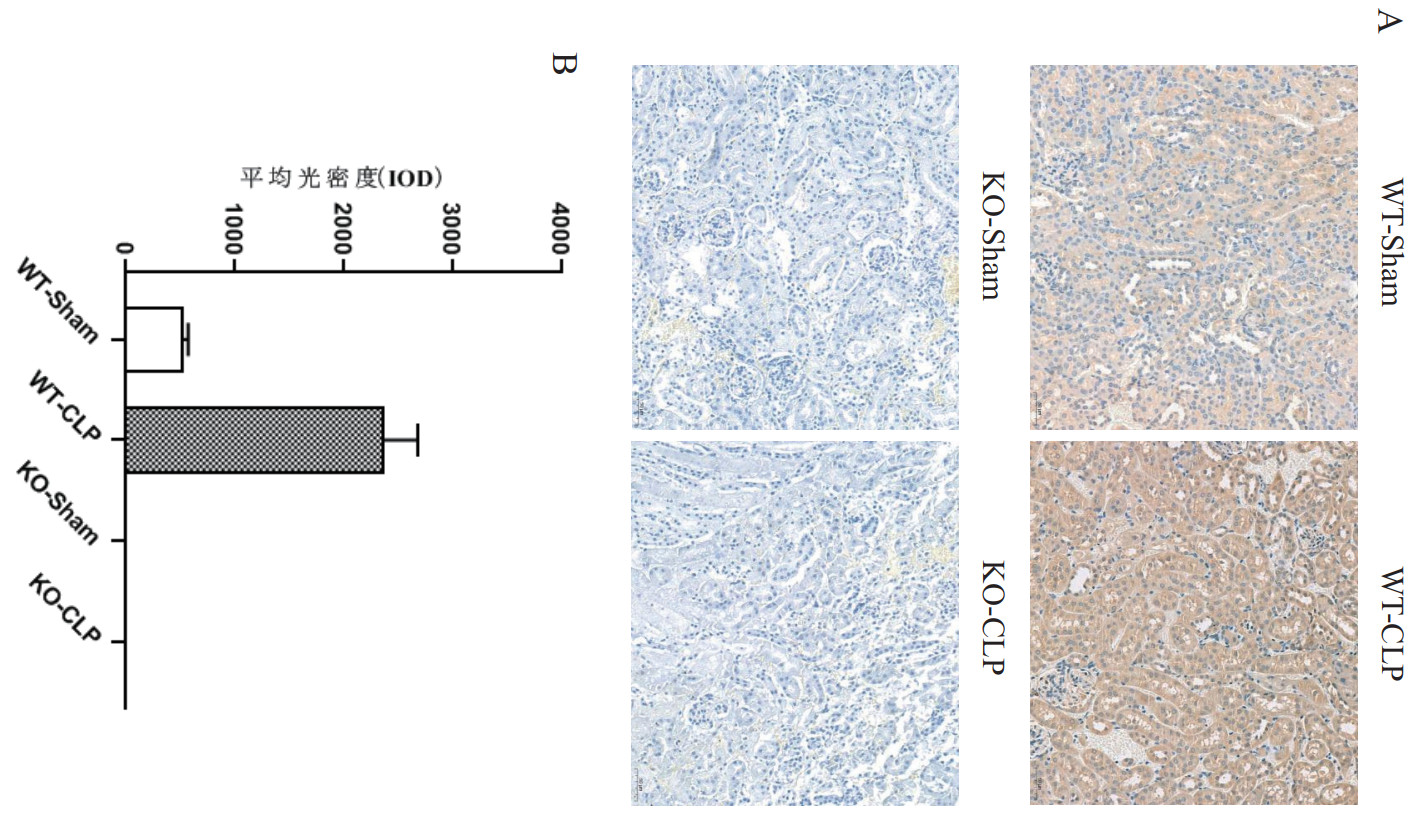
2 结果 2.1 SENP2在脓毒症小鼠肾组织中的表达在本实验中,使用CLP法建立脓毒症小鼠模型的成功率高达85.00%,WT-Sham组和KO-Sham组在预设实验终点内无小鼠死亡。WT-CLP组和KO-CLP组在CLP术后12 h内小鼠存活率高达100%,而在CLP术后24 h内WT-CLP组和KO-CLP组分别有2只(20.00%)和1只(10.00%)小鼠死亡。如图 1.所示,在WT-Sham组小鼠肾组织中可见少量SENP2蛋白表达,而在WT-CLP组小鼠肾组织中SENP2蛋白表达主要集中在肾小管上皮组织内。在SENP2 KO小鼠Sham组和CLP组均未见SENP2蛋白表达。与WT-Sham组比较,WT-CLP组小鼠肾组织中SENP2蛋白表达显著升高(P < 0.01)。
|
| 注:WT-Sham为野生型对照组;WT-CLP为野生型盲肠结扎和穿孔组;KO-Sham组为SENP2敲除对照组;KO-CLP组为SENP2敲除盲肠结扎和穿孔组;与WT-Sham组比较,P < 0.001 图 1 SENP2基因敲除小鼠肾组织中无SENP2蛋白表达(IHC,×200) Fig 1 No expression of SENP2 protein in renal tissue of SENP2 gene knockout mice (IHC, × 200) |
|
|
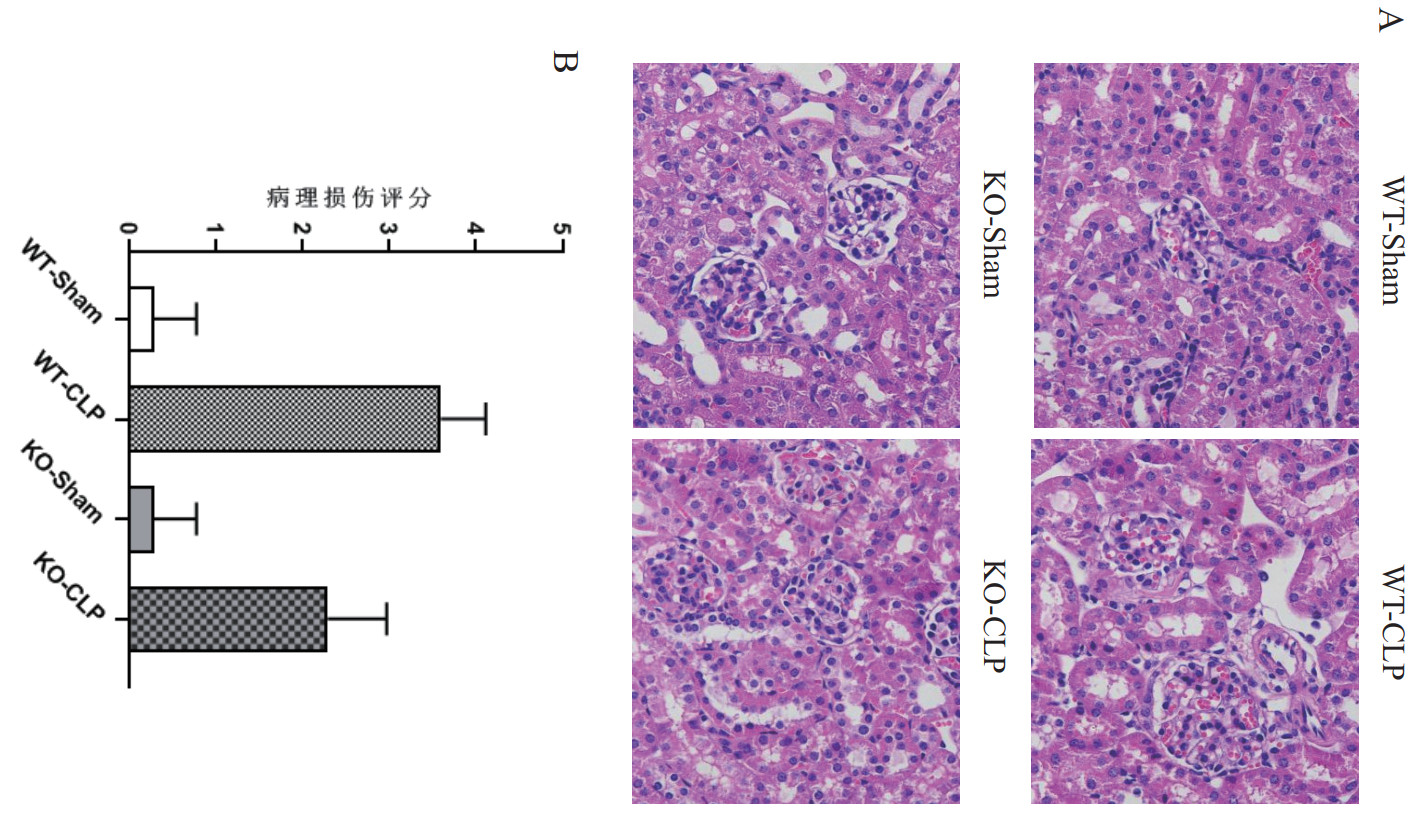
WT-Sham组小鼠肾小管和肾小球结构规整,肾小球包膜完整,间质未见炎症细胞;WT-CLP组小鼠肾小管和肾小球结构紊乱,肾小管上皮细胞脱落,肾小球包膜完全破裂,间质充满大量炎症细胞。SENP2 KO-Sham组小鼠肾小管和肾小球结构规整,肾小球包膜完整,间质无炎症细胞浸润;SENP2 KO-CLP组小鼠肾小管和肾小球结构较为规整,可见少量肾小管上皮细胞脱落,肾小球包膜部分破裂,间质少量炎症细胞浸润。使用半定量分析,WT-CLP组小鼠肾组织损伤评分显著高于WT-Sham组(P < 0.01),同时SENP2 KO-CLP组小鼠肾组织损伤评分也显著高于KO-Sham组(P < 0.01)。进一步与WT-CLP组小鼠比较,KO-CLP组小鼠肾组织损伤评分明显降低(P < 0.01)。见图 2。
|
| 注:WT-Sham为野生型对照组;WT-CLP为野生型盲肠结扎和穿孔组;KO-Sham组为SENP2敲除对照组;KO-CLP组为SENP2敲除盲肠结扎和穿孔组;与WT-Sham组比较,P < 0.001;与KO-Sham组比较,P < 0.001;与WT-CLP组比较,P < 0.01 图 2 SENP2基因敲除小鼠肾组织病理损伤减轻(HE,×400) Fig 2 Knockout of SENP2 gene reduces renal tissue pathological damage in mice (HE, ×400) |
|
|
4组小鼠肾功能指标SCr、BUN、pNGAL和pKIM-1表达水平比较,差异有统计学意义(P均 < 0.01)。与WT-Sham组小鼠比较,WT-CLP组SCr、BUN、pNGAL和pKIM-1表达水平均显著升高(P均 < 0.001)。与KO-Sham组小鼠比较,KO-CLP组SCr、BUN、pNGAL和pKIM-1表达水平同样均显著升高(P均 < 0.001)。进一步与WT-CLP小鼠比较,KO-CLP组SCr、BUN、pNGAL和pKIM-1表达水平均明显降低(P均 < 0.01)。见表 1。
| 组别 | 动物数(只) | SCr(μmol/L) | BUN(μmol/L) | pKIM-1(ng/mL) | pNGAL(ng/mL) |
| WT-Sham组 | 10 | 18.91±1.07 | 7.75±0.55 | 11.24±1.19 | 12.55±0.85 |
| WT-CLP组 | 10 | 155.50±6.64a | 29.52±1.59a | 43.24±1.14a | 46.09±2.00a |
| KO-Sham组 | 10 | 18.18±1.09 | 6.52±0.52 | 11.12±1.05 | 12.51±0.70 |
| KO-CLP组 | 10 | 116.50±6.70bc | 20.51±1.01bc | 35.71±0.94bc | 39.01±1.42bc |
| F值 | 212.60 | 116.02 | 236.49 | 170.91 | |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
| 注:WT-Sham为野生型对照组;WT-CLP为野生型盲肠结扎和穿孔组;KO-Sham组为SENP2敲除对照组;KO-CLP组为SENP2敲除盲肠结扎和穿孔组;SCr为血清肌酐;BUN为血尿素氮;pKIM-1为血浆肾损伤分子1;pNGAL为血浆中性粒细胞明胶酶相关载脂蛋白;与WT-Sham组比较,aP < 0.001;与KO-Sham组比较,bP < 0.001;与WT-CLP组比较,cP < 0.01 | |||||
4组小鼠血浆TNF-α、IL-1β、IL-4和IL-10水平比较,差异有统计学意义(P < 0.001)。与WT-Sham组小鼠比较,WT-CLP组小鼠血浆中TNF-α和IL-1β的水平均明显升高(P均 < 0.001),而IL-4和IL-10的水平均明显降低(P均 < 0.001)。与KO-Sham组小鼠比较,KO-CLP组小鼠血浆中TNF-α和IL-1β的水平也均明显升高(P均 < 0.001),而IL-4和IL-10的表达水平也均明显降低(P均 < 0.001)。进一步与WT-CLP小鼠比较,KO-CLP组小鼠TNF-α和IL-1β水平均明显降低(P均 < 0.05),而IL-4和IL-10的表达水平均有所升高,但差异无统计学意义(P均 > 0.05)。见表 2。
| 组别 | 动物数(只) | TNF-α(pg/mL) | IL-1β(pg/mL) | IL-4(pg/mL) | IL-10(pg/mL) |
| WT-Sham组 | 10 | 10.77±0.55 | 9.94±0.67 | 49.77±1.01 | 45.29±0.98 |
| WT-CLP组 | 10 | 40.98±1.34a | 43.60±1.97a | 26.15±1.62a | 19.38±1.17a |
| KO-Sham组 | 10 | 9.98±0.56 | 9.40±0.99 | 49.28±0.82 | 44.91±0.86 |
| KO-CLP组 | 10 | 34.44±1.34bc | 38.85±1.40bc | 28.56±1.47b | 22.24±1.29b |
| F值 | 262.60 | 185.01 | 101.91 | 166.72 | |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
| 注:WT-Sham为野生型对照组;WT-CLP为野生型盲肠结扎和穿孔组;KO-Sham组为SENP2敲除对照组;KO-CLP组为SENP2敲除盲肠结扎和穿孔组;与WT-Sham组比较,aP < 0.001;与KO-Sham组比较,bP < 0.001;与WT-CLP组比较,cP < 0.05 | |||||
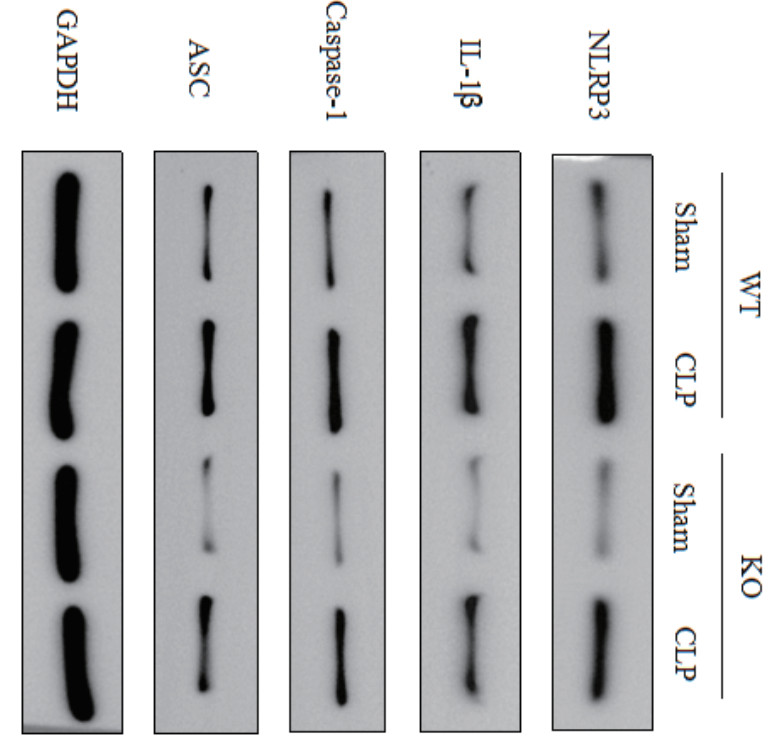
小鼠肾组织中NLRP3、IL-1β、Caspase-1和ASC蛋白水平比较,差异有统计学意义(P均 < 0.001)。与WT-Sham组小鼠比较,WT-CLP组小鼠NLRP3、IL-1β、Caspase-1和ASC蛋白水平均显著升高(P均 < 0.001)。与KO-Sham组小鼠比较,KO-CLP组小鼠NLRP3、IL-1β、Caspase-1和ASC蛋白水平也均显著升高(P均 < 0.001)。此外,与WT-CLP组小鼠比较,KO-CLP组小鼠NLRP3、IL-1β、Caspase-1和ASC蛋白水平均显著降低(P均 < 0.05)。见表 3,图 3。
| 组别 | 动物数(只) | NLRP3 | IL-1β | Caspase-1 | ASC |
| WT-Sham组 | 10 | 0.27±0.03 | 0.16±0.02 | 0.21±0.02 | 0.18±0.01 |
| WT-CLP组 | 10 | 0.89±0.01a | 0.57±0.01a | 0.56±0.02a | 0.41±0.02a |
| KO-Sham组 | 10 | 0.27±0.03 | 0.15±0.01 | 0.11±0.02 | 0.13±0.02 |
| KO-CLP组 | 10 | 0.71±0.04bc | 0.41±0.02bc | 0.41±0.02bc | 0.27±0.01bc |
| F值 | 109.21 | 100.83 | 95.84 | 20.53 | |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
| 注:WT-Sham为野生型对照组;WT-CLP为野生型盲肠结扎和穿孔组;KO-Sham组为SENP2敲除对照组;KO-CLP组为SENP2敲除盲肠结扎和穿孔组;与WT-Sham组比较,aP < 0.001;与KO-Sham组比较,bP < 0.001;与WT-CLP组比较,cP < 0.05 | |||||
|
| 注:WT为野生型;KO为SENP2基因敲除型;Sham为假手术组;CLP为盲肠结扎和穿孔组;GAPDH.甘油醛-3-磷酸脱氢酶(Western-blotting法) 图 3 各组小鼠肾组织NLRP3通路蛋白表达 Fig 3 Expression of NLRP3 pathway protein in kidney tissue of mice in each group |
|
|
脓毒症常常起病急、进展快,可迅速发展为多器官功能损伤,严重影响着全人类的生命健康[6-7]。在脓毒症的发病过程中,AKI是其常见的合并症之一,如不能及时发现和救治,可迅速进展为急性肾功能衰竭[8]。因此,深入探究SAKI的发病机制是防治的关键,具有非常重要的临床意义。最新研究发现,小泛素样修饰蛋白(small ubiquitin-related moditier protein,SUMO)是一种新发现的类泛素蛋白质,其主要通过与底物相结合调控相关蛋白活性[9-11]。SUMO家族属于高度保守蛋白,主要受SENP蛋白酶家族调控,而SENP2是人体重要的泛素样修饰因子,存在于人体的肾脏、大脑、肝脏等组织中,在人体组织细胞间传递中起着关键作用[12-13]。
为了探讨SENP2在SAKI发病机制中的作用,本研究利用SENP2基因敲除小鼠,并构建了SAKI小鼠模型。笔者前期的研究结果表明,肾脏作为脓毒症期间最常受损的靶器官,在疾病早期即可突显出来[14-16]。本研究发现在CLP后的24 h脓毒症小鼠即出现AKI,并且在肾组织中SENP2蛋白表达明显升高,伴随着肾组织病理损伤加重和肾功能的显著降低。然而,SENP2基因敲除后,虽然脓毒症小鼠的肾脏病理损伤和肾功能均有不同程度的降低,但与野生型脓毒症小鼠相比较,肾病理损伤和肾功能均有所减轻。由此可见,SENP2在SAKI发病过程中起着重要作用,通过某种手段降低SENP2基因表达将对AKI有显著的保护作用。
众所周知,炎症反应是脓毒症过程的核心,而炎症因子活性决定了疾病进展的速度和治疗的最终结局[17-18]。为了确定SENP2基因是否对脓毒症期间炎症因子活性产生影响,进行了深入研究。结果表明,在脓毒症早期促炎因子TNF-α和IL-1β水平均显著升高,而抗炎因子IL-4和IL-10水平均明显降低。在SENP2基因敲除情况下,CLP小鼠血浆TNF-α和IL-1β水平均显著降低,但抗炎因子IL-4和IL-10水平的升高却不显著。因此,SENP2基因的表达水平部分决定着炎症因子活性,然而具体调控机制仍不清楚。
NLRP3基因缺失可改善脓毒症诱发的肾功能不全和肾组织病理损害,具体机制与抑制炎症反应和抗细胞焦亡等密切相关。为了明确SENP2调控SAKI过程中的炎症反应是否与NLRP3信号通路相关,本研究进行了深入的研究。结果表明,CLP导致脓毒症小鼠肾组织中NLRP3、IL-1β、Caspase-1和ASC蛋白水平的显著升高,而SENP2基因敲除后小鼠肾组织中NLRP3、IL-1β、Caspase-1和ASC蛋白表达水平均显著降低。因此,笔者推断NLRP3信号通路可能是脓毒症期间引发过度炎症反应的关键环节,SENP2通过调控NLRP3信号通路在SAKI过程中起着重要作用。深入研究干预SENP2是否有效抑制NLRP3信号通路从而改善SAKI将是未来研究的重点。
利益冲突 所有作者声明无利益冲突
作者贡献声明 樊恒:动物实验、数据收集和整理、论文撰写;樊恒、孙敏和朱建华:工作支持、研究设计;朱建华:统计学分析指导和论文修改
| [1] | Salomão R, Ferreira BL, Salomão MC, et al. Sepsis: evolving concepts and challenges[J]. Braz J Med Biol Res, 2019, 52(4): e8595. DOI:10.1590/1414-431X20198595 |
| [2] | Peerapornratana S, Manrique-Caballero CL, Gómez H, et al. Acute kidney injury from sepsis: current concepts, epidemiology, pathophysiology, prevention and treatment[J]. Kidney Int, 2019, 96(5): 1083-1099. DOI:10.1016/j.kint.2019.05.026 |
| [3] | Fan H, Le JW, Sun M, et al. Pretreatment with S-nitrosoglutathione attenuates septic acute kidney injury in rats by inhibiting inflammation, oxidation, and apoptosis[J]. Biomed Res Int, 2021, 2021: 6678165. DOI:10.1155/2021/6678165 |
| [4] | Fan H, Sun M, Le JW, et al. S-Nitrosoglutathione protects acute kidney injury in septic rats by inhibiting the activation of NLRP3 inflammasome[J]. Iran J Basic Med Sci, 2023, 26(7): 830-835. DOI:10.22038/IJBMS.2023.69651.15169 |
| [5] | Kidney Disease: Improving Global Outcomes CKD Work Group. KDIGO 2024 clinical practice guideline for the evaluation and management of chronic kidney disease[J]. Kidney Int, 2024, 105(4S): S117-S314. DOI:10.1016/j.kint.2023.10.018 |
| [6] | Fan H, Su BJ, Le JW, et al. Salidroside protects acute kidney injury in septic rats by inhibiting inflammation and apoptosis[J]. Drug Des Devel Ther, 2022, 16: 899-907. DOI:10.2147/DDDT.S361972 |
| [7] | Napolitano LM. Sepsis 2018: definitions and guideline changes[J]. Surg Infect (Larchmt), 2018, 19(2): 117-125. DOI:10.1089/sur.2017.278 |
| [8] | 濮雪华, 高宁, 吴德章, 等. 血清PenKid是脓毒症相关急性肾损伤发生与死亡的危险因素[J]. 中华急诊医学杂志, 2023, 32(8): 1077-1082. DOI:10.3760/cma.j.issn.1671-0282.2023.08.012 |
| [9] | Chang HM, Yeh ETH. SUMO: from bench to bedside[J]. Physiol Rev, 2020, 100(4): 1599-1619. DOI:10.1152/physrev.00025.2019 |
| [10] | Hotz PW, Müller S, Mendler L. SUMO-specific isopeptidases tuning cardiac SUMOylation in health and disease[J]. Front Mol Biosci, 2021, 8: 786136. DOI:10.3389/fmolb.2021.786136 |
| [11] | Lascorz J, Codina-Fabra J, Reverter D, et al. SUMO-SIM interactions: From structure to biological functions[J]. Semin Cell Dev Biol, 2022, 132: 193-202. DOI:10.1016/j.semcdb.2021.11.007 |
| [12] | Huppelschoten Y, Mukhopadhyay R, Buchardt J, et al. In-plate chemical synthesis of isopeptide-linked SUMOylated peptide fluorescence polarization reagents for high-throughput screening of SENP preferences[J]. Chembiochem, 2023, 24(2): e202200601. DOI:10.1002/cbic.202200601 |
| [13] | Rosen C, Park S, Baxter T, et al. Sensed presence, attenuated psychosis, and transliminality: at the threshold of consciousness[J]. Psychopathology, 2023, 56(5): 359-370. DOI:10.1159/000528572 |
| [14] | Fan H, Sun M, Zhu JH. Clinical role of serum microRNA-155 in early diagnosis and prognosis of septic patients with acute kidney injury[J]. Int Urol Nephrol, 2024, 56(5): 1687-1694. DOI:10.1007/s11255-023-03855-z |
| [15] | Zarbock A, Nadim MK, Pickkers P, et al. Sepsis-associated acute kidney injury: consensus report of the 28th acute disease quality initiative workgroup[J]. Nat Rev Nephrol, 2023, 19(6): 401-417. DOI:10.1038/s41581-023-00683-3 |
| [16] | 戎珊, 叶久航, 朱曼晨, 等. 脓毒症患者早期发生急性肾损伤的预测模型构建与内部验证[J]. 中华急诊医学杂志, 2023, 32(9): 1178-1183. DOI:10.3760/cma.j.issn.1671-0282.2023.09.006 |
| [17] | Sun SJ, Chen R, Dou XK, et al. Immunoregulatory mechanism of acute kidney injury in sepsis: a narrative review[J]. Biomed Pharmacother, 2023, 159: 114202. DOI:10.1016/j.biopha.2022.114202 |
| [18] | Oczkowski S, Alshamsi F, Belley-Cote E, et al. Surviving sepsis campaign guidelines 2021: highlights for the practicing clinician[J]. Pol Arch Intern Med, 2022, 132(7/8): 16290. DOI:10.20452/pamw.16290 |
 2025, Vol. 34
2025, Vol. 34




