2. 宁夏医科大学总医院重症医学科,银川 750004
2. Department of Critical Care Medicine, General Hospital of Ningxia Medical University, Yinchuan 750004, China
机械通气(mechanical ventilation, MV)是重症监护病房(intensive care unit, ICU)最常见的生命支持技术之一,呼吸机相关性肺炎(ventilator-associated pneumonia, VAP)是MV最常见的并发症之一,发病率约为5.2%~48.4%,治疗难度增大,不仅延长患者MV及ICU住院时间,还增加医疗费用甚至死亡风险,严重影响患者预后[1-2]。VAP影响因素较多且发病机制复杂,目前临床诊断和治疗VAP主要依赖于下呼吸道病原学、影像学并结合患者临床表现,对已发生的VAP尚缺乏有效的风险预警和识别机制,且上述方法诊断VAP的准确性欠佳[3]。临床预测模型是以疾病高危因素为基础,利用方程公式建立统计模型,来估计某种特征人群患病概率的评估工具[4],可将风险评估和管理的焦点提前到VAP发生发展的早期阶段,有利于形成预测—预防—预警—干预的管理机制。目前已有学者构建了相关模型,但存在模型适用的病种人群受限、预测性能报告不充分、缺乏验证等局限,影响临床实用性[5-7]。因此,本研究通过回顾性研究,构建并验证VAP风险预测列线图模型,以期为医护人员早期识别VAP高危患者提供科学量化的评估工具,进一步提高医护人员的预警意识,并为制定精准化分层干预方案提供决策依据。
1 资料与方法 1.1 研究对象采用便利抽样法,根据研究对象入院顺序,回顾性选取2019年1月至2022年12月入住宁夏医科大学总医院重症医学科的MV患者为研究对象。纳入标准:(1)年龄≥18岁;(2)MV时间≥48 h;(3)患者病例资料完整。排除标准:(1)转入ICU已行MV时间 > 48 h;(2)依靠呼吸机长期支持者(> 90 d);(3)存在严重免疫缺陷或肿瘤姑息治疗者。剔除标准:因病情变化、自动离院或死亡等原因不再符合标准者。
本研究经系统学习文献结合专家会议法筛选VAP候选预测因子共49个,根据模型样本量计算公式EPV(Event Per Variable)[8],每个自变量需病例5~10例,参考研究[2]结果,VAP发病率取其中位数26.8%(5.2%~48.4%),再考虑20%无效样本,计算样本量约为1 097~2 194例。本研究已获宁夏医科大学总医院伦理委员会审批(伦理审批号:KYLL-2021-861)。
1.2 研究工具在系统学习文献基础上结合专家会议法,并根据研究目的设计《机械通气患者呼吸机相关性肺炎发生风险预测模型临床资料收集表》,包括一般资料(8项)、疾病指标(10项)、用药指标(5项)、病情指标(12项)和操作指标(14项),共49个候选预测因子。VAP诊断标准依据《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)》[9]。
1.3 资料收集和质量控制方法成立研究小组,获得科室负责人同意、授权后,由2名研究者采用上述临床资料收集表,根据纳入及排除标准严格筛选研究对象,并以是否发生VAP将MV患者分为非VAP组与VAP组,通过HIS系统及重症监护系统回顾性收集两组患者一般资料、疾病、用药、病情及操作指标。其中,病情指标收集患者MV 24 h内最异常值,用药及操作指标的资料收集截至患者发生VAP、或撤离呼吸机拔除气管插管,VAP观察时间至拔管48 h。资料收集前,课题负责人就系统使用方法、各指标的操作性定义等以讨论形式进行培训,确保资料收集准确可靠。采用Excel建立数据库,双人录入并核对数据。便利抽样法为非概率抽样,为控制偏倚,以VAP患者MV时间的第一个四分位数为界,将非VAP患者的MV时间四分位数与之进行匹配。
1.4 统计学方法采用SPSS 27.0进行统计分析。数据缺失值< 20%采用多重插补法填补;计数资料采用频数(百分比)描述,组间比较采用χ2检验或Fisher确切概率法;计量资料根据是否符合正态分布采用均数±标准差(x±s)或中位数(四分位数)[M(Q1, Q3)]描述,组间比较采用独立样本t检验或Mann-Whitney U检验。将单因素分析P < 0.05的候选预测因子纳入多因素Logistic逐步向前回归分析,筛选最终进入模型的预测因子。应用R 4.3.2软件(pROC、reportROC、fbroc、rms、rmda程序包)构建并验证列线图模型,通过受试者工作特征曲线(receiver operating characteristic curve,ROC)下面积(area under the ROC curve, AUC)及其95%置信区间(confidence interval, CI)评价模型区分度,计算模型在预测临界值下的诊断性试验结果。Hosmer-Lemeshow检验评价模型拟合度,采用Bootstrap重抽样1 000次进行内部验证,通过校准曲线和决策分析曲线评价模型校准度和临床适用度。以P < 0.05为差异具有统计学意义。
2 结果 2.1 研究对象临床资料及VAP发生情况本研究共纳入1 250例MV患者作为训练集构建模型,筛选流程见图 1。其中,男性855例(68.4%)、女性395例(31.6%),年龄为61(48, 72)岁,其余资料见表 1和表 2。本研究中148例MV患者发生VAP,发病率为11.8%,VAP发生时间为MV第8(5, 11)天。病原菌依次为鲍曼不动杆菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌、纹带棒状杆菌及其他病原菌感染。
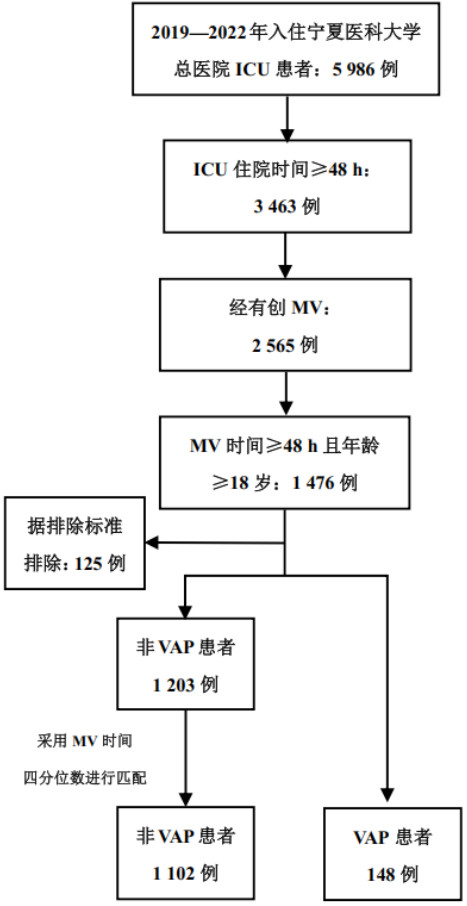
|
| 注:ICU为重症监护病房,MV为机械通气,VAP为呼吸机相关性肺炎 图 1 研究对象筛选流程图 Fig 1 Flowchart of participants inclusion |
|
|
| 指标 | 非VAP组(n=1 102) | VAP组(n=148) | χ2/Z值 | P值 |
| 一般资料 | ||||
| 男性a | 750(68.1) | 105(70.9) | 0.503 | 0.478 |
| 年龄(岁)b | 61(48, 72) | 59(45, 69) | -1.920 | 0.055 |
| 体重指数a | 2.724 | 0.436 | ||
| < 18.5 kg/m2 | 78(7.1) | 7(4.7) | ||
| 18.5~23.9 kg/m2 | 509(46.2) | 69(46.6) | ||
| 24.0~27.9 kg/m2 | 392(35.6) | 50(33.8) | ||
| ≥28 kg/m2 | 123(11.1) | 22(14.9) | ||
| 意识昏迷a | 310(28.1) | 55(37.2) | 5.148 | 0.023 |
| 吸烟史a | 278(25.2) | 40(27.0) | 0.223 | 0.637 |
| 一年内住院史a | 275(25.0) | 50(33.8) | 5.286 | 0.021 |
| 一年内手术史a | 262(23.8) | 46(31.1) | 3.751 | 0.053 |
| 检出多重耐药菌a | 128(11.6) | 111(75.0) | 338.980 | < 0.001 |
| 疾病指标a | ||||
| 高血压 | 366(33.2) | 47(31.8) | 0.125 | 0.724 |
| 糖尿病 | 148(13.4) | 21(14.2) | 0.064 | 0.800 |
| 心脏病 | 195(17.7) | 28(18.9) | 0.133 | 0.715 |
| 慢性肺部疾病 | 92(8.3) | 24(16.2) | 9.594 | 0.002 |
| 慢性肾脏疾病 | 33(3.0) | 10(6.8) | 5.560 | 0.018 |
| 脑血管疾病 | 105(9.5) | 25(16.9) | 7.593 | 0.006 |
| 消化系统溃疡 | 97(8.8) | 10(6.8) | 0.697 | 0.404 |
| 静脉血栓栓塞症 | 132(12.0) | 29(19.6) | 6.745 | 0.009 |
| 胸部损伤 | 118(10.7) | 31(20.9) | 13.026 | < 0.001 |
| 颅脑损伤 | 109(9.9) | 30(20.3) | 14.222 | < 0.001 |
| 用药指标a | ||||
| 使用抑酸药 | 954(86.6) | 127(85.8) | 0.064 | 0.800 |
| 使用激素类药物 | 975(88.5) | 135(91.2) | 0.985 | 0.321 |
| 使用抗菌药物 | 101.683 | < 0.001 | ||
| 否 | 16(1.5) | 1(0.7) | ||
| 1种 | 528(47.9) | 16(10.8) | ||
| 2种 | 407(36.9) | 71(48.0) | ||
| ≥3种 | 151(13.7) | 60(40.5) | ||
| 使用抗病毒药物 | 11(1.0) | 9(6.1) | 18.304 | < 0.001 |
| 使用抗真菌药物 | 93(8.4) | 37(25.0) | 38.402 | < 0.001 |
| 注:VAP为呼吸机相关性肺炎;a为(例,%),b为M(Q1, Q3) | ||||
| 指标 | 非VAP组(n=1 102) | VAP组(n=148) | χ2/Z值 | P值 |
| 病情指标 | ||||
| APACHE Ⅱ评分(分)a | 17(12, 22) | 17(14, 24) | -1.133 | 0.257 |
| 白细胞计数(×109/L)a | 10.8(7.5, 15.0) | 10.5(6.9, 14.4) | -0.720 | 0.472 |
| 中性粒细胞相对值(%)a | 85.9(79.0, 90.7) | 86.7(81.3, 90.4) | -0.847 | 0.397 |
| 淋巴细胞绝对值(×109/L)a | 0.7(0.4, 1.0) | 0.6(0.4, 0.9) | -0.940 | 0.347 |
| 白蛋白(g/L)a | 24.0(20.3, 27.8) | 25.0(21.6, 28.0) | -1.493 | 0.136 |
| 吸氧浓度(%)a | 45(40, 50) | 50(45, 60) | -3.992 | < 0.001 |
| pHa | 7.3(7.2, 7.4) | 7.4(7.3, 7.4) | -1.630 | 0.103 |
| PCO2(mmHg)a | 38.4(33.3, 45.4) | 36.9(32.8, 44.7) | -1.357 | 0.175 |
| PO2(mmHg)a | 88.9(70.2, 118.0) | 80.2(61.0, 109.8) | -3.295 | < 0.001 |
| 氧合指数a | 199(146, 264) | 164(106, 215) | -5.281 | < 0.001 |
| 乳酸(mmol/L)a | 1.8(1.2, 3.0) | 1.8(1.2, 2.8) | -0.183 | 0.855 |
| 降钙素原b | 2.187 | 0.535 | ||
| < 0.5 ng/mL | 523(47.5) | 69(46.6) | ||
| 0.5~2.0 ng/mL | 220(19.9) | 30(20.3) | ||
| 2.0~10.0 ng/mL | 151(13.7) | 26(17.6) | ||
| ≥10.0 ng/mL | 208(18.9) | 23(15.5) | ||
| 操作指标 | ||||
| 入科4 h氧疗方式b | 23.361 | < 0.001 | ||
| 鼻导管 | 12(1.1) | 9(6.1) | ||
| 面罩 | 19(1.7) | 6(4.1) | ||
| 高流量 | 16(1.5) | 6(4.1) | ||
| 有创通气 | 1 037(94.1) | 124(83.7) | ||
| 无创通气 | 18(1.6) | 3(2.0) | ||
| 气管插管场所b | 87.543 | < 0.001 | ||
| ICU | 121(11.0) | 43(29.1) | ||
| 麻醉科 | 656(59.5) | 38(25.7) | ||
| 急诊科 | 154(14.0) | 48(32.4) | ||
| 其他 | 171(15.5) | 19(12.8) | ||
| 气管切开b | 78(7.1) | 28(18.9) | 23.572 | < 0.001 |
| 再次气管插管b | 49(4.4) | 29(19.6) | 51.174 | < 0.001 |
| 使用纤维支气管镜b | 250(22.7) | 90(60.8) | 95.774 | < 0.001 |
| MV时间b | 110.822 | < 0.001 | ||
| < 5 d | 727(66.0) | 31(20.9) | ||
| ≥5 d | 375(34.0) | 117(79.1) | ||
| 进行手术b | 868(78.8) | 99(66.9) | 10.503 | 0.001 |
| 手术时间(h)a | 2.0(1.0, 3.5) | 2.0(0, 3.0) | -2.270 | 0.023 |
| 留置胃管b | 1 004(91.1) | 138(93.2) | 0.754 | 0.385 |
| 肠内营养b | 570(51.7) | 116(78.4) | 37.435 | < 0.001 |
| 留置空肠营养管b | 140(12.7) | 41(27.7) | 23.703 | < 0.001 |
| 留置胸腔引流管b | 212(19.2) | 26(17.6) | 0.236 | 0.627 |
| 留置腹腔引流管b | 466(42.3) | 54(36.5) | 1.807 | 0.179 |
| 留置CVC/PICC导管b | 762(69.1) | 94(63.5) | 1.918 | 0.166 |
| 注:VAP为呼吸机相关性肺炎,APACHE Ⅱ评分为急性生理与慢性健康状况Ⅱ评分,pH为酸碱度,PCO2为动脉血二氧化碳分压,PO2为动脉血氧分压,ICU为重症监护病房,MV为机械通气,CVC为中心静脉导管,PICC为经外周静脉置入中心静脉导管;a为M(Q1, Q3),b为(例, %) | ||||
单因素分析结果显示,与非VAP组患者相比,VAP组患者多呈意识昏迷状态,一年内住院史、检出多重耐药菌的比例较高,且通常合并有慢性肺部疾病、慢性肾脏疾病、脑血管疾病、静脉血栓栓塞症、胸部损伤和颅脑损伤,差异有统计学意义(均P < 0.05)。比较两组患者用药、病情和操作指标发现,VAP组患者使用抗菌药物、抗病毒药物、抗真菌药物、气管切开、再次气管插管、使用纤维支气管镜、MV时间≥5 d、肠内营养、留置空肠营养管的比例和吸氧浓度高于非VAP组,而PO2、氧合指数、进行手术、手术时间低于非VAP组,且两组在入科4 h氧疗方式、气管插管场所的比较上,差异具有统计学意义(均P < 0.05),见表 1和表 2。
2.3 MV患者发生VAP的多因素Logistic回归分析以MV患者是否发生VAP为因变量(赋值:非VAP =0,VAP =1),将单因素分析中P < 0.05的25个候选预测因子作为自变量,逐步向前回归分析,自变量赋值表见附表 1。结果显示,检出多重耐药菌、慢性肾脏疾病、颅脑损伤、氧合指数、气管插管场所、再次气管插管、使用纤维支气管镜、使用抗菌药物、MV时间为最终进入模型的预测因子,见表 3。
| 指标 | β值 | S.E. | Wald χ2值 | P值 | OR值 | 95% CI |
| 常数项 | -2.796 | 1.203 | 5.405 | 0.020 | 0.061 | - |
| 检出多重耐药菌 | 2.572 | 0.242 | 113.275 | < 0.001 | 13.097 | 8.155~21.033 |
| 慢性肾脏疾病 | 1.080 | 0.505 | 4.571 | 0.033 | 2.945 | 1.094~7.929 |
| 颅脑损伤 | 1.209 | 0.305 | 15.711 | < 0.001 | 3.351 | 1.843~6.093 |
| 氧合指数 | -0.004 | 0.001 | 5.815 | 0.016 | 0.996 | 0.994~0.999 |
| 气管插管场所 | ||||||
| 综合ICU | 1.000(基准组) | |||||
| 麻醉科 | -0.668 | 0.317 | 4.436 | 0.035 | 0.513 | 0.275~0.955 |
| 急诊科 | 0.225 | 0.326 | 0.474 | 0.491 | 1.252 | 0.660~2.373 |
| 其他 | -0.918 | 0.370 | 6.169 | 0.013 | 0.399 | 0.194~0.824 |
| 再次气管插管 | 1.197 | 0.337 | 12.649 | < 0.001 | 3.310 | 1.711~6.401 |
| 使用纤维支气管镜 | 0.637 | 0.244 | 6.806 | 0.009 | 1.890 | 1.172~3.050 |
| 使用抗菌药物 | ||||||
| 否 | 1.000(基准组) | |||||
| 1种 | -0.823 | 1.167 | 0.497 | 0.481 | 0.439 | 0.045~4.326 |
| 2种 | 0.044 | 1.146 | 0.001 | 0.969 | 1.045 | 0.111~9.874 |
| ≥3种 | 0.202 | 1.155 | 0.031 | 0.861 | 1.224 | 0.127~11.765 |
| MV时间 | 0.498 | 0.278 | 3.205 | 0.073 | 1.645 | 0.954~2.837 |
| 注:MV为机械通气 | ||||||
根据Logistic回归分析结果、赤池信息准则(AIC)并结合临床实际,构建MV患者VAP风险预测列线图模型,见图 2。根据模型预测概率绘制ROC曲线,见图 3。AUC为0.917(95%CI:0.895~0.939),最大约登指数0.697对应预测临界值为0.096,模型准确度为0.836,敏感度为0.865,特异度为0.832,阳性预测值及阴性预测值分别为0.409、0.979。根据预测临界值0.096计算出列线图临界分数为167分(即≥167分为VAP高危患者)。Hosmer-Lemeshow检验结果χ2=3.560,P=0.938(P > 0.05),说明模型拟合程度良好。
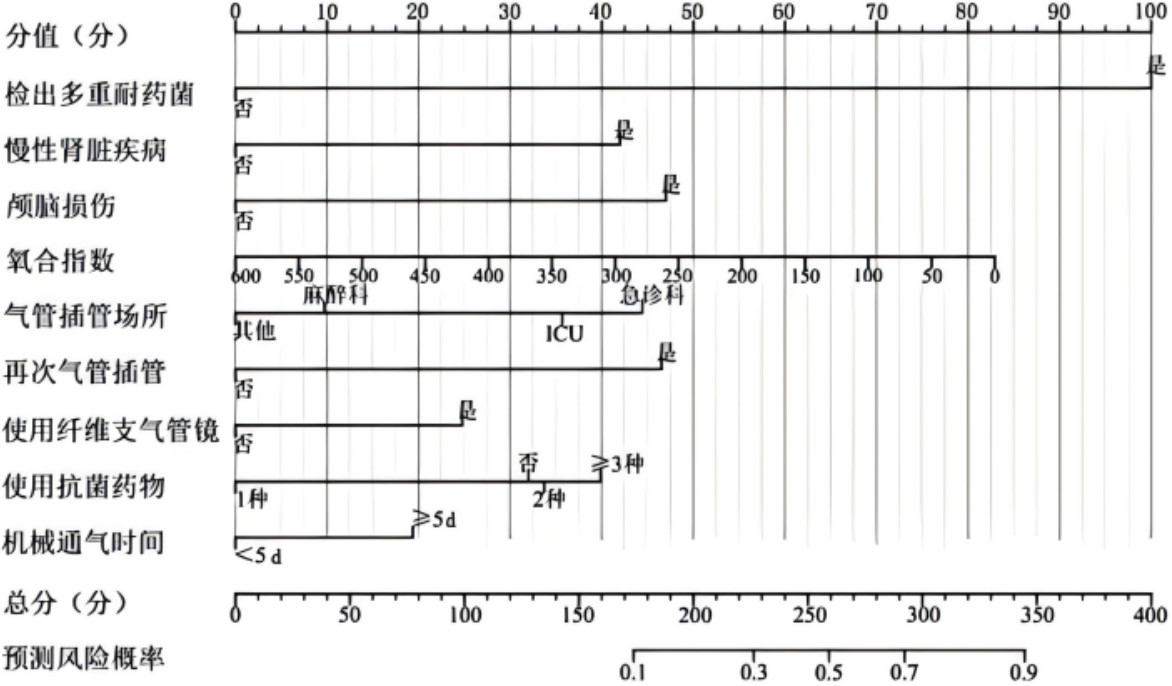
|
| 图 2 MV患者VAP风险预测列线图模型 Fig 2 Nomogram prediction model for the risk of VAP in MV patients |
|
|
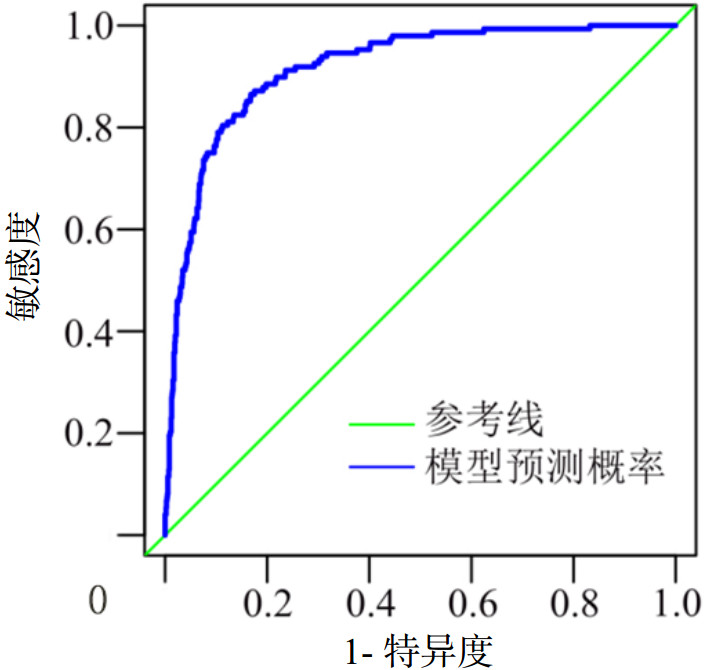
|
| 图 3 MV患者VAP风险预测模型的ROC曲线 Fig 3 ROC curve of VAP risk prediction model in MV patients |
|
|
在模型构建所用训练集中采用Bootstrap重抽样1 000次对模型进行内部验证,抽样后AUC为0.917(95%CI: 0.894~0.938)。校准曲线显示模型预测风险与实际风险基本一致,见图 4;决策分析曲线显示决策阈值概率为2%~90%,见图 5。
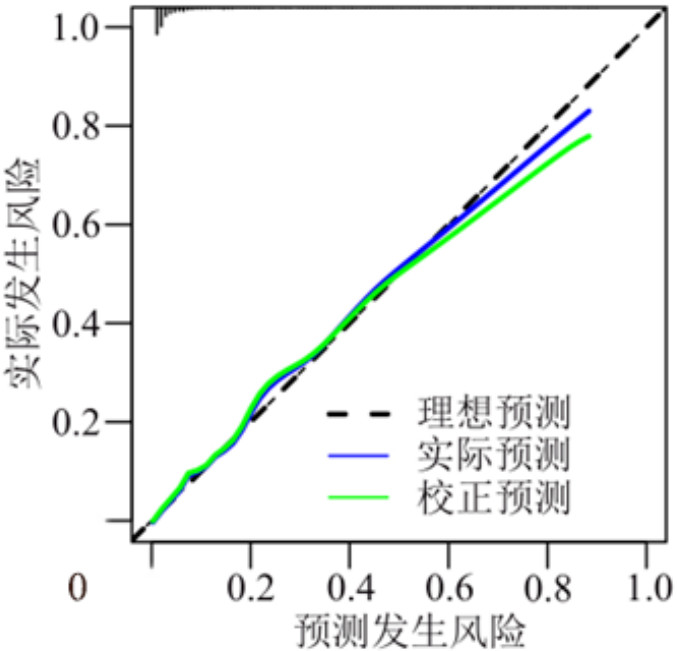
|
| 图 4 MV患者VAP风险预测模型的校准曲线 Fig 4 Calibration curve of the VAP risk prediction model in MV patients |
|
|
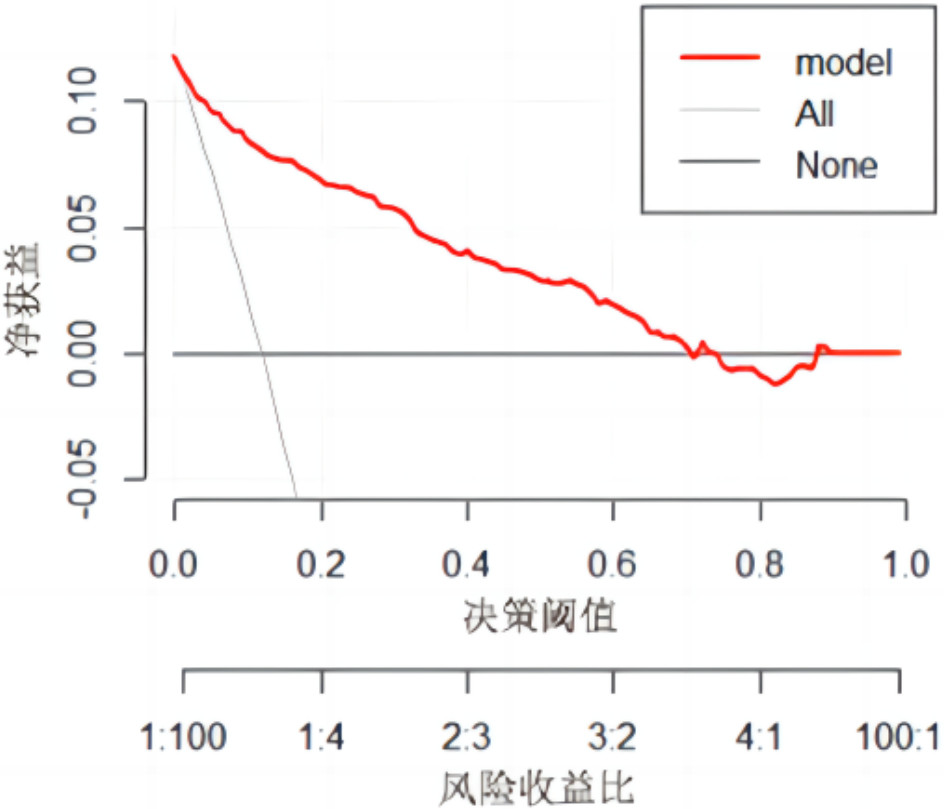
|
| 图 5 MV患者VAP风险预测模型的校准曲线 Fig 5 Calibration curve of the VAP risk prediction model in MV patients |
|
|
VAP防控是长期困扰临床医护人员的严重问题。本研究结果显示VAP发病率为11.8%(148/1250),低于既往研究结果[2, 5, 10],但仍处于较高水平。VAP发病机制复杂、不良影响严重,其发生风险每增加1%,相关医疗费用可增加近3~4万美元,年度总费用更高达近14.5亿美元[11]。其次,本研究中约70%的VAP患者为平均年龄近60岁的老年男性患者,多为迟发型VAP(MV≥5 d),病原菌感染以耐碳青霉烯类鲍曼不动杆菌为主,与Chang等[12]研究结果一致。随着年龄增长,患者合并基础疾病较多,气道廓清能力减弱,且男性吸烟等不良生活方式多于女性,加之MV损伤气道黏膜,期间接受侵入性操作、联用多种抗菌药物的机会增多,导致老年男性患者耐药菌感染风险和VAP易感性增高[13]。
本研究发现,使用≥3种抗菌药物、多重耐药菌感染的MV患者发生VAP风险较高,与Giang等[14]研究结果一致。研究显示,其VAP发生风险是使用抗菌药物 < 3种的4.9倍[6]。由于多种抗菌药物联合应用致使机体菌群失调,产生耐药基因和质粒[15],加之MV患者呼吸道屏障受损,易导致多重耐药菌或机会病原菌感染,大幅增加抗感染难度和VAP发生风险。此外,ICU因其特殊环境导致物品表面和仪器设备常被多重耐药菌污染,医护人员接触被其污染的物品后继而接触患者,病原菌会随之定植,增加水平传播和交叉感染概率[16]。医护人员应及时监测病原学结果,根据病原菌分布特征,制定抗菌药物管理计划,严格把控抗菌药物使用指征,合理选择抗菌药物种类及用量,避免长期联用多种抗菌药物并预防交叉感染[17]。
患有慢性肾脏疾病的MV患者发生VAP风险较高,与Deng等[18]研究结果相似。由于肾小球滤过率下降、血流毒性物质增高和免疫抑制,导致炎症因子水平升高,促使呼吸道上皮鳞状细胞增殖,破坏正常生理结构并损害气道廓清能力[19-20]。其次,慢性肾脏疾病患者常伴有低蛋白血症,而白蛋白在免疫调节、抗炎反应和维持肺泡毛细血管通透性方面具有重要作用[21],其降低水平与VAP易感性呈正相关[18],加之接受血液透析、激素冲击等治疗,易造成免疫微环境紊乱—感染的恶性循环,增加感染风险[22]。此外,伴有颅脑损伤的MV患者发生VAP风险较高,与Wang等[5]研究结果一致。研究显示,伴有颅脑损伤的MV患者其VAP发病率约为20.4%,且MV每增加1 d,VAP发生风险增加7%,是非颅脑损伤患者的14倍[23-24]。颅脑损伤通过诱导免疫抑制与脑—肺轴相互作用,释放炎性介质,激活淋巴系统,导致全身炎症反应综合征[25],加之意识水平改变、术后镇静镇痛和活动受限等,咳嗽反射及清除气道异物能力减弱,增加VAP发生风险。
再次气管插管、使用纤维支气管镜的MV患者发生VAP风险较高,与Liang等[26]研究结果一致。研究显示,相较于单次插管,插管次数≥2次可使VAP感染率由8.6%升高到47.7%[27]。由于ICU患者鼻(口)咽部与胃肠道耐药菌定植率较高,再次气管插管或使用纤维支气管镜时易将鼻咽部或气管插管壁内定植菌机械转移至下呼吸道,加之侵入性操作再次损伤气道黏膜,导致VAP风险及抗感染难度增加[28-29]。此外,在急诊科行气管插管的MV患者发生VAP的风险较高,与Angotti等[30]研究结果相似。研究显示,在急诊科行气管插管的MV患者,其VAP发病率约为20%[31]。由于急诊科就诊人员和环境复杂,为保障生命安全,患者在紧急情况下接受气管插管,污染的手部接触、就诊环境及器械设备均可增加VAP发生风险,加之患者若呈饱腹状态,易出现胃内容物反流误吸,反流误吸是发生VAP的独立危险因素,急诊科插管患者误吸发生率约8%[32-33]。医护人员需提高自身准备度,当面临紧急情况,尽可能在救治患者的同时将不良影响降至最低。
MV是发生VAP的先决条件,MV时间≥5 d的患者发生VAP风险较高,与Giang等[14]研究结果一致。MV时间≥5 d的VAP主要为多重耐药菌感染,病原菌聚集气管插管壁形成生物膜所致[28]。长时间MV导致患者气道防御功能减弱,接受侵入性操作、联用多种抗菌药物的机会增多,多重耐药菌感染风险增大,落实VAP集束化预防措施的难度随之增大。此外,氧合指数较低的MV患者发生VAP风险越高,与Liang等[26]研究结果一致。氧合指数是反映患者肺功能的重要指标,与肺部损伤严重程度密切相关,氧合指数在100~200时,MV持续时间可延长40%,VAP发生风险随之增加[34]。
临床预测模型是实用性较强的评估工具,应综合考虑模型的预测性能及其使用时的简洁便利。本研究基于逻辑回归构建了VAP风险预测列线图模型,其AUC > 0.900,预测临界值0.096对应的模型准确度、敏感度和特异度均 > 0.800,漏诊率和误诊率较低,Hosmer-Lemeshow检验显示模型拟合度良好。模型经内部验证后,其AUC仍 > 0.900,校准曲线和决策分析曲线提示模型具有良好的校准度和临床适用度,体现模型纳入9个预测因子所发挥的预测价值和较为稳定的预测性能,且以上结果均优于其他类似研究[5, 10, 14]。同时,该列线图将复杂方程可视化,计算操作便捷化,预测因子易获取,为医护人员早期识别VAP高危患者提供科学量化的评估工具,尤其当MV患者病情变化,模型预测因子改变时,可及时预测VAP发生风险,有助于提高医护人员预警意识和对VAP集束化预防措施的依从性,以此降低VAP发生风险。
本研究为单中心研究,资料收集方式为回顾性,且缺乏模型外部验证及临床应用,具有局限性。今后需对模型开展多中心、前瞻性的时段或空间外部验证,进一步评价可外推性,并将其初步应用于临床实践,检验模型临床预测效能,为个体化预测MV患者VAP发生风险提供依据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李嘉颖:研究设计、统计分析、论文撰写;李桂芳:研究设计、论文修改、基金支持;刘子青、王金聪、杨星雨、杨秋艳:数据收集与整理;边瑶、马荣、杨红晓:技术支持、工作支持
本文附表请登陆中华急诊网(www.cem.org.cn)浏览(Html格式全文)
| [1] | Goligher EC, Dres M, Fan E, et al. Mechanical ventilation-induced diaphragm atrophy strongly impacts clinical outcomes[J]. Am J Respir Crit Care Med, 2018, 197(2): 204-213. DOI:10.1164/rccm.201703-0536OC |
| [2] | Ding CY, Zhang YL, Yang ZR, et al. Incidence, temporal trend and factors associated with ventilator-associated pneumonia in mainland China: a systematic review and meta-analysis[J]. BMC Infect Dis, 2017, 17(1): 468. DOI:10.1186/s12879-017-2566-7 |
| [3] | Fernando SM, Tran A, Cheng W, et al. Diagnosis of ventilator-associated pneumonia in critically ill adult patients-a systematic review and meta-analysis[J]. Intensive Care Med, 2020, 46(6): 1170-1179. DOI:10.1007/s00134-020-06036-z |
| [4] | 谷鸿秋, 周支瑞, 章仲恒, 等. 临床预测模型: 基本概念、应用场景及研究思路[J]. 中国循证心血管医学杂志, 2018, 10(12) 1454-1456, 1462. DOI:10.3969/j.issn.1674-4055.2018.12.04 |
| [5] | Wang RR, Cai LR, Liu Y, et al. Machine learning algorithms for prediction of ventilator associated pneumonia in traumatic brain injury patients from the MIMIC-III database[J]. Heart Lung, 2023, 62: 225-232. DOI:10.1016/j.hrtlng.2023.08.002 |
| [6] | Xu Y, Lai CY, Xu GG, et al. Risk factors of ventilator-associated pneumonia in elderly patients receiving mechanical ventilation[J]. Clin Interv Aging, 2019, 14: 1027-1038. DOI:10.2147/CIA.S197146 |
| [7] | Wu ZS, Liu Y, Xu JY, et al. A ventilator-associated pneumonia prediction model in patients with acute respiratory distress syndrome[J]. Clin Infect Dis, 2020, 71(Suppl 4): S400-S408. DOI:10.1093/cid/ciaa1518 |
| [8] | 高永祥, 张晋昕. Logistic回归分析的样本量确定[J]. 循证医学, 2018, 18(2): 122-124. DOI:10.12019/j.issn.1671-5144.2018.02.015 |
| [9] | 中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 255-280. DOI:10.3760/cma.j.issn.1001-0939.2018.04.006 |
| [10] | Abujaber A, Fadlalla A, Gammoh D, et al. Machine learning model to predict ventilator associated pneumonia in patients with traumatic brain injury: the C.5 decision tree approach[J]. Brain Inj, 2021, 35(9): 1095-1102. DOI:10.1080/02699052.2021.1959060 |
| [11] | Ladbrook E, Khaw D, Bouchoucha S, et al. A systematic scoping review of the cost-impact of ventilator-associated pneumonia (VAP) intervention bundles in intensive care[J]. Am J Infect Control, 2021, 49(7): 928-936. DOI:10.1016/j.ajic.2020.11.027 |
| [12] | Chang YJ, Jeon K, Lee SM, et al. The distribution of multidrug-resistant microorganisms and treatment status of hospital-acquired pneumonia/ventilator-associated pneumonia in adult intensive care units: a prospective cohort observational study[J]. J Korean Med Sci, 2021, 36(41): e251. DOI:10.3346/jkms.2021.36.e251 |
| [13] | 陈亚男, 刘菁. 2014—2021年某院老年患者医院感染监测与综合干预效果报告[J]. 中华医院感染学杂志, 2023, 33(21): 3327-3331. DOI:10.11816/cn.ni.2023-238006 |
| [14] | Giang C, Calvert J, Rahmani K, et al. Predicting ventilator-associated pneumonia with machine learning[J]. Medicine, 2021, 100(23): e26246. DOI:10.1097/MD.0000000000026246 |
| [15] | Shi QC, Hu HD, Yu Q, et al. Chromosomal integration and plasmid fusion occurring in ST20 carbapenem-resistant Klebsiella pneumoniae isolates coharboring blaNDM-1 and blaIMP-4 induce resistance transmission and fitness variation[J]. Emerg Microbes Infect, 2024, 13(1): 2339942. DOI:10.1080/22221751.2024.2339942 |
| [16] | Diorio-Toth L, Wallace MA, Farnsworth CW, et al. Intensive care unit sinks are persistently colonized with multidrug resistant bacteria and mobilizable, resistance-conferring plasmids[J]. mSystems, 2023, 8(4): e0020623. DOI:10.1128/msystems.00206-23 |
| [17] | 冯玮, 王选锭. 重症感染抗菌治疗: 认知误区与改进策略[J]. 中华急诊医学杂志, 2024, 33(4): 455-459. DOI:10.3760/cma.j.issn.1671-0282.2024.04.001 |
| [18] | Deng WQ, Liu C, Cheng QH, et al. Predicting the risk of pulmonary infection in patients with chronic kidney failure: a-C2GH2S risk score-a retrospective study[J]. Int Urol Nephrol, 2024, 56(7): 2391-2402. DOI:10.1007/s11255-024-03953-6 |
| [19] | Webster AC, Nagler EV, Morton RL, et al. Chronic kidney disease[J]. Lancet, 2017, 389(10075): 1238-1252. DOI:10.1016/s0140-6736(16)32064-5 |
| [20] | Cobo G, Lindholm B, Stenvinkel P. Chronic inflammation in end-stage renal disease and dialysis[J]. Nephrol Dial Transplant, 2018, 33(suppl_3): iii35-iii40. DOI:10.1093/ndt/gfy175 |
| [21] | Wiedermann CJ. Hypoalbuminemia as surrogate and culprit of infections[J]. Int J Mol Sci, 2021, 22(9): 4496. DOI:10.3390/ijms22094496 |
| [22] | 王晶, 蒲建中, 段志学, 等. 糖尿病肾病合并肺部感染病原学与危险因素及与PTX3基因多态性的关联[J]. 中华医院感染学杂志, 2023, 33(8): 1192-1196. DOI:10.11816/cn.ni.2023-221321 |
| [23] | 周慧, 王红梅, 叶群, 等. 神经外科ICU病人呼吸机相关性肺炎风险预测模型的构建[J]. 护理研究, 2022, 36(23): 4174-4180. DOI:10.12102/j.issn.1009-6493.2022.23.007 |
| [24] | Robba C, Rebora P, Banzato E, et al. Incidence, risk factors, and effects on outcome of ventilator-associated pneumonia in patients with traumatic brain injury: analysis of a large, multicenter, prospective, observational longitudinal study[J]. Chest, 2020, 158(6): 2292-2303. DOI:10.1016/j.chest.2020.06.064 |
| [25] | Mrozek S, Gobin J, Constantin JM, et al. Crosstalk between brain, lung and heart in critical care[J]. Anaesth Crit Care Pain Med, 2020, 39(4): 519-530. DOI:10.1016/j.accpm.2020.06.016 |
| [26] | Liang YJ, Zhu CR, Tian C, et al. Early prediction of ventilator-associated pneumonia in critical care patients: a machine learning model[J]. BMC Pulm Med, 2022, 22(1): 250. DOI:10.1186/s12890-022-02031-w |
| [27] | 南玲, 刘运喜, 曹晋桂, 等. 呼吸机相关肺炎在多中心不同场所ICU的危险因素研究[J]. 中华医院感染学杂志, 2017, 27(13): 2893-2896. DOI:10.11816/cn.ni.2017-170703 |
| [28] | Chen XM, Ling XM, Liu GW, et al. Antimicrobial coating: tracheal tube application[J]. Int J Nanomedicine, 2022, 17: 1483-1494. DOI:10.2147/IJN.S353071 |
| [29] | 张磊, 陈国忠, 王华英, 等. 膈肌超声评估机械通气撤机中临床应用价值[J]. 中华急诊医学杂志, 2023, 32(2): 241-246. DOI:10.3760/cma.j.issn.1671-0282.2023.02.020 |
| [30] | Angotti LB, Richards JB, Fisher DF, et al. Duration of mechanical ventilation in the emergency department[J]. West J Emerg Med, 2017, 18(5): 972-979. DOI:10.5811/westjem.2017.5.34099 |
| [31] | Decelle L, Thys F, Zech F, et al. Ventilation-associated pneumonia after intubation in the prehospital or the emergency unit[J]. Eur J Emerg Med, 2013, 20(1): 61-63. DOI:10.1097/MEJ.0b013e3283501677 |
| [32] | 侍冬成, 李永霞, 姜家梅, 等. 引起急诊重症监护室内接受有创机械通气患者气管切开的因素分析[J]. 中华急诊医学杂志, 2023, 32(3): 360-364. DOI:10.3760/cma.j.issn.1671-0282.2023.03.014 |
| [33] | Driver BE, Klein LR, Schick AL, et al. The occurrence of aspiration pneumonia after emergency endotracheal intubation[J]. Am J Emerg Med, 2018, 36(2): 193-196. DOI:10.1016/j.ajem.2017.07.066 |
| [34] | Whiting J, Edriss H, Yang SP, et al. Peak pressures and PaO2/FiO2 ratios are associated with adverse outcomes in patients on mechanical ventilators[J]. Am J Med Sci, 2016, 351(6): 638-641. DOI:10.1016/j.amjms.2016.01.028 |
 2025, Vol. 34
2025, Vol. 34




