2. 宁海县第一医院重症医学科,宁海 315699
2. Department of Critical Care Medicine, The First Hospital of Ninghai County, Ninghai 315699, Zhejiang, China
随着老龄化问题的日益加重,有研究预测从2020年至2025年,全球65岁以上的人口比例将从9.3%上升至16%[1]。相应地,ICU内的老年患者比例也在上升。营养治疗作为ICU治疗的基石,ICU老年患者的营养治疗更具有挑战性[2]。一方面,随着年龄增长,人体脂肪组织增加,瘦体重减少,使得ICU老年患者在病程早期,可能需要更高的蛋白补充量以达到正氮平衡[3-4]。另一方面,由于肾功能下降等因素,高蛋白补充可能使得老年患者出现氮质血症的风险增高[5],其对老年患者临床预后的影响不明。目前对于ICU老年患者的营养实施缺乏指南推荐意见[6],主要原因在于此领域内研究证据偏少[7]。因此,本研究旨在探究早期蛋白供给量对ICU老年患者临床预后的影响。
1 资料与方法 1.1 研究设计与研究人群选择本研究是一项多中心、整群随机对照试验(NEED研究,研究注册号为:ISRCTN12233792)的事后分析。NEED研究旨在评估喂养流程对ICU患者营养实施和预后的影响[8]。最终纳入并随机化全国范围内97个ICU(2 772例患者),其中喂养流程组48个ICU(1 399例患者),对照组49个ICU(1 373例患者)。各参与中心的机构伦理委员会批准了该项目的研究方案(组长单位:东部战区总医院,伦理编号:22017NZKY-019-02),入组前获得了所有患者或其近亲属的知情同意。本事后分析计划纳入NEED研究中年龄≥70岁的高龄患者,入组后第3天仍未开始营养治疗、住ICU时长不足7 d以及主要结局指标缺失的患者被排除。
1.2 营养供给及患者分组根据各中心的临床实践,营养方式主要分为肠内营养(enteral nutrition,EN)、肠外营养(parenteral nutrition,PN)以及EN联合PN三种。EN实施途径主要分为鼻胃喂养、鼻-幽门后喂养以及空肠造口等[9]。一般而言,热卡目标为25~30 kcal/[kg(实际体重)·d],蛋白目标为1.2 g/[kg(实际体重)·d]。肠内营养、肠外营养以及含葡萄糖的静脉液体均算入总热卡量,由于NEED研究未记录丙泊酚等脂肪乳注射剂的使用情况,因此不算入总热卡量。总蛋白量主要来自肠内营养及肠外营养。平均热卡量是计算入组后第3~7天内的平均量,以kcal/d、kcal/(kg·d)两种方式展示;同样,平均蛋白量是计算入组后第3~7天内的平均量,以g/d、g/(kg·d)两种方式展示。热卡/蛋白达标率(%)是指实际热卡/蛋白量与热卡/蛋白目标量之间的比值。
根据早期蛋白供给量的三分位数,符合条件的患者被分为Q1~Q3三组:Q1[ < 0.6 g/(kg·d)],Q2[0.6~0.83 g/(kg·d)],Q3g/(kg·d)]≥0.83 g/(kg·d)]。
1.3 数据收集与主要指标本事后分析的所有数据均来自NEED研究电子数据库。主要收集基线特征、营养治疗情况、实验室检查、器官功能支持情况以及临床预后等指标。基线特征包括年龄、性别、身体质量指数(body mass index,BMI)、治疗组别(NEED研究流程组vs.对照组)、急性生理学及慢性健康状况评分(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)、序贯性脏器衰竭评分(sequential organ failure assessment,SOFA)、改良危重症营养风险评分(modified nutrition risk in the critically ill,mNUTRIC)、急性胃肠损伤(acute gastrointestinal injury,AGI)、入ICU类型、入ICU主要诊断、并存症情况等。营养治疗情况包括开始营养治疗时间、营养方式、营养途径、营养目标量、实际营养量、营养达标率、营养耐受情况等。喂养不耐受以出现以下三种症状的任一即可诊断:腹痛/腹胀、恶心/呕吐、腹泻。器官功能支持情况包括有创呼吸支持、无创呼吸支持、连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)以及血管活性药物的使用。
本研究的主要结局指标是入组后28 d内病死率;次要结局指标是28 d内无ICU天数,其定义为入组后28 d内存活且转出ICU的天数,28 d内死亡的患者赋值为0。
1.4 统计学方法连续变量以均值±标准差(x±s)或中位数(四分位数)[M(P25, P75)]表示,具体取决于数据的正态性,正态性通过Shapiro-Wilk检验进行评估。分类变量则以数字和百分比(%)表示。组间差异通过单因素方差分析或Kruskal-Wallis检验(针对连续变量)和χ2检验(针对分类变量)计算得出。使用对数秩检验(log-rank test)来比较28 d病死率的Kaplan-Meier生存曲线。通过Cox比例风险模型(Cox proportional hazards model)检测不同蛋白分组对患者28 d病死率的影响。本研究对包括年龄、性别(男性)、APACHE Ⅱ评分、SOFA评分、mNUTRIC评分、入ICU类型、CRP水平、白蛋白水平、淋巴细胞百分比、开始营养治疗时间、营养方式、营养途径、平均每日热卡摄入量和研究干预措施(流程组与对照组)在内的变量进行了单变量Cox分析。将具有临床意义的变量或P值< 0.1的变量纳入多变量模型。通过方差膨胀因子(variance inflation factor)检查潜在混杂变量之间的多重共线性。采用Schoenfeld残差法判断各个自变量的等比例风险(proportional hazards,PH)情况。同时计划根据患者入组时mNUTRIC评分将患者分为高营养风险组(mNUTRIC≥5分)和低营养风险组(mNUTRIC < 5分),是否合并急性肾功能损伤分为AKI组和非AKI组,探究不同亚组中早期蛋白供给量对患者28 d病死率的影响。双侧P值< 0.05被认为具有统计学意义。以上所有分析使用SPSS 25.0软件完成,入组后第3~7天每日热卡和蛋白平均量的小提琴图(Violin Plot)通过GraphPad Prism 8.0软件绘制。
2 结果 2.1 入组患者特征最终共789名患者纳入分析(图 1)。研究总人群中,大部分患者为男性(66.2%),年龄中位数(IQR)为79.0 (74.0, 84.0)。根据mNUTRIC评分,有75.6%的患者被认为存在高营养风险。近一半的患者来自急诊转入,入患者的主要诊断为呼吸衰竭和循环衰竭。在临床结局方面,28 d内病死率为19.6%,28 d内无ICU天数中位数为0 (0, 16),这意味着超过一半的患者未能在入组后28 d内存活并转出ICU。更多基线特征数据见表 1。
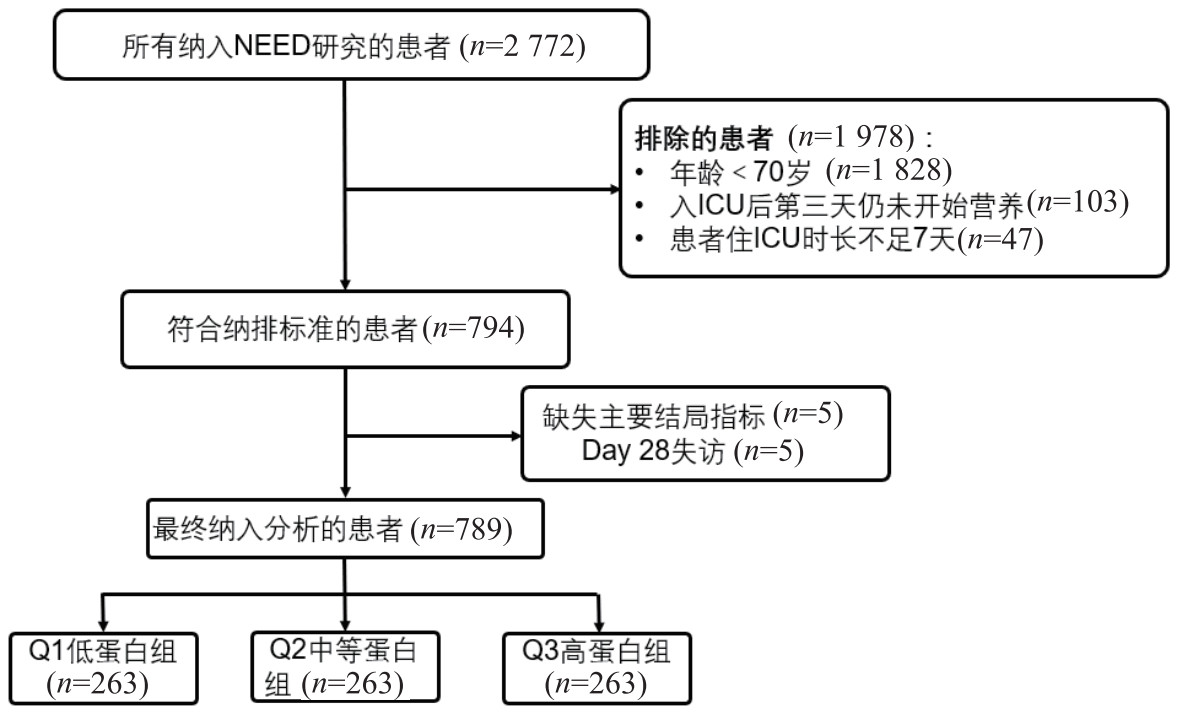
|
| 图 1 研究流程图 Fig 1 Study flowchart |
|
|
| 变量 | 总体(n=789) | Q1 (n=263) | Q2 (n=263) | Q3 (n=263) | P值 |
| 年龄a | 79.0 (74.0, 84.0) | 78.0 (73.0, 85.0) | 79.0 (74.0, 85.0) | 79.0 (74.0, 84.0) | 0.652 |
| 性别[男, (n, %)] | 522 (66.2) | 186 (70.7) | 174 (66.2) | 162 (61.6) | 0.087 |
| BMI(kg/m2)a | 22.09 (20.04, 24.22) | 23.18 (21.34, 25.18) | 22.04 (20.20, 24.22) | 21.22 (19.03, 22.99) | < 0.001 |
| 治疗组别 | 0.018 | ||||
| 流程组(n, %) | 407 (51.6) | 146 (55.5) | 144 (54.8) | 117 (44.5) | |
| 对照组(n, %) | 382 (48.4) | 117 (44.5) | 119 (45.2) | 146 (55.5) | |
| APACHEⅡ评分a | 21.0 (16.0, 26.0) | 21.0 (17.0, 26.0) | 20.0 (16.0, 25.0) | 21.0 (16.0, 26.0) | 0.779 |
| SOFA评分a | 7.0 (5.0, 10.0) | 8.0 (6.0, 10.0) | 7.0 (5.0, 10.0) | 7.0 (5.0, 10.0) | 0.132 |
| mNUTRIC评分 | 6 (5, 7) | 6 (5, 7) | 6 (4, 7) | 6 (4, 7) | 0.232 |
| 高营养风险b(n, %) | 596 (75.6) | 211 (80.2) | 188 (71.8) | 197 (74.9) | 0.063 |
| 合并AKI(n, %) | 139 (17.6) | 43 (16.3) | 51 (19.4) | 45 (17.1) | 0.635 |
| AGI分级 | 0.019 | ||||
| AGI Ⅰ级 | 612 (77.6) | 188 (71.5) | 209 (79.5) | 215 (81.7) | |
| AGI Ⅱ级 | 138 (17.5) | 60 (22.8) | 39 (14.8) | 39 (14.8) | |
| AGI Ⅲ级 | 28 (3.5) | 8 (3.0) | 13 (4.9) | 7 (2.7) | |
| AGI Ⅳ级 | 11 (1.4) | 7 (2.7) | 2 (0.8) | 2 (0.8) | |
| 入ICU类型(n, %) | 0.501 | ||||
| 内科转入 | 211 (26.7) | 76 (28.9) | 69 (26.2) | 66 (25.1) | |
| 外科转入 | 162 (20.5) | 53 (20.2) | 44 (16.7) | 65 (24.7) | |
| 急诊收入 | 354 (44.9) | 114 (43.3) | 127 (48.3) | 113 (43.0) | |
| 外院转入 | 52 (6.6) | 17 (6.5) | 18 (6.8) | 17 (6.5) | |
| 其他 | 10 (1.3) | 3 (1.1) | 5 (1.9) | 2 (0.8) | |
| 入ICU诊断(n, %) | 0.215 | ||||
| 呼吸衰竭 | 368 (46.6) | 110 (41.8) | 121 (46.0) | 137 (52.1) | |
| 循环衰竭 | 267 (33.8) | 105 (39.9) | 88 (33.5) | 74 (28.1) | |
| 中枢功能障碍或衰竭 | 83 (10.5) | 26 (9.9) | 29 (11.0) | 28 (10.6) | |
| 术后监护 | 13 (1.6) | 3 (1.1) | 4 (1.5) | 6 (2.3) | |
| 内环境紊乱 | 16 (2.0) | 6 (2.3) | 3 (1.1) | 7 (2.7) | |
| 其他 | 42 (5.3) | 13 (4.9) | 18 (6.8) | 11 (4.2) | |
| 并存症情况(n, %) | |||||
| 高血压 | 489 (62.0) | 168 (63.9) | 165 (62.7) | 156 (59.3) | 0.533 |
| 糖尿病 | 232 (29.4) | 84 (31.9) | 77 (29.3) | 71 (27.0) | 0.461 |
| 冠心病 | 271 (34.3) | 106 (40.3) | 90 (34.2) | 75 (28.5) | 0.017 |
| 脑卒中 | 212 (26.9) | 73 (27.8) | 70 (26.6) | 69 (26.2) | 0.920 |
| COPD | 146 (18.5) | 45 (17.1) | 56 (21.3) | 45 (17.1) | 0.362 |
| 器官功能支持情况(n, %) | |||||
| 有创呼吸支持 | 498 (63.1) | 166 (63.1) | 166 (63.1) | 166 (63.1) | 1.00 |
| 无创呼吸支持 | 57 (7.2) | 21 (8.0) | 17 (6.5) | 19 (7.2) | 0.797 |
| CRRT | 91 (11.5) | 38 (14.4) | 30 (11.4) | 23 (8.7) | 0.123 |
| 血管活性药物 | 280 (35.5) | 99 (37.6) | 91 (34.6) | 90 (34.2) | 0.668 |
| 实验室检查指标a | |||||
| 血红蛋白(g/L) | 106 (88, 126) | 108 (86.3, 128) | 106 (88, 126) | 106 (88, 125) | 0.834 |
| 淋巴细胞百分比(%) | 7.2 (4.0, 12.55) | 6.7 (4.0, 12.4) | 7.6 (4.4, 13.2) | 7.4 (3.8, 12.3) | 0.479 |
| C反应蛋白(mg/L) | 56.0 (18.47, 119.5) | 57.2 (17.0, 116) | 42.7 (13.6, 112) | 65.0 (23.0, 132) | 0.046 |
| 白蛋白(g/L) | 30.67 (27.0, 34.9) | 30.8 (27.0, 35.0) | 31.1 (27.2, 35.2) | 30.1 (26.9, 33.9) | 0.168 |
| 临床结局指标 | |||||
| 28 d病死率(n, %) | 155 (19.6) | 54 (20.5) | 41 (15.6) | 60 (22.8) | 0.103 |
| 28 d内无ICU天数(d) | 0 (0, 16) | 0 (0, 16) | 0 (0, 18) | 0 (0, 15) | 0.189 |
| 注:a为M(P25, P75), b为mNUTRIC ≥5的高营养风险的患者 | |||||
在总体人群中,大部分患者在入ICU后48 h内开始营养治疗(87.2%),启动营养的中位数时间为1.0(1.0, 2.0)d。首选的营养方式为EN,其次为EN联合PN,首选的营养途径为鼻胃管喂养。在营养给予量方面,Q1、Q2、Q3分组之间差异有统计学意义(P值均 < 0.001)。入ICU后Day 3~7的平均每日热卡量和蛋白量见图 2。在营养耐受情况方面,最常见的不耐受症状为腹痛/腹胀,其次为腹泻、恶心/呕吐等,Q1、Q2、Q3三组之间在喂养不耐受发生率方面差异无统计学意义。更多营养治疗数据见表 2。
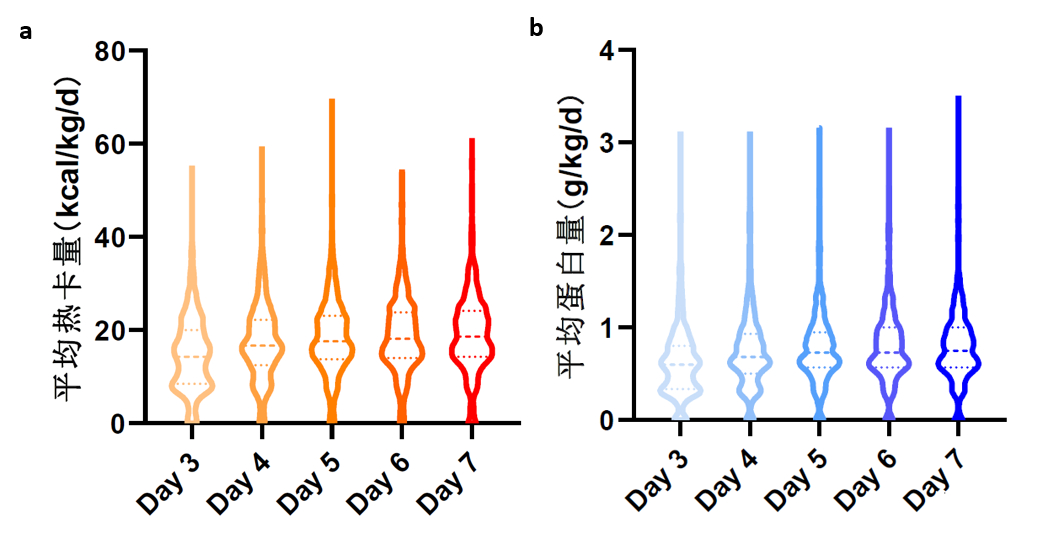
|
| 图 2 入ICU后Day3-7的平均每日热卡量和蛋白量 Fig 2 Daily caloric and protein intake in ICU after 3 to 7 days |
|
|
| 变量 | 总体(n=789) | Q1(n=263) | Q2(n=263) | Q3 (n=263) | P值 |
| 开始营养治疗时间a | 1.0 (1.0, 2.0) | 1.0 (1.0, 2.0) | 1.0 (1.0, 2.0) | 1.0 (1.0, 2.0) | < 0.001 |
| 48 h内进行营养治疗(n, %) | 688 (87.2) | 205 (77.9) | 239 (90.9) | 244 (92.8) | < 0.001 |
| 营养方式 | < 0.001 | ||||
| EN | 547 (69.9) | 198 (76.2) | 202 (77.1) | 147 (56.3) | |
| PN | 94 (12.0) | 36 (13.8) | 27 (10.3) | 31 (11.9) | |
| EN+PN | 142 (18.1) | 26 (10.0) | 33 (12.6) | 83 (31.8) | |
| 营养途径 | 0.017 | ||||
| 鼻胃喂养 | 658 (83.4) | 216 (82.1) | 222 (84.4) | 220 (83.6) | |
| 鼻-幽门后喂养 | 27 (3.4) | 6 (2.3) | 6 (2.3) | 15 (5.7) | |
| 空肠造口 | 8 (1.0) | 1 (0.4) | 6 (2.3) | 1 (0.4) | |
| 其他 | 96 (12.2) | 40 (15.2) | 29 (11.0) | 27 (10.3) | |
| 营养目标a | |||||
| 平均热卡目标(kcal/d) | 1550 (1375, 1750) | 1700 (1500, 1750) | 1500 (1375, 1750) | 1500 (1250, 1625) | < 0.001 |
| 平均蛋白目标(g/d) | 74.4 (66.0, 84.0) | 81.6 (72.0, 84.0) | 72.0 (66.0, 84.0) | 72.0 (60.0, 78.0) | < 0.001 |
| 营养量a | |||||
| 平均热卡量(kcal/d) | 1000 (820, 1316.5) | 800 (620, 940) | 1016.3 (940, 1200) | 1410 (1100, 1612) | < 0.001 |
| 平均蛋白量(g/d) | 41.0 (33.6, 56.0) | 28.8 (24.0, 36.0) | 42 (40, 48) | 60 (53.25, 72) | < 0.001 |
| 平均热卡量[kcal/(kg·d)] | 16.83 (12.94, 21.98) | 12.0 (9.71, 14.03) | 17.3 (15.63, 19.94) | 24.0 (20.66, 28.0) | < 0.001 |
| 平均蛋白量[g/(kg·d)] | 0.69 (0.53, 0.91) | 0.46 (0.36, 0.53) | 0.69 (0.63, 0.76) | 1.03 (0.91, 1.23) | < 0.001 |
| 平均热卡达标率(%) | 67.33 (51.76, 87.90) | 48.0 (38.83, 56.11) | 69.2 (62.5, 79.75) | 96.0 (82.63, 112.0) | < 0.001 |
| 平均蛋白达标率(%) | 57.78 (44.09, 75.54) | 38.1 (29.76, 44.12) | 57.78 (52.79, 63.33) | 86.11 (75.52, 102.38) | < 0.001 |
| 营养耐受情况(n, %) | |||||
| 使用胃肠动力药物 | 157 (19.9) | 41 (15.6) | 59 (22.4) | 57 (21.7) | 0.098 |
| 腹痛/腹胀 | 208 (26.4) | 69 (26.2) | 79 (30.0) | 60 (22.8) | 0.170 |
| 恶心/呕吐 | 54 (6.8) | 18 (6.8) | 19 (7.2) | 17 (6.5) | 0.942 |
| 腹泻 | 167 (21.2) | 58 (22.1) | 57 (21.7) | 52 (19.8) | 0.790 |
| 注:a为M(P25, P75);EN:肠内营养(enteral nutrition);PN:肠外营养(parenteral nutrition) | |||||
为了探究Q1、Q2、Q3不同蛋白分组与患者28天病死率之间的关联,笔者绘制了Kaplan-Meier生存曲线(图 3),结果显示Q2中等蛋白的患者28 d内病死率最低(Q2中等蛋白vs. Q3高蛋白两组比较P=0.042)。表 3展示总体人群、亚组一--高营养风险人群和亚组二--基线合并AKI人群中,不同营养分组与28 d病死率之间的关联。在总体人群中,相比于Q3高蛋白组,Q2中等蛋白组与更低的28 d病死率相关[风险比(hazard ratio, HR)=0.667,95% CI,0.448~0.992,P=0.045]。在多因素Cox回归分析中,对包括年龄、性别、APACHE Ⅱ评分、SOFA评分、mNUTRIC评分、入ICU类型、CRP水平、白蛋白水平、淋巴细胞百分比、开始营养治疗时间、营养方式、营养途径、平均每日热卡摄入量和研究干预措施(流程组/对照组)在内的可能的混杂因素进行了调整后,Q2中等蛋白组与更低的28 d病死率之间的相关性仍然成立(HR=0.595,95% CI: 0.363~0.976,P=0.040)。
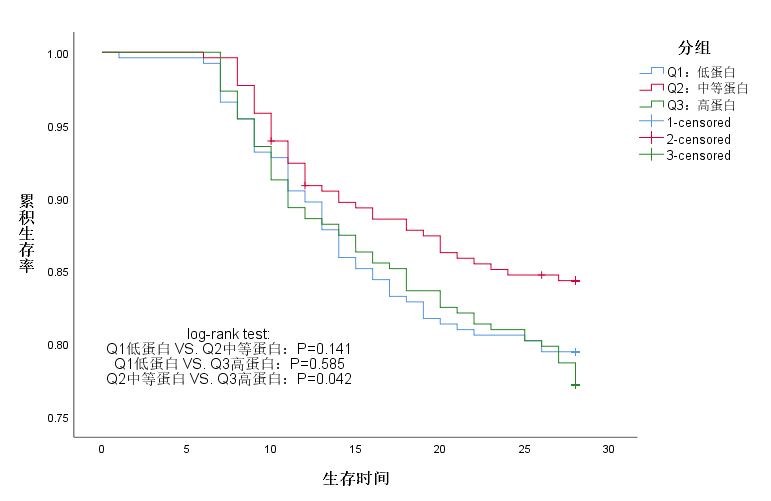
|
| 图 3 Kaplan-Meier生存曲线 Fig 3 Kaplan–Meier survival curves |
|
|
| 指标 | 未调整模型 | 调整后模型a | |||
| HR (95% CI) | P值 | HR (95% CI) | P值 | ||
| 28 d病死率 | |||||
| 所有患者(n=789) | |||||
| Q3 | reference | ||||
| Q1 | 0.903 (0.625~1.305) | 0.588 | 0.528 (0.284~0.979) | 0.043 | |
| Q2 | 0.667 (0.448~0.992) | 0.045 | 0.595 (0.363~0.976) | 0.040 | |
| 高营养风险患者b(n=596) | |||||
| Q3 | reference | ||||
| Q1 | 0.921 (0.618~1.371) | 0.684 | 0.515 (0.258~1.030) | 0.06 | |
| Q2 | 0.623 (0.396~0.982) | 0.041 | 0.534 (0.303~0.940) | 0.03 | |
| 合并AKI患者(n=139) | |||||
| Q3 | reference | ||||
| Q1 | 0.944 (0.401~2.223) | 0.895 | 0.817 (0.161~4.138) | 0.807 | |
| Q2 | 0.822 (0.349~1.935) | 0.653 | 0.480 (0.117~1.957) | 0.306 | |
| 注:aCox多因素回归分析对包括年龄、性别、APACHE Ⅱ评分、SOFA评分、mNUTRIC评分、入ICU类型、CRP水平、白蛋白水平、淋巴细胞百分比、开始营养治疗时间、营养方式、营养途径、平均每日热卡摄入量和研究干预措施(流程组/对照组)在内的变量进行了调整; b指mNUTRIC ≥5的高营养风险的患者 | |||||
在亚组分析-存在高营养风险的人群中,相比于高蛋白,中等蛋白组与更低的28 d病死率显著相关(未调整分析HR=0.623,95% CI,0.396~0.982,P=0.041;调整后分析HR=0.534,95% CI,0.303~0.940,P=0.030)。在合并AKI的亚组中,未观察到不同蛋白分组与患者28 d病死率之间的关联。
3 讨论本项RCT研究的纳入了789名高龄(≥70岁)患者,患者入ICU后第3~7天内的平均蛋白量为0.69 (0.53, 0.91) g/(kg·d)。研究结果显示,相比于高蛋白组,中等蛋白组与更低的28 d病死率相关,通过Cox多因素回归分析对可能的混杂因素进行控制后,中等蛋白组与更低的28 d病死率之间的相关性仍然成立。在高营养风险亚组中(mNUTRIC≥5分),中等蛋白组与更低的28 d病死率之间显著相关。
目前指南对于重症患者蛋白供给推荐意见的研究证据主要来自于观察性数据以及一些小的RCT研究结果。ASPEN指南对重症患者的蛋白推荐量在1.2~2.0 g/(kg·d)[10],ESPEN指南的推荐量则为1.3 g/(kg·d)[11]。对于急性期早期(入ICU后1~3 d),现有的研究结果显示蛋白的补充应遵循渐进式喂养的原则,这一阶段过量的蛋白供给会增加患者不良预后的发生率[12-13]。一项探讨蛋白供给剂量和时机的回顾性研究(PROTINVENT)显示,根据入ICU后1周内接受的蛋白供给剂量将患者分为3组,持续低蛋白组[ < 0.8 g/(kg·d)],持续高蛋白组[ > 0.8 g/(kg·d)]和渐进式蛋白供给组[第1~3天 < 0.8 g/(kg·d)],第4~7天 > 0.8 g/(kg·d)。生存分析结果显示相比于持续高蛋白供给,渐进式蛋白供给策略显著降低60 d病死率[13]。这与本研究结论不谋而合,入ICU后1周内的急性期病程中,相比于高蛋白供给,中等量的蛋白供给与28 d病死率显著相关。
对于这一研究结果,可以从生理学角度提供可能的解释。首先,患者病程早期,其大部分营养需求是由内源性能量提供的,且这一过程无法被外源性营养供给所抑制。当按照患者的需求进行营养供给时,其实已经造成了相对的喂养过量(overfeeding)[14]。其次,有研究指出自噬可能在重症患者病程早期发挥着重要作用[15]。早期过度喂养将抑制患者体内自噬过程的激活,从而抑制细胞内受损蛋白质和细胞器的分解,进而延迟患者从器官功能障碍中恢复。此外,重症急性期,创伤应激造成组织缺氧和线粒体功能障碍,蛋白质转录下调,重症患者会出现蛋白稳态效应。此时,给予大量的外源性蛋白质非但不会用于肝脏或骨骼肌蛋白质的生成,其分解的含氮产物反而会造成负面影响[16]。
现有的研究证据也不支撑高于指南推荐剂量的更高的蛋白质供给策略。两项全球多中心的RCT研究关注高蛋白对重症患者临床预后的影响。EFFORT-Protein研究在机械通气患者中对比入ICU 96 h内接受高蛋白供给[≥2.2 g/(kg·d)]和常规蛋白供给[≤1.2 g/(kg·d)],治疗周期最长为28 d。最终有645名患者纳入高蛋白组[实际供给(1.6±0.5) g/(kg·d)],656名患者纳入常规蛋白组[实际供给(0.9±0.3) g/(kg·d)]。结果显示两组在主要结局指标60 d内存活且出院的时间及60 d病死率等方面差异无统计学意义,但在基线有AKI和SOFA评分≥9分更危重的患者中,高蛋白供给对患者结局不利[17]。另一项PRECISe研究中,患者接受等热量肠内喂养,包括1.3 kcal/mL和0.06 g/mL蛋白(即标准蛋白)或1.3 kcal/mL和0.10 g/mL蛋白(即高蛋白)。研究营养干预仅限于患者在ICU住院期间需要肠内喂养的时间段,最长为90 d。主要指标是随机分组后30 d、90 d和180 d的生活质量评分(EQ-5D-5L)。结果显示,与标准蛋白供应相比,高蛋白供应导致重症患者的健康相关生活质量下降,且高蛋白组的总体病死率的风险比增加1.24(HR=1.24,95% CI: 0.99~1.55, P=0.063)[18]。
本研究主要存在以下一些局限性:首先,对于重症患者营养需求的确定,考虑本项目多中心之间临床实实践以及硬件设施之间的差别,本项目选用公式法来确定营养目标,而不是各项营养指南中推荐的间接测热法;其次,没有考虑丙泊酚、环泊酚等含脂质乳剂药物所贡献的热卡,这可能导致患者实际记录的热卡量并不准确;然后,本研究中各组的蛋白量要低于其他文献所报道的蛋白量,这可能限制了研究结果的外推性;最后,本研究作为一项事后分析,其得出的结论需谨慎看待,不能作为因果关系的参考。
利益冲突 所有作者声明无利益冲突
作者贡献声明 汪正权、魏维、张骏:实验操作、论文撰写;高金丹、黄晶晶、陆雯、何瑞钦、袁蓉蓉、俞锦霞、王迅、蔡荣、易清:数据收集及整理、统计学分析;李子龙、陈国锋、王才木:研究设计、论文修改
| [1] | United Nations Department of Economic and Social Affairs, Population Division. World Population Ageing 2020 Highlights: Living Arrangements of Older Persons, 2020. |
| [2] | Zhou HJ, Zuo DJ, Zhang D, et al. Nutritional status and prognostic factors for mortality in patients admitted to emergency department observation units: a national multi-center study in China[J]. World J Emerg Med, 2023, 14(1): 17-24. DOI:10.5847/wjem.j.1920-8642.2023.005 |
| [3] | St-Onge MP, Gallagher D. Body composition changes with aging: the cause or the result of alterations in metabolic rate and macronutrient oxidation?[J]. Nutrition, 2010, 26(2): 152-155. DOI:10.1016/j.nut.2009.07.004 |
| [4] | Li Y, Xie YP, Li XM, et al. Effects of early standardized enteral nutrition on preventing acute muscle loss in the acute exacerbation of chronic obstructive pulmonary disease patients with mechanical ventilation[J]. World J Emerg Med, 2023, 14(3): 193-197. DOI:10.5847/wjem.j.1920-8642.2023.046 |
| [5] | Frankenfield D, Cooney RN, Smith JS, et al. Age-related differences in the metabolic response to injury[J]. J Trauma, 2000, 48(1) 49-56;discussion 56-57. DOI:10.1097/00005373-200001000-00009 |
| [6] | 中国急诊危重症患者肠内营养治疗专家共识专家组. 中国急诊危重症患者肠内营养治疗专家共识[J]. 中华急诊医学杂志, 2022, 31(3): 281-290. DOI:10.3760/cma.j.issn.1671-0282.2022.03.004 |
| [7] | Lee ZY, Loh CTI, Lew CCH, et al. Nutrition therapy in the older critically ill patients: a scoping review[J]. Ann Acad Med Singap, 2022, 51(10): 629-636. DOI:10.47102/annals-acadmedsg.2022160 |
| [8] | Ke L, Lin JJ, Doig GS, et al. Actively implementing an evidence-based feeding guideline for critically ill patients (NEED): a multicenter, cluster-randomized, controlled trial[J]. Crit Care, 2022, 26(1): 46. DOI:10.1186/s13054-022-03921-5 |
| [9] | 国家急诊医学专业医疗质量控制中心, 北京市急诊质量控制和改进中心, 中华护理学会急诊护理专业委员会. 急危重症患者鼻空肠营养管管理专家共识[J]. 中华急诊医学杂志, 2024, 33(6): 761-766. DOI:10.3760/cma.j.issn.1671-0282.2024.06.005 |
| [10] | Compher C, Bingham AL, McCall M, et al. Guidelines for the provision of nutrition support therapy in the adult critically ill patient: the American society for parenteral and enteral nutrition[J]. JPEN J Parenter Enteral Nutr, 2022, 46(1): 12-41. DOI:10.1002/jpen.2267 |
| [11] | Singer P, Blaser AR, Berger MM, et al. ESPEN practical and partially revised guideline: clinical nutrition in the intensive care unit[J]. Clin Nutr, 2023, 42(9): 1671-1689. DOI:10.1016/j.clnu.2023.07.011 |
| [12] | de Koning MLY, Koekkoek WACK, Kars JCNH, et al. Association of PROtein and CAloric intake and clinical outcomes in adult SEPTic and non-septic ICU patients on prolonged mechanical ventilation: the PROCASEPT retrospective study[J]. JPEN J Parenter Enteral Nutr, 2020, 44(3): 434-443. DOI:10.1002/jpen.1663 |
| [13] | Koekkoek WACK, Coralien van Setten CHC, Olthof LE, et al. Timing of PROTein INtake and clinical outcomes of adult critically ill patients on prolonged mechanical VENTilation: the PROTINVENT retrospective study[J]. Clin Nutr, 2019, 38(2): 883-890. DOI:10.1016/j.clnu.2018.02.012 |
| [14] | Reintam Blaser A, Rooyackers O, Bear DE. How to avoid harm with feeding critically ill patients: a synthesis of viewpoints of a basic scientist, dietitian and intensivist[J]. Crit Care, 2023, 27(1): 258. DOI:10.1186/s13054-023-04543-1 |
| [15] | Hermans G, Casaer MP, Clerckx B, et al. Effect of tolerating macronutrient deficit on the development of intensive-care unit acquired weakness: a subanalysis of the EPaNIC trial[J]. Lancet Respir Med, 2013, 1(8): 621-629. DOI:10.1016/S2213-2600(13)70183-8 |
| [16] | Andréasson C, Ott M, Büttner S. Mitochondria orchestrate proteostatic and metabolic stress responses[J]. EMBO Rep, 2019, 20(10): e47865. DOI:10.15252/embr.201947865 |
| [17] | Heyland DK, Patel J, Compher C, et al. The effect of higher protein dosing in critically ill patients with high nutritional risk (EFFORT protein): an international, multicentre, pragmatic, registry-based randomised trial[J]. Lancet, 2023, 401(10376): 568-576. DOI:10.1016/S0140-6736(22)02469-2 |
| [18] | Bels JLM, Thiessen S, van Gassel RJJ, et al. Effect of high versus standard protein provision on functional recovery in people with critical illness (PRECISe): an investigator-initiated, double-blinded, multicentre, parallel-group, randomised controlled trial in Belgium and the Netherlands[J]. Lancet, 2024, 404(10453): 659-669. DOI:10.1016/S0140-6736(24)01304-7 |
 2024, Vol. 33
2024, Vol. 33




