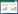急性缺血性脑卒中(acute ischemic stroke, AIS)是世界范围内致死率第二和致残率第一的疾病,是中国成年人致死致残的最主要原因,且发病率逐年上升[1]。“时间就是大脑”,AIS治疗的关键是迅速开通闭塞血管,恢复血供,挽救缺血半暗带和防止梗死核心的进展。多项研究表明现代AIS治疗从纯粹基于时间的治疗决策转变为主要基于灌注缺损组织的放射学结果的个体化决策[2]。目前,AIS的早期诊断依赖于影像技术,而影像学评价中最重要的内容包括梗死核心的判断,对梗死核心的准确识别是指导临床治疗决策、提高预后和生存质量的关键。
颅脑CT灌注成像(CT perfusion, CTP)因使用自动化软件而受益,是目前临床评估梗死核心和半暗带的主要方法。但其检查时间长、曝光次数多、运动敏感性强及额外辐射剂量大,并且缺乏标准化后处理协议和基于CT灌注的核心测量经常高估和低估梗死体积,使其在AIS评估中的适用性及准确性一直受到质疑[3]。
双层探测器光谱CT采用“同源、同时、同向”的能量分离扫描方式,具有辐射剂量低,时间及空间分辨力高,无扫描视野限制,回顾性按需光谱分析和不需要特殊协议的预扫描设置的优势[4-5]。因此,在AIS的诊断过程中,双层探测器光谱CTA有可能提供一种克服CT灌注重要限制和减少患者辐射暴露的综合方法[6]。既往研究发现在AIS患者灌注评估中,双层探测器光谱CTA参数与CTP部分参数间具有一定的相关性,并且具有区分灌注缺损区和正常脑组织的能力[7-9]。但其在评估梗死核心方面的研究至今未见报道,并且有研究指出能否区分梗死核心和缺血半暗带是其能否取代CTP的关键。因此本研究回顾性收集本院的AIS患者的影像学和临床资料,基于双层探测器光谱CT参数探讨AIS患者梗死核心的影响因素和预测效能,旨在为早期预防和治疗提供临床参考依据。
1 资料与方法 1.1 研究对象回顾性分析2022年3月至2023年5月在苏州大学附属第二医院诊治的163例急性缺血性脑卒中患者的影像学及临床资料。将2022年3月至2022年12月的患者作为训练集,2023年1月至2023年5的患者作为验证集。所有患者均接受双层探测器光谱CTA及CT灌注成像检查,按照CTP图上脑组织低灌注区是否出现梗死核心将训练集和验证集的患者都分为梗死核心组与无梗死核心组。训练集与验证集的纳入和排除标准相同。纳入标准:(1)所有纳入的患者均符合《中国急性缺血性脑卒中诊治指南2018》的诊断标准,并接受双层光谱探测器CTA及CTP扫描;(2)年龄≥18岁;(3)发病时间为 < 12 h;(4)影像学及临床等相关资料保存完整。排除标准:(1)脑卒中后遗症期和出血性脑卒中;(2)脑肿瘤、既往有重大头颅外伤、颅内手术史;(3)自身免疫性疾病、血液系统疾病、严重器官衰竭或其他危及生命的疾病。本研究由苏州大学附属第二医院伦理委员会审核批准(JD-HG-2022-69),所有患者均有签署知情同意书。
1.2 仪器与方法采用荷兰Philips公司IQon Spectral CT机对患者进行头颈部CTA及颅脑CTP成像。图 1展示了一名72岁女性患者入院后典型急性缺血性脑卒中的CTP和光谱CTA图像。
|
| A为CTP后处理得到的像,红色区域提示梗死核心,绿色区域提示半暗带;B~E分别为CTP的脑血流量(CBF)、脑血容量(CBV)、平均通过时间(MTT)、脑血流残余功能达峰时间(Tmax),CTP参数像显示左侧大脑半球呈低灌注改变,CBV、CBF较对侧减低,MTT、Tmax较对侧延长;F、G分别为光谱CTA碘密度与有效原子序数,显示左侧大脑半球灌注缺损,可见梗死核心区(红色箭头)及半暗带区(绿色箭头)的碘密度值分别为0.11 mg/mL、0.32 mg/mL,显著低于对侧正常脑实质区域的0.65 mg/mL、0.68 mg/mL,梗死核心区及半暗带区的有效原子序数值分别为7.33、7.47,显著低于对侧的7.68、7.70;H为CTA像显示正常大脑中动脉M1段重度狭窄、闭塞,其分支稀疏(白色箭头) 图 1 急性缺血性脑卒中患者的CTP和光谱CTA图像 Fig 1 CTP and spectral CTA Images of acute ischemic stroke patients |
|
|
患者仰卧,头部正中矢状面与床中线重合,听眦线垂直于床面。每位患者在检查时都被要求保持头部不动,避免吞咽运动,并在扫描前用固定板固定头部。
首先采用轴向扫描方式进行CTP检查,扫描范围为海绵窦以上覆盖范围8 cm。用高压注射器以4.6 mL/s的流率经右肘部静脉注射碘帕醇40 mL(370 mg/mL)和生理盐水18 mL(5 mL/s)。造影剂注射后3 s开始曝光,60 s内连续曝光15次。扫描参数为管电压120 kVp、管电流40 mAs、层厚5 mm、层间距5 mm、准直器宽度40 mm、视野250 mm、容积CT剂量指数(CTDLvol)103.5 mGy、剂量长度乘积875 mGy*cm。CTP扫描程序之后注射生理盐水50 mL和碘帕醇50 mL,ROI设在降主动脉水平,阈值为120 Hu,阈值触发后延迟6 s使靶血管内对比剂浓度达到高峰时双层探测器光谱CT机自动切换到光谱螺旋扫描模式进行CTA检查,扫描范围为主动脉弓至颅顶。扫描参数为管电压120 kVp、管电流109 mAs、层厚5 mm、层间距5 mm、准直器宽度40 mm、视野220 mm、容积CT剂量指数(CTDLvol)28.1 mGy、剂量长度乘积516.3 mGy*cm。
1.3 资料收集光谱参数收集:通过飞利浦星云工作站(Philips Healthcare)的Brain Perfusion分析软件获得CTP检查的后处理图像,其中红色区域代表rCBF < 30%的“不可逆”的梗死核心区脑组织[10],绿色区域代表“基本上可逆”处于休眠或半休眠状态的半暗带区脑细胞组织,是梗死核周围的能量代谢保存而神经细胞缺血及功能障碍的区域[11]。手动勾画脑灌注缺损区(梗死核心、半暗带)ROI,并自动获取对侧镜像脑区ROI。在Philips SpDS图像工作站和PACS系统通过光谱基图像数据包获得CTA碘密度图和有效原子序数图。参照CTP所获取的灌注缺损区(梗死核心、半暗带),在薄层能谱CT常规图像的相对应层面及部位识别及勾画患侧及健侧的ROI,然后切换至碘密度图及有效原子序数图测量和记录患侧与健侧的碘密度值、有效原子序数值。
临床资料收集:通过查阅本院的电子病例系统收集患者的临床资料,包括临床基本资料:入院格拉斯哥昏迷评分(Glasgow coma score, GCS)评分、饮酒史、吸烟史、性别、年龄、入院mRs评分、入院美国国立卫生研究院卒中量表(National Institutes of Health stroke scale, NIHSS)评分、病变位置(前循环、后循环)、TOAST分型(大动脉粥样硬化型、心源性栓塞型、其他类型等)、危险因素(既往卒中史、高血压、糖尿病、癌症、瘫痪、心房颤动、冠心病、慢性心衰、肺部感染);以及实验室指标:白细胞、血小板、淋巴细胞、中性粒细胞、单核细胞、C反应蛋白、胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、糖化血红蛋白等。
1.4 统计学方法采用SPSS 26.0和GraphPad Prism 9.0软件进行统计分析。正态性连续型变量以均数±标准差(x±s)表示,采用t检验;非正态性的计量资料以中位数[M(Q1, Q3]表示,采用Wilcoxon符号秩检验;计数资料以例数和百分比表示,采用χ2检验。测得碘密度值与有效原子序数值分别在梗死核心区与半暗带区的截断值,根据截断值将碘密度值及有效原子序数值进行赋值二分类。采用二元logistic回归分析,筛选出与急性缺血性脑卒中梗死核心有关的危险因素。绘制受试者工作曲线(receiver operator characteristic curve, ROC)评估独立预测因子的预测效能。以P < 0.05表示差异具有统计学意义。
2 结果 2.1 训练集与验证集的临床资料及光谱参数比较本研究共纳入163例AIS患者,其中男性119例(73.0%),女性44例(27.0%),年龄28~92(65.44±13.49)岁。训练集(112例)中出现梗死核心75例(67.0%),验证集(51例)中出现梗死核心40例(78.4%)。表 1显示除了病变位置和肺部感染之外,训练集与验证集的所有变量比较,差异均无统计学意义(P > 0.05),具有可比性。
| 项目 | 训练集(n=112) | 验证集(n=51) | t/χ2/Z值 | P值 |
| 性别(男) a | 84(75.0) | 35(68.6) | 0.722 | 0.395 |
| 年龄(≥70岁) a | 44(39.3) | 26(51.0) | 1.956 | 0.162 |
| 梗死核心a | 75(67.0) | 40(78.4) | 2.218 | 0.136 |
| 患侧碘密度值b | 0.20±0.12 | 0.18±0.11 | 0.736 | 0.463 |
| 患侧有效原子序数值b | 7.37±0.07 | 7.38±0.07 | 1.357 | 0.147 |
| 吸烟史a | 56(50.1) | 22(43.1) | 0.661 | 0.416 |
| 饮酒史a | 40(35.7) | 19(37.3) | 0.036 | 0.849 |
| 入院GCS评分(分) b | 12.90±2.63 | 13.10±3.04 | 0.420 | 0.675 |
| 入院mRs评分(分) a | 1.276 | 0.259 | ||
| 0~2 | 53(47.3) | 29(56.9) | ||
| 3~6 | 59(52.7) | 22(43.1) | ||
| 入院NIHSS评分(分)a | 0.034 | 0.853 | ||
| < 15 | 73(65.2) | 34(66.7) | ||
| ≥15 | 39(34.8) | 17(33.3) | ||
| 病变位置a | 12.766 | < 0.001 | ||
| 前循环 | 99(88.4) | 33(64.7) | ||
| 后循环 | 13(11.6) | 18(35.3) | ||
| TOAST分型a | 1.241 | 0.538 | ||
| 大动脉粥样硬化型 | 80(71.4) | 32(62.7) | ||
| 心源性栓塞型 | 13(11.6) | 8(15.7) | ||
| 其他类型 | 19(17.0) | 11(21.6) | ||
| 危险因素a | ||||
| 既往卒中史 | 75(67.0) | 32(62.7) | 0.277 | 0.599 |
| 高血压 | 78(69.6) | 39(76.5) | 0.806 | 0.369 |
| 糖尿病 | 41(36.6) | 15(29.4) | 0.804 | 0.370 |
| 癌症 | 6(6.4) | 1(2.0) | - | 0.436 |
| 瘫痪 | 26(23.2 | 18(35.3) | 2.595 | 0.107 |
| 心房颤动 | 16(14.3) | 9(17.6) | 0.305 | 0.581 |
| 冠心病 | 14(12.5) | 8(15.7) | 0.305 | 0.581 |
| 慢性心衰 | 23(20.5) | 8(15.7) | 0.535 | 0.464 |
| 肺部感染 | 66(58.9) | 19(37.3) | 6.597 | 0.010 |
| 实验室指标 | ||||
| 白细胞(10×9/L)b | 8.95±3.52 | 9.01±4.13 | 0.096 | 0.924 |
| 中性粒细胞(10×9/L)c | 5.90(4.23, 8.88) | 5.70(4.00, 8.90) | 1.859 | 0.065 |
| 淋巴细胞(10×9/L)b | 1.90±2.34 | 1.73±2.28 | 0.442 | 0.659 |
| 单核细胞(10×9/L)b | 0.53±0.21 | 0.52±0.25 | 0.362 | 0.718 |
| 血小板(10×9/L)b | 221.0±86.98 | 220.8±74.57 | 0.011 | 0.991 |
| C反应蛋白(mg/L) c | 5.95(5.20, 18.05) | 5.30(3.20, 16.40) | 1.212 | 0.227 |
| 胆固醇(mmol/L) c | 4.05(3.34, 4.69) | 4.24(3.46, 5.23) | 1.608 | 0.112 |
| 甘油三脂(mmol/L) b | 1.40±0.70 | 1.31±0.66 | 0.729 | 0.467 |
| 高密度脂蛋白(mmol/L) c | 1.07(0.88, 1.32) | 1.28(1.04, 1.44) | 0.525 | 0.600 |
| 低密度脂蛋白(mmol/L) c | 2.48(1.79, 2.99) | 2.36(1.83, 3.36) | 0.583 | 0.562 |
| 糖化血红蛋白(≥6.5%) a | 36(32.1) | 9(18.0) | 3.178 | 0.075 |
| 注:GCS为格拉斯哥昏迷评分;mRs为改良Rankin量表;NIHSS为美国国立卫生研究院卒中量表;TOAST为缺血性脑卒中病因分型;a为[例(%)],b为x±s,c为[M(Q1, Q3] | ||||
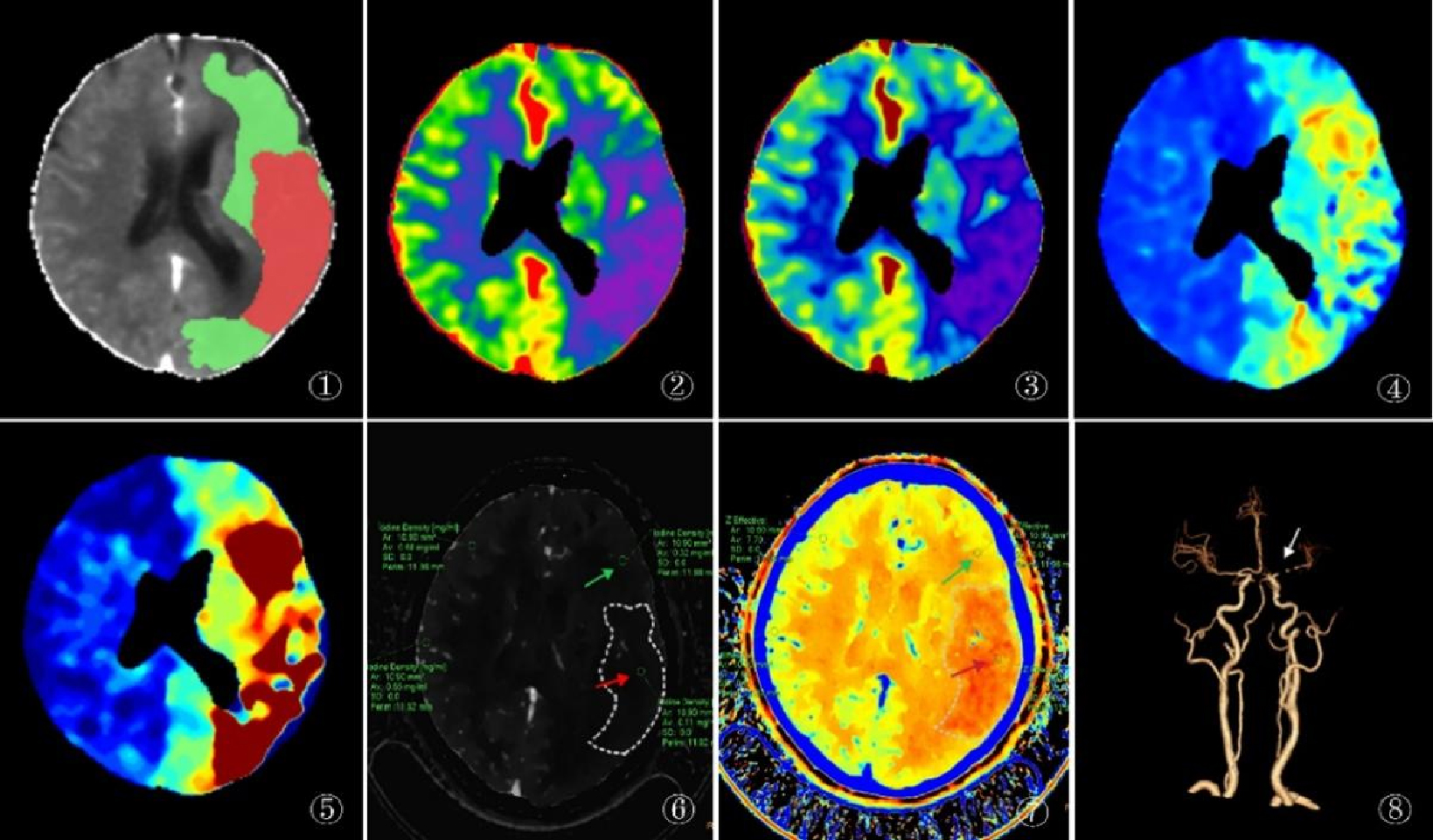
纳入训练集中的112例患者中,有75例出现梗死核心,37例无梗死核心,无梗死核心组的患侧碘密度值及患侧有效原子序数值为半暗带区的相应值。两组碘密度值、有效原子序数值、高血压、甘油三脂、中性粒细胞的差异具有统计学意义(P < 0.05),其中梗死核心区的碘密度值及有效原子序数值显著低于半暗带区的碘密度值及有效原子序数值(P < 0.001),见表 2。5个变量均容忍度 > 0.2,方差膨胀因子 < 10,无共线性,见表 3。
| 项目 | 梗死核心组(n=75) | 无梗死核心组(n=37) | t/χ2/Z值 | P值 |
| 性别(男,例) b | 58(77.3) | 26(70.3) | 0.659 | 0.417 |
| 年龄(≥70岁) b | 29(37.7) | 15(40.5) | 0.360 | 0.849 |
| 患侧碘密度值 | 0.14(0.11, 0.19) | 0.24(0.21, 0.41) | 6.024 | < 0.001 |
| 患侧有效原子序数值 | 7.34(7.32, 7.38) | 7.41(7.34, 7.45) | 3.590 | < 0.001 |
| 吸烟史b | 36(48.0) | 20(54.1) | 0.363 | 0.547 |
| 饮酒史b | 25(33.3) | 15(40.5) | 0.561 | 0.454 |
| 入院GCS评分(分) c | 12.92±2.58 | 12.86±2.78 | 0.104 | 0.918 |
| 入院mRs评分(分) b | 0.360 | 0.549 | ||
| 0~2 | 34(45.3) | 19(51.4) | ||
| 3~6 | 41(54.7) | 18(48.6) | ||
| 入院NIHSS评分(分)b | 2.683 | 0.101 | ||
| < 15 | 45(60.0) | 28(75.7) | ||
| ≥15 | 30(40.0) | 9(24.3) | ||
| 病变位置b | 0.659 | 0.417 | ||
| 前循环 | 65(86.7) | 34(91.9) | ||
| 后循环 | 10(13.3) | 3(8.1) | ||
| TOAST分型b | 0.163 | 0.921 | ||
| 大动脉粥样硬化型 | 54(72.0) | 26(70.3) | ||
| 心源性栓塞型 | 9(12.0) | 4(10.8) | ||
| 其他类型 | 12(16.0) | 7(18.9) | ||
| 危险因素b | ||||
| 既往卒中史 | 52(69.3) | 23(62.2) | 0.576 | 0.448 |
| 高血压 | 57(76.0) | 21(56.8) | 4.240 | 0.037* |
| 糖尿病 | 29(38.7) | 12(32.4) | 0.415 | 0.519 |
| 癌症 | 4(5.3) | 2(5.4) | - | 1.000 |
| 瘫痪 | 18(24.0) | 8(21.6) | 0.079 | 0.779 |
| 心房颤动 | 11(14.7) | 5(13.5) | 0.027 | 0.870 |
| 冠心病 | 12(16.0) | 2(5.4) | 1.666 | 0.197 |
| 慢性心衰 | 15(20.0) | 8(21.6) | 0.040 | 0.842 |
| 肺部感染 | 47(62.7) | 19(51.4) | 1.311 | 0.252 |
| 实验室指标 | ||||
| 白细胞(10×9/L)c | 9.36±3.64 | 8.14±3.13 | 1.743 | 0.084 |
| 中性粒细胞(10×9/L)a | 6.20(4.40, 10.10) | 5.20(3.70, 8.15) | 2.595 | 0.011 |
| 淋巴细胞(10×9/L)a | 1.40(1.10, 2.00) | 1.40(1.00, 1.90) | 1.682 | 0.096 |
| 单核细胞(10×9/L)c | 0.52±0.22 | 0.54±0.20 | 0.382 | 0.703 |
| 血小板(10×9/L)c | 226.7±91.52 | 209.3±76.81 | 0.994 | 0.332 |
| C反应蛋白(mg/L) a | 6.00(5.20, 19.10) | 5.70(5.20, 16.75) | 0.799 | 0.426 |
| 胆固醇(mmol/L) c | 4.10±1.05 | 4.09±0.97 | 0.042 | 0.967 |
| 甘油三脂(mmol/L) a | 1.23(0.81, 1.53) | 1.49(0.88, 2.35) | 2.396 | 0.020 |
| 高密度脂蛋白(mmol/L) a | 1.05(0.92, 1.33) | 1.10(0.84, 1.28) | 0.966 | 0.337 |
| 低密度脂蛋白(mmol/L) c | 2.53±1.14 | 2.50±1.15 | 0.124 | 0.902 |
| 糖化血红蛋白(≥6.5%) b | 23(30.7) | 13(34.335.1) | 0.227 | 0.634 |
| 注:GCS为格拉斯哥昏迷评分;mRs为改良Rankin量表;NIHSS为美国国立卫生研究院卒中量表;TOAST为缺血性脑卒中病因分型;a为[M(Q1, Q3],b数为[例(%)],c为x±s | ||||
| 因素 | 容忍度 | 方差膨胀因子 |
| 患侧碘密度值 | 0.349 | 2.865 |
| 患者有效原子序数值 | 0.350 | 2.857 |
| 高血压 | 0.989 | 1.012 |
| 甘油三酯 | 0.992 | 1.008 |
| 中性粒细胞 | 0.968 | 1.033 |
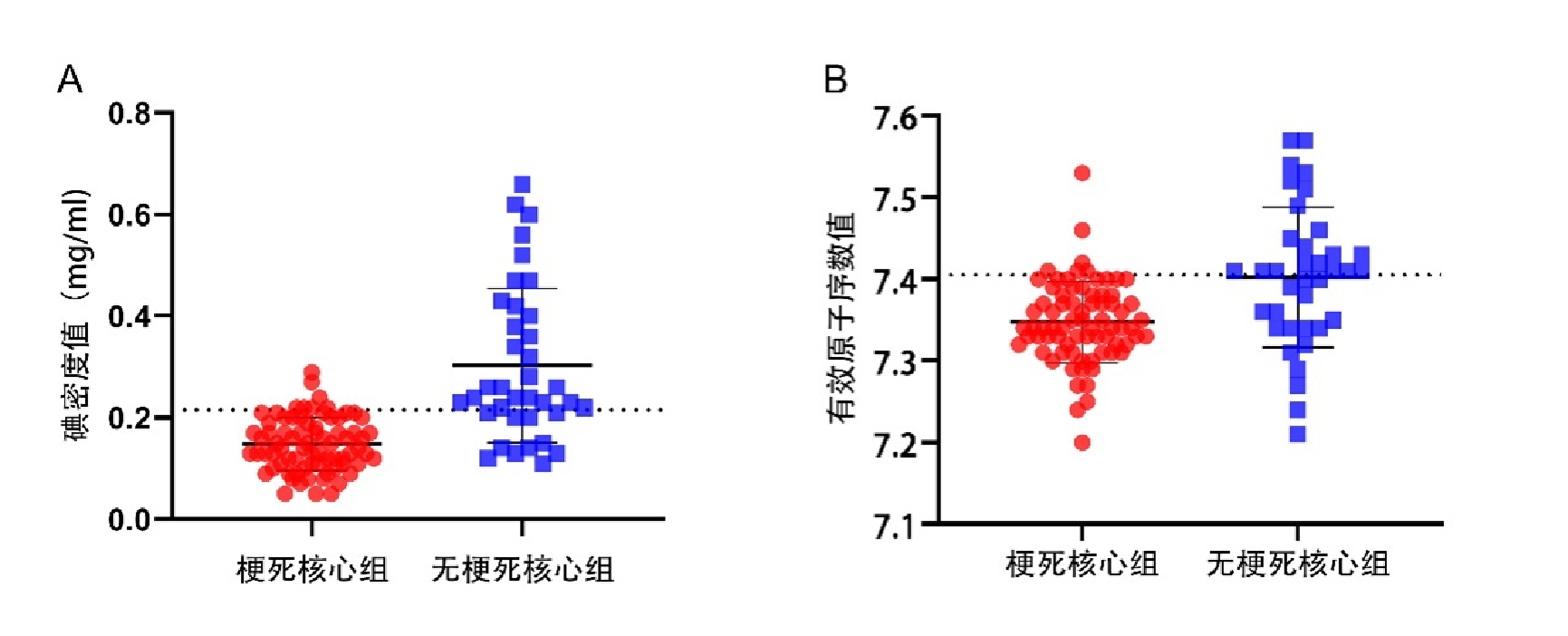
测得碘密度值及有效原子序数值在梗死核心区与半暗带区的截断值分别为0.215 mg/mL和7.405(图 2),将其根据最佳截断值进行二分类变量转化。以急性缺血性脑卒中患者是否出现梗死核心(0=否,1=是)为因变量,将单因素分析筛选出来的有意义的独立危险因素作为自变量,分类资料赋值[碘密度值(0=I < 0.215 mg/mL;1=I≥0.215 mg/mL)、有效原子序数值(0=Zeff < 7.405;1=Zeff≥7.405)、高血压(0=无;1=有)],计量资料原值录入,进行多因素Logistic回归分析。结果显示,患侧碘密度值、高血压以及甘油三酯为AIS梗死核心的独立预测因子。患侧高水平碘密度值及高血压是梗死核心的独立危险因素,高水平甘油三酯(进一步测得截断值为1.223 mmol/L)是梗死核心的独立保护因素(P < 0.05),见表 4。
|
| A:碘密度值在梗死核心区与半暗带区的截断值为0.215 mg/mL;B:有效原子序数值在梗死核心区与半暗带区的截断值为7.405 图 2 碘密度值及有效原子序数值的截断值 Fig 2 Cut off values of iodine density and effective atomic number values |
|
|
| 指标 | 回归系数 | 标准误 | Wald χ 2 | P值 | OR | 95%CI |
| 碘密度值 | -4.039 | 1.056 | 14.617 | < 0.001 | 0.018 | 0.002~0.140 |
| 高血压 | 2.002 | 0.709 | 7.980 | 0.005 | 7.405 | 1.846~29.703 |
| 甘油三酯 | -1.442 | 0.440 | 10.716 | 0.001 | 0.237 | 0.100~0.561 |
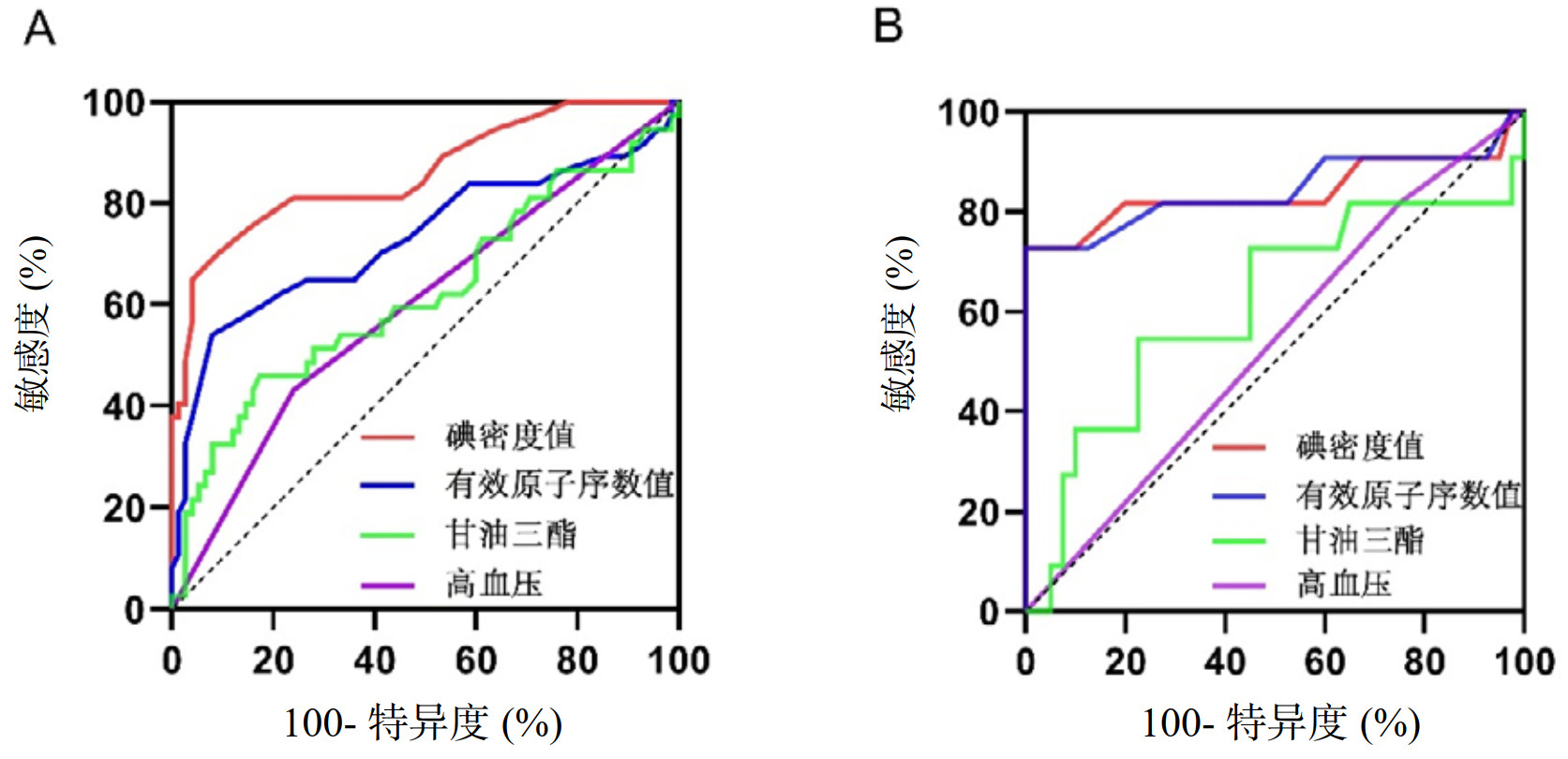
在训练集中,对碘密度值、高血压、甘油三酯等多因素分析中具有统计学意义的指标进行ROC曲线分析,结果显示碘密度值的曲线下面积(AUC)最大(0.859),敏感度为70.27%,特异度为90.67%,显示出较高的预测价值,其他指标的AUC值均低于0.7,预测价值相对较低。此外,尽管多因素分析结果中有效原子序数未显示出统计学显著性,但在ROC曲线分析中仍表现出一定的预测效能,提示其在临床上可能具有潜在的参考价值。验证集的ROC曲线分析结果与训练集一致,见表 5、图 3。
| 项目 | 指标 | AUC | 95%CI | 敏感度(%) | 特异度(%) | P值 |
| 训练集 | 碘密度值 | 0.859 | 0.780~0.938 | 70.27 | 90.67 | < 0.001 |
| 高血压 | 0.596 | 0.482~0.711 | 43.24 | 76.00 | 0.099 | |
| 甘油三酯 | 0.619 | 0.500~0.737 | 45.95 | 82.67 | 0.042 | |
| 有效原子序数值 | 0.730 | 0.618~0.842 | 54.05 | 92.00 | < 0.001 | |
| 验证集 | 碘密度值 | 0.841 | 0.654~1.000 | 72.73 | 90.00 | < 0.001 |
| 高血压 | 0.534 | 0.344~0.724 | 81.82 | 25.00 | 0.731 | |
| 甘油三酯 | 0.613 | 0.400~0.825 | 36.36 | 85.00 | 0.257 | |
| 有效原子序数值 | 0.844 | 0.664~1.000 | 72.73 | 97.50 | < 0.001 |
|
| A:训练集;B:验证集 图 3 训练集与验证集的ROC曲线分析 Fig 3 ROC curve analysis of the training and the validation groups |
|
|
AIS是最常见的卒中类型(70%),具有发病率、复发率、致残率和死亡率高、不易及时发现且有效治疗时间窗短等特点,给家庭和社会带来了沉重的负担[12]。当动脉阻塞导致供血区域内灌注降低至10 mL/(100 g·min)以下时,神经细胞就会在数分钟内发生不可逆的损伤而形成脑梗死核心[13]。超过时间窗或者急性大血管闭塞出现梗死核心时通常仅静脉溶栓难以治疗,需结合血管内治疗(endovascular treatment, EVT),EVT术后3个月预后良好率明显较高,神经功能缺损、脑疝等并发症发生率及病死率明显较低,并且梗死核心是EVT预后的独立影响因素[14]。因此早期预测脑组织灌注缺损区梗死核心的发生与发展对指导临床决策和提高患者预后至关重要。
近年来,双层探测器光谱CT发展迅速且独具特色,在头颈部血管成像中有更多的优点。原因主要在于:双层探测器光谱CT使用单个X射线管和双层堆叠探测器,通过一次常规扫描即可同时获得常规CT信息和高、低双能量图像,实现多参数成像;不需要特殊协议的预扫描设置,避免了额外的步骤和辐射剂量;光谱参数采用光谱基数据包(SBI)的形式存储,可进行回顾性按需光谱分析[15-16];常规CTA检查造影剂用量降低28%~70%,有效辐射剂量可低至1.5 mSv以下。另外,CTA成像技术能够准确的判断大血管闭塞的部位、评估侧支循环。因此双层探测器光谱CTA可实现对脑组织灌注缺损程度、颅内血管狭窄或闭塞情况的“一站式”评估,有望为AIS患者提供一种更安全快捷的评估方法。
碘密度值、有效原子序数值等光谱CT参数在脑卒中诊治中具有很大的应用潜能。碘密度图代表了碘摄取和分布情况,碘浓度是反映病灶灌注的敏感指标,测量碘浓度值并定量分析其强化程度,可反映组织的血供。既往多项研究探索了能谱CT在评估心肌、肝脏、胰腺、肾脏等脏器病变血液灌注方面的价值,证实碘密度值与CTP部分参数间具有一定的相关性[17]。表明其在评估AIS灌注缺损方面具有一定的价值。Fransson等[9]研究发现灌注缺损区的碘密度值低于正常脑组织区的测量值,表明双层探测器光谱CT参数碘密度值能够区分正常脑组织和灌注缺损组织。在此研究基础上,本研究进一步测得梗死核心区碘密度值(0.14 mg/mL)低于半暗带区碘密度值(0.24 mg/mL),差异具有统计学意义,且是梗死核心的独立危险因素,这在以往的研究中未见报道。本研究测得碘密度值区分梗死核心区和半暗带区的AUC值为0.859,敏感度和特异度分别为70.27%和90.67%,截断值为0.215 mg/mL,提示当碘密度值小于0.215 mg/mL时,应高度警惕其梗死核心的发生与进展。本研究表明碘密度值可在一定程度上反映梗死核心区与半暗带区的灌注差异情况,可能是早期及时预测梗死核心有效的影像学指标。
侯红军等[7]研究发现,碘密度值和有效原子序数值均与CTP部分参数间具有一定的相关性,且光谱CTA显示的脑灌注缺损面积与CTP显示的脑灌注缺损面积存在强相关性。Huang等[8]研究表明碘密度值及有效原子序数值能有效区分脑卒中患者的正常脑组织与灌注缺损组织。本研究进一步测得,梗死核心组的有效原子序数值(7.34)较无梗死核心组的有效原子序数值(7.41)低,组间差异具有统计学意义,表明有效原子序数值与AIS患者出现梗死核心有关。有效原子序数图将对应的单个像素的有效原子序数进行颜色量化,为每个像素添加了物质组成的信息,使得碘、钙等高原子序数物质以及水、脂肪等低原子序数物质很容易在有效原子序数图中分辨[18]。有效原子序数反映了物质的组成成分,脑组织中物质成分或比例的变化可间接反映组织的血供变化。本研究测得有效原子序数值在两组间的差异具有统计学意义,有效原子序数值区分梗死核心和半暗带的AUC值为0.730,敏感度为54.05%,特异度92%,截断值为7.405。提示有效原子序数值具有区分梗死核心和半暗带的潜能,并且当脑灌注缺损区的有效原子序数值小于7.405时,为梗死核心区的可能性较大。但是在多因素分析中,有效原子序数值不是梗死核心的独立危险因素,考虑原因为:本研究样本量较少,且纳入的病例均为急诊或者住院病例,对总体的统计结果会有一定的影响。
在本研究纳入的相关因素中,笔者发现除了CTA参数之外,临床指标中的高血压和甘油三酯也具有预测梗死核心的能力。本研究中,高血压的AUC值为0.596,敏感度44.24%,特异度76%;甘油三酯的AUC值为0.619,敏感度45.95%,特异度82.67%,表明它们具有一定的区分度和预测价值。单因素和多因素分析结果显示高血压和甘油三酯在梗死核心组和无梗死核心组差异具有统计学意义,且是梗死核心的独立预测因子。
研究表明,高血压性脑卒中患者拥有更大的梗死灶和较少的可挽救组织[19]。本研究得出了类似的结论,高血压与AIS梗死核心的进展呈正相关,高血压性脑卒中患者更易出现梗死核心。高血压是梗死核心的独立危险因素,既往研究表明其可能通过以下机制降低脑组织的局部代谢及加速梗死核心的形成:①脑动脉和小动脉的肥大和内向重塑,限制了血管扩张的能力;增加内皮的脉压和剪切力,导致血脑屏障破坏和血管壁损伤[20];②脑白质的损伤和水肿形成、大脑自我调节功能受损[21]。高血压(52%)被认为是脑卒中最常见的可改变危险因素, 收缩压每升高10 mmHg(1 mmHg=0.133 kPa),脑卒中发生风险增加53%[18]。本研究中,有78%的患者伴有高血压。因此,对于伴有高血压的AIS患者应早期干预、及时控制,以降低脑卒中的发生率及减缓梗死核心的进展。
有报道称甘油三酯水平与脑卒中结局呈负相关,低水平甘油三酯与入院时脑CT扫描梗死体积增大、脑卒中严重程度增加和脑卒中后死亡率增加有关[22]。本研究同样发现甘油三酯与AIS梗死核心的进展密切相关,且是梗死核心的独立保护因子。既往研究表明,高水平甘油三酯主要通过为AIS患者在代谢应激条件下的脑组织提供营养,促进AIS患者早期神经修复[23]。另外,甘油三酯作为大脑内高浓度的不饱和脂肪酸等脂毒性物质的缓冲物对AIS起保护作用。本研究中,甘油三酯在梗死核心与半暗带的截断值为1.223 mmol/L,提示当甘油三酯低于1.223 mmol/L时,应注意营养不良事件的发生以及对梗死核心的影响,这可能对指导临床医生早期预测和加强管理具有一定的积极作用。
中性粒细胞是AIS患者死亡率的独立预测因子。既往有研究表明入院中性粒细胞计数与AIS患者的梗死面积及早期神经功能恶化相关,提示在一定条件下,入院中性粒细胞计数越高,AIS患者出现梗死核心及不良预后可能性越大[24]。既往研究证实AIS患者的梗死核心区成为炎症的巢穴,毛细血管内的中性粒细胞粘附和停滞加重炎症和低灌注,导致微循环衰竭和梗塞扩张[25-26]。许多研究表明,阻断中性粒细胞相关通路可以减少梗死体积,从而可以构成一个新的治疗靶点。本研究中,梗死核心组的入院NIHSS较非梗死核心组的高,差异有统计学意义(P < 0.001),但入院NIHSS不是梗死核心的独立危险因素。因此可作为未来的研究方向进一步探索其相关性及预测价值。
本研究的局限性为单中心小样本的回顾性研究,患者数量较少,数据存在一定的信息偏倚,今后需结合前瞻性随机对照试验,进行多中心、多区域、大样本量的广泛研究。
综上所述,本研究结果显示光谱CT参数碘密度值及有效原子序数值能有效区分AIS患者的梗死核心区和半暗带区。碘密度值、高血压是AIS梗死核心的独立危险因素,甘油三酯是独立保护因素,其中双层探测器光谱CT参数碘密度值具有较高的预测价值,有利于在早期及时识别存在梗死核心发生和发展的不良潜在风险的AIS患者。
利益冲突 所有作者声明无利益冲突
作者贡献声明 顾燕:研究设计、统计学分析、论文撰写和修改;时代、徐亮:研究设计、论文修改;王业青、徐丹丹、肖奥齐:负责数据收集及整理;金丹、陆宽:负责数据管理;蔡武、范国华、沈钧康:负责监督和批判性审阅
| [1] | Juceviči ū tė N, Mikužis P, Balnytė R. Absolute blood eosinophil count could be a potential biomarker for predicting haemorrhagic transformation after intravenous thrombolysis for acute ischaemic stroke[J]. BMC Neurol, 2019, 19(1): 127. DOI:10.1186/s12883-019-1359-6 |
| [2] | Hasan TF, Todnem N, Gopal N, et al. Endovascular thrombectomy for acute ischemic stroke[J]. Curr Cardiol Rep, 2019, 21(10): 112. DOI:10.1007/s11886-019-1217-6 |
| [3] | Boned S, Padroni M, Rubiera M, et al. Admission CT perfusion may overestimate initial infarct core: the ghost infarct core concept[J]. J Neurointerv Surg, 2017, 9(1): 66-69. DOI:10.1136/neurintsurg-2016-012494 |
| [4] | 赵宝连, 涂文婷, 范丽, 等. 双层探测器光谱CT在头颈部疾病中的研究进展[J]. 国际医学放射学杂志, 2023, 46(1): 90-94. DOI:10.19300/j.2023.Z19910 |
| [5] | 贾萍, 王晓明. 双层探测器光谱CT在头颈部血管相关疾病中的研究进展[J]. 中国医学影像学杂志, 2021, 29(10): 1052-1055. DOI:10.3969/j.issn.1005-5185.2021.10.020 |
| [6] | Spira D, Adam P, Linder C, et al. Perfusion and flow extraction product as potential discriminators in untreated follicular and diffuse large B cell lymphomas using volume perfusion CT with attempt at histopathologic explanation[J]. AJR Am J Roentgenol, 2012, 198(6): 1239-1246. DOI:10.2214/AJR.11.7858 |
| [7] | 侯红军, 张洪胜, 刘杰, 等. 双层探测器光谱CT血管成像评估急性缺血性脑卒中灌注的价值[J]. 中华放射学杂志, 2021, 55(12): 1277-1281. DOI:10.3760/cma.j.cn112149-20210331-00306 |
| [8] | Huang J, Chen JH, Wang XM, et al. The diagnostic value of quantitative parameters on dual-layer detector-based spectral CT in identifying ischaemic stroke[J]. Front Neurol, 2023, 14: 1056941. DOI:10.3389/fneur.2023.1056941 |
| [9] | Fransson V, Mellander H, Wasselius J, et al. Detection of perfusion deficits in multiphase computed tomography angiography-a stroke imaging technique based on iodine mapping on spectral computed tomography: initial findings[J]. J Comput Assist Tomogr, 2021, 45(4): 618-624. DOI:10.1097/RCT.0000000000001173 |
| [10] | Sarraj A, Hassan AE, Savitz S, et al. Outcomes of endovascular thrombectomy vs medical management alone in patients with large ischemic cores: a secondary analysis of the optimizing patient's selection for endovascular treatment in acute ischemic stroke (SELECT) study[J]. JAMA Neurol, 2019, 76(10): 1147-1156. DOI:10.1001/jamaneurol.2019.2109 |
| [11] | Heit JJ, Zaharchuk G, Wintermark M. Advanced neuroimaging of acute ischemic stroke: penumbra and collateral assessment[J]. Neuroimaging Clin N Am, 2018, 28(4): 585-597. DOI:10.1016/j.nic.2018.06.004 |
| [12] | 杜庆霞, 李杰宾, 张敬, 等. 急性缺血性脑卒中合并脑心综合征的临床特点和相关危险因素分析[J]. 中华急诊医学杂志, 2022, 31(11): 1504-1507. DOI:10.3760/cma.j.issn.1671-0282.2022.11.012 |
| [13] | Conrad J, Ertl M, Oltmanns MH, et al. Prediction contribution of the cranial collateral circulation to the clinical and radiological outcome of ischemic stroke[J]. J Neurol, 2020, 267(7): 2013-2021. DOI:10.1007/s00415-020-09798-0 |
| [14] | 刘基, 贺峰, 王贤军, 等. 伴大面积核心梗死的急性缺血性脑卒中血管内治疗的预后及其影响因素分析[J]. 中华神经医学杂志, 2021, 20(8): 805-811. DOI:10.3760/cma.j.cn115354-20210326-00197 |
| [15] | Sellerer T, Noël PB, Patino M, et al. Dual-energy CT: a phantom comparison of different platforms for abdominal imaging[J]. Eur Radiol, 2018, 28(7): 2745-2755. DOI:10.1007/s00330-017-5238-5 |
| [16] | Demirler Simsir B, Danse E, Coche E. Benefit of dual-layer spectral CT in emergency imaging of different organ systems[J]. Clin Radiol, 2020, 75(12): 886-902. DOI:10.1016/j.crad.2020.06.012 |
| [17] | Thaiss WM, Haberland U, Kaufmann S, et al. Iodine concentration as a perfusion surrogate marker in oncology: further elucidation of the underlying mechanisms using Volume Perfusion CT with 80 kVp[J]. Eur Radiol, 2016, 26(9): 2929-2936. DOI:10.1007/s00330-015-4154-9 |
| [18] | Hsu CC, Jeavon C, Fomin I, et al. Dual-layer spectral CT imaging of upper aerodigestive tract cancer: analysis of spectral imaging parameters and impact on tumor staging[J]. AJNR Am J Neuroradiol, 2021, 42(9): 1683-1689. DOI:10.3174/ajnr.A7239 |
| [19] | 任海燕, 甄艳华, 郑加贺. 双层光谱探测器CT临床应用与研究进展[J]. 中国医学影像技术, 2020, 36(10): 1555-1558. DOI:10.13929/j.issn.1003-3289.2020.10.031 |
| [20] | Dunn KM, Nelson MT. Neurovascular signaling in the brain and the pathological consequences of hypertension[J]. Am J Physiol Heart Circ Physiol, 2014, 306(1): H1-H14. DOI:10.1152/ajpheart.00364.2013 |
| [21] | Tomaszewska-Lampart I, Wiącek M, Bartosik-Psujek H. Risk factors for infarct growth and haemorrhagic or oedematous complications after endovascular treatment - a literature review[J]. Neurol Neurochir Pol, 2022, 56(5): 389-398. DOI:10.5603/PJNNS.a2022.0056. |
| [22] | Pikija S, Trkulja V, Juvan L, et al. Higher on-admission serum triglycerides predict less severe disability and lower all-cause mortality after acute ischemic stroke[J]. J Stroke Cerebrovasc Dis, 2013, 22(7): e15-e24. DOI:10.1016/j.jstrokecerebrovasdis.2012.03.006 |
| [23] | Serhat Tokgoz O, Guney F, Kaya A, et al. Acute-phase stroke outcome and lipids[J]. Sisli Etfal Hastan Tip Bul, 2021, 55(4): 538-544. DOI:10.14744/SEMB.2020.26817 |
| [24] | Semerano A, Laredo C, Zhao YS, et al. Leukocytes, collateral circulation, and reperfusion in ischemic stroke patients treated with mechanical thrombectomy[J]. Stroke, 2019, 50(12): 3456-3464. DOI:10.1161/STROKEAHA.119.026743 |
| [25] | 吕苏, 高伟波, 朱继红. 中性粒细胞和淋巴细胞比率与溶栓后急性脑卒中预后的关系[J]. 中华急诊医学杂志, 2020, 29(7): 976-980. DOI:10.3760/cma.j.issn.1671-0282.2020.07.015 |
| [26] | Rolfes L, Riek-Burchardt M, Pawlitzki M, et al. Neutrophil granulocytes promote flow stagnation due to dynamic capillary stalls following experimental stroke[J]. Brain Behav Immun, 2021, 93: 322-330. DOI:10.1016/j.bbi.2021.01.011 |
 2024, Vol. 33
2024, Vol. 33