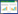2. 河南省急诊与创伤研究医学重点实验室, 郑州 450052;
3. 河南省急诊与创伤工程研究中心, 郑州 450052
2. Henan Medical Key Laboratory of Emergency and Trauma Research, Zhengzhou 450052, China;
3. Henan Emergency and Trauma Engineering Research Center, Zhengzhou 450052, China
急性胰腺炎(acute pancreatitis, AP)是急诊科发病率位居第3~5位的常见急腹症,以血、尿淀粉酶升高及突发剧烈腹痛为主要临床表现,且发病率逐年有增高趋势[1]。约20%患者常伴有局部及全身并发症,如全身炎症反应综合征(SIRS)、多器官功能障碍(MODS)等,最终可能进展为重症急性胰腺炎(severe acute pancreatitis,SAP)。近年来AP的防治取得进展的同时,SAP的病死率仍高达36%~50%。尽早识别发展为SAP可能性对于改善患者预后至关重要[2]。ALI是AP常见并发症,70% AP可能并发ALI,表现为ALT、AST、白蛋白等实验室指标异常[3]。AP并发ALI与炎症反应密切相关,因此可用炎症指标来预测AP患者ALI发生风险[4],且已有报道显示,相关指标如血小板计数与淋巴细胞比值(PLR)、中性粒细胞与淋巴细胞比值(NLR)在AP相关ALI的预测价值[5]。PPR作为降钙素原(PCT)与血小板(PLT)的比值,其升高对脓毒症心肌损伤具有预警价值[6],同时CAR作为C反应蛋白(CRP)与白蛋白(ALB)的比值,其入院时升高往往提示SAP预后较差[7],但目前未有二者联合在SAP中的相关报道。本研究旨在探讨PPR和CAR与AP严重程度及并发ALI的预测价值。
1 资料与方法 1.1 一般资料 1.1.1 诊断标准(1)AP诊断标准:根据我国AP诊治指南[8]。(2)SAP诊断标准:AP患者且满足以下任一项, ①休克或其他器官功能衰竭且超过48 h后无好转;②出现胰腺局部并发症;③急性生理学与慢性健康状况评分Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)超过8分;④Ranson评分达3分及以上;⑤ MCTSI评分为重度(见表 1)。(3)肝损伤诊断标准[9]:肝细胞型ALI:ALT和(或)AST超3倍正常值上限;胆管细胞型ALI:ALP和(或)GGT超2倍正常值上限;同时满足称为混合型ALI。
| 指标 | 评分 |
| 胰腺炎症 | |
| 正常 | 0 |
| 胰腺+胰周炎症 | 2 |
| ≥1处积液或胰周脂肪坏死 | 4 |
| 胰腺坏死 | |
| 无 | 0 |
| 30% | 2 |
| >30% | 4 |
| 胰腺外并发症(胸腔积液、腹水、血管、胃肠道等) | 2 |
| 注:MCTSI评分0~2分为轻度AP,4~6分为中度AP,8~10分为重度AP | |
(1)纳入标准:①AP诊断符合我国标准;②年满18周岁;③48 h内入院并完善相关检验检查;④病例记录完整且无不遵医嘱记录。
(2)排除标准:①既往AP外科干预史或病程为慢性者;②年龄超过80岁、未满18周岁及妊娠期、哺乳期妇女;③合并恶性肿瘤,或慢性消耗性疾病者(如肺结核、慢性肝炎等);④应用免疫抑制剂或存在免疫缺陷、影响BISAP评分的患者;⑤就诊7 d内有致ALI可疑行为者(如服用肝毒性药物等);⑥临床资料欠缺者。
1.1.3 伦理学已获本院伦理委员会批准(审批号:2022-KY-0054-002)。
1.1.4 分组资料收集2021年6月至2022年12月期间在本院急诊医学部就诊的374名AP患者资料,并根据上述纳排标准选定195名纳入本研究。按照AP分类标准,将195名患者分成两组,重症急性胰腺炎组(SAP组)88例,非重症急性胰腺炎组(NSAP组)107例。按照ALI分类标准,将195名患者分为ALI组88例和NALI组107例,将ALI组进一步分为肝细胞型ALI亚组13例,胆管细胞型ALI亚组52例,混合型ALI亚组23例。
1.2 数据收集收集本院AP患者入院48 h内首次检验检查结果并行BISAP评分(见表 2),统计PPR、CAR等指标。
| 指标 | 评分 |
| BUN(1分) | 25 mg/dL |
| 意识障碍(1分) | Glasgow评分 < 15 |
| SIRS(1分) | 体温 < 36℃或 > 38℃ 呼吸频率 > 20次/min或PaCO2 < 32 mmHg 脉搏 > 90次/min WBC < 4×109/L或 > 12×109/L或杆状核 > 10% |
| 年龄(1分) | > 60岁 |
| 胸腔积液(1分) | 影像学可见胸腔积液 |
| 注:BUN为血尿素氮;PaCO2为动脉二氧化碳分压;WBC为血白细胞计数;SIRS为全身炎症反应综合征,四项指标满足任意两项,得分≥3分为SAP | |
采用SPSS 23.0和GraphPad Prism 8.0对数据进行统计分析。计量资料中符合正态分布者采取独立样本t检验方法,以均数±标准差(x ± s)表示;否则采用非参数检验Mann-Whitney U检验,以中位数(四分位数)[M(Q1, Q3)]表示。计数资料则应用χ2检验。绘制ROC曲线,并采用二元Logistic回归分析对两组比较后差别有显著性的指标进行探究。以P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者一般资料对比共纳入195例,分为SAP组(n=88)和NSAP组(n=107)。SAP组男性58例、女性30例,其中20例为胆源性胰腺炎,37例为高脂血症性胰腺炎,6例为酒精性胰腺炎,25例为其他病因。NSAP组男性74例、女性33例,其中33例为胆源性胰腺炎,40例为高脂血症性胰腺炎,1例为酒精性胰腺炎,33例为其他病因。住院天数的比较中,NSAP组少于SAP组(P < 0.001)。两组性别、年龄以及疾病类型的比较, 差异无统计学意义(P > 0.05)。见表 3。
| 指标 | NSAP组(n=107) | SAP组(n=88) | t或χ2值 | P值 |
| 年龄(岁) | 44(34.5,60) | 37.5(31,55) | -1.512 | 0.130 |
| 性别(男/女,例) | 74/33 | 58/30 | 0.192 | 0.661 |
| 住院天数 | 10(7,16) | 17(11,22) | -4.332 | < 0.001 |
| 病因(例) | 6.119 | 0.106 | ||
| 胆源性 | 33(30.8) | 20(22.7) | ||
| 高脂血症性 | 40(37.4) | 37(42.0) | ||
| 酒精性 | 1(0.9) | 6(6.8) | ||
| 其他 | 33(30.8) | 25(28.4) | ||
| 注:NSAP为非重症急性胰腺炎;SAP为重症急性胰腺炎 | ||||
SAP组脉搏、呼吸、PCT、CRP、白细胞计数、中性粒细胞计数、平均血小板体积、白蛋白、甘油三酯、血淀粉酶、血脂肪酶、PPR、CAR、BISAP评分及MCTSI评分较NSAP组差异有统计学意义(P<0.05)。两组体温、收缩压、舒张压、红细胞计数、血红蛋白、血小板、淋巴细胞计数、谷丙转氨酶、谷草转氨酶、谷氨酰转肽酶、碱性磷酸酶及总胆固醇的比较无统计学意义(P>0.05)。见表 4。
| 指标 | NSAP组(n=107) | SAP组(n=88) | t或z值 | P值 |
| 体温(℃)a | 36.7(36.5,37) | 36.8(36.6,37.48) | -2.159 | 0.031 |
| 脉搏(次/min)b | 95.55±18.14 | 114.44±24.15 | -6.057 | < 0.001 |
| 呼吸(次/min)a | 20(18,22) | 20(18,28) | -2.199 | 0.028 |
| 收缩压(mmHg)a | 131.05±25.70 | 128.73±27.32 | 0.608 | 0.544 |
| 舒张压(mmHg)a | 83.77±14.46 | 80.28±18.23 | 1.487 | 0.139 |
| PCT(ng/mL)a | 0.19(0.07,0.55) | 1.92(0.54,1.82) | -8.488 | < 0.001 |
| CRP(mg/L)a | 51.62(10.46,157.97) | 224.42(108.32,323.32) | -6.668 | < 0.001 |
| WBC(×109)a | 10.88(7.95,14.54) | 13.26(9.48,15.95) | -2.240 | 0.025 |
| RBC(×1012)b | 4.39±0.71 | 4.41±1.17 | -0.243 | 0.809 |
| HGB(g/L)a | 136.20(119.53,151.00) | 137.00(111.55,160.95) | -0.381 | 0.703 |
| PLT(109/L)a | 204.50(155.00,253.50) | 189.00(146.50,272.50) | -0.388 | 0.698 |
| NEUT(109/L)a | 9.23(5.81,12.23) | 11.06(8.29,13.82) | -2.610 | 0.009 |
| LYM(109/L)a | 1.03(0.70,1.88) | 1.02(0.70,1.27) | -1.076 | 0.282 |
| 平均血小板体积(fL)a | 9.37(8.28,10.50) | 10.28(9.10,11.40) | -3.578 | < 0.001 |
| ALT(U/L)a | 27.50(15.00,63.25) | 22.00(12.00,80.50) | -0.874 | 0.382 |
| AST(U/L)a | 25.00(19.00,48.25) | 36.00(20.25,67.75) | -1.742 | 0.082 |
| GGT(U/L)a | 70.50(32.00,180.00) | 91.50(34.25,156.75) | -0.290 | 0.772 |
| ALP(U/L)a | 81.50(63.75,107.25) | 88.50(63.50,118.25) | -0.042 | 0.996 |
| ALB(g/L)a | 37.70(33.15,41.22) | 30.50(27.33,36.08) | -6.287 | < 0.001 |
| TC(mmol/L)a | 4.81(3.29,6.60) | 4.79(2.89,9.00) | -0.281 | 0.779 |
| TG(mmol/L)a | 1.96(0.87,5.16) | 3.19(1.61,8.68) | -3.013 | 0.003 |
| 血淀粉酶(U/L)a | 130.50(68.75,355.75) | 288.00(86.75,689.75) | -2.409 | 0.016 |
| 血脂肪酶(U/L)a | 150.75(66.98,595.25) | 485.6(96.35,1669.08) | -2.594 | 0.009 |
| PPR a | 0.0009(0.0003,0.0045) | 0.0119(0.0030,0.0422) | -8.055 | < 0.001 |
| CAR a | 1.38(0.28,4.23) | 7.26(3.46,10.75) | -7.007 | < 0.001 |
| BISAP评分a | 1.00(1.00,2.00) | 3.00(2.00,3.00) | -9.421 | < 0.001 |
| MCTSI评分a | 2.00(2.00,2.50) | 4.00(4.00,6.00) | -8.597 | < 0.001 |
| 注:PCT为降钙素原,CRP为C反应蛋白,WBC为白细胞计数,HGB为血红蛋白,PLT为血小板计数,NEUT为中性粒细胞计数,LYM为淋巴细胞计数,ALT为丙氨酸氨基转移酶,AST为天门冬氨酸氨基转移酶,GGT为γ-谷氨酰转移酶,ALP为碱性磷酸酶,ALB白蛋白,TC为总胆固醇,TG为甘油三酯,PPR为降钙素原与血小板比值,CAR为C反应蛋白与白蛋白比值,BISAP评分为急性胰腺炎严重程度床旁指数,MCTSI评分为修正CT严重度指数评分;1 mmHg=0.133 kPa;a为M(Q1,Q3),b为x ± s | ||||
ALI组PPR、CAR均高于NALI组,差异有统计学意义(P<0.05)。见表 5。
| 指标 | NALI组(n=107) | ALI组(n=88) | z值 | P值 |
| PPR | 1.02(0.28,4.82) | 9.56(2.01,47.5) | -7.323 | < 0.001 |
| CAR | 1.34(0.21,3.44) | 7.91(3.88,10.94) | -8.300 | < 0.001 |
将PPR、CAR纳入Logistic回归模型。结果提示,PPR、CAR升高是AP患者病情变化的独立危险因素(P < 0.05)。见表 6。
| 影响因素 | 回归系数 | 标准误 | Wald χ2 | P值 | OR | 95% CI |
| PPR | 0.047 | 0.016 | 8.758 | 0.003 | 1.05 | 1.02, 1.08 |
| CAR | 0.213 | 0.048 | 19.60 | < 0.001 | 1.24 | 1.13, 1.36 |
PPR、CAR单项检测及BISAP评分预测SAP的AUC分别为:0.85,0.79,0.82。PPR联合CAR、PPR联合BISAP及CAR联合BISAP评分预测SAP的AUC分别为:0.86,0.90,0.88。PPR、CAR、BISAP三项指标联合检测预测SAP的AUC为:0.91。ROC曲线分析显示,PPR、CAR、BISAP三项指标联合检测预测AP病情严重程度的曲线下面积最大,灵敏度及特异度较高,大于PPR、CAR及BISAP评分及任两项联合评分。见表 7、图 1。
| 指标 | AUC | 95% CI | 最佳截断值 | 约登指数 | 敏感度(%) | 特异度(%) |
| PPR | 0.85 | 0.78~0.89 | 0.0023 | 0.503 | 79.50 | 70.80 |
| CAR | 0.79 | 0.73~0.86 | 4.3184 | 0.469 | 70.50 | 76.40 |
| BISAP | 0.82 | 0.76~0.88 | 1.5000 | 0.522 | 85.20 | 67.00 |
| PPR+CAR | 0.86 | 0.80~0.91 | 0.4463 | 0.563 | 70.50 | 85.80 |
| PPR+BISAP | 0.90 | 0.85~0.94 | 0.3932 | 0.652 | 84.10 | 81.10 |
| CAR+BISAP | 0.88 | 0.84~0.93 | 0.3537 | 0.639 | 87.50 | 76.40 |
| 三者联合 | 0.91 | 0.87~0.95 | 0.5187 | 0.675 | 80.70 | 86.80 |
| 注:AUC为ROC曲线下面积,95%CI为95%置信区间,PPR为降钙素原与血小板比值,CAR为C反应蛋白与白蛋白比值,BISAP为急性胰腺炎严重程度床边指数,三者联合为PPR、CAR、BISAP三项指标联合 | ||||||
|
| 图 1 PPR、CAR、BISAP评分及联合试验预测SAP的ROC曲线 Fig 1 ROC curve of PPR、CAR and BISAP scores and combined tests for predicting SAP |
|
|
肝细胞型ALI、胆管细胞型ALI和混合型ALI各自与NALI组相比,PPR和CAR差异均差异有统计学意义(P<0.05)。见表 8。
| 类型 | 指标 | 数值[M(Q1, Q3)] | Z值 | P值 |
| 肝细胞亚组(n=13) | PPR | 42.59(9.02,130.80) | -5.062 | <0.001 |
| CAR | 9.02(1.10,11.07) | -3.112 | 0.002 | |
| 胆管型亚组(n=52) | PPR | 7.03(1.41,28.87) | -5.335 | <0.001 |
| CAR | 8.52(5.36,10.99) | -8.275 | <0.001 | |
| 混合型亚组(n=23) | PPR | 15.88(2.24,69.49) | -5.000 | <0.001 |
| CAR | 4.33(2.22,10.15) | -3.859 | <0.001 | |
| 注:Mann-Whitney U检验 | ||||
PPR和CAR升高是AP发生ALI的危险因素,PPR同时是肝细胞型和混合型ALI的危险因素,CAR是肝细胞型、胆管型和混合型ALI的危险因素(P<0.05)。见表 9。
| 类型 | 影响因素 | 回归系数 | 标准误 | Wald χ2 | P值 | OR | 95% CI |
| ALI | PPR | 0.050 | 0.017 | 8.402 | 0.004 | 1.05 | 1.02~1.09 |
| CAR | 0.320 | 0.056 | 32.22 | < 0.001 | 1.38 | 1.23~1.54 | |
| 肝细胞型 | PPR | 0.090 | 0.027 | 10.62 | 0.001 | 1.09 | 1.04~1.15 |
| CAR | 0.258 | 0.122 | 4.49 | 0.034 | 1.29 | 1.02~1.64 | |
| 胆管型 | PPR | 0.023 | 0.015 | 2.27 | 0.132 | 1.02 | 0.99~1.05 |
| CAR | 0.445 | 0.076 | 34.20 | < 0.001 | 1.56 | 1.35~1.81 | |
| 混合型 | PPR | 0.063 | 0.024 | 6.74 | 0.009 | 1.07 | 1.02~1.12 |
| CAR | 0.160 | 0.081 | 3.90 | 0.048 | 1.17 | 1.00~1.38 |
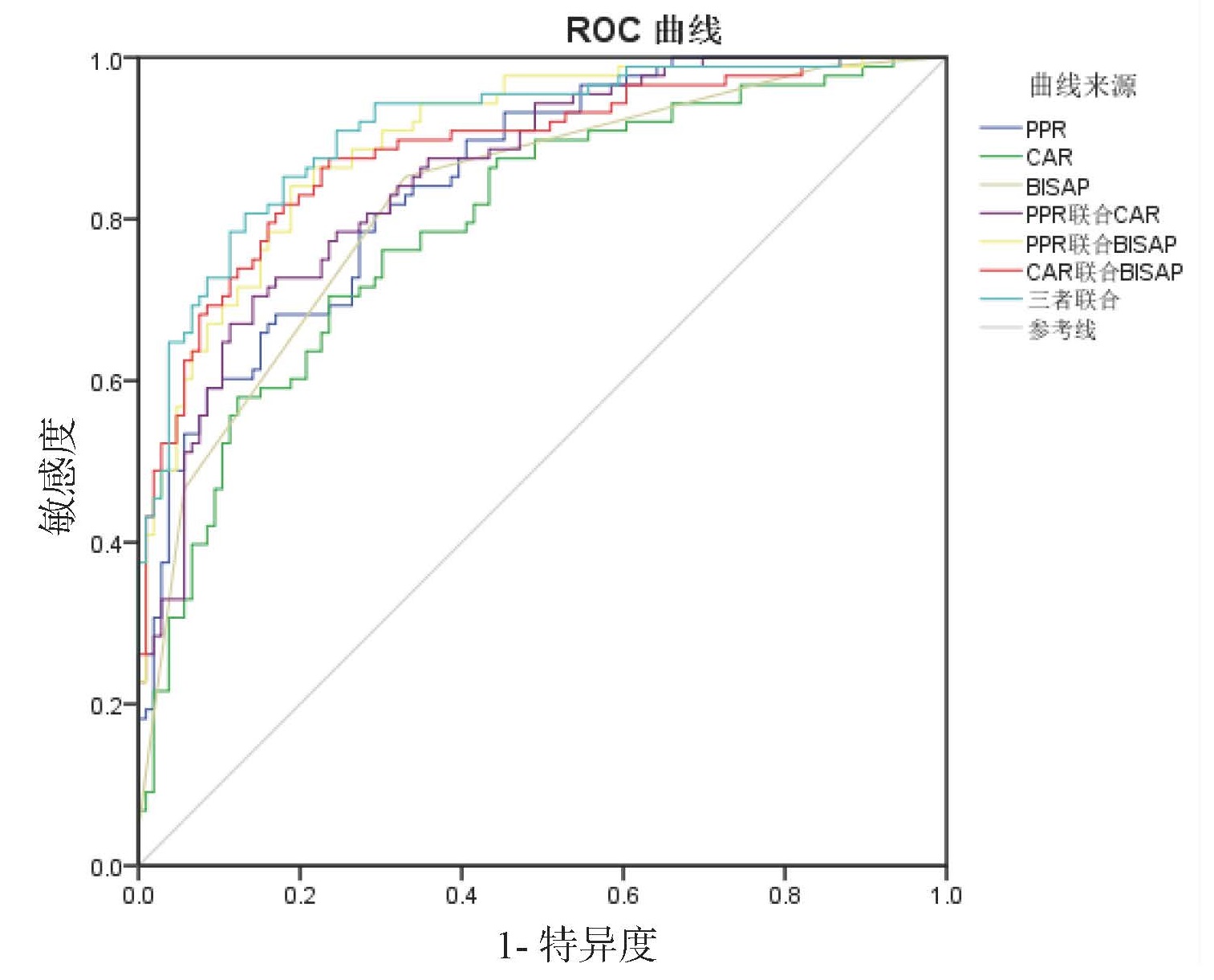
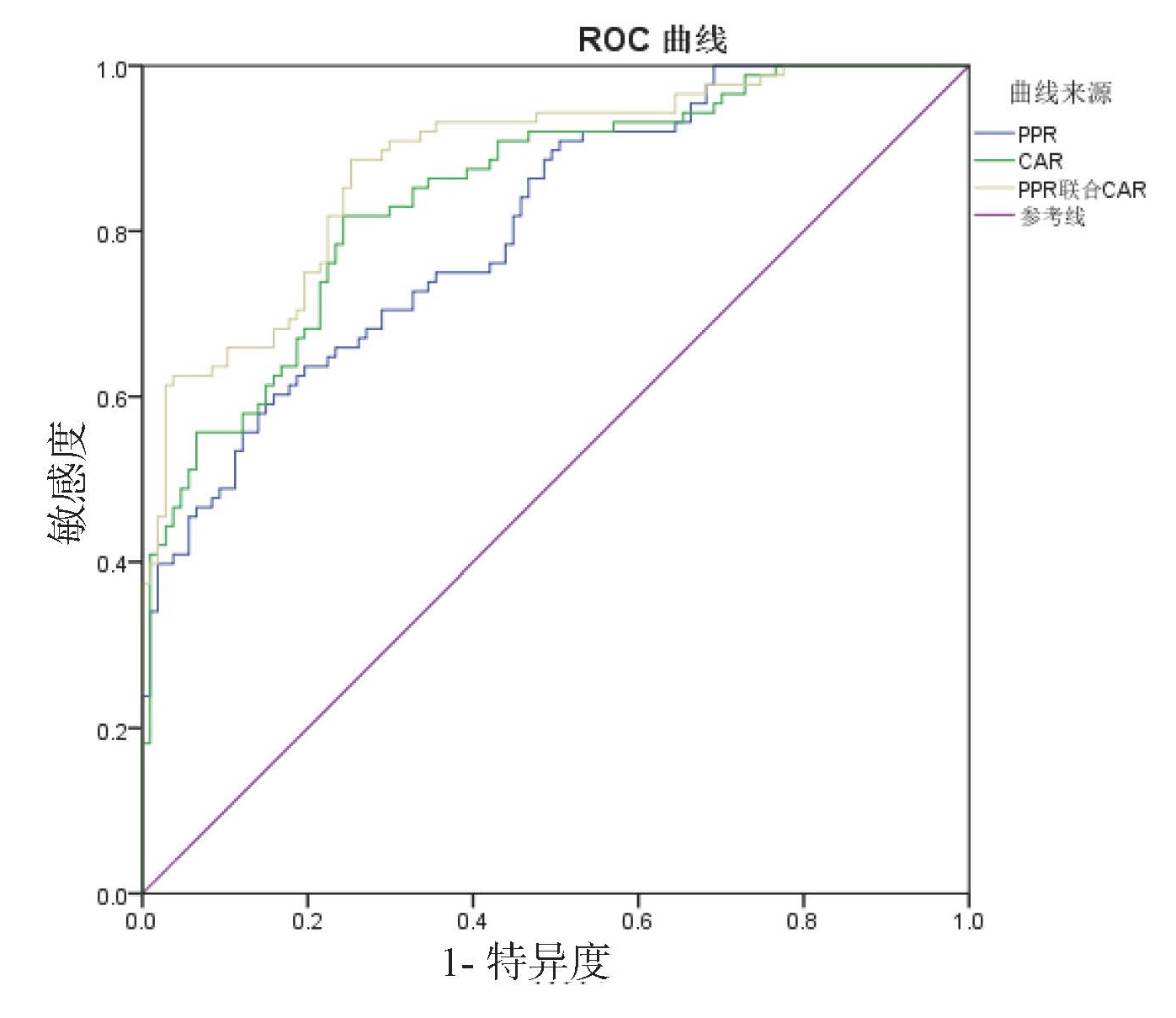
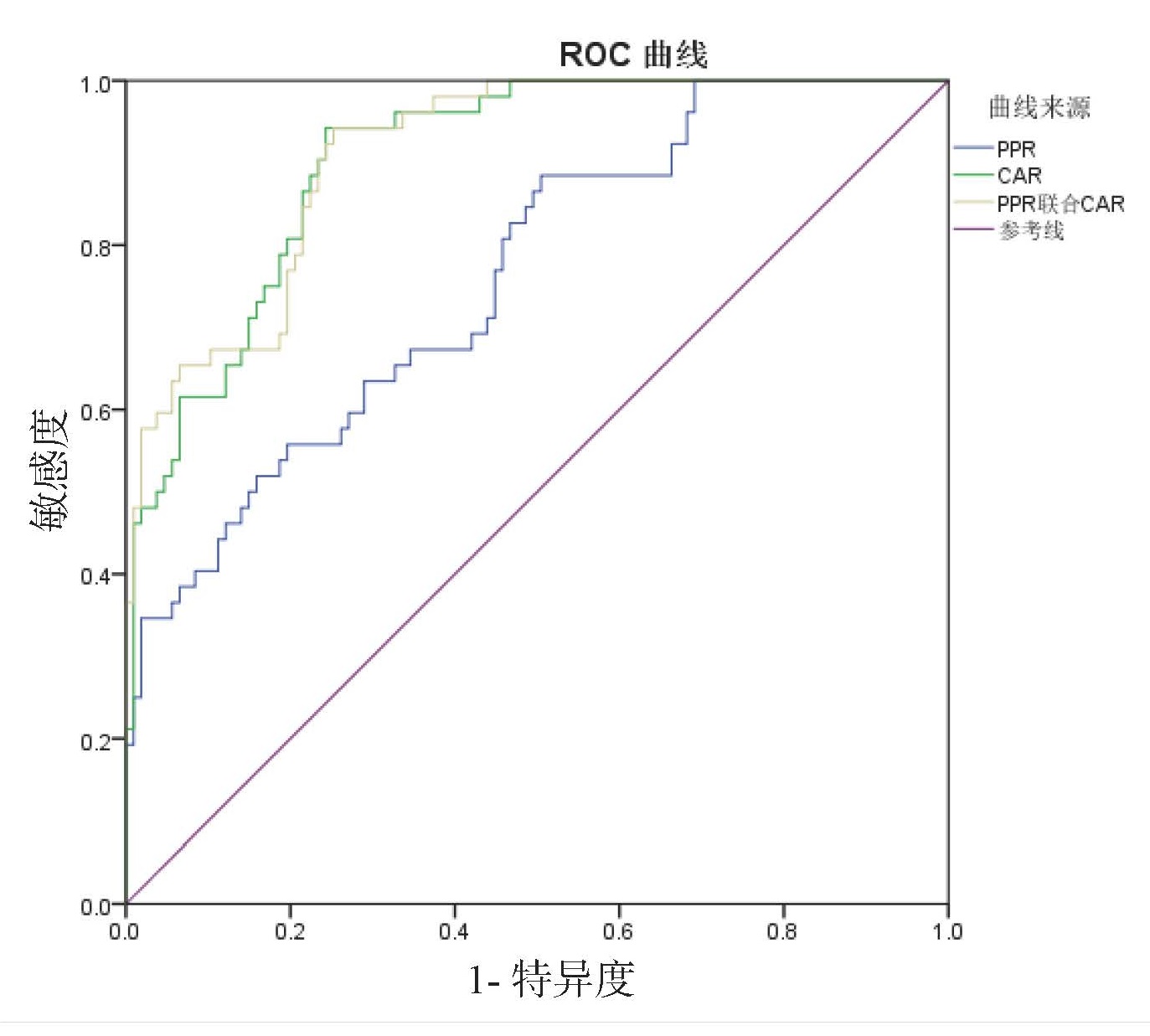
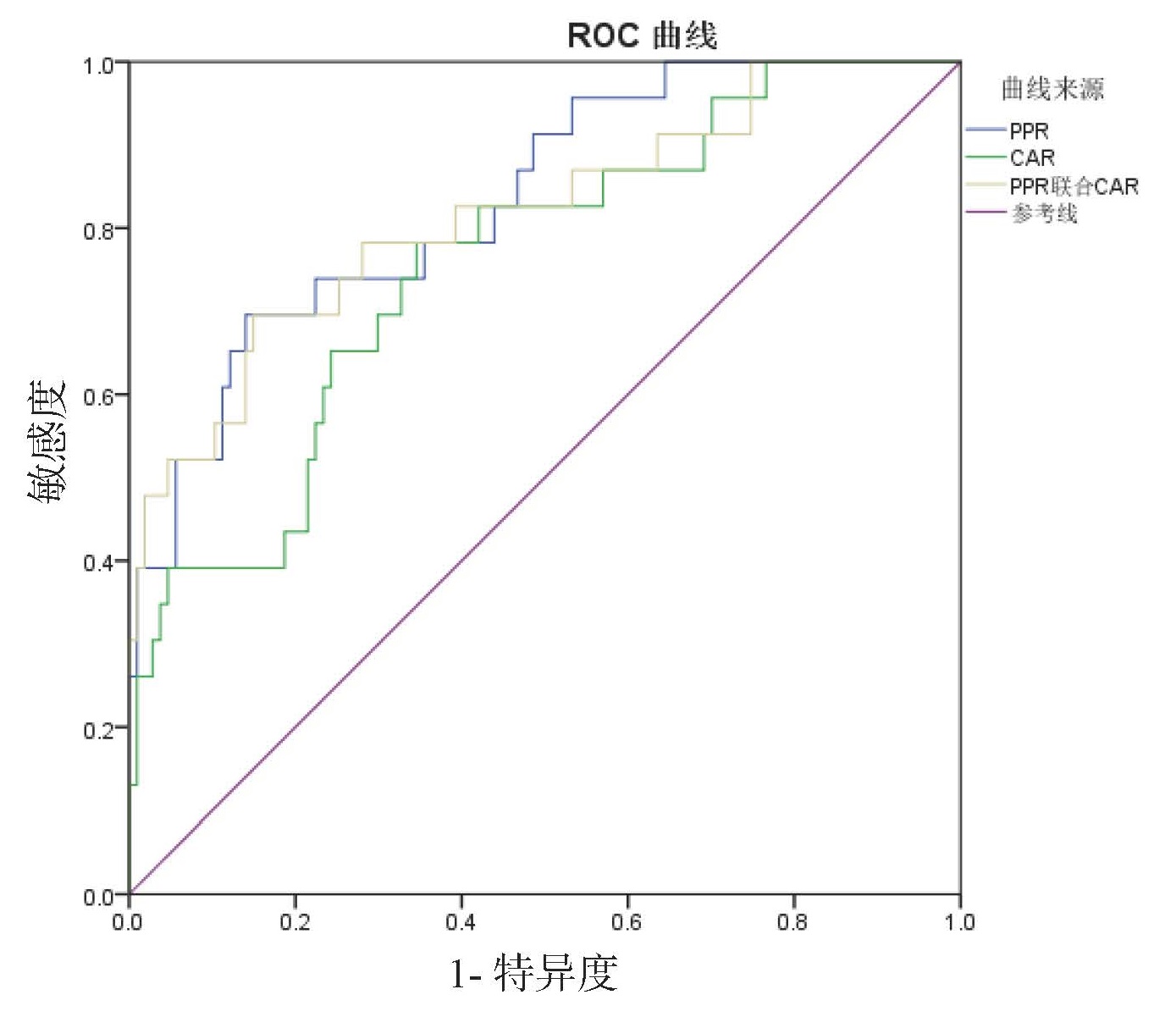
PPR、CAR及联合预测ALI的ROC曲线下面积分别为0.81、0.85、0.88;PPR、CAR及联合预测肝细胞型ALI的ROC曲线下面积分别为0.93、0.77、0.92;PPR、CAR及联合预测胆管细胞型ALI的ROC曲线下面积分别为0.76、0.91、0.91;PPR、CAR及联合预测混合型ALI的ROC曲线下面积分别为0.83、0.76、0.82。PPR对肝细胞型ALI和混合型ALI预测效能优于CAR,CAR对胆管型ALI预测效能优于PPR。见表 10、图 2、图 3、图 4、图 5。
| 指标 | AUC | 95% CI | 最佳截断值 | 约登指数 | 敏感度(%) | 特异度(%) |
| ALI | ||||||
| PPR | 0.81 | 0.75~0.87 | 6.93 | 0.443 | 0.602 | 0.841 |
| CAR | 0.85 | 0.79~0.90 | 3.45 | 0.575 | 0.818 | 0.757 |
| 二者联合 | 0.88 | 0.84~0.93 | 0.26 | 0.634 | 0.886 | 0.748 |
| 肝细胞型 | ||||||
| PPR | 0.93 | 0.87~0.99 | 4.83 | 0.689 | 0.923 | 0.766 |
| CAR | 0.77 | 0.60~0.93 | 7.85 | 0.559 | 0.615 | 0.944 |
| 二者联合 | 0.92 | 0.83~1.00 | 0.17 | 0.790 | 0.846 | 0.944 |
| 胆管型 | ||||||
| PPR | 0.76 | 0.68~0.84 | 0.97 | 0.380 | 0.885 | 0.495 |
| CAR | 0.91 | 0.86~0.95 | 3.45 | 0.699 | 0.94 | 0.757 |
| 二者联合 | 0.91 | 0.87~0.95 | 0.16 | 0.69 | 0.94 | 0.748 |
| 混合型 | ||||||
| PPR | 0.83 | 0.74~0.92 | 7.97 | 0.56 | 0.70 | 0.86 |
| CAR | 0.76 | 0.65~0.87 | 3.45 | 0.70 | 0.94 | 0.76 |
| 二者联合 | 0.82 | 0.71~0.92 | 0.16 | 0.69 | 0.94 | 0.75 |
|
| 图 2 PPR、CAR及二者联合预测ALI的ROC曲线 Fig 2 ROC curve of PPR, CAR and the combined tests for predicting ALI |
|
|
|
| 图 3 PPR、CAR及二者联合预测肝细胞型ALI的ROC曲线 Fig 3 ROC curve of PPR, CAR and the combined tests for predicting hepatocellular ALI |
|
|
|
| 图 4 PPR、CAR及二者联合预测胆管细胞型ALI的ROC曲线 Fig 4 ROC curve of PPR, CAR and the combined tests for predicting cholangiocytic ALI |
|
|
|
| 图 5 PPR、CAR及二者联合预测混合型ALI的ROC曲线 Fig 5 ROC curve of PPR, CAR and the combined tests for predicting mixed ALI |
|
|
AP病因和病理机制复杂,重症率及病死率高,是急诊科常见消化急症之一[10],早期快速、准确预测SAP的发生发展临床上具有重要意义。目前临床多采用不同评分系统来预测SAP,如BISAP评分、Ranson评分、APACHE Ⅱ评分等,但仍缺乏特异性SAP早期病情演变预测模型。AP发生时,大量炎性介质经门脉系统入肝导致肝损伤[4-5],肝损伤又可引发SIRS甚至MODS,产生不良后果。肝脏起到控制全身内毒素血症、菌血症和血管活性副产物的重要作用,与肝衰竭相关的SAP患者的病死率高达83%[11];尽早预测AP并发ALI有重要临床意义。
PCT升高是机体急性反应的重要特征,与多种炎症反应严重程度及不良预后密切相关[6]。PCT是检测AP最敏感的化验结果之一,特别是低水平的PCT是感染性坏死的强阴性预测因子[12]。研究证实AP发病3 d内PLT数量、大小及变异系数与病情严重程度密切相关[13],同时在ALI中,PLT可通过多种机制促进肝脏再生[14],还可通过与炎性巨噬细胞之间的podoplanin-CLEC2信号传导减少TNF-α的分泌和中性粒细胞募集,从而减轻炎症反应[15]。PPR作为PCT与PLT的比值,其升高对脓毒症心肌损伤具有预警价值[6],而在AP及相关ALI中发挥何作用鲜有报道;CRP是机体发挥固有免疫的重要因子,机体损伤或应激后,CRP水平迅速升高。相关研究证实CRP水平与SAP密切相关,是SAP的独立预测因素[16-18]。CRP与HBV所致肝损伤风险密切相关。CAR与2型糖尿病并发症风险紧密联系。入院时CAR升高与SAP进展、病死率的升高以及住院时间的延长呈正相关[7]。本研究发现:PPR和CAR升高是SAP发生的独立因素,同时也是AP并发ALI的独立因素;进一步研究提示PPR、CAR与BISAP评分具有相关性,即PPR和CAR随着BISAP评分的升高而升高。虽然CAR与BISAP评分指标均已有用于AP严重程度预测的相关研究,但尚无文献报道PPR对AP严重程度的早期预测价值;本研究首次将PPR与CAR分别联合BISAP评分来预测SAP,结果虽然提示PPR、CAR和BISAP评分三者联合诊断效能较单一指标及任两项指标联合检测更优,但较PPR联合BISAP评分无明显优势,显示PPR较CAR预测SAP更优。
PPR和CAR预测AP相关ALI具有一定意义。实验研究发现,经脂多糖刺激小鼠肝实质细胞诱导肝损伤时,观察到肝细胞经NF-κb促炎通路释放大量PCT,加剧炎症反应;又因急性肝损伤等可致PLT数量减少并功能受损,同时PLT可通过依赖肝细胞的PLT内化过程刺激肝细胞增殖修复[22],PLT数量与ALI严重程度密切相关,这些可能为PPR对AP相关肝细胞型和混合型ALI预测价值优于CAR的解释。胆源性肝损伤一种观点为免疫细胞介导的炎症反应而非胆汁淤滞对胆管细胞和肝实质细胞引起的直接毒性作用[5]。还有学者认为胆管细胞型肝损伤通常与胆汁淤积性肝病相关,而在肝脏中合成的CRP在胆管细胞型肝损伤中体现其炎症标志物的作用,CRP在急性和慢性胆汁淤积性肝病中显著升高,同时其可作为评估肝损伤严重程度与治疗效果的独立指标。本研究显示出CAR对AP相关胆管细胞型ALI预测价值优于PPR。
作者贡献声明 崔梦巍、何倩倩:数据分析、论文撰写;王海峰、李慧慧:数据收集;李继业、崔宗超:论文修改;王巧芳、陈三洋:研究设计;朱长举:技术支持、研究经费
利益冲突 所有作者均声明无利益冲突
| [1] | Zheng YM, Zhou Z, Li HC, et al. A multicenter study on etiology of acute pancreatitis in Beijing during 5 years[J]. Pancreas, 2015, 44(3): 409-414. DOI:10.1097/MPA.0000000000000273 |
| [2] | Chen HJ, Wang JJ, Tsay WI, et al. Epidemiology and outcome of acute pancreatitis in end-stage renal disease dialysis patients: a 10-year national cohort study[J]. Nephrol Dial Transplant, 2017: gfw400. DOI:10.1093/ndt/gfw400 |
| [3] | 刘玉兰, 王洋. 重症急性胰腺炎致肝损伤的诊断和治疗[J]. 中华消化杂志, 2019, 39(5): 292-294. DOI:10.3760/cma.j.issn.0254-1432.2019.05.002 |
| [4] | 王磊, 王兆伟, 徐志华. NLR对急性胰腺炎患者病情严重程度及肝损伤风险的预测价值[J]. 肝脏, 2022, 27(12) 1331-1334, 1339. DOI:10.14000/j.cnki.issn.1008-1704.2022.12.020 |
| [5] | 廖国豪, 程斌, 余红雨, 等. 中性粒细胞与淋巴细胞比值和血小板计数与淋巴细胞比值与胆源性急性胰腺炎严重程度及并发肝损伤的相关性研究[J]. 中国全科医学, 2022, 25(12): 1449-1454. DOI:10.12114/j.issn.1007-9572.2021.02.141 |
| [6] | 刘梦婷, 钟文宏, 文茵, 等. PCT/PLT比值对脓毒症心肌损伤的预警价值[J]. 中华急诊医学杂志, 2022, 31(8): 1071-1076. DOI:10.3760/cma.j.issn.1671-0282.2022.08.010 |
| [7] | Tarar MY, Khalid A, Choo XY, et al. Use of the C-reactive protein (CRP)/albumin ratio as a severity tool in acute pancreatitis: systematic review[J]. Cureus, 2022, 14(9): e29243. DOI:10.7759/cureus.29243 |
| [8] | 李非, 曹锋. 中国急性胰腺炎诊治指南(2021)[J]. 中国实用外科杂志, 2021, 41(7): 739-746. DOI:10.19538/j.cjps.issn1005-2208.2021.07.03 |
| [9] | Cai QX, Huang DL, Yu H, et al. COVID-19: Abnormal liver function tests[J]. J Hepatol, 2020, 73(3): 566-574. DOI:10.1016/j.jhep.2020.04.006 |
| [10] | 宋小静, 高伟波, 朱继红. 中性粒/淋巴细胞比率、血小板/淋巴细胞比率联合BISAP评分对于重症高三酰甘油血症性胰腺炎早期预测分析[J]. 中华急诊医学杂志, 2022, 31(9): 1193-1199. DOI:10.3760/cma.j.issn.1671-0282.2022.09.007 |
| [11] | Liu W, Du JJ, Li ZH, et al. Liver injury associated with acute pancreatitis: The current status of clinical evaluation and involved mechanisms[J]. World J Clin Cases, 2021, 9(34): 10418-10429. DOI:10.12998/wjcc.v9.i34.10418 |
| [12] | Silva-Vaz P, Abrantes AM, Castelo-Branco M, et al. Multifactorial scores and biomarkers of prognosis of acute pancreatitis: applications to research and practice[J]. Int J Mol Sci, 2020, 21(1): 338. DOI:10.3390/ijms21010338 |
| [13] | Mariyko VA, Shlyakhova MA, Mariyko AV. Platelet variation coefficient and its prognostic value in acute pancreatitis[J]. Khirurgiia, 2022(8): 38-44. DOI:10.17116/hirurgia202208138 |
| [14] | Groeneveld D, Cline-Fedewa H, Baker KS, et al. Von Willebrand factor delays liver repair after acetaminophen-induced acute liver injury in mice[J]. J Hepatol, 2020, 72(1): 146-155. DOI:10.1016/j.jhep.2019.09.030 |
| [15] | Morris SM, Chauhan A. The role of platelet mediated thromboinflammation in acute liver injury[J]. Front Immunol, 2022, 13: 1037645. DOI:10.3389/fimmu.2022.1037645 |
| [16] | Kaplan M, Ates I, Akpinar MY, et al. Predictive value of C-reactive protein/albumin ratio in acute pancreatitis[J]. Hepatobiliary Pancreat Dis Int, 2017, 16(4): 424-430. DOI:10.1016/S1499-3872(17)60007-9 |
| [17] | Cardoso FS, Ricardo LB, Oliveira AM, et al. C-reactive protein prognostic accuracy in acute pancreatitis: timing of measurement and cutoff points[J]. Eur J Gastroenterol Hepatol, 2013, 25(7): 784-789. DOI:10.1097/MEG.0b013e32835fd3f0 |
| [18] | 项和平, 李贺, 张长乐. C反应蛋白和胸腔积液在急性胰腺炎早期预后评估中的价值[J]. 中华急诊医学杂志, 2011, 20(8): 820-823. DOI:10.3760/cma.j.issn.1671-0282.2011.08.009 |
 2024, Vol. 33
2024, Vol. 33