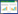近年来严重呼吸道传染性疾病频发,严重威胁人类健康。如2003年的严重急性呼吸综合征(severe acute respiratory syndrome, SARS)和2012年的中东呼吸综合征(Middle East respiratory syndrome, MERS)到2009年的新型甲型H1N1流感和2019年出现的新型冠状病毒肺炎(corona virus disease 2019, COVID-19)的全球大流行,已经成为国际关注的突发公共卫生事件(public health emergency of international concern, PHEIC)[1]。COVID-19在某一阶段时的某个器官的病毒载量与损害程度明确相关[2]。同时,流感病毒对机体的损害具有多系统性、持续性等特点。流感累及器官中比较重要的靶器官或目标人群,依重要性排列依次为:神经系统[3]、心脏[4-5]、呼吸系统[6]、孕产妇[7]、肌肉组织[8-9]。神经系统受损主要表现为脑膜炎、横贯性脊髓炎(包括格林-巴利综合征)[10]。孕产妇作为H1N1感染的高危人群,同样呈现出COVID-19的高危趋势[7]。肌肉损害主要表现为横纹肌溶解,也逐渐被认识到了属于病毒损害靶器官[9]。宿主面临感染的一个根本挑战是在清除病原体和维持组织功能之间能否取得平衡。强大的免疫反应可能会迅速清除病原体,但也会因为过度的炎症反应造成广泛的附带损害,进而损害宿主本身的免疫功能[9, 11]。
1 重新认识病毒感染并非一过性、自限性病毒作为一种具有传染性和非自主复制的生物体,存在于地球上生命的所有进化中。从天花到西班牙流感、艾滋病毒流行和SARS-CoV-2大流行,病毒和病毒感染对社会发展产生了重大影响[12]。新、旧病毒感染的出现和传播与人际关系的重大转变及自然环境的变化息息相关,更反映了人类社会中发生的环境、技术、人口和行为变化的影响。SARS-CoV-2流行相关封闭期间,常见呼吸道病毒感染的流行率短期有所下降。根据过去四个世纪发生的大规模流行病数据,以及与环境变化有关的动物宿主的疾病出现率不断上升等证据,有理由预测很有可能会促进病毒在以前被隔离的野生动物物种之间的共享,必将大大增加人畜共患疾病中溢出的可能性,尤其是在人口稠密地区[13],这似乎可以通过2023年至2024年初肆虐的流行病得到进一步的证实。
越来越多的证据表明,病毒感染并非以往认知的自限性疾病,病毒感染被控制了,但是病毒对机体的损伤仍在持续,甚至我们很可能远远低估了病毒对宿主的攻击力。一项研究通过采用多维度方法识别COVID-19感染带来的诸多相关后遗症[14],包括神经系统和神经认知障碍、精神健康障碍、代谢障碍、心血管疾病、胃肠疾病、疲劳、肌肉骨骼疼痛、脏器功能异常指标或贫血等表现。同时也观察到COVID -19之后使用更多的镇痛剂、镇静剂、降压或降糖药物的证据。该研究结果表明,在COVID-19急性期后存活的患者经历了跨越肺部和诸多肺外器官系统的损伤表现[15-18]。研究发现病毒感染对免疫系统、代谢性疾病均有不同程度的影响,现有研究证据更多的是病毒感染与代谢性疾病之间存在双向互为因果的关系[19]。糖尿病作为威胁人类生命的第九大死亡原因[20],通常会认为糖尿病患者本身就是各种病原体感染的易感人群甚至成为严重感染的高危人群,但是我们忽视了病毒对胰岛细胞的损伤在病毒转阴之后依然持续存在,不但会加剧血糖的代谢紊乱,还会进一步增加缺血性心脏病、中风、慢性阻塞性肺部疾病和肾病的风险[21-22]。越来越多的研究证明在SARS-CoV-2流行的早期,代谢性疾病与SARS-CoV-2严重程度和病死率之间存在明确的相关性[21-22]。
2 病毒感染对代谢性疾病的影响机制病毒对机体的影响在病毒清除后仍然存在,并且会导致持续不可逆器官功能损害。COVID-19作为近3年流行性疾病的病原,对代谢性疾病的影响有了更多的证据。表现为大大增加了代谢疾病的发生率,如糖尿病(HR 8.2)、肥胖(HR 9.5)、血脂异常(HR 9 ~10)和心血管疾病(HR从心力衰竭的3.9上升到高血压的15.2)等[14, 23-24]。研究表明,病毒是通过影响重要的细胞功能来加剧代谢性疾病的进展。例如,病毒可以调节细胞存活和内分泌、代谢器官中的细胞死亡、增殖、生成或去分化相关的特定途径[25-26]。病毒还可以通过操纵细胞的分子(如miRNAs、干扰素和脂肪细胞因子) 释放,影响受感染细胞和远端细胞的功能,参与葡萄糖或能量体内平衡[25, 27-29]。流行病学研究显示,伴有代谢性疾病的患者发生严重COVID-19的风险增加,新发糖尿病和糖尿病酮症酸中毒的发生率增加[21-24],甚至新发糖尿病的风险增加11%~276%之间[30]。发病风险取决于研究人群的年龄、感染的临床病程及其严重程度、风险评估的时间等因素[30-31]。病毒产生多肽与内源性免疫调节剂具有同源性蛋白质、生长因子、或者激素都可以产生拮抗、交叉反应或对抗宿主蛋白质的影响,进而影响细胞的代谢和生存[27-28, 32-34],见图 1。
|
| 实线箭头代表的是病毒对相应器官或代谢影响;虚线代表病毒对糖代谢影响形成恶行循环的潜在机制。 图 1 病毒感染时可以侵袭机体多个系统并持续存在对机体造成的潜在影响(以糖尿病为例)(引自医脉通) |
|
|
可以通过以下3种假说来解释上述机制:第一种假说,病毒可能会持续感染或在器官、组织中遗留非感染性抗原,这些抗原将作为慢性病原体储存库。这些病原体或病原体残留物可能对常规检测方法产生逃逸,但仍然能够诱导慢性亚临床炎症。病毒感染也可能导致自身抗体的产生,影响内分泌和代谢功能,并从最初的感染开始存在相当长的延迟现象[25, 28, 32];第二种假说,训练有素的先天免疫可能在病毒感染对新陈代谢的慢性影响中发挥作用。具体来说,微生物感染或其他非微生物性炎症刺激,引起先天免疫细胞和骨髓祖细胞(包括造血干细胞和祖细胞) 持续的表观遗传和代谢变化[35-38];第三种假说,部分病毒(如流感病毒、肠道病毒、SARS-CoV-2和艾滋病毒) 的变化(生态失调) 和肠道功能障碍有关,这可能会损害机体未来对炎症抗衡和继发性感染的反应。
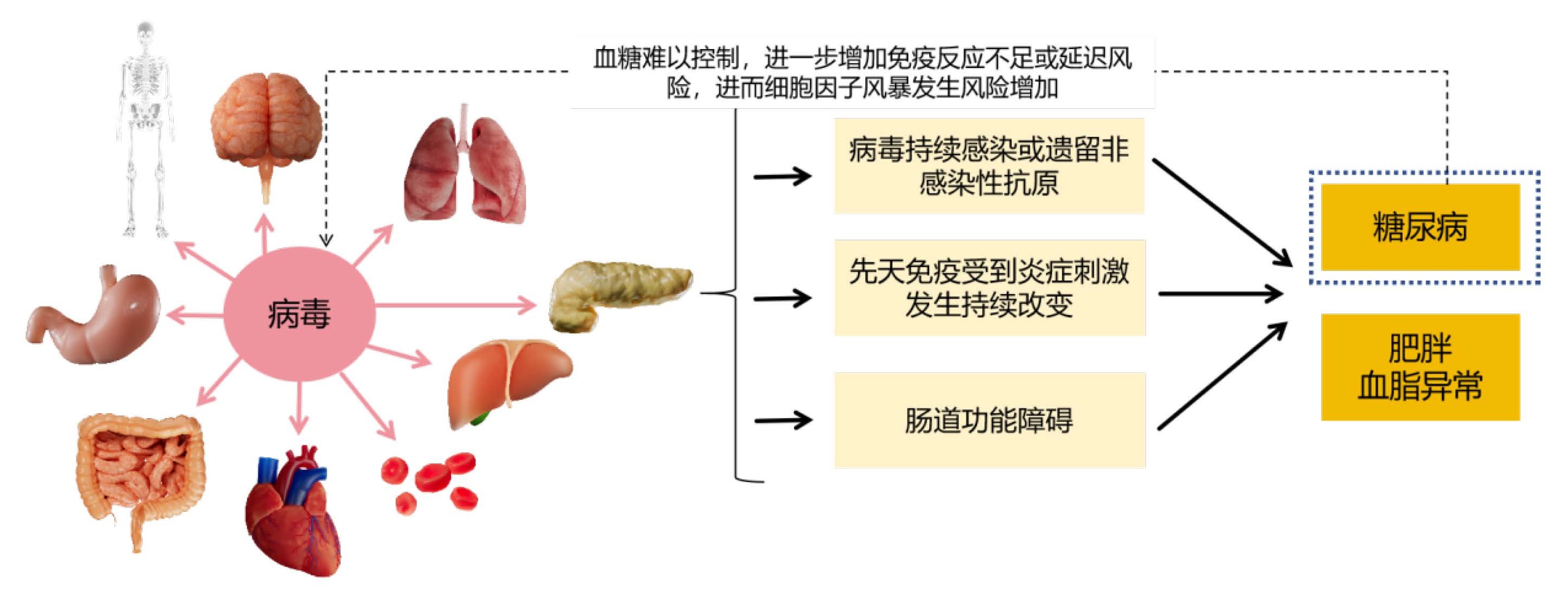
研究发现在肥胖、2型糖尿病和非酒精性脂肪性肝病中出现了与疾病进展有关的代谢紊乱[31, 39-40]。部分病毒通过口腔-粪便途径传播,它们可以与免疫细胞相互作用并到达胰腺,特异性感染胰腺β细胞[41]。在不同的病毒中,肠道病毒与1型糖尿病的流行病学联系最强。尤其是肠病毒A[42]、埃可病毒、脊髓灰质炎病毒、柯萨奇病毒A和柯萨奇病毒B等[43]。埃可病毒(血清型3、4、6、9、16和30)和柯萨奇病毒B (CVB;特别是血清型CVB1和CVB4) 与1型糖尿病密切相关[41]。丙型肝炎病毒(HCV)感染与2型糖尿病发病风险增加相关[优势比(OR) 1.8]。HCV通过自身调节葡萄糖转运蛋白的表达来减少肝脏从循环中摄取葡萄糖。此外,HCV通过增加IRS-1和IRS-2降解抑制PI3K/Akt通路,从而直接损害胰岛素信号传导。此外,HCV可能降低胰岛素受体的表达,增加糖异生基因的表达。HCV感染也与严重的外周胰岛素抵抗有关[44-45],推测肝功能障碍改变了循环miRNAs的特征,从而降低了脂肪和肌肉组织的胰岛素敏感性[39]。新型高效直接作用抗病毒药物,在消除HCV时表现出的对葡萄糖稳态的改善,进一步证实了HCV对葡萄糖稳态的显著影响[46]。同时,可以通过清除HCV后,胰岛素敏感性和分泌以及血糖控制得到改善来证实。更为重要的是,2型糖尿病发病和进展的风险明显降低[47-48],见图 2。
|
| 实线箭头代表HCV病毒通过对不同器官或组织代谢的影响;虚线代表胰腺受损之后对上述反应应激的非同步导致的代谢进一步紊乱的可能机制。 图 2 病毒感染后对机体血糖调节系统的影响(乙肝病毒感染为例)(引自医脉通) |
|
|
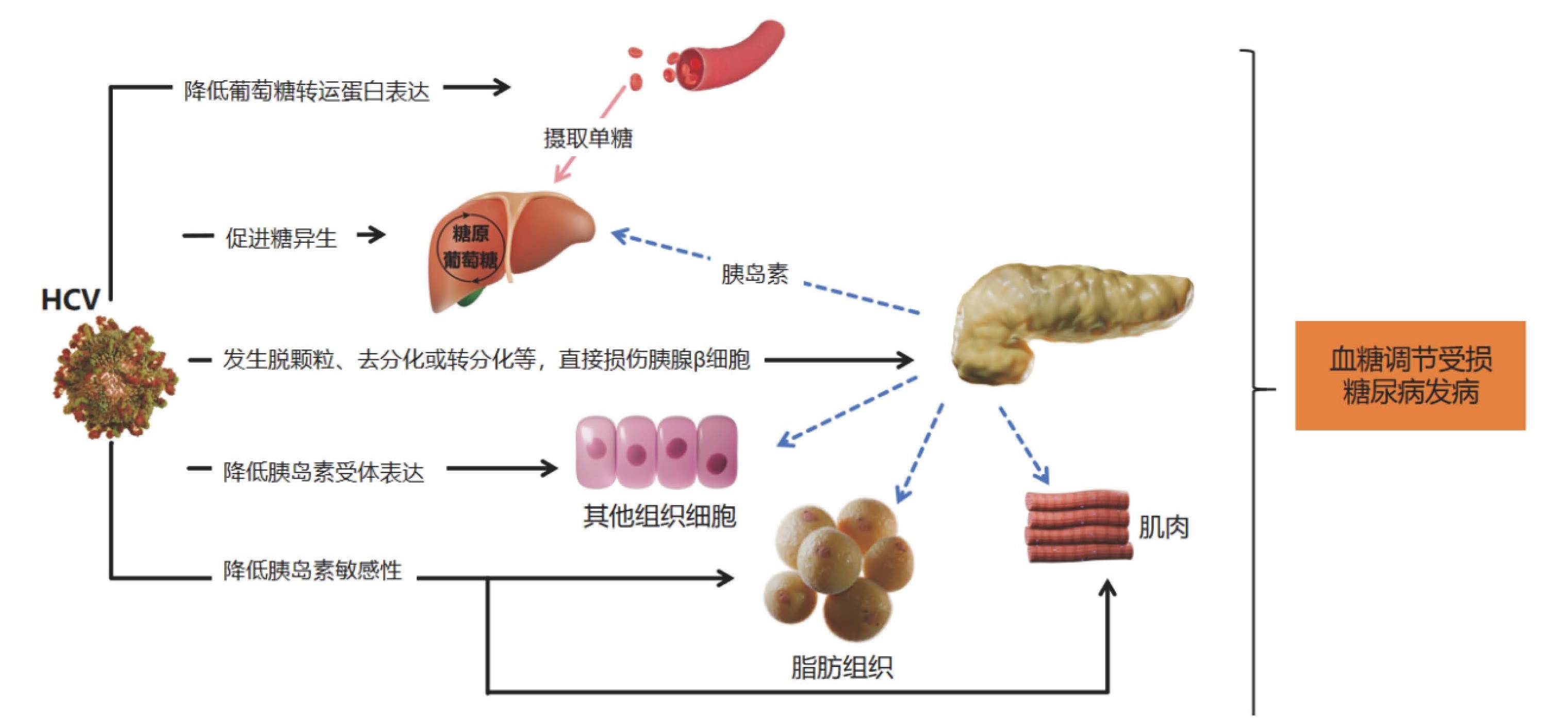
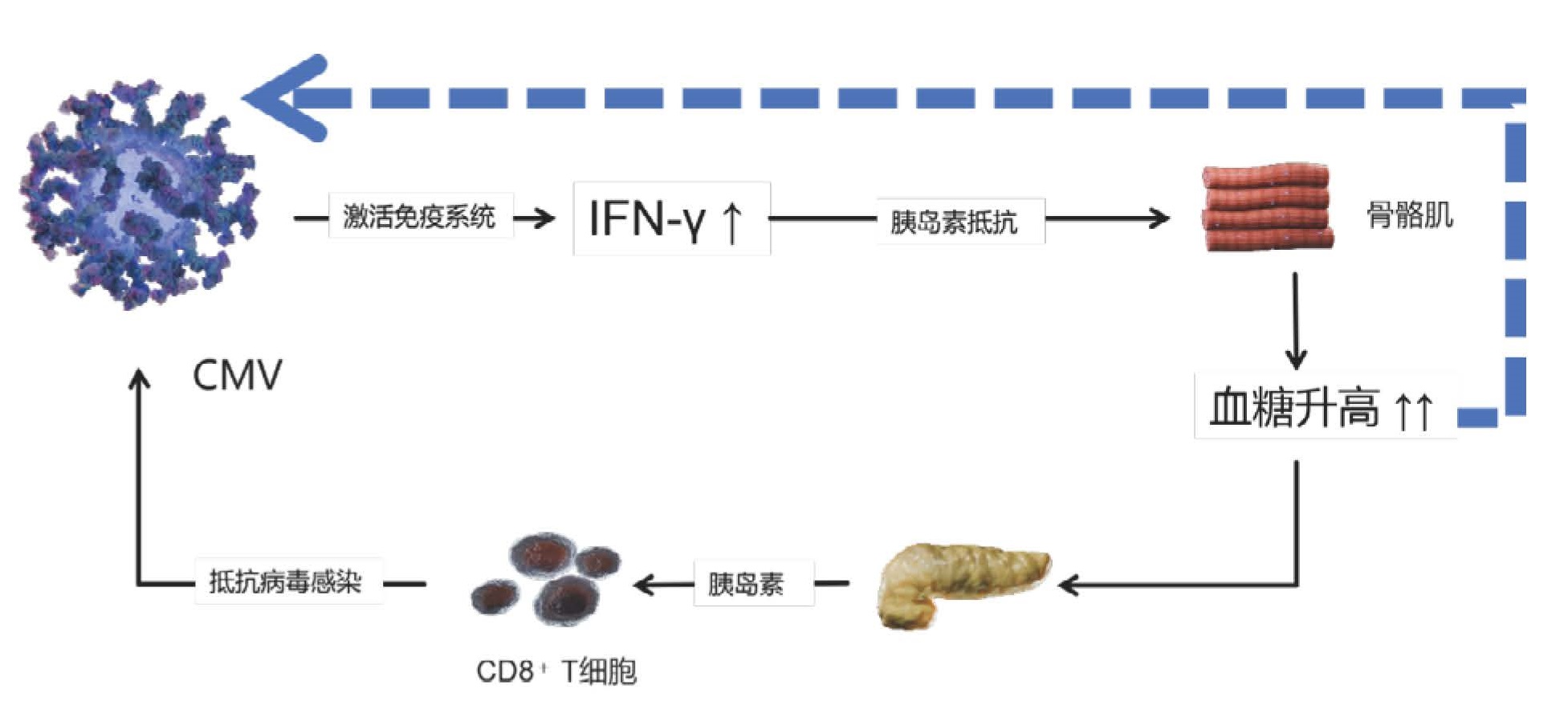
一项为期6.5年的大型队列研究发现,在校正多项混杂因素后,单纯疱疹病毒2 (HSV-2)和巨细胞病毒(CMV) 血清阳性与糖尿病前期或糖尿病发病率相关(HSV-2 OR 1.59,CMV OR 1.33)[49]。HSV-2的血清状态与HbA1c呈正相关,且证实HSV-2的基线血清患病率为11%,CMV的基线血清患病率为46%。普通病毒对人体代谢具有重要的慢性影响,因此促进了代谢性疾病的发生或进展。研究[50]显示,呼吸道感染与短暂的血浆胰岛素升高有关,但不影响空腹血糖,推测存在胰岛素抵抗。动物研究发现,巨细胞病毒感染诱导的IFN-γ导致骨骼肌中胰岛素受体的下调和胰岛素分泌的代偿性增加,巨细胞病毒诱导的高胰岛素血症直接刺激CD8+效应T细胞功能,从而以牺牲血糖控制为代价促进抗病毒免疫(图 3所示)。而在感染巨细胞病毒的肥胖小鼠中,由于胰岛素抵抗的进一步加重,血糖控制能力丧失[50]。
|
| 实线箭头代表机体抵抗病毒感染的机制。但是可能会最终以加重代谢紊乱,牺牲了血糖明显升高进而增加病毒感染可能性为代价(虚线箭头所示)。 图 3 病毒感染后对机体的影响(CMV为例)(引自医脉通) |
|
|
上述有害的双向关系的程度和临床相关性,也存在不同的结果[19]。研究证实β细胞存在SARS-CoV-2感染,与脱颗粒、胰岛素分泌受损、去分化或转分化以及细胞死亡有关[26, 51-52]。然而与其他组织相比,胰腺中SARS-CoV-2 mRNA的检测量很小,时间也很短。因此,尚不能完全解释新发糖尿病患者数量较高的原因[53]。SARS-CoV-2具有广泛的组织亲和性,表明其他内分泌器官可能导致代谢失调。例如,脂肪细胞也会受到病毒的攻击,脂肪组织作为一个病毒库可以在很长一段时间内,因过度产生促炎细胞因子和浸润性巨噬细胞而加剧病情进展[54]。生活方式的改变导致体重增加、各种原因导致的不能及时就医等原因,进一步加剧了那些原已存在的异常或边缘性代谢状态,甚至因脂肪分解和循环游离脂肪酸增加出现急诊患者的应激性高血糖[21-22]。通常用于治疗COVID-19感染的类固醇等药物,也不可避免地成为诱发或进一步加重高血糖的重要因素。需要强调的是,还需要更多的数据来证实目前观察到的COVID-19感染(和其他感染)与代谢性疾病之间的双向关联的潜在机制。
3 代谢性疾病遭遇病毒感染后的免疫反应及代谢性疾病相关药物在保护或加剧严重病毒感染中的作用代谢疾病中免疫系统功能的受损使患者对病毒感染的免疫反应不足和延迟,随后发生细胞因子风暴的风险增加。研究发现2型糖尿病患者的中性粒细胞趋化性和吞噬功能、自然杀伤细胞均表现为活性降低,而巨噬细胞在脂肪组织中积聚形成促炎的表型[55]。病毒感染相关的高血糖可能会成为糖尿病诱导记忆性CD8 T细胞功能障碍的重要媒介[56]。与胰岛素敏感性正常的人相比,胰岛素抵抗的人群在呼吸道病毒感染后表现出延迟的免疫反应[57]。肥胖患者脂肪组织中的自然杀伤T细胞数量减少,而在脂肪组织中B细胞数量增加并分泌更多的促炎细胞因子[58]。此外,在肥胖小鼠模型中,流感病毒感染由于氧化应激导致T细胞功能受损,导致TNF-α降低,IFN-γ产生降低,B细胞反应不足[59-60]。上述改变最终会导致感染后免疫反应延迟和受损,使得病毒复制更快、病毒脱落时间更长、肺组织损伤更大、病死率更高甚至导致更强毒性流感病毒群的出现[61]。在肥胖和SARS-CoV-2患者中,脂肪组织产生的高瘦素和IL-6可能会增加细胞因子风暴的风险。研究发现可能是通过HIF-1a或糖酵解依赖机制,进而降低T细胞和单核细胞功能[62-64]。
常用于治疗代谢性疾病的药物可能会对病毒感染有什么样的影响?COVID-19期间,2型糖尿病患者入院前使用二甲双胍、GLP-1RA和SGLT2i往往会有更高的病死率,尚未证实入院前使用磺脲类、噻唑烷二酮类或α -葡萄糖苷酶抑制剂与病死率的关系[39]。一项Ⅲ期临床试验显示,超重或肥胖的人群在确诊COVID-19感染3 d内给予二甲双胍尚不能预防疾病的严重进展,但在随访10个月期间后,二甲双胍将COVID-19后病情严重程度的发生率降低了42%[65]。他汀类药物的使用与降低COVID-19的全因病死率相关[66],并对艾滋病毒和丙型肝炎病毒感染的肝损伤具有保护作用[67]。此外,感染期间常用的抗生素、抗病毒药物、免疫调节药物、镇痛药等药物可进一步加重代谢性疾病及其相关的不良反应。尤其是被广泛用于COVID-19的地塞米松等糖皮质激素可加剧高血糖或导致新发糖尿病甚至高渗状态的风险[68]。
4 未来与展望随着对病毒特征的深入了解及病毒感染对机体的持续影响的研究,我们不得不重新认识病毒感染远绝非一过性或自限性疾病的事实,极大可能存在着病毒性感染与代谢性疾病之间的双向甚至因果关系。远不仅如此,未来还需要更多研究去证实病毒类型或代谢表型相关的信息、感染对代谢性疾病的急性期和远期的影响、挖掘可能会降低代谢性疾病发展和恶化风险等潜在因素、探索代谢性疾病患者严重感染风险的最佳预防或治疗措施。
利益冲突 所有作者声明无利益冲突
| [1] | Shang LH, Xu JY, Cao B. Viral pneumonia in China: from surveillance to response[J]. Lancet Public Health, 2020, 5(12): e633-e634. DOI:10.1016/S2468-2667(20)30264-4 |
| [2] | Kain T, Fowler R. Preparing intensive care for the next pandemic influenza[J]. Crit Care, 2019, 23(1): 337. DOI:10.1186/s13054-019-2616-1 |
| [3] | Taga A, Lauria G. COVID-19 and the peripheral nervous system. A 2-year review from the pandemic to the vaccine era[J]. J Peripher Nerv Syst, 2022, 27(1): 4-30. DOI:10.1111/jns.12482 |
| [4] | Lippi G, Sanchis-Gomar F. Cardiac troponin elevation in patients with influenza virus infections[J]. Biomed J, 2021, 44(2): 183-189. DOI:10.1016/j.bj.2020.06.001 |
| [5] | Chow EJ, Rolfes MA, O'Halloran A, et al. Acute cardiovascular events associated with influenza in hospitalized adults: a cross-sectional study[J]. Ann Intern Med, 2020, 173(8): 605-613. DOI:10.7326/M20-1509 |
| [6] | Kalil AC, Thomas PG. Influenza virus-related critical illness: pathophysiology and epidemiology[J]. Crit Care, 2019, 23(1): 258. DOI:10.1186/s13054-019-2539-x |
| [7] | Flerlage T, Boyd DF, Meliopoulos V, et al. Influenza virus and SARS-CoV-2: pathogenesis and host responses in the respiratory tract[J]. Nat Rev Microbiol, 2021, 19(7): 425-441. DOI:10.1038/s41579-021-00542-7 |
| [8] | Jacob S, Kapadia R, Soule T, et al. Neuromuscular complications of SARS-CoV-2 and other viral infections[J]. Front Neurol, 2022, 13: 914411. DOI:10.3389/fneur.2022.914411 |
| [9] | Papazian L, Klompas M, Luyt CE. Ventilator-associated pneumonia in adults: a narrative review[J]. Intensive Care Med, 2020, 46(5): 888-906. DOI:10.1007/s00134-020-05980-0 |
| [10] | Grisanti SG, Franciotta D, Garnero M, et al. A case series of parainfectious Guillain-Barré syndrome linked to influenza A (H1N1) virus infection[J]. J Neuroimmunol, 2021, 357: 577605. DOI:10.1016/j.jneuroim.2021.577605 |
| [11] | Torres A, Loeches IM, Sligl W, et al. Severe flu management: a point of view[J]. Intensive Care Med, 2020, 46(2): 153-162. DOI:10.1007/s00134-019-05868-8 |
| [12] | Koonin EV, Senkevich TG, Dolja VV. The ancient Virus World and evolution of cells[J]. Biol Direct, 2006, 1: 29. DOI:10.1186/1745-6150-1-29 |
| [13] | Carlson CJ, Albery GF, Merow C, et al. Climate change increases cross-species viral transmission risk[J]. Nature, 2022, 607(7919): 555-562. DOI:10.1038/s41586-022-04788-w |
| [14] | Al-Aly Z, Xie Y, Bowe B. High-dimensional characterization of post-acute sequelae of COVID-19[J]. Nature, 2021, 594(7862): 259-264. DOI:10.1038/s41586-021-03553-9 |
| [15] | Raman B, Bluemke DA, Lüscher TF, et al. Long COVID: post-acute sequelae of COVID-19 with a cardiovascular focus[J]. Eur Heart J, 2022, 43(11): 1157-1172. DOI:10.1093/eurheartj/ehac031 |
| [16] | Chow EJ, Uyeki TM, Chu HY. The effects of the COVID-19 pandemic on community respiratory virus activity[J]. Nat Rev Microbiol, 2023, 21(3): 195-210. DOI:10.1038/s41579-022-00807-9 |
| [17] | Copur S, Berkkan M, Basile C, et al. Post-acute COVID-19 syndrome and kidney diseases: what do we know?[J]. J Nephrol, 2022, 35(3): 795-805. DOI:10.1007/s40620-022-01296-y |
| [18] | Choutka J, Jansari V, Hornig M, et al. Unexplained post-acute infection syndromes[J]. Nat Med, 2022, 28(5): 911-923. DOI:10.1038/s41591-022-01810-6 |
| [19] | Laurenzi A, Caretto A, Molinari C, et al. No evidence of long-term disruption of glycometabolic control after SARS-CoV-2 infection[J]. J Clin Endocrinol Metab, 2022, 107(3): e1009-e1019. DOI:10.1210/clinem/dgab792.[PubMed |
| [20] | WHO. The top 10 causes of death[EB/OL]. (2022-11-10) https://www.who. int/news-room/fact-sheets/detail/the-top-10-causes-of-death. |
| [21] | Hartmann-Boyce J, Rees K, Perring JC, et al. Risks of and from SARS-CoV-2 infection and COVID-19 in people with diabetes: a systematic review of reviews[J]. Diabetes Care, 2021, 44(12): 2790-2811. DOI:10.2337/dc21-0930 |
| [22] | Khunti K, Valabhji J, Misra S. Diabetes and the COVID-19 pandemic[J]. Diabetologia, 2023, 66(2): 255-266. DOI:10.1007/s00125-022-05833-z |
| [23] | Xie Y, Al-Aly Z. Risks and burdens of incident diabetes in long COVID: a cohort study[J]. Lancet Diabetes Endocrinol, 2022, 10(5): 311-321. DOI:10.1016/S2213-8587(22)00044-4 |
| [24] | Xu E, Xie Y, Al-Aly Z. Risks and burdens of incident dyslipidaemia in long COVID: a cohort study[J]. Lancet Diabetes Endocrinol, 2023, 11(2): 120-128. DOI:10.1016/S2213-8587(22)00355-2 |
| [25] | Girdhar K, Powis A, Raisingani A, et al. Viruses and metabolism: the effects of viral infections and viral insulins on host metabolism[J]. Annu Rev Virol, 2021, 8(1): 373-391. DOI:10.1146/annurev-virology-091919-102416 |
| [26] | Tang XM, Uhl S, Zhang T, et al. SARS-CoV-2 infection induces beta cell transdifferentiation[J]. Cell Metab, 2021, 33(8): 1577-1591.e7. DOI:10.1016/j.cmet.2021.05.015 |
| [27] | Chrudinová M, Moreau F, Noh HL, et al. Characterization of viral insulins reveals white adipose tissue-specific effects in mice[J]. Mol Metab, 2021, 44: 101121. DOI:10.1016/j.molmet.2020.101121 |
| [28] | Petzold A, Solimena M, Knoch KP. Mechanisms of beta cell dysfunction associated with viral infection[J]. Curr Diab Rep, 2015, 15(10): 73. DOI:10.1007/s11892-015-0654-x |
| [29] | Amako Y, Munakata T, Kohara M, et al. Hepatitis C virus attenuates mitochondrial lipid β-oxidation by downregulating mitochondrial trifunctional-protein expression[J]. J Virol, 2015, 89(8): 4092-4101. DOI:10.1128/JVI.01653-14 |
| [30] | Harding JL, Oviedo SA, Ali MK, et al. The bidirectional association between diabetes and long-COVID-19 - A systematic review[J]. Diabetes Res Clin Pract, 2023, 195: 110202. DOI:10.1016/j.diabres.2022.110202 |
| [31] | Bouzoni E, Perakakis N, Connelly MA, et al. PCSK9 and ANGPTL3 levels correlate with hyperlipidemia in HIV-lipoatrophy, are regulated by fasting and are not affected by leptin administered in physiologic or pharmacologic doses[J]. Metabolism, 2022, 134: 155265. DOI:10.1016/j.metabol.2022.155265 |
| [32] | de Beeck AO, Eizirik DL. Viral infections in type 1 diabetes mellitus: why the β cells?[J]. Nat Rev Endocrinol, 2016, 12(5): 263-273. DOI:10.1038/nrendo.2016.30 |
| [33] | Moreau F, Kirk NS, Zhang F, et al. Interaction of a viral insulin-like peptide with the IGF-1 receptor produces a natural antagonist[J]. Nat Commun, 2022, 13(1): 6700. DOI:10.1038/s41467-022-34391-6 |
| [34] | Belavgeni A, Maremonti F, Tonnus W, et al. vPIF-1 is an insulin-like antiferroptotic viral peptide[J]. Proc Natl Acad Sci U S A, 2023, 120(21): e2300320120. DOI:10.1073/pnas.2300320120 |
| [35] | Chavakis T, Wielockx B, Hajishengallis G. Inflammatory modulation of hematopoiesis: linking trained immunity and clonal hematopoiesis with chronic disorders[J]. Annu Rev Physiol, 2022, 84: 183-207. DOI:10.1146/annurev-physiol-052521-013627 |
| [36] | Li XF, Wang H, Yu X, et al. Maladaptive innate immune training of myelopoiesis links inflammatory comorbidities[J]. Cell, 2022, 185(10): 1709-1727.e18. DOI:10.1016/j.cell.2022.03.043 |
| [37] | Penkov S, Mitroulis I, Hajishengallis G, et al. Immunometabolic crosstalk: an ancestral principle of trained immunity?[J]. Trends Immunol, 2019, 40(1): 1-11. DOI:10.1016/j.it.2018.11.002 |
| [38] | Divangahi M, Aaby P, Khader SA, et al. Trained immunity, tolerance, priming and differentiation: distinct immunological processes[J]. Nat Immunol, 2021, 22(1): 2-6. DOI:10.1038/s41590-020-00845-6 |
| [39] | Nguyen NN, Ho DS, Nguyen HS, et al. Preadmission use of antidiabetic medications and mortality among patients with COVID-19 having type 2 diabetes: a meta-analysis[J]. Metabolism, 2022, 131: 155196. DOI:10.1016/j.metabol.2022.155196 |
| [40] | Polyzos SA, Perakakis N, Mantzoros CS. Fatty liver in lipodystrophy: a review with a focus on therapeutic perspectives of adiponectin and/or leptin replacement[J]. Metabolism, 2019, 96: 66-82. DOI:10.1016/j.metabol.2019.05.001 |
| [41] | Carré A, Vecchio F, Flodström-Tullberg M, et al. Coxsackievirus and type 1 diabetes: diabetogenic mechanisms and implications for prevention[J]. Endocr Rev, 2023, 44(4): 737-751. DOI:10.1210/endrev/bnad007 |
| [42] | Ylipaasto P, Klingel K, Lindberg AM, et al. Enterovirus infection in human pancreatic islet cells, islet tropism in vivo and receptor involvement in cultured islet beta cells[J]. Diabetologia, 2004, 47(2): 225-239. DOI:10.1007/s00125-003-1297-z |
| [43] | Nekoua MP, Alidjinou EK, Hober D. Persistent coxsackievirus B infection and pathogenesis of type 1 diabetes mellitus[J]. Nat Rev Endocrinol, 2022, 18(8): 503-516. DOI:10.1038/s41574-022-00688-1 |
| [44] | Singhal A, Agrawal A, Ling J. Regulation of insulin resistance and type Ⅱ diabetes by hepatitis C virus infection: a driver function of circulating miRNAs[J]. J Cell Mol Med, 2018, 22(4): 2071-2085. DOI:10.1111/jcmm.13553 |
| [45] | Vanni E, Abate ML, Gentilcore E, et al. Sites and mechanisms of insulin resistance in nonobese, nondiabetic patients with chronic hepatitis C[J]. Hepatology, 2009, 50(3): 697-706. DOI:10.1002/hep.23031 |
| [46] | Chen JZ, Wang F, Zhou Y, et al. Chronic hepatitis C virus infection impairs insulin secretion by regulation of p38δ MAPK-dependent exocytosis in pancreatic β-cells[J]. Clin Sci, 2020, 134(5): 529-542. DOI:10.1042/CS20190900 |
| [47] | Cheng CH, Chu CY, Chen HL, et al. Virus elimination by direct-acting antiviral agents impacts glucose homeostasis in chronic hepatitis C patients[J]. Front Endocrinol, 2021, 12: 799382. DOI:10.3389/fendo.2021.799382 |
| [48] | Chen Y, Ji HZ, Shao JG, et al. Different hepatitis C virus infection statuses show a significant risk of developing type 2 diabetes mellitus: a network meta-analysis[J]. Dig Dis Sci, 2020, 65(7): 1940-1950. DOI:10.1007/s10620-019-05918-7 |
| [49] | Woelfle T, Linkohr B, Waterboer T, et al. Health impact of seven herpesviruses on (pre)diabetes incidence and HbA1c: results from the KORA cohort[J]. Diabetologia, 2022, 65(8): 1328-1338. DOI:10.1007/s00125-022-05704-7 |
| [50] | Šestan M, Marinović S, Kavazović I, et al. Virus-induced interferon-γ causes insulin resistance in skeletal muscle and derails glycemic control in obesity[J]. Immunity, 2018, 49(1): 164-177.e6. DOI:10.1016/j.immuni.2018.05.005 |
| [51] | Müller JA, Groß R, Conzelmann C, et al. SARS-CoV-2 infects and replicates in cells of the human endocrine and exocrine pancreas[J]. Nat Metab, 2021, 3(2): 149-165. DOI:10.1038/s42255-021-00347-1 |
| [52] | Steenblock C, Richter S, Berger I, et al. Viral infiltration of pancreatic islets in patients with COVID-19[J]. Nat Commun, 2021, 12(1): 3534. DOI:10.1038/s41467-021-23886-3 |
| [53] | Stein SR, Ramelli SC, Grazioli A, et al. SARS-CoV-2 infection and persistence in the human body and brain at autopsy[J]. Nature, 2022, 612(7941): 758-763. DOI:10.1038/s41586-022-05542-y |
| [54] | Zickler M, Stanelle-Bertram S, Ehret S, et al. Replication of SARS-CoV-2 in adipose tissue determines organ and systemic lipid metabolism in hamsters and humans[J]. Cell Metab, 2022, 34(1): 1-2. DOI:10.1016/j.cmet.2021.12.002 |
| [55] | Hotamisligil GS. Inflammation, metaflammation and immunometabolic disorders[J]. Nature, 2017, 542(7640): 177-185. DOI:10.1038/nature21363 |
| [56] | Kavazović I, Krapić M, Beumer-Chuwonpad A, et al. Hyperglycemia and not hyperinsulinemia mediates diabetes-induced memory CD8 T-cell dysfunction[J]. Diabetes, 2022, 71(4): 706-721. DOI:10.2337/db21-0209 |
| [57] | Zhou WY, Sailani MR, Contrepois K, et al. Longitudinal multi-omics of host-microbe dynamics in prediabetes[J]. Nature, 2019, 569(7758): 663-671. DOI:10.1038/s41586-019-1236-x |
| [58] | Hotamisligil GS. Foundations of immunometabolism and implications for metabolic health and disease[J]. Immunity, 2017, 47(3): 406-420. DOI:10.1016/j.immuni.2017.08.009 |
| [59] | Karlsson EA, Sheridan PA, Beck MA. Diet-induced obesity impairs the T cell memory response to influenza virus infection[J]. J Immunol, 2010, 184(6): 3127-3133. DOI:10.4049/jimmunol.0903220 |
| [60] | Kosaraju R, Guesdon W, Crouch MJ, et al. B cell activity is impaired in human and mouse obesity and is responsive to an essential fatty acid upon murine influenza infection[J]. J Immunol, 2017, 198(12): 4738-4752. DOI:10.4049/jimmunol.1601031 |
| [61] | Honce R, Karlsson EA, Wohlgemuth N, et al. Obesity-related microenvironment promotes emergence of virulent influenza virus strains[J]. mBio, 2020, 11(2): e03341-19. DOI:10.1128/mBio.03341-19 |
| [62] | Maurya R, Sebastian P, Namdeo M, et al. COVID-19 severity in obesity: leptin and inflammatory cytokine interplay in the link between high morbidity and mortality[J]. Front Immunol, 2021, 12: 649359. DOI:10.3389/fimmu.2021.649359 |
| [63] | Chung TH, Kim JK, Kim JH, et al. Fatty liver index as a simple and useful predictor for 10-year cardiovascular disease risks determined by Framingham risk score in the general Korean population[J]. J Gastrointestin Liver Dis, 2021, 30(2): 221-226. DOI:10.15403/jgld-3404 |
| [64] | Codo AC, Davanzo GG, Monteiro LB, et al. Elevated glucose levels favor SARS-CoV-2 infection and monocyte response through a HIF-1α/glycolysis-dependent axis[J]. Cell Metab, 2020, 32(3): 498-499. DOI:10.1016/j.cmet.2020.07.015 |
| [65] | Bramante CT, Huling JD, Tignanelli CJ, et al. Randomized trial of metformin, ivermectin, and fluvoxamine for covid-19[J]. N Engl J Med, 2022, 387(7): 599-610. DOI:10.1056/NEJMoa2201662 |
| [66] | Pawlos A, Niedzielski M, Gorzelak-Pabiś P, et al. COVID-19: direct and indirect mechanisms of statins[J]. Int J Mol Sci, 2021, 22(8): 4177. DOI:10.3390/ijms22084177 |
| [67] | Oliver NT, Hartman CM, Kramer JR, et al. Statin drugs decrease progression to cirrhosis in HIV/hepatitis C virus coinfected individuals[J]. AIDS, 2016, 30(16): 2469-2476. DOI:10.1097/QAD.0000000000001219 |
| [68] | Rayman G, Lumb AN, Kennon B, et al. Dexamethasone therapy in COVID-19 patients: implications and guidance for the management of blood glucose in people with and without diabetes[J]. Diabet Med, 2021, 38(1): e14378. DOI:10.1111/dme.14378 |
 2024, Vol. 33
2024, Vol. 33