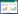2. 杭州医学院基础医学与法医学院,杭州 311300
2. School of Basic Medicine and Forensic Science, Hangzhou Medical College, Hangzhou 311300, China
新型冠状病毒感染(coronavirus disease 2019, COVID-19)自2019年底爆发至今已3年余,据世界卫生组织统计,截至2023年4月6日全球确诊病例已超7.6亿例次,造成累计超过689万的死亡人数[1]。据WHO数据显示,自2019年起,全球共经历6波疫情,而从2022年12月开始,中国也经历了第一次大规模SARS-CoV-2感染潮,各大医院均收治了不同病情程度的COVID-19患者,在临床救治中,存在不少并发急性胰腺炎(acute pancreatitis, AP)患者,且病情各异。据研究报道,COVID-19不仅发现在肺泡细胞、肝脏、心肌、胃肠道中高度表达[2-3],还有少许新冠病毒性相关性AP(SARS-CoV-2 associated acute pancreatitis, SAAP)的个案报道[4-6],但有关SAAP群体发病率、临床预后及危险因素分析等尚未见报道。本研究旨在对疫情流行期间的COVID-19人群进行回顾性分析,以了解SAPP发病率、预后及其危险因素,为临床早期识别与早期干预提供决策依据。
1 资料与方法 1.1 研究对象采用回顾性分析方法,选取2022年12月1日至2023年1月31日在浙江省人民医院住院的COVID-19患者为研究对象。纳入标准:(1)具有新冠病毒感染的相关临床表现;(2)新冠病毒核酸检测或者抗原检测阳性;(3)年龄≥18岁。排除标准:入院后未检测血淀粉酶或血脂肪酶指标患者。
本研究符合医学伦理学要求,不涉及人体干预,并经浙江省人民医院医学伦理委员会审核批准[浙人医伦申2023其他第(289号)]。
1.2 研究方法通过住院电子病历系统获取入选对象的相关信息,收集人口统计学资料(性别、年龄),收集入院后48 h内血常规、肝肾功能、血清淀粉酶/脂肪酶、炎症因子[超敏C反应蛋白、降钙素原(procalcitonin, PCT)、血沉、铁蛋白、白细胞介素(interleukin, IL)-2、IL-4、IL-6、IL-10等]、凝血功能[D-二聚体(D-dimer, D-D)及纤维蛋白(原)降解物(fibrinogen degradation product, FDP)]、血气分析[吸入氧浓度、血氧分压及乳酸(lactate, LAC)]、免疫球蛋白及补体等血液学参数。根据既往对胰腺损伤的相关定义[7-8],本研究根据血清淀粉酶/脂肪酶水平的高低,将COVID-19患者分为两组,血清淀粉酶或脂肪酶水平高于正常值的为胰腺损伤组,其余为非胰腺损伤组。
1.3 诊断标准及分级 1.3.1 AP诊断标准根据2012年亚特兰大分类标准[7],AP诊断标准为至少符合下述3项标准中的2项:(1)AP典型的上腹部疼痛表现;(2)血清淀粉酶和(或)脂肪酶活性高于正常值上限3倍以上;(3)AP典型的影像学表现。
1.3.2 胰腺损伤定义胰腺损伤定义参考国内外相关文献[8-9],具体为:Somogyi方法检测血清淀粉酶(35~135 U/L)和(或)脂肪酶水平(16~63 U/L)高于正常值范围。诊断为胰腺损伤和SAAP患者需首先临床排除非胰源性淀粉酶升高(如急性胃肠炎、胆系感染、肠梗阻、消化道穿孔、腹主动脉瘤、尿毒症、急性腹膜炎、腮腺炎症和肿瘤等)和高脂血症性AP、胆源性AP和酒精性胰腺炎等其他常见AP。
1.4 统计学方法采用SPSS 25.0统计学软件对数据进行分析,正态分布的定量数据采用均数±标准差(x±s)表示,组间比较采用两样本t检验;非正态分布的定量数据采用中位数(四分位数)[M(Q1, Q3)]表示,组间比较采用Mann-Whitney U检验。定性数据采用例数和百分率表示,组间比较采用Pearson χ2检验或Fisher确切概率法检验。危险因素分析采用Logistic回归分析法。以P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者基本临床特征2022年12月1日至2023年1月31日期间本院共收治COVID-19患者2 618人次,共纳入2 101例患者,其中男性1 173例(55.83%),年龄为74(60, 86)岁;胰腺损伤组共有298例(14.18%),其中确诊为SAAP患者17例(占胰腺损伤患者5.7%,占总COVID-19患者0.8%),非胰腺损伤组共有1803例(85.82%),见图 1。

|
| 图 1 病例入组及基本情况 Fig 1 Case enrollment and basic information |
|
|
胰腺损伤组患者年龄、男性比例高于非胰腺损伤组,差异有统计学意义(P < 0.05)。胰腺损伤组中共有107例患者死亡,病死率为35.9%,非胰腺损伤组中共有461例患者死亡,病死率为22.1%,差异有统计学意义(P < 0.05),见表 1。
| 指标 | 总人数(n=2 101) | 非胰腺损伤组(n=1 803) | 胰腺损伤组(n=298) | Z/t/χ2值 | P值 |
| 性别(n, %) | -2.722 | 0.006 | |||
| 男性 | 1 173(55.83) | 985(54.63) | 188(63.09) | ||
| 女性 | 928(44.17) | 818(45.37) | 110(36.91) | ||
| 年龄[岁,M(Q1, Q3)] | 74.0(60.0, 86.0) | 72.0(59.0, 85.0) | 80.5(69.0, 88.0) | -7.165 | < 0.001 |
| 病死率(%) | 27.0 | 22.1 | 35.9 | -3.427 | < 0.001 |
胰腺损伤组患者白细胞计数、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)、超敏C反应蛋白、PCT、红细胞沉降率(erythrocyte sedimentation rate, ESR)、炎症细胞因子(IL-2、IL-4、IL-6、TL-10)、肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)、肝肾功能(丙氨酸氨基转移酶、AST、GGT、TBIL、LDH、肌酐等)、凝血功能(D-D及FDP)、LAC等血液学指标均高于非胰腺损伤组,差异均具有统计学意义(均P < 0.05)。与非胰腺损伤组患者相比,胰腺损伤组患者的血清补体C3、白蛋白、白球比例、动脉血氧合指数(PaO2/FiO2)等值则更低,差异均具有统计学意义(均P < 0.05)。而两组之间的铁蛋白、促红细胞生成素、γ干扰素、免疫球蛋白(IgA、IgG、IgM)、补体C4、白细胞分化抗原(CD3+CD4+、CD4/CD8)等指标差异无统计学意义(均P > 0.05),见表 2。
| 指标 | 总人数(n=2 101) | 非胰腺损伤组(n=1 803) | 胰腺损伤组(n=298) | t/χ2值 | P值 |
| WBC(×109/L)a | 8.78 (6.41, 12.51) | 8.35 (6.24, 11.62) | 13.12 (8.76, 19.17) | -11.685 | < 0.001 |
| NLRa | 9.47 (4.38, 21.26) | 8.19 (3.96, 17.01) | 25.36 (12.24, 62.48) | -14.542 | < 0.001 |
| CRP(mg/L)a | 53.10 (12.20, 113.80) | 44.90 (9.70, 98.80) | 118.70(50.10, 208.80) | -11.560 | < 0.001 |
| PCT(ng/L)a | 0.12(0.05, 0.61) | 0.10(0.04, 0.29) | 0.96(0.20, 5.38) | -13.823 | < 0.001 |
| ESR(mm/h)a | 34.00(19.00, 58.00) | 33.00(18.00, 56.00) | 41.50(25.00, 67.75) | -2.800 | 0.005 |
| Fer(μg/L)a | 301.60(144.19, 703.07) | 293.54(140.01, 653.87) | 339.24(188.69, 828.04) | -1.772 | 0.076 |
| EPO(mIU/mL)a | 17.75(11.83, 22.83) | 17.10(11.60, 21.80) | 19.30(12.25, 30.75) | -1.051 | 0.293 |
| IL-2(pg/mL)a | 5.22(3.96, 6.42) | 4.69(3.73, 6.42) | 5.44(4.40, 6.42) | -3.996 | < 0.001 |
| IL-4(pg/mL)a | 2.02(1.37, 2.75) | 2.02(1.32, 2.75) | 2.38(1.39, 3.10) | -2.168 | 0.030 |
| IL-6(pg/mL)a | 14.15(5.19, 53.21) | 11.99(4.54, 33.85) | 31.08(10.68, 150.85) | -6.965 | < 0.001 |
| IL-10(pg/mL)a | 8.59(4.80, 19.29) | 7.7(4.29, 16.15) | 14.29(7.60, 32.22) | -6.197 | < 0.001 |
| IFN-γ(pg/mL)a | 4.25(2.66, 6.93) | 3.98(2.47, 6.93) | 4.54(3.13, 6.93) | -1.180 | 0.238 |
| TNF-α(pg/mL)a | 3.41(2.43, 4.56) | 3.41(2.02, 4.04) | 3.78(2.65, 5.42) | -5.383 | < 0.001 |
| IgA(g/L)a | 2.43(1.76, 3.33) | 2.46(1.77, 3.34) | 2.36(1.73, 3.30) | -0.238 | 0.812 |
| IgM(g/L)a | 0.85(0.57, 1.17) | 0.86(0.59, 1.21) | 0.80(0.50, 1.09) | -1.668 | 0.095 |
| IgG(g/L)b | 11.84±3.53 | 11.87±3.54 | 11.71±3.53 | 1.214 | 0.653 |
| C3(g/L)b | 0.85±0.21 | 0.86±0.22 | 0.80±0.19 | 3.510 | 0.008 |
| C4(g/L)b | 0.24±0.08 | 0.24±0.08 | 0.24±0.08 | 0.035 | 0.172 |
| CD3+CD4+(%)b | 34.70±12.09 | 34.90±12.07 | 33.94±12.19 | 0.011 | 0.410 |
| CD4/CD8a | 1.65(1.06, 2.41) | 1.68(1.08, 2.39) | 1.54(0.97, 2.52) | -0.727 | 0.467 |
| Alb(g/L)b | 31.68±5.23 | 32.25±5.11 | 28.27±4.63 | 6.639 | < 0.001 |
| A/G b | 1.12±0.26 | 1.14±0.26 | 1.00±0.21 | 6.697 | < 0.001 |
| TG(mmol/L)a | 1.39(1.00, 2.02) | 1.35(0.98, 1.95) | 1.66(1.23, 2.41) | -6.006 | < 0.001 |
| ALT(U/L)a | 33.00(21.00, 59.00) | 31.00(20.00, 53.00) | 53.50(27.75, 110.00) | -9.156 | < 0.001 |
| AST(U/L)a | 32.00(22.00, 52.00) | 30.00(22.00, 48.00) | 54.00(31.00, 105.00) | -11.058 | < 0.001 |
| GGT(U/L)a | 33.00(21.00, 62.00) | 32.00(20.00, 59.00) | 48.00(20.00, 98.00) | -6.833 | < 0.001 |
| TBIL(μmol/L)a | 12.90(9.70, 18.15) | 12.5(9.50, 17.35) | 16.45(11.10.26.23) | -7.338 | < 0.001 |
| DBIL(μmol/L)a | 3.10(2.10, 4.70) | 2.90(2.00, 4.40) | 4.60(2.80, 9.83) | -9.887 | < 0.001 |
| LDH(U/L)a | 239.50(189.00, 321.00) | 229.00(185.00, 296.00) | 339.00(251.00, 509.75) | -12.701 | < 0.001 |
| Cr(μmol/L)a | 82.7(64.00, 116.75) | 78.4(62.00, 106.00) | 138.5(93.90, 246.20) | -15.327 | < 0.001 |
| D-D(μg/L)a | 1 190(510, 3 242) | 1 030(450, 2 435) | 4 190(1 390, 11405) | -13.192 | < 0.001 |
| FDP(μg/L)a | 3 920(2 000, 1 0360) | 3 410(2 000, 7 790) | 12 400(4 455, 29 125) | -12.702 | < 0.001 |
| PaO2(mmHg)a | 77.00(60.00, 99.00) | 79.00(64.00, 102.00) | 61.00(46.00, 81.50) | -13.025 | < 0.001 |
| PaO2/FiO2(mmHg)a | 242.86(131.11, 380.95) | 278.79(165.85, 390.48) | 100.00(50.50, 227.92) | -11.918 | < 0.001 |
| LAC(mmol/L)a | 2.10(1.50, 3.10) | 2.00(1.40, 2.80) | 3.20(2.20, 6.55) | -10.783 | < 0.001 |
| 注:WBC为白细胞计数,NLR为中性粒细胞/淋巴细胞比值,CRP为C反应蛋白,PCT降钙素原,ESR红细胞沉降率,Fer为铁蛋白,EPO为促红细胞生成素,IL为白细胞介素,IFN-γ为γ干扰素,TNF-α为肿瘤坏死因子,IgA为免疫球蛋白A,IgM为免疫球蛋白M,IgG为免疫球蛋白G,C3即补体C3,C4即补体C4,CD3+CD4+为白细胞分化抗原CD3+CD4+绝对计数,CD4/CD8为白细胞分化抗原CD4、CD8比值,Alb为白蛋白,A/G为白球比例,TG为甘油三酯,ALT为丙氨酸氨基转移酶,AST为天门冬氨酸氨基转移酶,GGT为谷氨酰转移酶,TBIL为总胆红素,DBIL为直接胆红素,LDH为乳酸脱氢酶,Cr为肌酐,D-D为D-二聚体,FDP为纤维蛋白(原)降解物,PaO2为动脉氧分压,PaO2/FiO2为氧合指数(其中FiO2为吸入氧浓度百分比),LAC为动脉血乳酸;a为M (Q1, Q3),b为x±s | |||||
Logistic多因素回归分析结果显示,男性SAAP发生风险是女性的2.426倍(OR=2.426,95%CI: 1.223~4.812,P < 0.05)。年龄、CRP、PCT、TBIL、肌酐、PaO2、PaO2/FiO2、LAC等是COVID-19患者发生胰腺损伤的独立危险因素(P < 0.05),见表 3。
| 参数 | OR值 | 95%CI | P值 |
| 性别 | 2.426 | 1.223~4.812 | 0.011 |
| 年龄 | 1.025 | 1.000~1.051 | 0.046 |
| WBC | 1.034 | 0.973~1.097 | 0.281 |
| NLR | 1.003 | 0.997~1.009 | 0.326 |
| CRP | 1.005 | 1.001~1.010 | 0.015 |
| PCT | 1.064 | 1.029~1.101 | < 0.001 |
| ESR | 1.008 | 0.999~1.018 | 0.068 |
| IL-2 | 1.064 | 0.976~1.161 | 0.161 |
| IL-4 | 1.047 | 0.952~1.151 | 0.346 |
| IL-6 | 1.000 | 1.000~1.000 | 0.597 |
| IL-10 | 1.001 | 1.000~1.001 | 0.189 |
| TNF-α | 0.981 | 0.930~1.035 | 0.486 |
| C3 | 0.652 | 0.148~2.866 | 0.571 |
| Alb | 0.931 | 0.842~1.030 | 0.164 |
| A/G | 0.628 | 0.073~5.398 | 0.672 |
| TG | 1.073 | 0.930~1.239 | 0.333 |
| ALT | 1.001 | 1.000~1.001 | 0.100 |
| AST | 1.000 | 1.000~1.001 | 0.336 |
| GGT | 1.001 | 0.998~1.004 | 0.610 |
| TBIL | 1.044 | 1.002~1.087 | 0.041 |
| DBIL | 0.974 | 0.910~1.042 | 0.441 |
| LDH | 1.000 | 1.000~1.001 | 0.069 |
| Cr | 1.005 | 1.003~1.008 | < 0.001 |
| D-D | 1.000 | 1.000~1.000 | 0.575 |
| FDP | 1.000 | 1.000~1.000 | 0.426 |
| PaO2 | 1.019 | 1.001~1.037 | 0.041 |
| PaO2 /FiO2 | 0.992 | 0.987~0.997 | 0.001 |
| LAC | 1.064 | 1.008~1.122 | 0.025 |
| 注:WBC为白细胞计数,NLR为中性粒细胞/淋巴细胞比值,CRP为C反应蛋白,PCT降钙素原,ESR红细胞沉降率,IL为白细胞介素,TNF-α为肿瘤坏死因子,C3即补体C3,Alb为白蛋白,A/G为白球比例,TG为甘油三酯,ALT为丙氨酸氨基转移酶,AST为天门冬氨酸氨基转移酶,GGT为谷氨酰转移酶,TBIL为总胆红素,DBIL为直接胆红素,LDH为乳酸脱氢酶,Cr为肌酐,D-D为D-二聚体,FDP为纤维蛋白(原)降解物,PaO2为动脉氧分压,PaO2/FiO2为氧合指数(其中FiO2为吸入氧浓度百分比),LAC为动脉血乳酸 | |||
随着COVID-19逐渐淡出公众视野,监控与防护措施的优化调整,新型变异株的传播及自然感染获得的免疫保护的衰退。综合国外流行情况,COVID-19或将呈长期散发流行趋势,但临床需要从三年的疫情救治中总结经验以应对未来可能的流行,尤其是针对COVID-19引起的肺外器官或组织损伤,而这往往容易被忽略,而目前也缺乏足够研究去深入认识肺外器官损伤。有研究报道COVID-19患者具有胃肠道症状的高发生率,COVID-19流行期间AP重症率及胰腺坏死率升高[10],这对早期诊断及干预SAAP提出了更高的要求,而诸如奥密克戎亚型变异毒株XBB的流行又给本就扑朔迷离的SAAP诊断带来困难,因此本研究旨在分析总结发生SAAP的潜在危险因素。
随着COVID-19病例的增多,COVID-19与胰腺损伤的关系逐渐受到人们关注[11],有研究认为,COVID-19对胰腺的损伤可以通过胰岛细胞中血管紧张素转化酶2(angiotensin-converting enzyme 2, ACE2)感染人体[12],其不仅在肺泡中表达,在胰腺β细胞中也是高表达,进而造成胰腺损伤[13-14]。除了COVID-19的直接细胞病理效应外,其发病机制还包括全身炎症反应、药物相关的胰腺损伤或继发性免疫介导的炎症反应[8, 15]。另有研究发现,新冠流行期间AP重症率、SIRS和胰腺坏死发生率均显著高于流行前基准[16-17]。而新冠阳性的AP患者中特发性胰腺炎发生率明显高于新冠阴性AP患者,研究者认为特发性胰腺炎发病率的升高归因于COVID-19感染[18-19]。
本研究纳入的2 101例COVID-19患者中,共有17例(0.8%)患者最终被确诊为SAAP,高于既往对SAAP发生率的报道[8, 14, 19]。同时,由于纳入胰腺损伤组研究的病例中,有35.91%的住院病死率及相当一部分的ICU住院率,这些患者由于病情危重,临床医生更多关注肺部而不是腹部脏器、放射科短时间内由于大量COVID-19患者检查肺部CT而导致的医疗挤兑等因素,大多数患者未能行胰腺CT检查,这些因素对SAAP的诊断带来了困难。另外,由于这部分患者大多处于虚弱或昏迷状态,缺乏腹痛、腹胀、呕吐等胃肠道症状,也给SAAP诊断带来干扰,临床上诊断SAAP更多地依靠淀粉酶/脂肪酶值以及有限的腹部超声检查,而超声检查由于易受气体干扰导致胰腺往往显示不清)。因此,可以推测实际SAAP的发生率可能高于本项研究结果,临床医生需要更加提高对SAAP早期识别的认识与关注。另外,本研究也应注意到在COVID-19发病期间由于相关影像学检查不完善导致的胆源性AP的漏诊和治疗COVID-19的相关药物如甲强龙、洛匹那韦/利托那韦等导致的药物性AP的可能,这些因素在不同程度影响了SAAP发病率的判断。
尽管COVID-19发生期间有少数有关SAAP发病机制的报道,但其确切机制仍未明。关于SAAP的发病机制目前主要有三种假说:(1)新冠病毒的直接损害作用。研究表明ACE2在肺、肝、肾、肠道等均有表达[8, 20],在胰腺中也高度表达[13],SARS-CoV-2在胰腺导管、腺泡和胰岛细胞中均有表达,SARS-CoV-2可能与胰腺中的ACE2结合通过局部复制产生直接细胞毒性作用导致胰腺损伤,本研究中的关于胰腺损伤组患者的肝肾功能、氧合指数等指标均明显低于非胰腺损伤组的结果也验证了该假说。(2)SAAP可能继发于全身免疫介导性炎症反应,SARS-CoV-2加重全身炎症,强烈的炎症反应和炎症因子风暴介导胰腺组织的损伤,加速急性呼吸窘迫综合征的发生,本研究发现胰腺损伤组患者白细胞计数、NLR、CRP、PCT、ESR、炎症细胞因子等明显高于非胰腺损伤组的结果,与该假说分析相符合,也与既往相关研究结果一致[8]。(3)胰腺微循环障碍,导致弥漫性微缺血性疾病,在严重的SARS-CoV-2感染中,包括最近的组织病理学研究在内的新数据强调了内皮细胞在血管功能障碍、免疫血栓形成和炎症中的关键作用[21],随着免疫细胞因子(IL-2、IL-4、IL-6、TL-10、TNF-α)、凝血功能(D-D、FDP)、LAC的升高,促炎细胞因子风暴也可能参与微血管内皮细胞功能障碍和白细胞募集,SARS-CoV-2会导致促凝血状态、微血管渗漏和器官缺血,导致胰腺缺血缺氧而致损伤发生,该机制也可能是新冠病毒感染患者肺外器官组织损伤的原因之一。在本研究中,胰腺损伤组患者D-D与FDP较非胰腺损伤组明显升高,也反映了胰腺损伤患者存在高凝状态与胰腺微循环障碍的可能。
预后分析中,胰腺损伤组患者病死率明显高于非胰腺损伤组,但这些SAAP患者胰腺炎局部影像学表现较轻,胰腺坏死发生率低,大部分为轻型AP,因此其高病死率更多的要归因于新冠病毒感染导致的ARDS或MODS,而并不能说明SAAP直接导致了高病死率,否则将会高估其病情严重度。
在多因素回归分析中,研究发现男性患者罹患SAAP风险是女性患者的2.426倍,年龄、CRP、PCT、TBIL、Cr、LAC等指标均为独立危险因素。因此对于男性高龄患者,应加强胰腺功能检测与影像学检查,尤其针对CRP、PCT、TBIL、Cr、LAC等指标明显异常患者。由于COVID-19患者往往表现为肺部症状,轻度的消化道症状易被忽略或者部分患者胃肠道症状不明显而导致延误诊断与治疗,且本研究中的SAAP患者,许多仅表现为轻度的恶心和不全性肠梗阻表现,说明SAAP患者存在一定的隐蔽性,因此要加强对存在上述危险因素患者的SAAP相关筛查与识别。
综上所述,合并胰腺损伤的COVID-19患者炎症相关指标和D-D、FDP明显高于非胰腺损伤患者。男性高龄患者罹患SAAP风险明显增高,性别、年龄、CRP、PCT、总胆红素、肌酐、氧合指数、LAC是COVID-19患者并发胰腺损伤的独立危险因素。
利益冲突 所有作者声明无利益冲突
作者贡献声明 蔡文伟、谭兆旺:研究构思,文章撰写及修改;毛云云、周晟昂、李恒杰:论文数据的收集及整理;郑悦亮、李茜:统计学分析;涂建锋:数据审核,论文的修订,结果的分析与解释,对文章整体质量的监督与管理
| [1] | WHO COVID-19 Dashboard. Geneva: World Health Organization[EB/OL]. 2020[2023-04-06]. https://covid19.who.int/. |
| [2] | Petrov MS, Yadav D. Global epidemiology and holistic prevention of pancreatitis[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(3): 175-184. DOI:10.1038/s41575-018-0087-5 |
| [3] | Wang TB, Du Z, Zhu FX, et al. Comorbidities and multi-organ injuries in the treatment of COVID-19[J]. Lancet, 2020, 395(10228): e52. DOI:10.1016/S0140-6736(20)30558-4 |
| [4] | Akkus C, Yilmaz H, Mizrak S, et al. Development of pancreatic injuries in the course of COVID-19[J]. Acta Gastroenterol Belg, 2020, 83(4): 585-592. |
| [5] | Kusmartseva I, Wu WT, Syed F, et al. Expression of SARS-CoV-2 entry factors in the pancreas of normal organ donors and individuals with COVID-19[J]. Cell Metab, 2020, 32(6): 1041-1051. DOI:10.1016/j.cmet.2020.11.005 |
| [6] | Schepis T, Larghi A, Papa A, et al. SARS-CoV2 RNA detection in a pancreatic pseudocyst sample[J]. Pancreatology, 2020, 20(5): 1011-1012. DOI:10.1016/j.pan.2020.05.016 |
| [7] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis: 2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [8] | Wang F, Wang HZ, Fan JL, et al. Pancreatic injury patterns in patients with coronavirus disease 19 pneumonia[J]. Gastroenterology, 2020, 159(1): 367-370. DOI:10.1053/j.gastro.2020.03.055 |
| [9] | Barlass U, Wiliams B, Dhana K, et al. Marked elevation of lipase in COVID-19 disease: a cohort study[J]. Clin Transl Gastroenterol, 2020, 11(7): e00215. DOI:10.14309/ctg.0000000000000215 |
| [10] | Grusova G, Bruha R, Bircakova B, et al. Pancreatic injury in patients with SARS-cov-2 (COVID-19) infection: a retrospective analysis of CT findings[J]. Gastroenterol Res Pract, 2021, 2021: 5390337. DOI:10.1155/2021/5390337 |
| [11] | de-Madaria E, Capurso G. COVID-19 and acute pancreatitis: examining the causality[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(1): 3-4. DOI:10.1038/s41575-020-00389-y |
| [12] | 张韬, 朱帅, 黄耿文. 新型冠状病毒相关性急性胰腺炎的认识现状[J]. 中国普通外科杂志, 2021, 30(9): 1017-1022. DOI:10.7659/j.issn.1005-6947.2021.09.004 |
| [13] | Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor[J]. Cell, 2020, 181(2): 271-280. DOI:10.1016/j.cell.2020.02.052 |
| [14] | Liu FR, Long X, Zhang BX, et al. ACE2 expression in pancreas may cause pancreatic damage after SARS-CoV-2 infection[J]. Clin Gastroenterol Hepatol, 2020, 18(9): 2128-2130. DOI:10.1016/j.cgh.2020.04.040 |
| [15] | Bircakova B, Bruha R, Lambert L, et al. A bimodal pattern of the onset of COVID-19 related acute pancreatitis supports both the cytotoxic and immune-related pathogenesis - a systematic review[J]. Scand J Gastroenterol, 2021, 56(7): 870-873. DOI:10.1080/00365521.2021.1922751 |
| [16] | Ramsey ML, Patel A, Sobotka LA, et al. Hospital trends of acute pancreatitis during the coronavirus disease 2019 pandemic[J]. Pancreas, 2022, 51(5): 422-426. DOI:10.1097/MPA.0000000000002046 |
| [17] | Inamdar S, Benias PC, Liu Y, et al. Prevalence, risk factors, and outcomes of hospitalized patients with coronavirus disease 2019 presenting as acute pancreatitis[J]. Gastroenterology, 2020, 159(6): 2226-2228. DOI:10.1053/j.gastro.2020.08.044 |
| [18] | Dirweesh A, Li YT, Trikudanathan G, et al. Clinical outcomes of acute pancreatitis in patients with coronavirus disease 2019[J]. Gastroenterology, 2020, 159(5): 1972-1974. DOI:10.1053/j.gastro.2020.07.038 |
| [19] | McNabb-Baltar J, Jin DX, Grover AS, et al. Lipase elevation in patients with COVID-19[J]. Am J Gastroenterol, 2020, 115(8): 1286-1288. DOI:10.14309/ajg.0000000000000732 |
| [20] | Mao R, Qiu Y, He JS, et al. Manifestations and prognosis of gastrointestinal and liver involvement in patients with COVID-19: a systematic review and meta-analysis[J]. 2020, 5(7): 667-678. DOI: 10.1016/S2468-1253(20)30126-6. |
| [21] | Pons S, Fodil S, Azoulay E, et al. The vascular endothelium: the cornerstone of organ dysfunction in severe SARS-CoV-2 infection[J]. Crit Care, 2020, 24(1): 353. DOI:10.1186/s13054-020-03062-7. |
 2024, Vol. 33
2024, Vol. 33