2. 徐州医科大学附属医院重症医学科,徐州 221000
2. Department of intensive care unit, the Affiliated Hospital of Xuzhou Medical University, Xuzhou 221000, China
脓毒症是一种严重且常危及生命的综合征,是由宿主对细菌或病毒感染的反应失调引起的,仍然是重症监护室(intensive care unit, ICU)患者死亡的主要原因[1]。胃肠道是脓毒症最先侵犯的器官,被认为是“机体应激状态时器官功能障碍的核心”[2]。脓毒症可以引起胃肠动力学紊乱和胃肠内分泌失调,从而导致胃肠道黏膜发生缺血、炎症反应以及菌群移位等不良后果[3]。研究表明,胃肠道功能障碍或衰竭是脓毒症进行性加重的重要原因,改善胃肠功能可以延缓脓毒症恶化并且改善预后[4]。因此,及早改善胃肠道功能对阻断脓毒症病情进展尤为重要。血清胃功能指标包括胃蛋白酶原(pepsinogen, PG)Ⅰ,PGⅡ和胃泌素17(gastrin 17, G17)。PGⅠ和PGⅡ是胃黏膜细胞分泌的一种蛋白,G17是一种重要的胃肠道肽类激素,它们常用于发现消化性溃疡、萎缩性胃炎乃至胃癌等胃部疾病,对胃病早期诊断的普查以及胃癌的预防干预具有重要意义[5]。参附注射液已广泛应用于脓毒症治疗,研究表明其在降低全身炎症反应,改善心功能、保护肺缺血-再灌注等方面的均有显著作用[6-7],但参附注射液对脓毒症患者的胃肠功能是否有保护作用,目前尚无相关报道。这一领域的研究不仅能够揭示参附注射液在治疗脓毒症中的潜在新机制,还可能为临床实践提供新的治疗策略。本文将参附注射液用于脓毒症合并急性胃肠损伤(acute gastrointestinal injury, AGI)患者的救治,进一步探讨参附注射液对脓毒症患者血清PGⅠ,PGⅡ和G17的影响,揭示其在保护胃肠功能方面的效果,从而为临床治疗提供新的依据。
1 资料与方法 1.1 研究对象本研究为单中心随机对照临床试验,选取2021年6至2022年12月于徐州医科大学附属医院重症医学科住院治疗的脓毒症合并AGI患者为研究对象。纳入标准:(1)依据2016年美国重症学会中脓毒症的诊断标准[8],序贯器官衰竭(sequential organ failure assessment score, SOFA)评分≥2分;(2)胃肠功能障碍由脓毒症所致,AGI评分≥2分,排除由慢性心、肺、肝、肾等疾病引起的胃肠道功能障碍。排除标准:(1)ICU住院时间 < 7 d;(2)年龄≤18岁;(3)严重肝功能不全,血清总胆红素 > 3倍正常上限或者天冬氨酸氨基转移酶和丙氨酸氨基转移酶 > 3倍正常上限的患者;(4)严重肾功能不全,血清肌酐 > 3倍正常上限或需要血液透析治疗的患者;(5)妊娠期或哺乳期妇女;(6)精神心理疾病者或原发性神经系统损伤者。
研究方案符合医学伦理学标准,经徐州医科大学附属医院医学伦理委员会批准(XYFY2021-KL173-01)。本研究所有治疗均取得患者或家属的知情同意。
1.2 研究方法本研究采用随机数字表法将患者分为参附组和对照组。所有患者均按“拯救脓毒症运动”指南2016版采取治疗措施,包括初始液体复苏、抗感染治疗、机械通气、血管活性药物应用、维持内环境稳定,尽早行肠内营养支持等[9]。参附组除常规治疗外,同时加用参附注射液(四川雅安三九药业有限公司,规格10 mL/支)治疗,用法:250 mL 5%葡萄糖注射液+100 mL参附注射液进行静脉滴注,2次/d,连用7 d。
1.3 观察指标 1.3.1 一般资料记录两组患者一般情况包括年龄、性别、基础病史、感染部位(呼吸系统、血行感染及其他部位)、氧合指数、急性生理学及慢性健康状况系统Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)评分以及SOFA评分。
1.3.2 观察指标患者入院后治疗前(D0),治疗后第3、7天(D3、D7)测定血清胃功能及AGI分级。血清胃功能:所有研究对象在空腹状态下采取静脉血3 mL,将血液标本高速离心,取血清,采用酶联免疫吸附试验(ELISA)检测PG Ⅰ,PG Ⅱ和G17等血清胃功能指标,检测选择全自动酶标仪,使用必欧瀚生物技术合肥公司的试剂盒,严格按照试剂盒说明进行操作。AGI分级[10]:根据2012年急性胃肠损伤的定义与分级诊疗建议,AGI定义为重症患者因急性疾病本身导致的胃肠功能障碍。将AGI分级Ⅰ级、Ⅱ级、Ⅲ级、Ⅳ级赋予相应分值1分、2分、3分、4分,得出AGI评分。AGI Ⅰ级(1分):有明确病因,胃肠道功能部分受损;AGI Ⅱ级(2分):胃肠道消化和吸收功能障碍,但未影响到全身的情况;AGI Ⅲ级(3分):胃肠功能丧失,给予干预处理后,胃肠功能仍不恢复;AGI Ⅳ级(4分):AGI进展至胃肠功能衰竭,出现多脏器功能障碍(multiple organ dysfunction syndrome, MODS),随时有生命危险。本研究将AGI评分≥2分纳入AGI的诊断范畴。其他指标:记录患者在ICU住院时间以及应用机械通气的时间。
1.4 统计学方法采用SPSS 26.0软件进行统计学分析。连续数据通过Shapiro-Wilk检验判断是否服从正态分布;假如服从正态分布则应用均数±标准差(x±s)表示,组间比较采用两独立样本t检验;若非正态分布则采用中位数(四分位间距)[M(Q1, Q3)]表示,采用Mann-Whitney U检验;计数资料采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者一般资料统计本研究共纳入89例脓毒症患者,其中参附组44例,对照组45例。两组患者年龄、性别、基础疾病、感染部位、氧合指数、APACHE Ⅱ评分以及SOFA评分等比较,均差异无统计学意义(均P > 0.05),组间具有可比性。见表 1。
| 指标 | 对照组(n=45) | 参附组(n=44) | t/χ2值 | P值 |
| 年龄(岁)a | 56.12± 8.58 | 58.19± 9.52 | -1.08 | -1.08 |
| 性别 b | 0.15 | 0.15 | ||
| 男 | 30(66.7) | 31(70.5) | ||
| 女 | 15(33.3) | 13(29.5) | ||
| 基础疾病 b | ||||
| 高血压 | 16(35.5) | 13(29.5) | 0.37 | 0.37 |
| 糖尿病 | 14(31.1) | 17(38.6) | 0.56 | 0.56 |
| 脑血管病 | 12(17.8) | 10(15.9) | 0.19 | 0.19 |
| 感染部位 b | ||||
| 呼吸系统 | 23(51.1) | 21(47.7) | 0.10 | 0.10 |
| 血行感染 | 14(31.1) | 16(36.4) | 0.27 | 0.27 |
| 其他部位 | 8(17.8) | 7(15.9) | 0.06 | 0.06 |
| 氧合指数 a | 248.09± 82.73 | 252.81± 86.97 | -0.26 | -0.26 |
| APACHE Ⅱ评分 a | 25.00± 6.07 | 27.32± 5.54 | -1.88 | -1.88 |
| SOFA评分 a | 8.62± 1.96 | 8.52± 1.72 | 0.26 | 0.26 |
| 注:APACHE Ⅱ评分为急性生理学与慢性健康状况评分Ⅱ;SOFA评分为序贯器官衰竭评分;a为x±s,b为例(%) | ||||
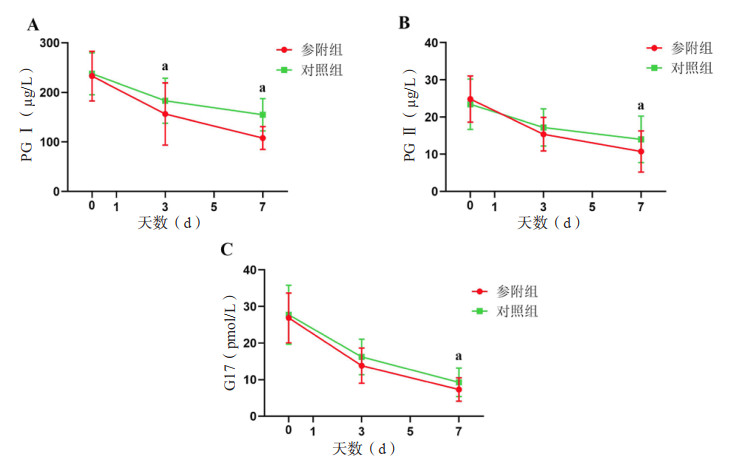
治疗前两组患者血清PGⅠ、PGⅡ和G17均差异无统计学意义(均P > 0.05)。治疗第3天,参附组血清PGⅠ低于对照组[(156.46±62.90) µg/L vs. (183.03±45.44) µg/L, t=-2.29, P < 0.05),两组血清PGⅡ和G17差异无统计学意义(P > 0.05)。治疗第7天,参附组血清PGⅠ、PGⅡ、G17低于对照组[(107.97±23.18) µg/L vs. (154.78±33.11) µg/L, t=-7.71;(10.73±5.62) µg/L vs. (13.83±6.30) µg/L, t=-2.45;(7.31±3.20) pmol/L vs. (9.29±3.92) pmol/L, t=-2.62),差异均有统计学意义(均P < 0.05)。见图 1。
|
| A:两组血清PGⅠ比较;B:两组血清PGⅡ比较;C:两组血清G17比较;两组间比较,aP < 0.05 图 1 两组患者不同时间点血清PGⅠ、PGⅡ和G17的比较 Fig 1 Comparison of serum PGⅠ, PGⅡ, and G17 between the two groups at different times |
|
|
治疗前,两组患者AGI评分差异无统计学意义(P > 0.05);治疗后第3天,参附组AGI评分低于对照组[1.92(1.16, 2.18)分vs. 2.25(2.05, 2.51)分,P=0.001];治疗后第7天,参附组AGI评分低于对照组[1.00(1.00, 2.00)分vs. 2.21(2.03, 2.36)分,P < 0.001]。见表 2。
| 组别 | 入院时 | 治疗第3天 | 治疗第7天 |
| 对照组(n=45) | 2.42(1.99, 2.93) | 2.25(2.05, 2.51) | 2.21(2.03, 2.36) |
| 参附组(n=44) | 2.36(2.27, 2.50) | 1.92(1.16, 2.18) | 1.00(1.00, 2.00) |
| Z值 | 0.123 | 3.383 | 6.017 |
| P值 | 0.902 | 0.001 | < 0.001 |
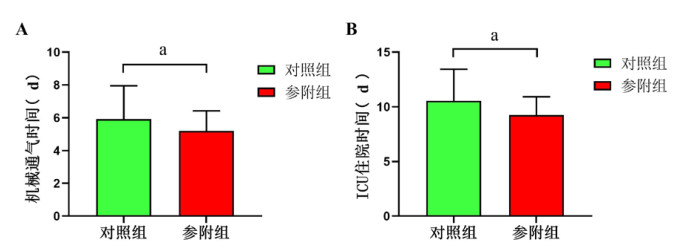
与对照组相比,参附组患者的机械通气时间[(5.91±2.04) d vs. (5.18±1.23) d, t=2.04, P < 0.05]和ICU住院时间[(10.58±2.73) d vs. (9.25±1.75) d, t=2.04, P < 0.05]均明显减少。见图 2。
|
| A:两组机械通气时间比较;B:两组ICU住院时间比较;两组间比较,aP < 0.05 图 2 两组患者机械通气时间和ICU住院时间比较 Fig 2 Comparison of mechanical ventilation time and the length of ICU stay between the two groups |
|
|
胃肠道是脓毒症加重时最早和最易侵犯的器官,同时当胃肠道受损时,炎症反应直接作用于胃肠黏膜,引起胃肠黏膜水肿、充血、自身通透性改变,通过毒素释放和细菌移位等多重机制进一步加重脓毒症,造成恶性循环,严重者引起脓毒性休克、MODS[11-12]。保护胃肠道黏膜功能,对改善脓毒症患者的临床预后具有积极作用,已经成为提高ICU脓毒症患者生存率的重要研究方向。本研究结果显示,参附注射液在改善脓毒症患者的胃肠功能和缩短ICU住院时间方面具有显著效果。
脓毒症在中医学里没有明确定义,指南认为符合以“脱证”、“厥证”范畴即可诊断。中医认为脓毒症是因“正虚一时,邪气暴发”,正气亏虚是疾病发生、发展的内在因素,而胃肠为气血生化之源、后天之本,故在强调“厥证”的治疗同时,应着重关注胃肠功能[13]。参附注射液是一种中药注射剂,源于传统中药参附汤,由红参、附片两味中药组成,临床上主要用于治疗阳气暴脱的厥脱症(如失血、失液性休克以及感染性休克等)[14]。现代药理学研究表明,参附注射液具有拟异丙肾上腺素的作用,在脓毒症的治疗中发挥着改善微循环、抑制炎症反应、清除氧自由基,保护器官再灌注损伤的作用[15-16]。近年来,参附注射液广泛用于脓毒症以及脓毒性休克的治疗,并且在急诊以及ICU患者的应用中表现出良好的治疗效果[17]。据笔者所知,本研究是迄今为止首次探索参附注射液对脓毒症胃肠功能障碍治疗效果的临床研究。
2012年急性胃肠损伤的定义与分级诊疗建议提出了AGI的概念,以腹胀、肠鸣音、消化道出血、腹内压等一系列临床症状与体征为参考,将由于急性损伤导致的胃肠功能障碍分为四个等级,来规范AGI的诊治[10]。近年来,多项研究表明重症患者的AGI与不良预后密切相关,精准地进行AGI的实时评估对于预测危重症患者的预后并积极采取有效手段早期优化危重症患者的治疗具有重要临床意义[18-19]。本研究发现,脓毒症患者应用参附注射液治疗3 d和7 d时,AGI评分较对照组明显降低,说明参附注射液可以改善脓毒症引起的胃肠功能损害。然而在临床实践中,胃肠道的损伤往往在临床表现出现前就已经存在,使得AGI分级在实际临床评估中具有一定的难度和延迟性,单独依靠AGI评分来判断胃肠道功能障碍不利于判断早期病情及指导用药。血清胃功能的指标包括PG Ⅰ、PG Ⅱ和G17,当机体出现应激反应时,胃肠道首先出现这些分泌产物的变化。血清胃蛋白酶原分泌部位主要是胃黏膜的主细胞,在临床上可分成PGⅠ、PG Ⅱ两个亚群,PG值的异常可以早期反应胃部不同部位存在炎症或萎缩[20]。胃泌素是一种重要的胃肠激素,其血清水平的升高常常提示重症患者早期胃肠功能损害,而且还与胃肠功能障碍的严重程度呈正相关,胃肠功能障碍越重,血清中胃泌素水平越高。其中G17由胃窦G细胞合成和分泌,是人体中含量最多并且最重要的胃泌素分子,它可以刺激胃酸的分泌,并且能促进胃黏膜细胞的增殖与分化,对胃肠道功能具有调节作用[21]。
本研究发现,脓毒症患者早期给予参附注射液治疗3 d,患者血清PG Ⅰ水平较常规治疗的患者显著降低,治疗7 d的患者PG Ⅰ、PG Ⅱ和G17水平以较常规治疗患者显著降低,表明在常规治疗基础上加用参附注射液能保护胃肠黏膜屏障,有效改善脓毒症患者胃肠功能。PG Ⅰ、PG Ⅱ和G17等血清胃功能指标能够反映胃黏膜以及胃肠功能情况,早期预测脓毒症引起的胃肠道损伤,本文将血清胃功能与AGI分级相结合,既能全面评估胃肠道功能障碍的严重程度,又能反映早期胃黏膜功能的改变。本研究还发现,与常规治疗相比,参附治疗组机械通气时间以及ICU住院时间显著减少,提示参附注射液在改善脓毒症患者胃肠道功能的同时还可以提高脓毒症患者的疗效并且缩短患者病程。
综上所述,参附注射液联合规范化治疗对脓毒症患者具有显著疗效,能够有效改善血清胃功能,降低AGI分级,缩短机械通气和ICU住院时间,显示出其在脓毒症治疗中的重要作用。然而,参附注射液对胃肠道有利影响的具体机制尚需进一步研究。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张苏明、张尧尧:数据收集、论文撰写;王博、刘艳存:数据整理、统计学分析;Salwa M. Imran、柴艳芬:研究设计、论文修改
| [1] | Ahn YH, Lee J, Oh DK, et al. Association between the timing of ICU admission and mortality in patients with hospital-onset sepsis: a nationwide prospective cohort study[J]. J Intensive Care, 2023, 11(1): 16. DOI:10.1186/s40560-023-00663-6 |
| [2] | Königsrainer I, Türck MH, Eisner F, et al. The gut is not only the target but a source of inflammatory mediators inhibiting gastrointestinal motility during sepsis[J]. Cell Physiol Biochem, 2011, 28(4): 753-760. DOI:10.1159/000335769 |
| [3] | Rossaint J, Zarbock A. Pathogenesis of multiple organ failure in sepsis[J]. Crit Rev Immunol, 2015, 35(4): 277-291. DOI:10.1615/critrevimmunol.2015015461 |
| [4] | Chen DC. Sepsis and intestinal microvascular endothelial dysfunction[J]. Chin Med J (Engl), 2017, 130(10): 1137-1138. DOI:10.4103/0366-6999.205865 |
| [5] | Zhu YN, Wang J, Wang J, et al. Application of serum gastric function markers and digestive tumor indices to the diagnosis of early gastric cancer and precancerous lesions[J]. Saudi Med J, 2023, 44(8): 795-800. DOI:10.15537/smj.2023.44.8.20230231 |
| [6] | Xu P, Zhang WQ, Xie J, et al. Shenfu injection prevents sepsis-induced myocardial injury by inhibiting mitochondrial apoptosis[J]. J Ethnopharmacol, 2020, 261: 113068. DOI:10.1016/j.jep.2020.113068 |
| [7] | 南富耀, 吴彩军, 苏家卉, 等. 年龄校正查尔森合并症指数对脓毒性休克老年患者预后及参附注射液治疗时机的评估[J]. 中华急诊医学杂志, 2023, 32(04): 546-551. DOI:10.3760/cma.j.issn.1671-0282.2023.04.018 |
| [8] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [9] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3): 304-377. DOI:10.1007/s00134-017-4683-6 |
| [10] | Reintam Blaser A, Malbrain MLNG, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems[J]. Intensive Care Med, 2012, 38(3): 384-394. DOI:10.1007/s00134-011-2459-y |
| [11] | Fay KT, Ford ML, Coopersmith CM. The intestinal microenvironment in sepsis[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(10 Pt B): 2574-2583. DOI:10.1016/j.bbadis.2017.03.005 |
| [12] | Tie MH, Chen B, Lv RP, et al. Effects of Shenling Chengqi Decoction on gastrointestinal function and immune status of patients with gastrointestinal injury in severe sepsis[J]. Comput Math Methods Med, 2022, 2022: 2219451. DOI:10.1155/2022/2219451 |
| [13] | 张松, 龙坤兰, 张楷晨, 等. 脓毒症患者中医证候分析[J]. 中华中医药杂志, 2020, 35(10): 5207-5210. |
| [14] | Luo S, Gou LP, Liu SP, et al. Efficacy and safety of Shenfu injection in the treatment of sepsis: a protocol for systematic review and meta-analysis[J]. Medicine, 2021, 100(37): e27196. DOI:10.1097/MD.0000000000027196 |
| [15] | Guo FM, Wang XH, Guo YY, et al. Shenfu administration improves cardiac fibrosis in rats with myocardial ischemia-reperfusion through adenosine A2a receptor activation[J]. Hum Exp Toxicol, 2022, 41: 9603271221077684. DOI:10.1177/09603271221077684 |
| [16] | 孙家艳, 王云云, 谈定玉, 等. 早期应用参附注射液预防脓毒性心肌病的探索性随机对照研究[J]. 中华急诊医学杂志, 2024, 33(3): 353-359. DOI:10.3760/cma.j.issn.1671-0282.2024.03.015 |
| [17] | Zhao LY, Jin LL, Luo YY, et al. Shenfu injection attenuates cardiac dysfunction and inhibits apoptosis in septic mice[J]. Ann Transl Med, 2022, 10(10): 597. DOI:10.21037/atm-22-836 |
| [18] | Han C, Guo NN, Bu Y, et al. Intestinal microbiota and antibiotic-associated acute gastrointestinal injury in sepsis mice[J]. Aging, 2021, 13(7): 10099-10111. DOI:10.18632/aging.202768 |
| [19] | 俞隼, 许春阳, 叶宏伟, 等. 急性胃肠损伤分级联合qSOFA评分在脓毒症诊断中的价值[J]. 中华急诊医学杂志, 2021, 30(11): 1358-1365. DOI:10.3760/cma.j.issn.1671-0282.2021.11.014 |
| [20] | Nguyen CL, Dao TT, Phi TN, et al. Serum pepsinogen: a potential non-invasive screening method for moderate and severe atrophic gastritis among an Asian population[J]. Ann Med Surg, 2022, 78: 103844. DOI:10.1016/j.amsu.2022.103844 |
| [21] | Loong TH, Soon NC, Nik Mahmud NRK, et al. Serum pepsinogen and gastrin-17 as potential biomarkers for pre-malignant lesions in the gastric corpus[J]. Biomed Rep, 2017, 7(5): 460-468. DOI:10.3892/br.2017.985 |
 2024, Vol. 33
2024, Vol. 33