2. 南京大学医学院附属金陵医院(中国人民解放军东部战区总医院)急诊医学科,南京 210002;
3. 南京中医药大学金陵临床医学院 急诊医学科,南京 210002;
4. 徐州医科大学附属徐州市立医院 急诊医学科,徐州 221000
2. Department of Emergency Medicine, Jinling Hospital (General Hospital of Eastern Theater Command), Affiliated Hospital of Medical School, Nanjing University, Nanjing, 210002, China;
3. Department of Emergency Medicine, Jinling Clinical Medical College, Nanjing University of Chinese Medicine, Nanjing 210002, China;
4. Department of Emergency Medicine, Xuzhou Municipal Hospital Affiliated to Xuzhou Medical University, Xuzhou 221000, China
脓毒症是由感染引起的危及生命的免疫紊乱与器官功能障碍,急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是脓毒症最常见、最严重并发症之一。脓毒症相关ARDS疾病严重程度高,常伴严重低氧血症,病死率高[1-2]。鉴于当前治疗的选择比较有限,越来越多的研究开发新的治疗措施,其中,中医药逐渐受到认可[3]。有研究显示,血必净注射液(简称血必净)能够改善脓毒症相关ARDS患者的预后,降低病死率[4]。然而,其潜在机制尚未完全明确。
缺氧诱导因子(hypoxia-inducible factor,HIF)-1α广泛存在于哺乳动物的细胞中,参与多种信号通路,是介导缺氧信号的转导中心。HIF-1α与人类多种生理、病理过程密切相关,HIF-1α异常升高或降低均可能对机体造成损害。目前已发现一些中药可以调控HIF-1α[5]。有文献报道,调控HIF-1α信号通路能够干预脓毒症相关ARDS[6]。但是,目前暂无报道血必净能否通过该通路改善脓毒症相关ARDS。有报道显示,p38 MAPK、NF-κB信号通路在脓毒症相关ARDS中具有重要的致病作用[7]。同时,HIF-1α的调节可以影响p38 MAPK、NF-κB的磷酸化[8]。另外,炎症反应、氧化应激和细胞凋亡被认为是极其相关的事件,它们参与了脓毒症相关ARDS的病理生理过程,且与HIF-1α密切相关。本研究探讨血必净是否可通过调控HIF-1α /p38 MAPK/NF-κB信号通路,发挥抗炎、抗氧化、抗凋亡等作用,改善脓毒症相关ARDS。
1 材料与方法 1.1 实验动物、细胞、药物与试剂C57BL/6小鼠由东部战区总医院实验动物中心提供。小鼠肺泡巨噬细胞(MH-S)购自美国ATCC细胞库。血必净购自天津红日药业股份有限公司。TNF-α、IL-1β、IL-6 ELISA试剂盒购自深圳达科为生物技术股份有限公司。活性氧(reactive oxygen species,ROS)检测试剂盒、脂质氧化丙二醛(malondialdehyde,MDA)检测试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(WST-8法)、Caspase-3活性检测试剂盒购自上海碧云天生物技术有限公司。HIF-1α、p-p38 MAPK、p38 MAPK、NF-κB p65、Bax、Cleaved Caspase-3、Caspase-3一抗购自美国CST公司,p-NF-κB p65、Bcl-2一抗购自美国Abcam公司,β-actin一抗购自上海泊湾生物科技有限公司,山羊抗兔二抗购自美国Jackson Immuno Research公司。脂多糖(LPS)购自美国Sigma公司。二甲基草酰甘氨酸(DMOG)、二甲氧基雌二醇(2ME2)购自美国MCE公司。Annexin V-FITC/PI荧光双染细胞凋亡检测试剂盒购自武汉伊莱瑞特生物科技股份有限公司。
1.2 实验动物分组与处理健康雄性6~8周C57BL/6小鼠(18~22 g)饲养在实验室动物设施中,适应性饲养1周后实验。采用经典盲肠结扎穿孔术(cecal ligation and puncture,CLP)建立脓毒症相关ARDS小鼠模型。将100只小鼠每组25只随机(随机数字法)分为4组:假手术组(Sham组,假手术处理)、CLP组(CLP术处理)、CLP+L-XBJ组(CLP+低剂量血必净处理)、CLP+H-XBJ组(CLP+高剂量血必净处理)。Sham组小鼠仅行开腹操作,不结扎穿刺盲肠。CLP+L-XBJ组给予腹腔注射低剂量血必净[4 mL/(kg·d)],CLP+H-XBJ组给予腹腔注射高剂量血必净[8 mL/(kg·d)],Sham组、CLP组给予等体积0.9%氯化钠溶液,术后连续给药3 d。每组各取10只小鼠观察7 d生存情况,绘制生存曲线。余每组小鼠于术后72 h处以安乐死,每组随机选取6只小鼠获取标本。
1.3 苏木精-伊红(HE)染色和肺损伤评分4 %多聚甲醛固定肺组织,石蜡包埋,切片,HE染色。显微镜下观察肺组织病理学变化并行肺损伤评分。
1.4 肺湿/干(W/D)比用吸水纸吸干肺组织表面液体,称湿重(W),然后置于60℃干燥器中72 h去除所有水分,称干重(D),计算W/D比。
1.5 支气管肺泡灌洗液(bronchoalveolar lavage fluids,BALF)分析留取BALF予1 500 r/min离心10 min(4℃),PBS重悬细胞沉淀,行总细胞计数。BALF细胞涂片用Wright-Giemsa染色确定中性粒细胞计数。BCA法测定总蛋白浓度。
1.6 ELISA法检测炎症因子水平按照ELISA试剂盒说明配置试剂,取各组小鼠血清以及MH-S细胞上清液进行实验操作,并计算炎症因子水平。
1.7 氧化应激指标检测根据制造商说明,分别使用ROS检测试剂盒、脂质氧化MDA检测试剂盒和SOD活性检测试剂盒,测定肺组织与细胞的ROS、MDA和SOD值。
1.8 蛋白质免疫印迹法(Western blot, WB)肺组织或细胞在RIPA裂解缓冲液中冰上裂解30 min,12 000 r/min离心30 min(4 ℃)。BCA法测定蛋白浓度,将各组浓度调至相同。加入SDS-PAGE蛋白上样缓冲液(5×),震荡混匀,100 ℃金属浴10 min。使用SDS-PAGE凝胶电泳分离蛋白提取物,并电印迹到PVDF膜。5% (w/v)脱脂牛奶封闭膜2 h,4 ℃下孵育稀释一抗过夜。TBST(含0.1% Tween 20)洗膜3次10 min后,孵育稀释二抗2 h。使用极超敏ECL化学发光试剂对蛋白条带显影,Image J软件分析条带强度,并将结果归一化为β-actin表达。
1.9 免疫组织化学(Immunohistochemistry,IHC)石蜡切片二甲苯脱蜡,梯度乙醇水化,柠檬酸抗原修复液(PH 6.0)修复抗原,3% H2O2阻断内源性过氧化物酶,3% BSA封闭30 min。加入稀释的一抗4 ℃孵育过夜。次日复温30 min,PBS浸洗3次。加入即用型快捷免疫组织化学MaxVisionTM HRP二抗室温孵育30 min。DAB工作液显色,苏木精复染,脱水封片。使用显微镜观察拍照,ImageJ分析平均吸光度。
1.10 细胞培养、处理和分组使用RPMI-1640完全培养基(含100 U/mL青霉素与100 μg/mL链霉素的双抗生素、10%胎牛血清FBS)在37 ℃、5% CO2细胞培养箱中培养MH-S细胞。细胞传至3代后用于实验造模。将细胞分为6组:对照组(Con组,无处理)、LPS组(LPS处理)、LPS+L-XBJ组(LPS+低剂量血必净处理)、LPS+H-XBJ组(LPS+高剂量血必净处理)、LPS+H-XBJ+DMOG组(LPS+高剂量血必净+HIF-1α激动剂DMOG处理)、LPS+H-XBJ+2ME2组(LPS+高剂量血必净+HIF-1α抑制剂2ME2处理),其中LPS给药浓度5 μg/mL,低、高剂量血必净浓度2、5 µL/mL,DMOG浓度100 μmol/L,2ME2浓度2 μmol/L。处理24 h后,收集细胞和上清液下一步实验。
1.11 CCK-8法检测细胞活力胰蛋白酶消化细胞,RPMI-1640完全培养基重悬,96孔板中接种细胞(2×104个/mL),培养24 h。分别使用LPS、血必净、DMOG、2ME2处理24 h后,取10% CCK-8液100 μL孵育细胞1~2 h,酶标仪检测吸光度,确定LPS、血必净、DMOG、2ME2合适浓度。
1.12 流式细胞术检测细胞凋亡6孔板接种并培养细胞。分组处理至时长后,PBS洗涤,胰酶(不含EDTA)消化,1 200 r/min离心5 min,PBS洗涤3次。500 μL binding buffer重悬,加入Annexin V-FITC与PI各5 μL,避光孵育15 min。使用流式细胞仪测凋亡,FlowJo软件分析。
1.13 Caspase-3活性检测分组处理至时长后,细胞在冷裂解液中裂解15min,离心取上清液,使用Caspase-3活性检测试剂盒,测定Caspase-3活性。
1.14 免疫荧光(Immunofluorescence,IF)将细胞接种于15 mm玻璃底培养皿,生长至适当浓度后分组处理。至时长后,PBS洗涤3次,4%多聚甲醛固定,0.3% Triton X-100穿孔破膜20 min,3% BSA 37 ℃封闭1h,稀释的一抗4 ℃孵育过夜,Alexa FluorTM 488 donkey anti-Rabbit IgG (H+L)二抗37℃孵育1 h,DAPI染核10 min,加入抗荧光淬灭封片液。使用倒置荧光显微镜观察,ImageJ计算荧光强度。
1.15 统计学方法采用GraphPad Prism 8.0.2软件统计分析。所有定量资料均呈正态分布,以均数±标准差(x±s)表示。使用单因素方差分析多组间比较,Tukey's检验组间多重比较。使用Kaplan–Meier方法构建生存曲线。以P < 0.05表示差异具有统计学意义。所用实验至少进行3次独立的实验。
2 结果 2.1 血必净改善脓毒症相关ARDS小鼠的肺组织损伤和存活率组织病理学研究结果显示,与Sham组相比,CLP组小鼠肺组织出现肺泡充血、出血、炎细胞浸润、肺泡壁增厚等明显病理性改变,肺损伤评分和肺组织W/D比显著升高(P < 0.01);与CLP组相比,CLP+L-XBJ组、LPS+H-XBJ组的肺组织病理性改变显著减轻,肺损伤评分和肺组织W/D比显著降低(P < 0.05),且LPS+H-XBJ组变化更明显。见图 1A-C。该结果表明血必净可以减轻脓毒症相关ARDS小鼠的肺组织损伤。生存分析显示,Sham组小鼠在7 d内全部存活;与Sham组相比,CLP组小鼠存活率显著降低(P < 0.05);与CLP组相比,CLP+L-XBJ组、LPS+H-XBJ组存活率显著升高(P < 0.05),且LPS+H-XBJ组升高更明显。见图 1D。该结果表明血必净可以提高脓毒症相关ARDS小鼠的存活率。
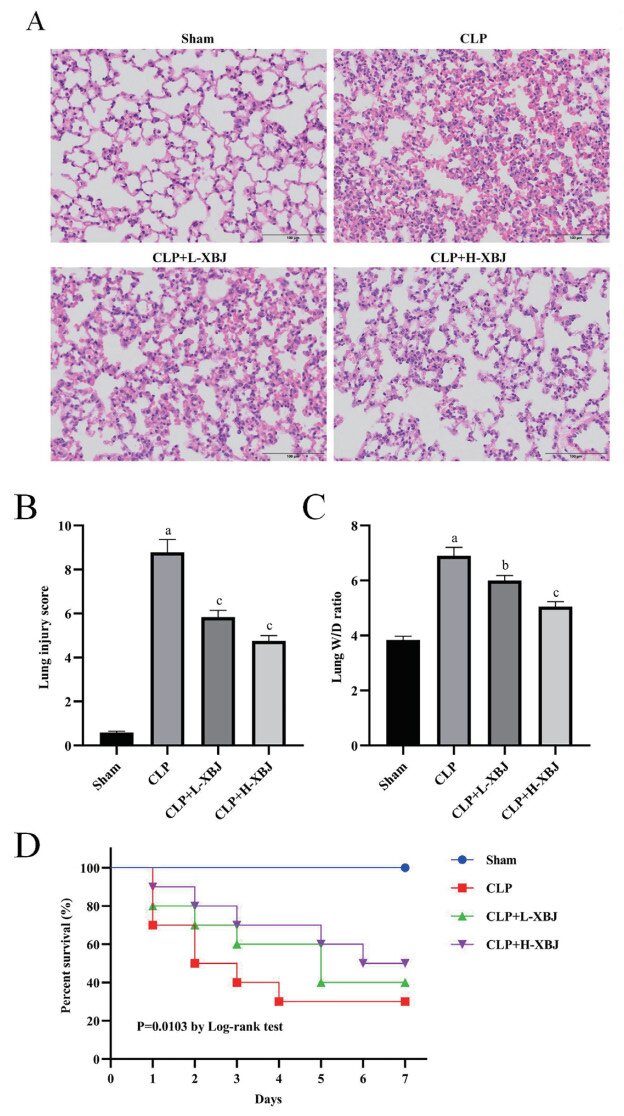
|
| 与Sham组相比,aP<0. 01;与CLP组相比,bP<0. 05,cP<0. 01 图 1 血必净改善脓毒症相关ARDS小鼠的肺组织损伤和存活率(HE,×200) Fig 1 Xuebijing ameliorated lung tissue injury and survival rate in mice with sepsis-associated ARDS(HE, ×200) |
|
|
研究结果显示,与Sham组相比,CLP组小鼠总细胞计数、中性粒细胞计数、蛋白浓度显著增加(P < 0.01);与CLP组相比,CLP+L-XBJ组、LPS+H-XBJ组的总细胞计数、中性粒细胞计数、蛋白浓度显著减少(P < 0.01),且LPS+H-XBJ组减少更明显。见图 2A。该结果表明血必净可以减少脓毒症相关ARDS小鼠BALF的细胞计数和蛋白浓度,减少肺部炎细胞浸润与蛋白渗出,维持肺毛细血管通透性。ELISA检测显示,与Sham组相比,CLP组小鼠血清中TNF-α、IL-1β、IL-6水平显著上升(P < 0.01);与CLP组相比,CLP+L-XBJ组、LPS+H-XBJ组血清中TNF-α、IL-1β、IL-6水平显著下降(P < 0.05),且LPS+H-XBJ组下降更明显。见图 2B。该结果表明血必净可以抑制脓毒症相关ARDS小鼠的炎症反应。氧化应激检测结果显示,与Sham组相比,CLP组小鼠肺组织ROS、MDA显著增加,SOD显著减少(P < 0.01);与CLP组相比,CLP+L-XBJ组、LPS+H-XBJ组ROS、MDA显著减少,SOD显著增加(P < 0.05),且LPS+H-XBJ组变化更明显。见图 2C。该结果表明血必净可以逆转脓毒症相关ARDS小鼠的ROS、MDA、SOD表达变化,减轻氧化应激。
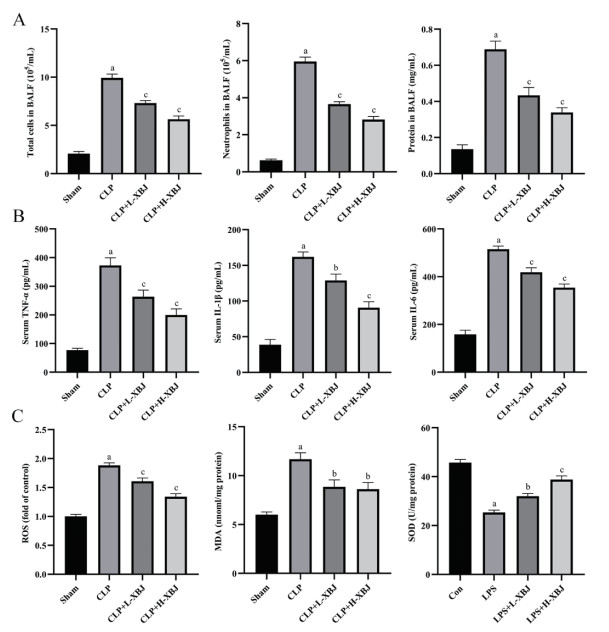
|
| 与Sham组相比,aP<0. 01;与CLP组相比,bP<0. 05,cP<0. 01 图 2 血必净减轻脓毒症相关ARDS小鼠的炎症和氧化应激 Fig 2 Xuebijing alleviated inflammation and oxidative stress in mice with sepsis-associated ARDS |
|
|
Western blot结果显示,与Sham组相比,CLP组小鼠肺组织Bax、Cleaved Caspase-3蛋白表达显著上升,Bcl-2显著下降(P < 0.01);与CLP组相比,CLP+L-XBJ组、LPS+H-XBJ组Bax、Cleaved Caspase-3蛋白表达显著下降,Bcl-2显著上升(P < 0.05),且LPS+H-XBJ组的蛋白表达变化更明显。见图 3A。该结果证实,血必净可以降低脓毒症相关ARDS小鼠肺组织的细胞凋亡。同时,Bax的免疫组织化学检测进一步验证了该结果,见图 3B。
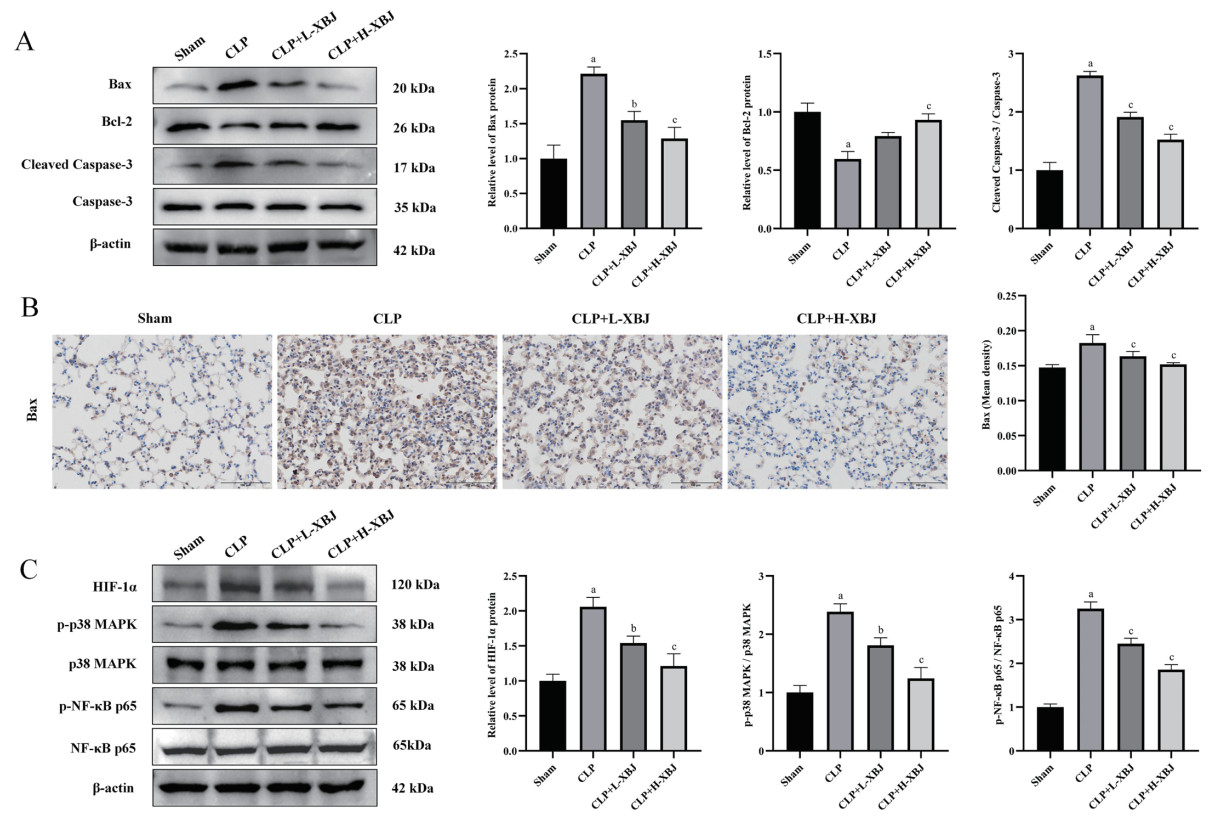
|
| 与Sham组相比,aP<0. 01;与CLP组相比,bP<0. 05,cP<0. 01 图 3 血必净对脓毒症相关ARDS小鼠肺组织的细胞凋亡与HIF-1α/p38 MAPK/NF-κB信号通路的影响(IHC,×200) Fig 3 Effects of Xuebijing on cell apoptosis and HIF-1α/p38 MAPK/NF-κB signaling pathway in lung tissue of mice with sepsis-associated ARDS (IHC, ×200) |
|
|
Western blot结果显示,与Sham组相比,CLP组小鼠肺组织HIF-1α、p-p38 MAPK、p-NF-κB p65蛋白表达显著上升(P < 0.01);与CLP组相比,CLP+L-XBJ组、LPS+H-XBJ组的HIF-1α、p-p38 MAPK、p-NF-κB p65蛋白表达显著下降(P < 0.05),且LPS+H-XBJ组下降更明显。见图 3C。该结果表明,血必净可以抑制脓毒症相关ARDS小鼠的HIF-1α/p 38MAPK/NF-κB信号通路的蛋白表达。
2.5 不同浓度LPS、血必净、DMOG与2ME2对MH-S细胞活力的影响为明确LPS、血必净、DMOG、2ME2对MH-S细胞活力的影响,使用CCK-8法检测细胞活力,结果显示,5 µL/mL及以内的血必净、100 μmol/L及以内的DMOG、2 μmol/L及以内的2ME2对细胞活力无明显影响(P > 0.05),5 µg/mL及以上的LPS、10 µL/mL及以上的血必净、200 μmol/L及以上的DMOG、5 μmol/L及以上的2ME2使细胞活力明显下降(P < 0.05)。见图 4A。因此,后续细胞实验LPS的最大给药浓度为5 µg/mL,血必净最大给药浓度为5 µL/mL,DMOG、2ME2给药浓度分别为100 μmol/L、2 μmol/L。此外,为研究本实验使用浓度的血必净、DMOG、2ME2对LPS诱导的MH-S细胞活力的叠加影响,CCK-8法检测结果显示,与Con组相比,LPS组的细胞活力显著下降(P < 0.01);与LPS组相比,LPS+L-XBJ、LPS+H-XBJ、LPS+H-XBJ+DMOG、LPS+H-XBJ+2ME2组的细胞活力显著上升(P < 0.05),且与Con组相比这4组的细胞活力未见明显降低(P > 0.05)。见图 4B。由此可见,血必净能够抑制LPS对MH-S细胞的损伤,维持细胞活力。
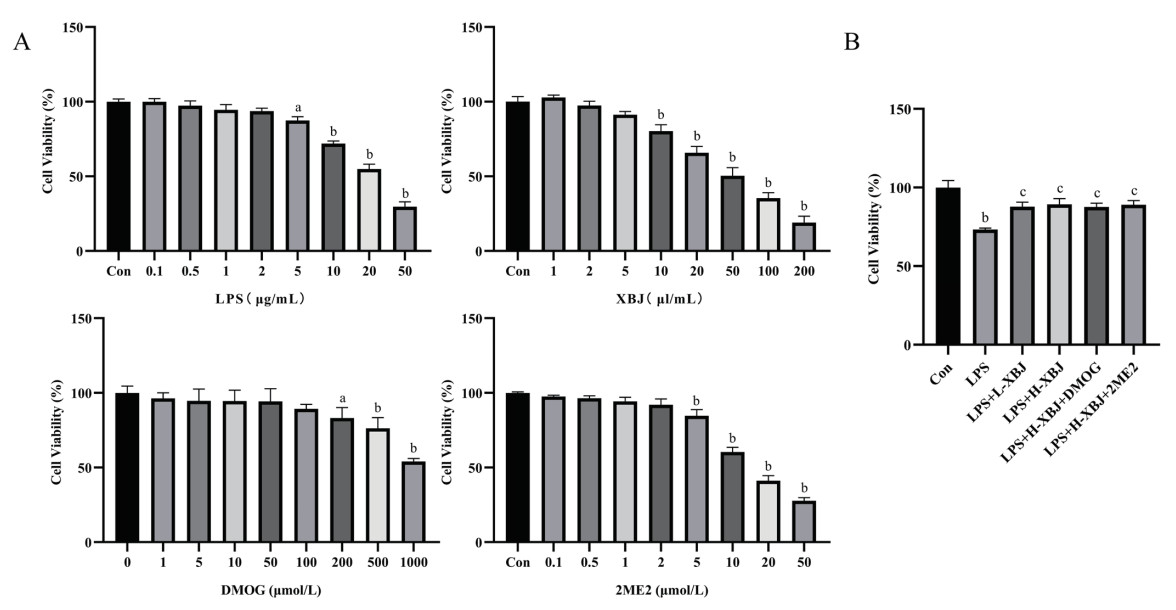
|
| 与Con组相比aP<0. 05,bP<0. 01;与LPS组相比cP<0. 05 图 4 CCK-8法检测LPS、血必净、DMOG与2ME2对MH-S细胞活力的影响 Fig 4 Effects of LPS, Xuebijing, DMOG, and 2ME2 on the viability of MH-S cells determined by CCK-8 assay |
|
|
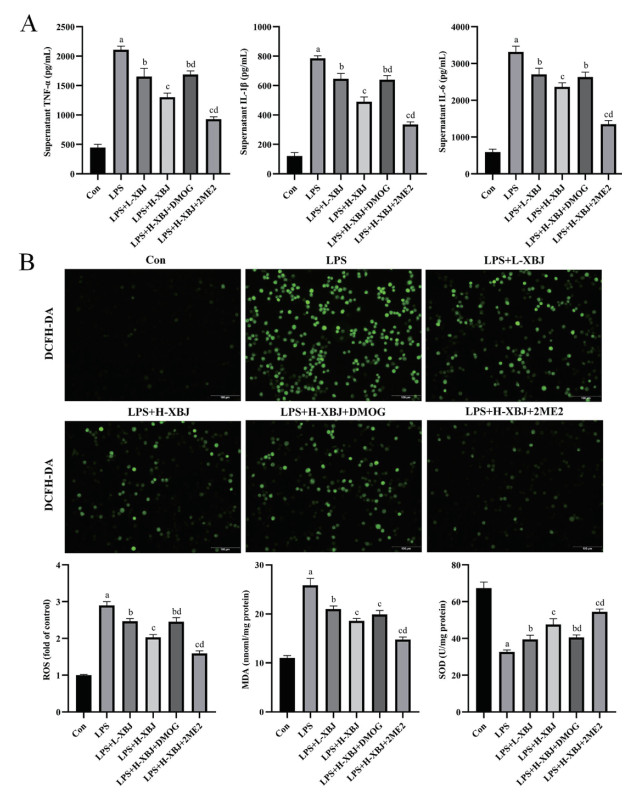
ELISA检测结果显示,LPS可以显著升高TNF-α、IL-1β、IL-6表达(P < 0.01),血必净能够呈剂量依赖性显著降低LPS诱导的MH-S细胞中TNF-α、IL-1β和IL-6的表达(P < 0.05),DMOG可以减弱、2ME2可以加强血必净对上述炎症因子的降低(P < 0.05)。见图 5A。该结果表明,血必净能够抑制LPS诱导的MH-S细胞中的炎症反应。氧化应激检测结果显示,LPS诱导使MH-S细胞内ROS、MDA显著增加,SOD显著减少(P < 0.01),血必净能够呈剂量依赖性显著逆转LPS诱导的MH-S细胞中ROS、MDA、SOD的变化(P < 0.05),DMOG可以减弱、2ME2可以加强血必净对上述指标的调节(P < 0.05)。见图 5B。该结果表明,血必净能够减轻LPS诱导的MH-S细胞的氧化应激。
|
| 与Con组相比,aP<0. 01;与LPS组相比,bP<0. 05,cP<0. 01;与LPS+H-XBJ组相比,dP<0. 05 图 5 血必净减轻LPS诱导的MH-S细胞的炎症和氧化应激(ROS,×200) Fig 5 Xuebijing attenuated inflammation and oxidative stress in LPS- induced MH-S cells(ROS, ×200) |
|
|
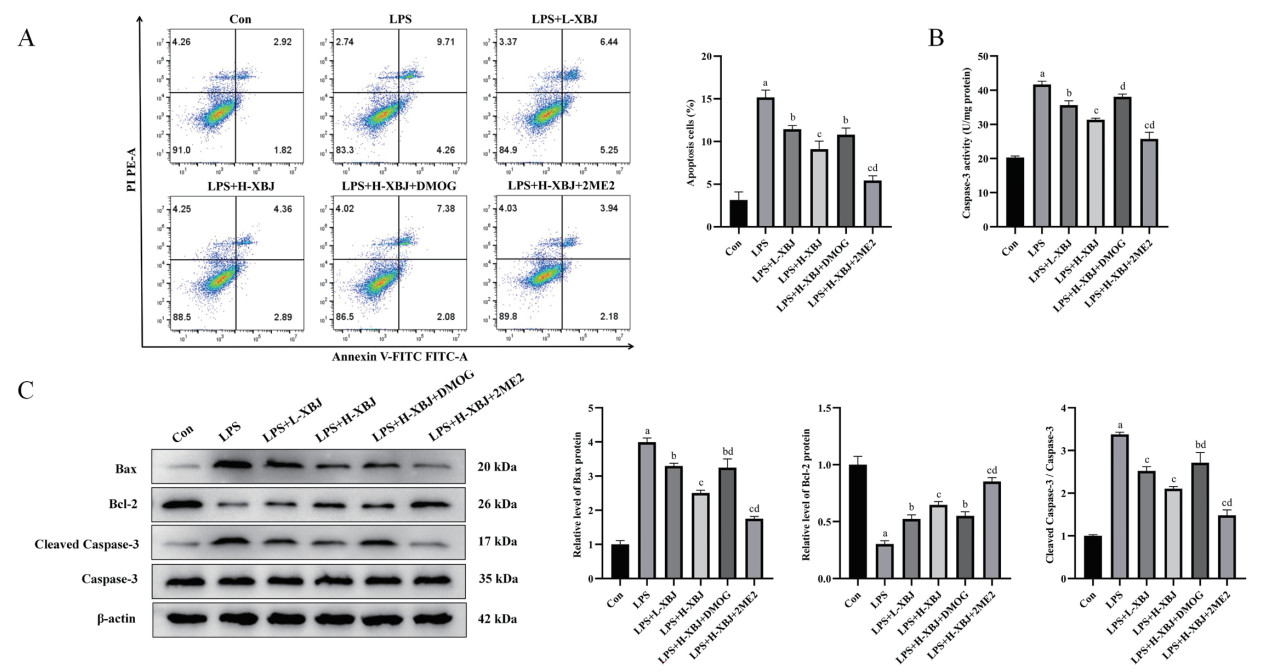
流式细胞术结果显示LPS可以显著升高细胞凋亡率(P < 0.01),血必净能够使之显著降低(P < 0.05),并呈剂量依赖性,DMOG可以减弱、2ME2可以加强血必净对细胞凋亡率的降低(P < 0.05)。见图 6A。另外,Caspase-3活性检测进一步验证了血必净对LPS诱导的MH-S细胞凋亡的降低作用。见图 6B。Western blot检测结果显示,LPS可以显著上调Bax、Cleaved Caspase-3蛋白表达,下调Bcl-2蛋白表达(P < 0.01),血必净能够呈剂量依赖性显著逆转LPS诱导的MH-S细胞中上述蛋白的表达变化(P < 0.05),DMOG可以减弱、2ME2可以加强血必净对上述蛋白的调节(P < 0.05)。见图 6C。该结果表明,血必净能够降低LPS诱导的MH-S细胞凋亡。
|
| 与Con组相比,aP<0. 01;与LPS组相比,bP<0. 05,cP<0. 01;与LPS+H-XBJ组相比,dP<0. 05 图 6 血必净降低LPS诱导的MH-S细胞凋亡 Fig 6 Xuebijing reducesed apoptosis of LPS- induced MH-S cells |
|
|
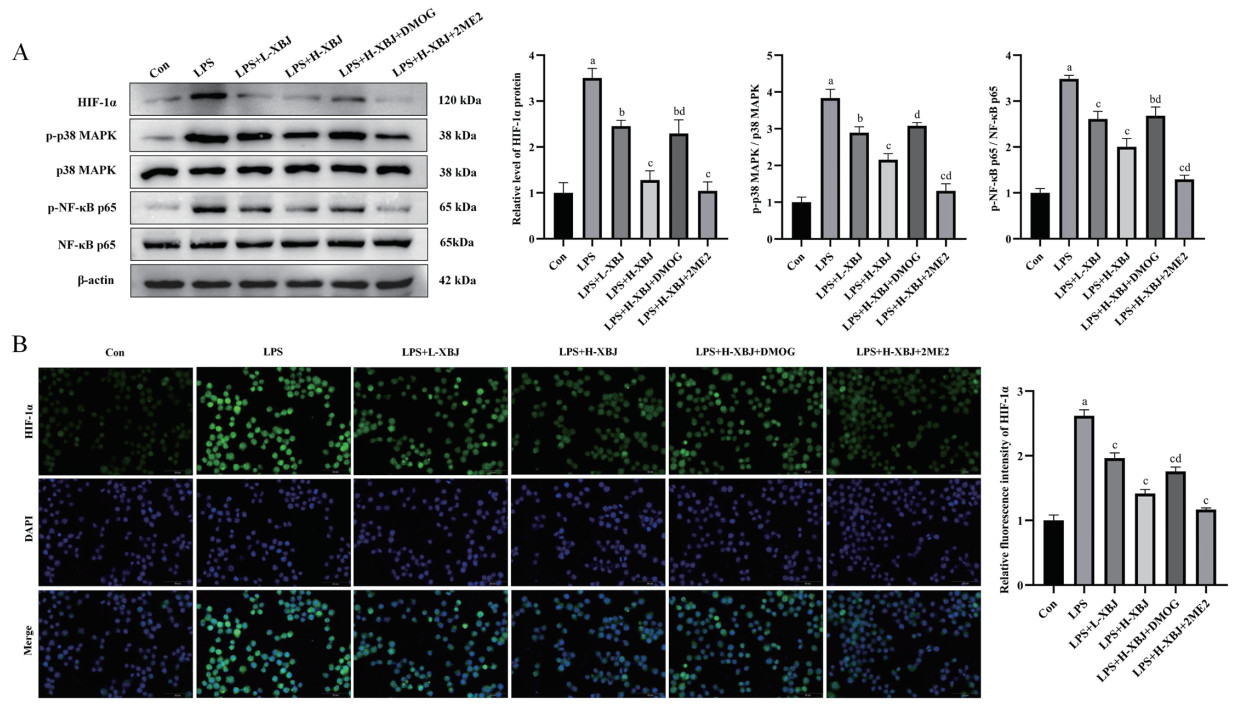
Western blot结果显示,LPS可以显著上调HIF-1α、p-p38 MAPK、p-NF-κB p65蛋白表达(P < 0.01),血必净能够显著下调LPS诱导的MH-S细胞中上述蛋白的表达变化(P < 0.05),并呈现剂量依赖性,同时,DMOG可以减弱、2ME2可以加强血必净对上述蛋白的下调(P < 0.05)。见图 7A。另外,HIF-1α的免疫荧光检测进一步验证了该结果,见图 7B。这些结果表明,血必净能够抑制LPS诱导的MH-S细胞的HIF-1α/p38 MAPK/NF-κB信号通路的激活,从而发挥抗炎、抗氧化、抗凋亡作用。
|
| 与Con组相比,aP<0. 01;与LPS组相比,bP<0. 05,cP<0. 01;与LPS+H-XBJ组相比,dP<0. 05 图 7 血必净抑制LPS诱导的MH-S细胞的HIF-1α/p38 MAPK/NF-κB信号通路(IF,×400) Fig 7 Xuebijing inhibited the HIF-1α/p38 MAPK/NF-κB signaling pathway in LPS- induced MH-S cells |
|
|
近年来,随着对脓毒症相关ARDS的研究加深,包括血必净在内的中医药研究逐渐受到重视。血必净源自血府逐瘀汤,具有化瘀、解毒等功效,其组成成分为红花、赤芍、丹参、川芎与当归。虽已证明血必净可以改善脓毒症相关ARDS[9],然而,其具体机制仍待阐明。鉴于此,本研究首先使用HE染色、肺损伤评分证实血必净可以减轻脓毒症相关ARDS小鼠的肺组织损伤、生存分析显示血必净可以提高脓毒症相关ARDS小鼠的存活率,这与既往报道相似[10]。随后,通过多种实验方法研究其机制。
脓毒症相关ARDS最初是由失调的炎症驱动的[11]。巨噬细胞吞噬病原体的同时,能够产生大量炎症因子。对病原体清除而言,炎症因子十分重要,但高水平的炎症因子会加重炎症与免疫反应。因此,清除高水平的炎症因子,调节炎症失衡对减轻脓毒症相关ARDS意义重大。本研究结果表明,血必净可以在体内和体外减轻脓毒症相关ARDS的炎症反应,降低TNF-α、IL-1β、IL-6等炎症因子水平。另外,肺水肿、毛细血管通透性增加等多种病理过程也参与了脓毒症相关ARDS的发病机制[12]。肺W/D比升高反映肺水肿加重,BALF中的蛋白浓度升高反映脓毒症相关ARDS小鼠的肺毛细血管通透性增加,本研究证实血必净可以使其降低。
在脓毒症相关ARDS的病理生理过程中,氧化应激是起关键作用的核心机制之一。脓毒症相关ARDS炎症反应过程中可释放大量炎症细胞和细胞因子,促进氧化应激反应产生大量ROS,对细胞造成不同程度损伤[13]。同时,氧化应激又可以加重炎症反应并促进疾病进展[14]。脓毒症相关ARDS表现为过度的ROS积累和MDA形成,以及保护细胞免受氧化损伤的抗氧化酶SOD减少。既往血必净的研究主要集中在抗炎等作用上,其对氧化应激影响的研究仍偏少。本研究发现血必净减轻了脓毒症相关ARDS的氧化应激,表现为使用血必净后,LPS诱导的MH-S细胞和CLP诱导的脓毒症相关ARDS小鼠肺组织中,ROS、MDA含量降低以及SOD活力增加。
脓毒症能够诱导细胞凋亡,诱发ARDS[15-16]。研究证实,肺上皮细胞凋亡与脓毒症相关ARDS发生发展相关,抑制细胞凋亡可以减轻ARDS[17]。此外,在脓毒症相关ARDS发病过程中,免疫细胞凋亡起关键作用。起初,免疫细胞凋亡可以减轻肺部炎症改善ARDS,其中包括T、B淋巴细胞与巨噬细胞等;但是,当免疫细胞大量凋亡时会出现免疫受损,加重病情[18]。在脓毒症相关ARDS中,细胞凋亡发挥关键作用,调控凋亡也是治疗该病的关键环节之一。本研究通过动物和细胞实验,证实了血必净能够降低脓毒症相关ARDS的凋亡。
HIF-1是由功能亚基HIF-1α和结构亚基HIF-1β组成的异源二聚体,HIF-1α是缺氧调节亚基,它控制HIF-1介导的基因转录的缺氧诱导[19]。缺氧发生时,HIF-1α能够调节一系列缺氧相关基因的表达以维持体内氧稳态。HIF-1α也是参与炎症调节的重要因子[20],是炎症反应过程中与基因调控相关的重要因素。ARDS有正反馈促炎作用,大量炎症因子上调HIF-1α,增加的HIF-1α刺激炎症因子的释放,放大炎症反应,并加重肺损伤[21]。此外,HIF-1α与氧化应激之间也存在密切联系。缺氧最初可能促进ROS产生,ROS可以促进HIF-1α的激活[22],HIF-1 α又能够促进氧化应激[23]。有研究证实,HIF-1α促进细胞凋亡[24],这种效应可能与HIF-1α调控的不同信号通路有关。因此,在脓毒症相关ARDS发病过程中,HIF-1α可能参与了炎症反应、氧化应激、凋亡等病理生理过程,调控HIF-1α信号通路可能有助于抗炎、抗氧化和抗凋亡。研究证实,HIF-1α信号通路在脓毒症相关ARDS中发挥作用[25],调控HIF-1α能够干预脓毒症相关ARDS[26]。然而,通过调控HIF-1α信号通路,血必净能否保护脓毒症相关ARDS未见报道。本研究的体内和体外实验均表明血必净可以抑制脓毒症相关ARDS中HIF-1α的表达。
MAPKs是一种广泛存在于真核细胞中的丝氨酸/苏氨酸蛋白激酶,MAPK被分为3个主要亚家族:ERK、JNK和p38,其中,p38 MAPK是应激信号中最重要的MAPK[27]。研究证实,p38 MAPK信号通路除了参与应激、炎症反应外,还与细胞凋亡、分化等密切相关[28]。NF-κB是B淋巴细胞中的二聚体转录因子,在静息状态下不具有转录活性,当受到外界刺激时,启动靶基因的转录和表达。常见激活形式是二聚体p65/p50。NF-κB与宿主免疫反应、炎症反应、细胞增殖、凋亡等过程有关[29]。文献报道,阻断p38 MAPK、NF-κB信号通路可以减轻脓毒症相关ARDS[30]。而HIF-1α的表达变化可以影响p38 MAPK、NF-κB的活性[8]。由此可见,HIF-1α/p38 MAPK/NF-κB信号通路在脓毒症相关ARDS中发挥重要作用。本研究在动物和细胞实验均证实了血必净在抑制HIF-1α表达的同时也抑制了p38 MAPK和NF-κB磷酸化。
鉴于上述研究结果,为了进一步阐明脓毒症相关ARDS中血必净表现出的抗炎、抗氧化和抗凋亡作用是否与调控HIF-1α活性直接相关,本研究不仅使用不同浓度血必净处理了LPS诱导的MH-S细胞,还在此基础上分别加用了HIF-1α激动剂DMOG和HIF-1α抑制剂2ME2,从正反两方面验证了血必净可以通过抑制HIF-1α/p38 MAPK/NF-κB信号通路,降低炎症因子TNF-α、IL-1β和IL-6表达,减少氧化应激过程中ROS、MDA产生和SOD消耗,下调促凋亡蛋白Bax、Cleaved Caspase-3表达,上调抗凋亡蛋白Bcl-2表达,降低细胞凋亡率。
综上所述,本研究通过动物和细胞实验的多种方法,研究血必净改善脓毒症相关ARDS的具体作用机制,最终证实,血必净能够通过抑制HIF-1α/p38 MAPK/NF-κB信号通路,发挥抗炎、抗氧化、抗凋亡等作用,改善脓毒症相关ARDS。本研究为血必净治疗脓毒症相关ARDS的临床应用提供了实验支持和科学依据,并为血必净干预炎症、氧化应激和凋亡相关疾病提供了一些有益证据。但是,本研究还存在一些局限性,DMOG和2ME2都是HIF-1α表达的调节剂,它们的作用可能不能仅仅归因于对HIF-1α信号通路的调节。因此,下一步需构建HIF-1α过表达或低表达慢病毒、建立HIF-1α基因敲除小鼠模型等进一步相关研究探索。
利益冲突 所有作者声明无利益冲突
作者贡献声明 丁伟超:实验操作、论文撰写、数据收集及整理、统计学分析;陈娟:实验操作、数据收集及整理、统计学分析;姬晓航、任艺、张炜、王蒙蒙、冯靖、伍芯瑶、孟健康:实验操作;聂时南、孙兆瑞:研究设计、论文修改、经费支持
| [1] | Hu QH, Hao CP, Tang SJ. From sepsis to acute respiratory distress syndrome (ARDS): emerging preventive strategies based on molecular and genetic researches[J]. Biosci Rep, 2020, 40(5): BSR20200830. DOI:10.1042/BSR20200830 |
| [2] | 杨铃清, 马辰东, 王雷, 等. 光甘草定调控NETs抑制细胞焦亡缓解脓毒症肺损伤机制[J]. 中华急诊医学杂志, 2024, 33(2): 179-185. DOI:10.3760/cma.j.issn.1671-0282.2024.02.007 |
| [3] | Song YQ, Lin WJ, Zhu W. Traditional Chinese medicine for treatment of sepsis and related multi-organ injury[J]. Front Pharmacol, 2023, 14: 1003658. DOI:10.3389/fphar.2023.1003658 |
| [4] | 周长静, 周雅楠, 杨蕾, 等. 血必净注射液治疗脓毒症伴轻度急性呼吸窘迫综合征疗效及对多配体蛋白聚糖-1和氧化应激指标的影响[J]. 药物评价研究, 2023, 46(7): 1552-1558. DOI:10.7501/j.issn.1674-6376.2023.07.020 |
| [5] | Li RL, He LY, Zhang Q, et al. HIF-1α is a potential molecular target for herbal medicine to treat diseases[J]. Drug Des Dev Ther, 2020, 14: 4915-4949. DOI:10.2147/dDDT.s274980 |
| [6] | Li XY, Yu JB, Gong LR, et al. Heme oxygenase-1(HO-1) regulates Golgi stress and attenuates endotoxin-induced acute lung injury through hypoxia inducible factor-1α (HIF-1α)/HO-1 signaling pathway[J]. Free Radic Biol Med, 2021, 165: 243-253. DOI:10.1016/j.freeradbiomed.2021.01.028 |
| [7] | Li ZL, Fu XP, Fan YR, et al. Effect of epicatechin on inflammatory cytokines and MAPK/NF-κB signaling pathway in lipopolysaccharideinduced acute lung injury of BALB/c mice[J]. Gen Physiol Biophys, 2022, 41(4): 299-308. DOI:10.4149/gpb_2022023 |
| [8] | Jiao X, Zhang YX, Li WT, et al. HIF-1α inhibition attenuates severity of Achilles tendinopathy by blocking NF-κB and MAPK pathways[J]. Int Immunopharmacol, 2022, 106: 108543. DOI:10.1016/j.intimp.2022.108543 |
| [9] | Zhang CP, Chen XY, Wei TC, et al. Xuebijing alleviates LPS-induced acute lung injury by downregulating pro-inflammatory cytokine production and inhibiting gasdermin-E-mediated pyroptosis of alveolar epithelial cells[J]. Chin J Nat Med, 2023, 21(8): 576-588. DOI:10.1016/S1875-5364(23)60463-7 |
| [10] | Shang T, Zhang ZS, Wang XT, et al. Xuebijing injection inhibited neutrophil extracellular traps to reverse lung injury in sepsis mice via reducing Gasdermin D[J]. Front Pharmacol, 2022, 13: 1054176. DOI:10.3389/fphar.2022.1054176 |
| [11] | Meyer NJ, Gattinoni L, Calfee CS. Acute respiratory distress syndrome[J]. Lancet, 2021, 398(10300): 622-637. DOI:10.1016/s0140-6736(21)00439-6 |
| [12] | Lv HM, Liu QM, Wen ZM, et al. Xanthohumol ameliorates lipopolysaccharide (LPS)-induced acute lung injury via induction of AMPK/GSK3β-Nrf2 signal axis[J]. Redox Biol, 2017, 12: 311-324. DOI:10.1016/j.redox.2017.03.001 |
| [13] | Gong HK, Chen Y, Chen ML, et al. Advanced development and mechanism of sepsis-related acute respiratory distress syndrome[J]. Front Med, 2022, 9: 1043859. DOI:10.3389/fmed.2022.1043859 |
| [14] | Jiang JY, Huang K, Xu SQ, et al. Erratum to Targeting NOX4 alleviates sepsis-induced acute lung injury via attenuation of redox-sensitive activation of CaMKII/ERK1/2/MLCK and endothelial cell barrier dysfunction, Redox Biology 36 (2020) 101638[J]. Redox Biol, 2021, 48: 102200. DOI:10.1016/j.redox.2021.102200 |
| [15] | Zhou HC, Wang XH, Zhang B. Depression of lncRNA NEAT1 antagonizes LPS-evoked acute injury and inflammatory response in alveolar epithelial cells via HMGB1-RAGE signaling[J]. Mediators Inflamm, 2020, 2020: 8019467. DOI:10.1155/2020/8019467 |
| [16] | Girardot T, Rimmelé T, Venet F, et al. Apoptosis-induced lymphopenia in sepsis and other severe injuries[J]. Apoptosis, 2017, 22(2): 295-305. DOI:10.1007/s10495-016-1325-3 |
| [17] | Li XY, Jamal M, Guo PP, et al. Irisin alleviates pulmonary epithelial barrier dysfunction in sepsis-induced acute lung injury via activation of AMPK/SIRT1 pathways[J]. Biomedecine Pharmacother, 2019, 118: 109363. DOI:10.1016/j.biopha.2019.109363 |
| [18] | Yang L, Zhang Z, Zhuo YZ, et al. Resveratrol alleviates sepsis-induced acute lung injury by suppressing inflammation and apoptosis of alveolar macrophage cells[J]. Am J Transl Res, 2018, 10(7): 1961-1975. |
| [19] | Evans CE. Hypoxia-inducible factor signaling in inflammatory lung injury and repair[J]. Cells, 2022, 11(2): 183. DOI:10.3390/cells11020183 |
| [20] | Talwar H, Bauerfeld C, Liu YS, et al. The dataset describes: HIF-1 α expression and LPS mediated cytokine production in MKP-1 deficient bone marrow derived murine macrophages[J]. Data Brief, 2017, 14: 56-61. DOI:10.1016/j.dib.2017.07.036 |
| [21] | 林红卫, 金发光. 缺氧诱导因子1在急性肺损伤中的研究进展[J]. 国际呼吸杂志, 2019, 39(24): 1885-1889. DOI:10.3760/cma.j.issn.1673-436X.2019.24.009 |
| [22] | Xia TY, Guo JN, Zhang BM, et al. Bisphenol A promotes the progression of colon cancer through dual-targeting of NADPH oxidase and mitochondrial electron-transport chain to produce ROS and activating HIF-1α/VEGF/PI3K/AKT axis[J]. Front Endocrinol, 2022, 13: 933051. DOI:10.3389/fendo.2022.933051 |
| [23] | 何丽囡, 兰钰茹, 贺光明, 等. 白藜芦醇通过调控HIF-1α/NOX4/ROS通路抑制低氧诱导的大鼠肺动脉平滑肌细胞氧化应激与增殖[J]. 生理学报, 2020, 72(5): 551-558. DOI:10.13294/j.aps.2020.0067 |
| [24] | He XY, Shi XY, Yuan HB, et al. Propofol attenuates hypoxia-induced apoptosis in alveolar epithelial type Ⅱ cells through down-regulating hypoxia-inducible factor-1α[J]. Injury, 2012, 43(3): 279-283. DOI:10.1016/j.injury.2011.05.037 |
| [25] | Meng Y, Kong KW, Chang YQ, et al. Histone methyltransferase SETD2 inhibits M1 macrophage polarization and glycolysis by suppressing HIF-1α in sepsis-induced acute lung injury[J]. Med Microbiol Immunol, 2023, 212(5): 369-379. DOI:10.1007/s00430-023-00778-5 |
| [26] | Li XQ, Shan C, Wu ZH, et al. Emodin alleviated pulmonary inflammation in rats with LPS-induced acute lung injury through inhibiting the mTOR/HIF-1α/VEGF signaling pathway[J]. Inflamm Res, 2020, 69(4): 365-373. DOI:10.1007/s00011-020-01331-3 |
| [27] | Feng Y, Fang ZC, Liu BY, et al. p38MAPK plays a pivotal role in the development of acute respiratory distress syndrome[J]. Clinics, 2019, 74: e509. DOI:10.6061/clinics/2019/e509 |
| [28] | Li WL, Li D, Chen YS, et al. Classic signaling pathways in alveolar injury and repair involved in sepsis-induced ALI/ARDS: new research progress and prospect[J]. Dis Markers, 2022, 2022: 6362344. DOI:10.1155/2022/6362344 |
| [29] | Alharbi KS, Fuloria NK, Fuloria S, et al. Nuclear factor-kappa B and its role in inflammatory lung disease[J]. Chem Biol Interact, 2021, 345: 109568. DOI:10.1016/j.cbi.2021.109568 |
| [30] | Cong ZK, Li D, Tao YF, et al. α2A-AR antagonism by BRL-44408 maleate attenuates acute lung injury in rats with downregulation of ERK1/2, p38MAPK, and p65 pathway[J]. J Cell Physiol, 2020, 235(10): 6905-6914. DOI:10.1002/jcp.29586 |
 2024, Vol. 33
2024, Vol. 33




