2. 新疆医科大学第一附属医院急救·创伤中心急诊内科,乌鲁木齐 830011;
3. 临沂市人民医院生物样本库,临沂 276000;
4. 临沂市人民医院脑肿瘤与功能神经外科,临沂 276000
2. Emergency Trauma Center, The First Affiliated Hospital of Xinjiang Medical University, Wulumuqi 830011, China;
3. Biobank, Linyi People's Hospital, Linyi 276000, China;
4. Department of Neurosurgery, Linyi People's Hospital, Linyi 276000, China
作为脓毒症的严重并发症和感染后过度免疫反应的临床表现,急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)相关的免疫功能障碍与继发性细菌或真菌感染构成恶性循环[1]。从1967年第一例ARDS病例报告,到2023年ESICM指南根据病程、影像学表现以及肺水肿和缺氧的恶性程度做出精确而全面的定义,ARDS因其复杂的发病机制和高病死率一直是研究人员关注的焦点[2-3],能否准确的预测病情发展并实施个性化的临床干预措施是改善预后的关键[4]。
免疫相关的肺泡-毛细血管屏障损伤是脓毒性ARDS的特征之一,由复杂的体内/体外因素共同诱导的“炎症风暴”导致全身炎性组织损伤,临床表现为肺水肿、持续缺氧,严重者可伴弥漫性肺功能和结构损伤、呼吸衰竭甚至死亡[5]。免疫相关的肺泡-毛细血管屏障损伤研究对于揭示脓毒性ARDS的进展至关重要。
目前脓毒性ARDS和免疫相关损伤的研究集中于临床标志物和基于转录组的生物标志物研究,但作为一种高度异质性的感染性疾病,上述方法难以揭示脓毒性ARDS个体间迥异的生物学过程。因此,本研究综合单细胞测序数据和转录组数据,通过构建脓毒性ARDS的细胞分化轨迹和细胞通讯特征,从单细胞层面探讨免疫细胞分化在肺泡-毛细血管屏障损伤中的作用。
1 材料与方法 1.1 数据下载与整理从GEO数据库(https://www.ncbi.nlm.nih.gov/)下载转录组和单细胞测序数据,排除诊断数据缺失的样本。转录组数据使用“sva”包对数据集进行合并和批次校正。使用“limma”包进行差异性分析。WGCNA建立ARDS相关基因共表达网络,模块成员相关性(Module Membership,MM) > 0.6和基因重要性(Gene significance,GS) > 0.3的基因标注为ARDS相关基因(ARDS-related genes,ARGs)。单细胞测序数据使用“Seurat”软件包进行质量控制后,剔除了基因 < 100个、测序 < 50个或线粒体基因含量 > 5%的细胞。主成分分析(principal component analysis, PCA)确定显著的分离维度(FDR < 0.05)。使用TSNE算法对主成分(Principal components, PCs)进行降维并聚类。
1.2 细胞分化轨迹和细胞通讯伪时序分析建立细胞分化轨迹,轨迹内高度变异基因用于细胞注释,其中免疫细胞分化轨迹中的高变异基因标注为免疫分化相关基因(immunodifferentiation-related genes,IDRGs)。使用“CellChat”预测细胞通讯及其相关信号通路和配体-受体对。
1.3 构建RS取ARGs和IDRGs的交集基因,使用“glmnet”包进行Lasso回归分析构建ARDS相关逻辑回归模型。使用“rms”包绘制列线图,“rmda”和“pROC”包分别绘制决策曲线和ROC曲线,用以评估RS的有效性和准确性。
1.4 RS组间免疫微环境使用CIBERSORT评估免疫浸润;以基因表达中位值将患者分为高表达组(High)和低表达组(Low),使用ssGSEA评估基因表达对免疫细胞丰度的影响。使用Lasso回归分析筛选ARDS相关的免疫细胞,“Corrplot”包展示基因与免疫细胞的相关性。
1.5 RS组间生物学功能Metascape(https://metascape.org/)、GSVA和GO富集分析展示信号通路和生物学过程。基因组富集分析基于分子特征数据库(c2.cp.kegg.Hs.symbols.gmt和c5.go.Hs.symbols.gmt)进行,根据默认的加权富集度,随机组合数的临界值为1 000,名义P 值(NOM P-val) < 0.05,假发现率(FDR) < 0.25。
1.6 统计学方法所有统计分析基于R4.4.0进行。计量资料以均数±标准差(x±s)表示。两样本比较采用成组t检验,多样本的比较采用单因素方差分析。定性数据以百分比(%)表示,组间比较采用χ2检验。生存分析采用Cox回归和Kaplan-Meier分析(P < 0.05)。皮尔逊相关系数(r)评估基因间表达相关性,以P < 0.05为差异有统计学意义。
2 结果 2.1 数据下载与处理转录组数据集GSE104747,GSE32707和GSE66890包含正常、单纯脓毒症、脓毒性ARDS的全血样本,消除批次效应后合并数据(图 1A~B)。单细胞测序数据集GSE242127包含3名患者第1天和第7天的6个脓毒性ARDS全血样本;GSE264032包含2个鼠气管内注射LPS诱导的急性肺损伤样本和1个正常样本。对GSE242127的脓毒性ARDS第1天血液样本(GSM7749422、GSM7749424、GSM7749426)的质量控制分别展示了每个样本检测的基因数目(图 1C)、测序深度(图 1D)和样品中线粒体的含量(图 1E);测序深度与线粒体基因序列无关(r=0.1,图 1F),但与细胞内总序列呈正相关(r=0.91,图 1G)。前1500个高变异基因用于细胞注释(图 1H),PCA得分图用于评价质控后的三个样品(GSM7749422、GSM7749424、GSM7749426)间细胞差异性(图 1I),降维后获得15个PCs(图 1J)。GSE264032的小鼠脓毒性肺损伤模型的肺组织样本(GSM8209056)经质量控制后,测序深度与线粒体基因序列无关(r=NA),但与细胞内总序列呈正相关(r=0.95),降维后获得20个PCs。

|
| A-B: Transcriptome data merged after eliminating batch effects. C-G: Quality control of GSE242127 single-cell sequencing data. H: The top 1500 high-variable genes of GSE242127 annotated as signature genes. I-J: PCA of GSE242127 图 1 转录组和单细胞测序数据的处理 Fig 1 The processing of transcriptome and single-cell sequencing data |
|
|
小鼠急性肺损伤模型(GSE264032)的细胞分化轨迹包含粒细胞、B细胞、T细胞、单核细胞、树突状细胞、NK细胞、成纤维细胞、巨噬细胞、红细胞和内皮细胞(图 2A)。细胞相互作用的数量(图 1B)和细胞相互作用的强度(图 2C)显示免疫细胞与成纤维细胞/内皮细胞间的调控关系。以成纤维细胞和内皮细胞为目标的信号通路包括TGFb、EGF、FGF、IGF、MIF、IL6、OSM、IFN-I、IFN-II、TNF、SPP1、VISFATIN、ANGPTL、EDN、PARs、GAS、PROS、GALECTIN、VEGF、CCL、CXCL、KIT、SEMA3和CALCR(图 2D)。

|
| A: Cell differentiation trajectory of GSE264032 lung tissue. B: Number of cell communication. C: Strength of cell communication. D: Signaling pathways and receptor-ligand pairs of cell communication 图 2 脓毒性ARDS的细胞分化轨迹和细胞通讯 Fig 2 Cell differentiation trajectories and cell communication in septic ARDS |
|
|
WGNCA对基因和表型聚类(图 3A),并评估基因模块与表型模块(健康vs. ARDS)的相关性(图 3B),与脓毒性ARDS相关性最显著的天青色模块(turquoise module)(r=0.38,P < 0.05)内的1075个核心基因标注为ARGs(MM > 0.6,GS > 0.3)(图 3C)。人脓毒性ARDS全血单细胞测序样本(GSE242127_ GSM7749422、GSE242127_GSM7749424和GSE242127_GSM7749426)经降维聚类后的细胞分群包含单核细胞、T细胞、B细胞、NK细胞、血小板和中性粒细胞(图 3D),对应13个clusters(图 3E),它们中的高变异基因以热图的形式展示(图 3F),排除血小板(cluster 9)外的1147个高变异基因标注为IDRGs。取ARGs和IDRGs的186个交集基因(图 3G),细胞通讯分析显示它们激活了CCL和TGFb信号通路,涉及免疫细胞对内皮细胞和成纤维细胞的调控(图 3H~I)。

|
| A: WGCNA clustering genes and phenotypes. B: Correlation analysis of gene modules and phenotypes. C: Scatter plot of genes within the turquoise module (MM > 0.6, GS > 0.3) with the most significant septic ARDS correlation (R=0.38, P < 0.05). D: Cell types of GSE242127 after dimensionality reduction and clustering. E: PCs of GSE242127 after dimensionality reduction and clustering. F: Heatmap of highly variable gene expression in PCs. G: Intersecting genes of ARGs and IDRGs. H-I: Cell communication and related signaling pathways activated by intersecting genes. 图 3 脓毒性ARDS相关基因 Fig 3 Septic ARDS-related genes |
|
|
ARGs和IDRGs的186个交集基因在经Lasso回归分析筛选(图 4A),构建了包含DSTN、SNRPA和FGL2的RS(图 4B)。高RS多为于脓毒性ARDS,低RS多为单纯脓毒症,两者差异有统计学意义(P < 0.01)(图 4C)。DSTN、SNRPA和FGL2在正常、单纯脓毒症和脓毒性ARDS中差异表达(图 4D)。在小鼠急性肺损伤的细胞分化进程中,Dstn、Snrpa和Fgl2富集于内皮细胞、巨噬细胞、成纤维细胞、树突状细胞、单核细胞和粒细胞(图 4E);在人脓毒性ARDS血液样本的细胞分化进程中,DSTN、SNRPA和FGL2主要富集于B细胞、NK细胞、T细胞和单核细胞(图 4F)。从GSE10474、GSE32707和GSE66890提取单纯脓毒症和脓毒性ARDS患者表达数据,包含133个单纯脓毒症和131个脓毒性ARDS,构建包含DSTN、SNRPA和FGL2的列线图,预测单纯脓毒症进展为脓毒性ARDS的可能性(图 4G),并使用决策曲线(图 4H)和ROC曲线(图 4I)检验其有效性和准确性。

|
| A-B: Lasso regression analysis established RS containing DSTN, SNRPA, and FGL2. C: Correlation analysis between RS and clinical characteristic. D: Differential expression of DSTN, SNRPA and FGL2 in healthy, sepsis and septic ARDS. E: Dstn, Snrpa, and Fgl2 affect cell differentiation in mice with septic acute lung injury. F: DSTN, SNRPA and FGL2 affect cell differentiation in human with septic ARDS. G: A nomogram predicting the progression of sepsis to septic ARDS. H-I: DCA and ROC test the validity and accuracy of RS. 图 4 构建RS Fig 4 Construction of RS |
|
|
ssGSEA显示DSTN、SNRPA和FGL2的差异表达影响了9种免疫细胞(CD8+T细胞、Th1细胞、辅助性T细胞,Th1辅助细胞、T调节细胞、中性粒细胞、NK细胞、肥大细胞和浆细胞样树突状细胞)和9种免疫功能(细胞溶解活性、促炎、副炎症、T细胞共抑制、抗原呈递细胞公抑制、免疫检查点、人类白细胞抗原、主要组织相容性复合体Ⅰ类分子和Ⅰ型干扰素)(图 5A~C)。筛选脓毒性ARDS中差异表达的免疫细胞(P < 0.05)(图 5D),经过Lasso回归筛选后,记忆B细胞、浆细胞、CD8+T细胞、巨噬细胞M0是脓毒性ARDS相关免疫细胞(图 5E),其中DSTN与M0负相关(r=-0.29,P < 0.05),SNRPA与CD8+T细胞正相关(r=0.28,P < 0.05),FGL2与记忆B细胞正相关(r=0.32,P < 0.05)(图 5F)。RS组间差异表达的免疫细胞包括CD4幼稚型T细胞、CD4记忆激活T细胞、调节T细胞、γ-δ T细胞、M0、激活的树突状细胞(图 5G)。
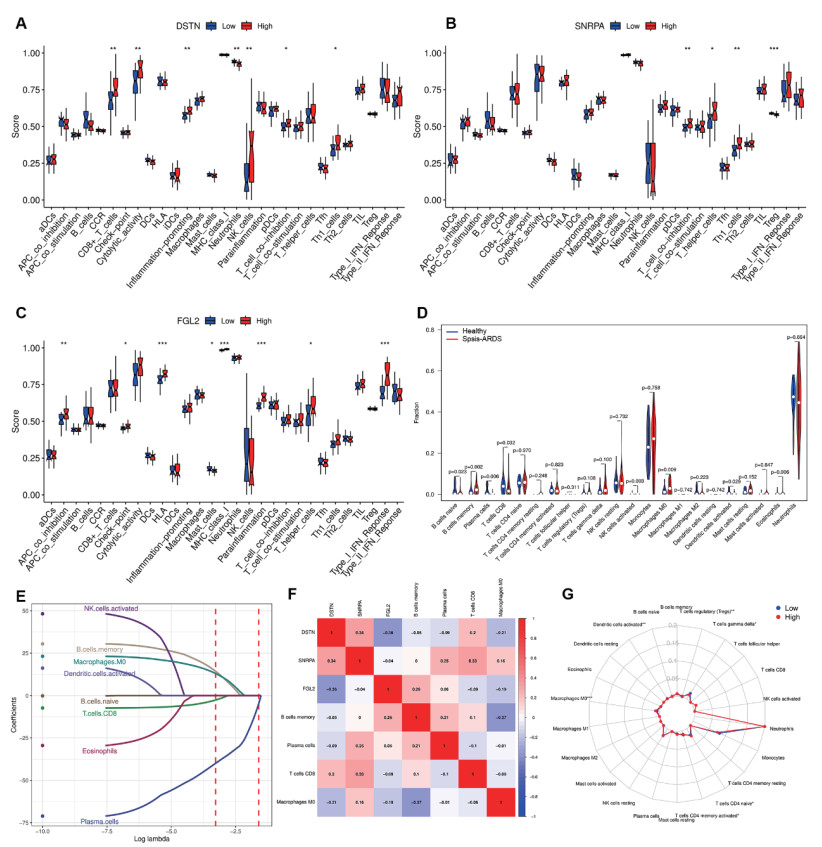
|
| A-C: DSTN, SNRPA, and FGL2-related immune cell abundance assessed by ssGSEA. D: Immune infiltration of septic ARDS assessed by CIBERSORT. E: Identification of septic ARDS-related immune cells by Lasso regression. F: Correlation analysis of DSTN, SNRPA, and FGL2 with immune cells. G: Differences in the immune microenvironment between RS groups 图 5 RS相关免疫微环境 Fig 5 RS-related immune microenvironment |
|
|
ARGs和IDRGs的186个交集基因的生物学功能涉及免疫系统中细胞因子信号传导、抗原呈递、免疫系统的调控、细胞凋亡等生物学功能。DSTN的差异表达激活了B细胞受体信号通路、Notch信号通路、Toll样受体信号通路、p53信号通路(图 6B);SNRPA的差异表达激活了细胞分子-受体相互作用信号通路、Toll样受体信号通路、凋亡信号通路(图 6C);FGL2的差异表达激活了VEGF信号通路、抗原加工和呈递信号通路(图 6D)。它们共同影响了MHC对T细胞的激活、树突状细胞的抗原呈递、记忆T细胞的分化调控和肌动蛋白丝的解聚/切断(图 6E)。

|
| A: The biological functions of the intersecting genes of ARGs and IDRGs. B-D: DSTN, SNRPA, and FGL2-related signaling pathways assessed by GSVA. E: RS-related biological functions assessed by GO analysis 图 6 RS相关生物学功能 Fig 6 RS-related biological functions |
|
|
脓毒症作为最常见、最致命的感染性疾病,被描述为“宿主对感染的反应不平衡导致的危及生命的器官衰竭”,包括肺损伤、肾损伤、肝损伤和心脏损伤等,其中以呼吸系统功能障碍为主的脓毒性ARDS对病原体的易感性和治疗效果的个体差异明显,一直是研究人员关注的焦点[6]。
脓毒性ARDS的病理学基础是严重的全身炎性反应,即“宿主对感染的反应不平衡”导致的免疫相关肺泡-毛细血管屏障损伤[7]。肺泡-毛细血管屏障被认为是呼吸系统抵御病原体入侵的前线,由肺泡上皮(扁平的Ⅰ型细胞和立方体Ⅱ型细胞)、成纤维细胞、血管内皮细胞和肺泡巨噬细胞组成。Ⅰ型肺泡上皮细胞确保稳定的气体交换,并分泌血小板衍生生长因子A和血管内皮生长因子A,以滋养成纤维细胞和肺泡毛细血管的内皮细胞。Ⅱ型肺泡上皮细胞主要分泌表面活性剂,降低肺泡表面张力,并与成纤维细胞分泌的弹性蛋白合作,发挥抗张力作用,维持肺泡的良好形态和功能。血管内皮细胞是环绕肺泡的毛细血管网的结构基础,它将循环血液与肺间质和空气隔开。肺泡巨噬细胞是肺泡对病原体的非特异性炎症反应的重要组成部分,因为它存在于肺泡中并清除吸气时带入的颗粒和微生物[8-9]。肺泡-毛细血管屏障破坏是免疫相关性肺泡损伤的标志,也是ARDS恶化的特征[10]。
脓毒性ARDS细胞分化和生物过程存在多样性[11]。肺泡的超微结构研究表明,“炎症风暴”中炎症介质的失控性激活和释放是免疫相关的肺泡-毛细血管屏障损伤的基础,可导致肺内皮细胞凋亡、肺泡毛细血管通透性增加、细胞连接松弛、炎性肺泡蛋白渗漏等[12]。免疫相关损伤是一个复杂的过程,包括炎症反应、抗原递呈、血管内皮细胞钙调蛋白的改变、细胞凋亡、自噬和氧化应激等[13-14]。在本研究中基于LPS诱导的小鼠ARDS模型,笔者建立了ARDS相关肺组织的的细胞分化轨迹,结果表明细胞分化轨迹不仅包括免疫效应细胞(单核细胞、T细胞、B细胞、NK细胞和巨噬细胞)和与免疫刺激因子的招募/释放相关的粒细胞,还包括内皮细胞和成纤维细胞。而进一步的细胞通讯分析表明,在急性肺损伤的进程中内皮细胞和成纤维细胞作为免疫细胞的调控目标,受到多达22条信号通路的影响,它们涉及免疫系统中细胞因子信号传导、抗原呈递、免疫系统的调控、细胞凋亡等生物学功能。重叠的细胞分化轨迹和复杂的细胞间通讯表明肺毛细血管内皮细胞和成纤维细胞的分化与特定的免疫微环境有关,免疫浸润影响了肺泡-毛细血管屏障的结构和功能完整性。
动物模型明确了免疫细胞与内皮细胞/成纤维细胞的潜在联系,因此,我们基于人全血单细胞测序数据和转录组数据,分别建立了脓毒性ARDS的免疫细胞的分化轨迹和疾病相关基因共表达网络,使用Lasso回归模型构建了包含DSTN、SNRPA和FGL2的免疫分化相关RS。DSTN、SNRPA和FGL2不仅在脓毒性ARDS中差异表达,而且与免疫细胞、成纤维细胞和内皮细胞的分化相关。细胞通讯表明RS可以通过TGFb和CCL信号通路影响免疫细胞对内皮细胞/成纤维细胞分化的调控,功能涵盖细胞增殖、凋亡、分化和迁移,以及传导细胞因子、调节免疫反应等。基因富集分析表明DSTN、SNRPA和FGL2的差异表达激活了包括B细胞受体信号通路、Notch信号通路、Toll样受体信号通路、p53信号通路、细胞分子-受体相互作用信号通路,凋亡信号通路,VEGF信号通路、抗原加工和呈递信号通,它们共同影响了MHC对T细胞的激活、树突状细胞的抗原呈递、记忆T细胞的分化调控和肌动蛋白丝的解聚/切断。
既往研究证实,全身炎症免疫反应和免疫功能障碍在ARDS中起着重要作用[15-16]。早期的研究利用单细胞RNA测序技术,对ARDS的早期基因标记物和免疫景观进行了探索,以期能够发现辅助治疗的机会[17]。He等[18]研究证实,与健康人群相比,脓毒性ARDS患者的免疫细胞群体严重失衡,患者的B细胞比例明显降低,表明ARDS患者的B淋巴细胞功能受损。进一步的研究发现,随着ARDS患者炎症反应的减轻,B细胞水平逐渐升高,提示B细胞水平可能是ARDS患者预后的预测因素[19]。除B细胞外,ARDS患者的NK细胞和CD4+T细胞也都有不同程度的减少[20]。Huang等[21]研究发现Th1细胞分化、Th2细胞分化、PI3K-Akt信号通路、NOD受体信号通路、IL-17信号通路以及补体和调节凝血级联在ARDS免疫细胞中富集。异常的补体激活,引起高凝状态和高炎症反应,最终导致组织损伤,脓毒性ARDS的细胞毒性细胞更倾向于Th1细胞免疫。上述研究都证实免疫微环境对ARDS的发生和发展都产生了重要的影像,并且免疫微环境的变化与ARDS患者病情的进展和预后密切相关。在本研究中,RS对脓毒性ARDS的免疫微环境有着显著的影响,经过Lasso回归筛选后,记忆B细胞,浆细胞,CD8+T细胞,巨噬细胞M0是脓毒性ARDS相关免疫细胞,其中DSTN与M0负相关(r=-0.29,P < 0.05),SNRPA与CD8+T细胞正相关(r=0.28,P < 0.05),FGL2与记忆B细胞正相关(r=0.32,P < 0.05)。RS组间差异表达的免疫细胞包括CD4幼稚型T细胞、CD4记忆激活T细胞、调节T细胞、γ-δ T细胞、M0、激活的树突状细胞。以基因表达的中位值将患者分为高/低表达组,ssGSEA表明DSTN、SNRPA和FGL2可以影响9种免疫细胞(CD8+T细胞、Th1细胞、辅助性T细胞,Th1辅助细胞、T调节细胞、中性粒细胞、NK细胞、肥大细胞和浆细胞样树突状细胞)和9种免疫功能(细胞溶解活性、促炎、副炎症、T细胞共抑制、抗原呈递细胞公抑制、免疫检查点、人类白细胞抗原、主要组织相容性复合体Ⅰ类分子和Ⅰ型干扰素),并与M0、CD8+T和记忆B细胞的表达相关。上述结果提示DSTN、SNRPA和FGL2影响了ARDS进程中的免疫浸润,可作为预测脓毒性ARDS中免疫相关损伤的潜在特征基因。
综上所述,本研究通过构建脓毒性ARDS的细胞分化轨迹和细胞通讯特征,揭示了肺部免疫细胞、内皮细胞和成纤维细胞间相互作用。免疫相关RS(DSTN、SNRPA和FGL2)影响免疫细胞、成纤维细胞和内皮细胞的分化,调节脓毒性ARDS的免疫微环境,是预测脓毒性ARDS进展的潜在标志物。但是,由于缺乏体内-体外实验的验证,DSTN、SNRPA和FGL2在脓毒性ARDS内表达差异性和相关生物学功能需要进一步探讨。
利益冲突 所有作者声明无利益冲突
作者贡献声明 迟骋:数据分析、论文撰写;李雯莉:数据收集及整理;陆玉成:统计学分析;华实:研究设计、论文修改
| [1] | Ono S, Tsujimoto H, Hiraki S, et al. Mechanisms of sepsis-induced immunosuppression and immunological modification therapies for sepsis[J]. Ann Gastroenterol Surg, 2018, 2(5): 351-358. DOI:10.1002/ags3.12194 |
| [2] | Grasselli G, Calfee CS, Camporota L, et al. ESICM guidelines on acute respiratory distress syndrome: definition, phenotyping and respiratory support strategies[J]. Intensive Care Med, 2023, 49(7): 727-759. DOI:10.1007/s00134-023-07050-7 |
| [3] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [4] | Su CF, Kao SJ, Chen HI. Acute respiratory distress syndrome and lung injury: Pathogenetic mechanism and therapeutic implication[J]. World J Crit Care Med, 2012, 1(2): 50-60. DOI:10.5492/wjccm.v1.i2.50 |
| [5] | Torres LK, Pickkers P, van der Poll T. Sepsis-induced immunosuppression[J]. Annu Rev Physiol, 2022, 84: 157-181. DOI:10.1146/annurev-physiol-061121-040214 |
| [6] | Saguil A, Fargo MV. Acute respiratory distress syndrome: diagnosis and management[J]. Am Fam Physician, 2020, 101(12): 730-738. |
| [7] | Xu HK, Sheng SY, Luo WW, et al. Acute respiratory distress syndrome heterogeneity and the septic ARDS subgroup[J]. Front Immunol, 2023, 14: 1277161. DOI:10.3389/fimmu.2023.1277161 |
| [8] | Zhang K, Yao E, Wang SA, et al. A functional circuit formed by the autonomic nerves and myofibroblasts controls mammalian alveolar formation for gas exchange[J]. Dev Cell, 2022, 57(13): 1566-1581.e7. DOI:10.1016/j.devcel.2022.05.021 |
| [9] | Branchfield K, Li RB, Lungova V, et al. A three-dimensional study of alveologenesis in mouse lung[J]. Dev Biol, 2016, 409(2): 429-441. DOI:10.1016/j.ydbio.2015.11.017 |
| [10] | Matthay MA, Ware LB, Zimmerman GA. The acute respiratory distress syndrome[J]. J Clin Invest, 2012, 122(8): 2731-2740. DOI:10.1172/JCI60331 |
| [11] | Mo JJ, Yang YL, Feng JH, et al. Single-cell analysis reveals dysregulated inflammatory response in peripheral blood immunity in patients with acute respiratory distress syndrome[J]. Front Cell Dev Biol, 2023, 11: 1199122. DOI:10.3389/fcell.2023.1199122 |
| [12] | Liu D, Huang SY, Sun JH, et al. Sepsis-induced immunosuppression: mechanisms, diagnosis and current treatment options[J]. Mil Med Res, 2022, 9(1): 56. DOI:10.1186/s40779-022-00422-y |
| [13] | El Agha E, Thannickal VJ. The lung mesenchyme in development, regeneration, and fibrosis[J]. J Clin Invest, 2023, 133(14): e170498. DOI:10.1172/JCI170498 |
| [14] | Storck EM, Wojciak-Stothard B. Rho GTPases in pulmonary vascular dysfunction[J]. Vascul Pharmacol, 2013, 58(3): 202-210. DOI:10.1016/j.vph.2012.09.004 |
| [15] | van der Poll T, Shankar-Hari M, Wiersinga WJ. The immunology of sepsis[J]. Immunity, 2021, 54(11): 2450-2464. DOI:10.1016/j.immuni.2021.10.012 |
| [16] | Ming TQ, Dong MY, Song XM, et al. Integrated analysis of gene co-expression network and prediction model indicates immune-related roles of the identified biomarkers in sepsis and sepsis-induced acute respiratory distress syndrome[J]. Front Immunol, 2022, 13: 897390. DOI:10.3389/fimmu.2022.897390 |
| [17] | Jiang YL, Rosborough BR, Chen J, et al. Single cell RNA sequencing identifies an early monocyte gene signature in acute respiratory distress syndrome[J]. JCI Insight, 2020, 5(13): e135678. DOI:10.1172/jci.insight.135678 |
| [18] | He D, Yu Q, Zeng XN, et al. Single-cell RNA sequencing and transcriptome analysis revealed the immune microenvironment and gene markers of acute respiratory distress syndrome[J]. J Inflamm Res, 2023, 16: 3205-3217. DOI:10.2147/JIR.S419576 |
| [19] | Zhu GF, Liu Y, Zhang WM, et al. CD27+TIM-1+ memory B cells promoted the development of Foxp3+ Tregs and were associated with better survival in acute respiratory distress syndrome[J]. Immunol Res, 2018, 66(2): 281-287. DOI:10.1007/s12026-017-8983-2 |
| [20] | Torres M, Casado G, Vigón L, et al. Changes in the immune response against SARS-CoV-2 in individuals with severe COVID-19 treated with high dose of vitamin D[J]. Biomedecine Pharmacother, 2022, 150: 112965. DOI:10.1016/j.biopha.2022.112965 |
| [21] | Huang J, Wang B, Tao S, et al. D-tagatose protects against oleic acid-induced acute respiratory distress syndrome in rats by activating pten/pi3k/akt pathway[J]. Front Immunol, 2022, 13: 928312. DOI: 10.3389/fimmu.2022.928312.eCollection2022. |
 2024, Vol. 33
2024, Vol. 33




