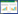2. 浙江大学医学院附属第二医院大肠外科,杭州 310009
外科手术技术的发展和免疫抑制药物的改良使小肠移植成为不可逆性肠功能衰竭的首选治疗方案之一[1]。小肠含有许多淋巴细胞,因此移植后的排异反应相比肝、肾等器官移植后的排异反应更强,这也是导致小肠移植发展慢且成功率低的原因之一[2]。移植术后出现的血管吻合口血栓、出血和感染等并发症也提高了移植受体的病死率和移植物的失功率[3],同时也提高了二次移植率。研究显示2001年至2009年成人再移植的数量比前十年增加了近5倍,但再次小肠移植的结果明显差于首次移植[4]。浙江大学医学院附属第一医院于2022年7月收治1例小肠肿瘤术后腹腔广泛转移患者,于2022-07-19行“自体小肠移植术”,术后3 d出现移植肠缺血坏死,切除移植肠段,2022-08-24再次行“异体小肠移植术”,经过治疗,恢复良好。本研究通过浙江大学医学院附属第一医院临床研究伦理委员会审批[编号: (2023)伦审研第(0702)号],并已签署知情同意。
1 资料与方法患者,男,39岁,右下腹部隐痛2 d于当地医院就诊,肠镜检查发现末端回肠肿瘤,距回盲瓣20 cm,广基息肉,表面糜烂坏死。2021-02-20当地医院行“剖腹探查+小肠部分切除+回盲部切除术”,术后病理报告示:末端回肠溃疡浸润型中分化腺癌,癌组织侵犯浆膜下脂肪组织,TNM分期T3N0M0。多次化疗后肿瘤复发,2022-07-08在本院全腹CT平扫+增强提示:术区近段小肠及远段结肠壁异常增厚,肿瘤复发考虑,继发近段小肠梗阻,腹盆腔系膜、网膜及腹膜转移。肝胆胰肿瘤及血管CTA检查示:肿瘤复发,累及回盲部及十二指肠,包绕肠系膜右侧部血管,肝门部、腹膜后及系膜淋巴结转移,肝脏异常灌注考虑。2022-07-11门诊拟“回肠癌伴腹腔种植转移”收治入院,入院时体重62 kg,体重指数21.4 kg/m2,血红蛋白104 g/L,总蛋白66.6 g/L,白蛋白39.2 g/L。2022-07-19行“胰十二指肠切除+自体小肠移植+腹主动脉-肠系膜上动脉搭桥术”,术后3 d出现移植肠管缺血性改变,门静脉血栓形成,予“移植小肠切除术”,剩余肠段仅剩10 cm,成为超短肠综合征患者。2022-08-23为患者行“异体小肠移植手术”,以“短肠综合征、小肠恶性肿瘤术后、腹腔继发恶性肿瘤、淋巴结继发恶性肿瘤、低蛋白血症”转入移植病房。
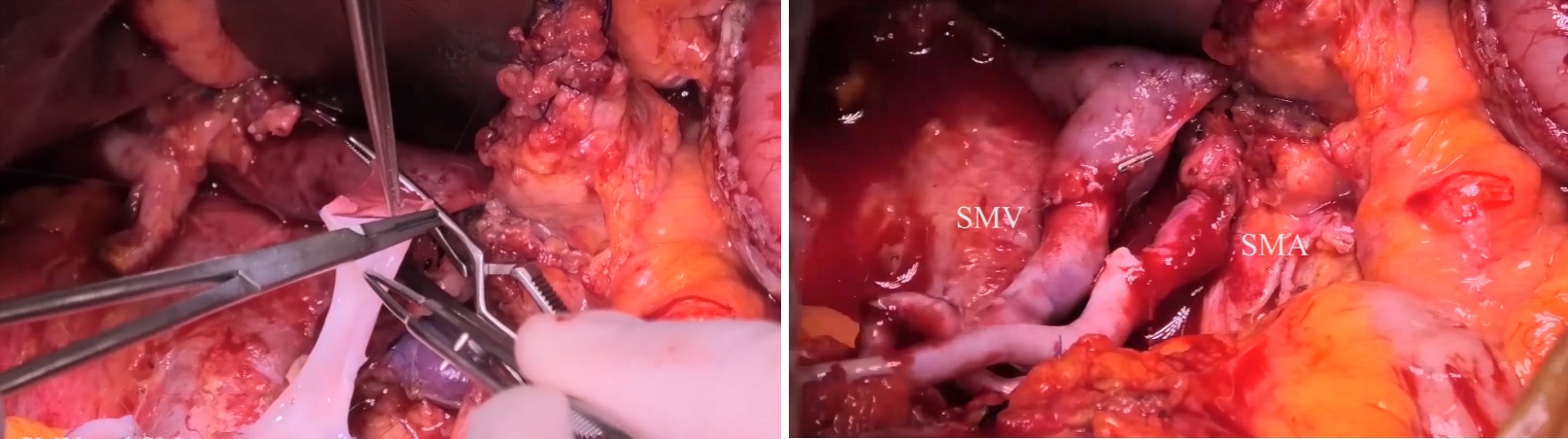
经过结直肠外科、移植中心、消化内科、麻醉科及重症医学科等多学科讨论,患者于2022-08-24在全麻下行“异体小肠移植术”,此次小肠移植的重点为血管吻合和消化道重建。血管吻合(见图 1):从受体髂血管分叉处向头侧方向游离动脉约7 cm, 并游离其右侧下腔静脉。用无损伤血管钳夹闭腹主动脉,用尖刀挑开动脉前壁,再分别用3.5 mm打孔器扩大血管开口。用湿冷纱布垫包裹移植肠段移入腹腔,显露移植肠段血管断端。用6-0 C1 Prolene缝线行端侧连续缝合,吻合成功后先夹闭吻合口远端移植肠动脉,开放血流后吻合口无活动性出血;动脉吻合完成之后部分阻断下腔静脉血流,在其前壁开口约1.5 cm,用7-0 Prolene缝线端侧连续缝合静脉。首先开放静脉血流,再开放移植肠动脉阻断钳。消化道重建(见图 2): 将移植肠断端间断加强缝合,距离其8 cm处与空肠近端行侧侧吻合。距移植肠末端10 cm与受体降结肠行侧侧吻合,移植肠末端从右下腹壁切口引出造口(患者手术视频见网站附录)。
|
| SMV为肠系膜上静脉,SMA为肠系膜上动脉 图 1 术中血管吻合 |
|
|
|
| 图 2 消化道重建 |
|
|
患者移植小肠肠段250 cm,术中生命体征平稳,出血量1 500 mL,输注悬浮红细胞6个单位。留置胃肠减压及鼻肠管各1根,右侧颈内静脉置入双腔抗感染中心静脉导管,腹部留置T管、盆腔引流管、肝下引流管、胃后引流管各1根,术后转入移植层流监护室,予抗感染、抗排异及营养支持治疗。两次移植期间营养消耗大,多学科介入指导,予分阶段营养管理,促进肠功能康复。术后第4天腹腔引流液检出大肠埃希菌及肺炎克雷伯菌,予接触隔离,进一步抗感染、抗排异反应治疗后恢复正常。患者术后第23天,生命体征平稳,转结直肠外科病房继续治疗,术后第28天移植肠造口24 h总排泄量高达2 500 mL,结合高热等临床表现和肠镜检查结果疑似排异反应,以激素大剂量冲击联合兔抗人胸腺细胞免疫球蛋白治疗后情况逐渐稳定。再次移植术后第55天康复出院,4个月后成功进行造口还纳术,目前已随访5个月,患者状况良好。
2 讨论血管吻合口血栓是小肠移植术后最凶险的早期并发症之一,发生率低但血栓一旦形成后将危及移植肠段存活率,危及患者生命[5]。本案例中,患者因既往多次化疗致血管脆弱,二次移植手术增加了血管吻合难度。对此,术后首日绝对卧床休养,密切关注吻合口血栓临床征兆,48 h内每15~30 min观察一次肠造口黏膜色泽及水肿情况,每日多普勒超声检测动静脉血流是否通畅。术后两周内每日监测凝血功能与血常规,兼顾防出血与抗血栓的动态平衡。术后一周,患者肠造口黏膜鲜红、无明显水肿,术后48 h移植肠开始恢复蠕动,未出现吻合口血栓。
小肠移植术后排异反应率高至87.5%[6],但排异反应临床表现缺乏特异性,需要内窥镜检查和肠黏膜活检病理结果进行诊断。本病例免疫抑制方案以他克莫司为基础,联合兔抗人胸腺细胞免疫球蛋白和甲基强的松龙注射液,维持他克莫司血药浓度在15~20 ng/mL范围内[6]。密切关注患者体温变化、腹部体征及造口黏膜排泄量等临床表现。术后48 h内每15~30 min监测肠造口状况,之后调整为每30~60 min一次,每周一次肠镜检查。术后28 d,造口引流量剧增、便性改变及体温升高,血药浓度降低(11.3 ng/mL),疑似排异反应,遂采用激素冲击疗法与兔抗人胸腺细胞免疫球蛋白联合治疗,并专人密切关注肠造口黏膜状态及引流液变化,后逐渐恢复正常。术后36 d肠镜检查示移植肠粘膜绒毛丰富,连续性佳。
小肠肠腔内含有大量细菌,术中创伤、术后有创操作及长期使用免疫抑制剂等原因使细菌感染的发生率高达90%[7],严重影响移植肠段和受体的存活率。因此,预防和控制感染尤为重要。患者移植术后转入单间层流监护室,进行全方位的感染防控措施。密切关注体温、C-反应蛋白、血培养、血常规及巨细胞病毒等感染指标变化,确保患者周边环境清洁。术后第6天,腹水细菌培养结果显示大肠埃希菌和肺炎克雷伯菌感染,遵循药敏结果改用替加环素治疗,实施床边隔离,增加环境清洁消毒频率。通过早发现、早治疗和精细化管理,成功控制感染症状,术后30 d腹水培养转阴,未出现院内交叉感染。
移植肠段切除后,剩余小肠仅10 cm,成为超短肠综合征患者,面临营养吸收困难。组建多学科营养管理小组,涵盖结直肠外科、移植中心、消化内科、营养科、康复科和内分泌科等专业团队,共同制定并执行分阶段、个性化营养支持方案[8-9]。术前,针对患者肠黏膜吸收面积锐减、体重下降、营养风险极高等情况,采用肠外营养支持以稳定内环境,改善急性应激状态下机体消耗[10-11]。营养管理小组制定详细的肠外营养方案,逐步调整热量供给,合理配置蛋白质、糖脂比例,并根据患者肝功能受损状况调整脂肪乳剂类型与用量,同时补充电解质、维生素及微量元素,输血制品改善贫血与营养不良。术后,依据营养风险筛查结果及生化指标动态调整营养配方,保证血糖控制在适宜范围。肠道功能逐步恢复后,适时转换为肠内营养,通过肠内肠外联合营养管理,最终成功过渡至经口进食,确保患者营养状况持续改善,营养风险显著降低。
开展出院准备服务有利于患者出院后平稳的过渡至日常家庭生活[7],有效提升患者及家庭的疾病管理水平。在出院前一周,系统评估患者及家属的文化水平、接受能力和学习习惯,定制个性化的出院宣教计划,并通过多元化健康教育方式传授居家自我照护知识,重点涵盖造口袋更换、营养管理、免疫抑制药物使用和并发症防范、随访频率及方式等内容。利用“互联网医院”平台进行线上延续管理,指导患者进行饮食、营养、康复锻炼等,并坚持每周微信、电话随访。术后1、2、3个月复查发现患者病情观察日记填写准确且详细,能自行更换造口袋,抗排异药物服用正确,未发生并发症。
综上所述,切除自体小肠移植肠段后再次行异体小肠移植手术难度较高,治疗难度较大。该例患者手术重点在于血管吻合和消化道重建,术后应做好吻合口血运、血药浓度、感染征象等监测和预防,并及时识别、处理并发症,严格执行多重耐药菌的消毒隔离制度,防止发生院内交叉感染。与此同时启动个体化营养支持,促进身体机能恢复,实施个性化出院准备服务和延续性管理方案,提高患者及家庭疾病管理水平,帮助患者早日回归社会。
利益冲突 所有作者声明无利益冲突
本文附录请登录中华急诊网(www.cem.org.cn) 浏览(Html格式全文)
| [1] | Morris G, Kennedy A Jr, Cochran W. Small bowel congenital anomalies: a review and update[J]. Curr Gastroenterol Rep, 2016, 18(4): 16. DOI:10.1007/s11894-016-0490-4 |
| [2] | 赵龙, 王金海. 小肠移植进展[J]. 中华炎性肠病杂志, 2022, 6(1): 36-41. DOI:10.3760/cma.j.cn101480-20211117-00094 |
| [3] | 柳晶晶, 黄飞燕, 汪彩娜, 等. 14例亲缘性活体小肠移植患者术后早期并发症的护理[J]. 中华护理杂志, 2021, 56(9): 1383-1386. DOI:10.3761/j.issn.0254-1769.2021.09.018 |
| [4] | Matsumoto CS, Subramanian S, Fishbein TM. Adult intestinal transplantation[J]. Gastroenterol Clin North Am, 2018, 47(2): 341-354. DOI:10.1016/j.gtc.2018.01.011 |
| [5] | 卢芳燕, 汤洒潇, 王燕, 等. 活体小肠移植受者多学科协作护理方案的制订及应用[J]. 中华护理杂志, 2021, 56(2): 218-224. DOI:10.3761/j.issn.0254-1769.2021.02.010 |
| [6] | 卢芳燕, 张婉莹, 宋运莲, 等. 小肠移植围手术期护理质量评价指标体系的构建[J]. 中国护理管理, 2022, 22(10): 1513-1518. DOI:10.3969/j.issn.1672-1756.2022.10.016 |
| [7] | 沈鸣雁, 鲁剑芳, 金亚仙, 等. 1例肝移植术后门静脉血栓形成继发肝衰竭患者的护理[J]. 中华护理杂志, 2020, 55(12): 1855-1858. DOI:10.3761/j.issn.0254-1769.2020.12.017 |
| [8] | Lauro A, Lacaille F. Short bowel syndrome in children and adults: from rehabilitation to transplantation[J]. Expert Rev Gastroenterol Hepatol, 2019, 13(1): 55-70. DOI:10.1080/17474124.2019.1541736 |
| [9] | 程晓英, 梅伶俐, 陈朔晖. 短肠综合征患儿促进肠道适应的影响因素及管理策略的研究进展[J]. 军事护理, 2023, 40(11): 101-104. DOI:10.3969/j.issn.2097-1826.2023.11.024 |
| [10] | Kovler ML, Hackam DJ. Generating an artificial intestine for the treatment of short bowel syndrome[J]. Gastroenterol Clin North Am, 2019, 48(4): 585-605. DOI:10.1016/j.gtc.2019.08.011 |
| [11] | 曹晖, 陈亚进, 顾小萍, 等. 中国加速康复外科临床实践指南(2021版)[J]. 中国实用外科杂志, 2021, 41(9): 961-992. DOI:10.19538/j.cjps.issn1005-2208.2021.09.01 |
 2024, Vol. 33
2024, Vol. 33