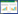2. 景德镇市第一人民医院,景德镇 333000;
3. 解放军总医院第八医学中心重症医学科,北京 100091
2. Jingdezhen No.1 People's Hospital, Jingdezhen 333000, China;
3. Department of Critical Care Medicine, The Eighth Medical Center of Chinese PLA General Hospital, Beijing 100091, China
热射病(heat stroke, HS)是一种与高温高湿环境相关的热疾病,如若得不到有效救治致残率和致死率极高。根据致热原因不同分为“经典型热射病”和“劳力型热射病”。其中劳力型热射病(exertional heat stroke, EHS)多发生在夏季户外工作和运动训练的人群中,易进展为多器官功能损害,具有极高的致死率[1]。肺作为调节机体散热的重要器官,易遭受热打击而发生损伤,从而发生通气功能改变,导致急性肺损伤(acute lung injury, ALI)(或)急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的发生[2]。热射病致器官损伤与全身炎症反应(systemic inflammatory response syndrome, SIRS)激活有关。研究证实,热打击可直接造成线粒体的损伤,产生大量活性氧(reactive oxygen species, ROS),增强细胞内氧化应激,诱发炎症反应[3]。而氧化应激和炎症反应又会进一步侵蚀端粒、损伤线粒体[4],从而产生恶性循环,使氧化应激程度呈级联放大,最终产生SIRS,导致脏器功能衰竭。因此有效地和选择性地清除受损线粒体,对减轻热射病器官损伤至关重要。
线粒体自噬是指受损、老化和发生功能障碍的线粒体可被特定的自噬小体识别后选择性地运输到溶酶体完成降解的过程。线粒体自噬在控制线粒体质量和维持线粒体动态平衡中起着至关重要的作用[5]。PTEN诱导酶1(PTEN-induced putative kinase 1, Pink1)/帕金蛋白(Parkin)通路是调控线粒体自噬的一种经典通路。研究发现,在脓毒症小鼠模型中,Pink1、Parkin基因敲除小鼠细胞内线粒体损伤程度更重,器官衰竭数量和病死率更高[6]。但Pink1/Parkin通路和线粒体自噬在热射病肺损伤中的作用仍缺乏研究。由于劳力型热射病的病理生理机制与脓毒症有相似之处,都存在线粒体损伤和失控的SIRS,因此本研究通过建立EHS大鼠模型,观察Parkin过表达对HS大鼠肺组织的影响,探讨Pink1/Parkin通路在EHS肺损伤中的作用,为EHS肺损伤的的救治提供相应的理论依据。
1 材料与方法 1.1 实验动物健康雄性SD大鼠60只,体重300~350 g,8周龄,购自斯贝福(北京)生物科技有限公司,许可证编号:SCXK(京)2019-0010。动物饲养于解放军总医院第八医学中心动物实验室(SPF等级),室内适度通风,光照12 h,温度25~26 ℃,相对湿度为50%~60%。实验动物相关方案通过解放军总医院第八医学中心动物伦理委员会批准,批号为:309202011301010。
1.2 主要仪器和试剂六道小动物跑台(XR-PT-10A,上海欣软信息科技有限公司)放置于透明模拟高温高湿环境实验舱中,该舱能精准控制舱内温度及湿度并维持恒定。TH212型大鼠肛温仪,购自上海玉研科技仪器公司。伊文思蓝(Evans blue,EB)购自美国MCE公司;兔抗大鼠磷酸甘油醛脱氢酶(glyceraldehyde phosphatedehydrogenase,GAPDH)单克隆抗体和兔抗大鼠微管相关蛋白1轻链3(Microtubule-associated protein 1 light chain 3,LC3)多克隆抗体购自美国CST公司;兔抗大鼠Pink1多克隆抗体、兔抗大鼠Parkin多克隆抗体及兔抗大鼠单克隆抗体p62均购自英国Abcam公司;辣根过氧化物酶标记的山羊抗兔多克隆抗体购自北京中杉金桥生物技术有限公司;原位末端转移酶标记法(TdT-mediated dUTP nick-end labeling,TUNEL)试剂盒购自瑞士Roche公司;IL-6和TNF-α的ELISA试剂盒购自英国Abcam公司;活性氧(ROS)化学荧光法试剂盒购自上海雅吉生物科技有限公司;甲酰胺购自上海麦克林生化科技有限公司;Spot图像采集处理系统(日本Nikon公司),凝胶成像系统(美国Bio-Rad公司)。其他试剂均为国产分析纯。
1.3 动物分组及模型构建将60只健康雄性SD大鼠按照随机数字表法分为4组,正常组(CON组)、正常Parkin过表达组(CON+Parkin组)、热射病组(EHS组)和热射病Parkin过表达组(EHS+Parkin组),每组大鼠15只。在EHS建模之前,实验大鼠均放入热环境舱,在室温(24~26℃)下采用阶梯训练法进行适应性训练,周期为7 d。适应性饲养7 d后,大鼠经尾静脉注射[7]携带有Parkin基因的腺相关病毒0.15 μL,使大鼠肺组织过表达Parkin。大鼠热应激实验前禁食12 h,饮水不限。大鼠在开始建模前30 min称重并禁止饮水(操作前先刺激大鼠排便)。当实验舱温度达到(39.5±0.3)℃,相对湿度为(55±5)%时,将大鼠放入跑台,以5 m/min的初始速度开始跑步(坡度为0°),每2 min增速1 m/min,20 min后增速至15 m/min后保持恒定速度持续跑步,直到出现疲劳状态(适当驱赶后仍无法继续跑步)。实验全程严密观察大鼠意识、精神变化。在大鼠达到EHS诊断标准后,将其从热舱中取出,停止热暴露,称重,室温(24~26 ℃)下自然降温,监测各组大鼠核心温度(肛温)3 h。5 h后解剖大鼠并取材。EHS的诊断标准为大鼠核心温度 > 40 ℃,且出现中枢神经系统功能障碍表现,即无自主活动时间大于5 s(轻度无痛刺激不能驱赶动物爬行或改变位置)。
1.4 检测指标及方法 1.4.1 观察建模后3 h内的大鼠核心温度大鼠建模后,取校对后的肛温测量仪,固定大鼠,将涂有润滑剂的肛温传感器水平插入肛门,传感器插入深度5~7 cm。核心温度保持10 s不变为最终测量温度。每隔10 min测量核心温度,测量3 h,绘制各组大鼠核心温度变化曲线。
1.4.2 观察大鼠5 h生存率每组取15只大鼠,建模后分别于0 h、1 h、2 h、3 h、4 h和5 h观察其生存情况并记录,绘制生存曲线,计算各组生存率。
1.4.3 大鼠肺系数的测定大鼠肺系数测定采用腹主动脉放血法处死大鼠后取双肺组织,PBS液反复漂洗,用滤纸吸干肺组织表面水分,称量全重,计算肺系数(lung weight/body weight,LW/BW)。LW/BW=肺湿重(mg)/大鼠体重(g)。
1.4.4 大鼠肺血管通透性测定采用EB染料渗出技术检测大鼠肺组织通透性[8]。EB溶于生理盐水配置浓度为2%的溶液,以2 mL/kg从大鼠尾静脉注射。观察到大鼠双耳和眼睛变蓝,可以确定EB染料已经均匀分布于大鼠体内。体内的EB染料循环2 h,腹腔麻醉,开胸后剪开右心耳,经左心室用磷酸盐缓冲液(phosphate-buffered saline,PBS)10 mL冲洗肺循环。取全肺组织,浸泡在2 mL甲酰胺溶液中(10 mL/kg),然后与甲酰胺在60 ℃的条件下共孵育16 h,待肺组织中色素全部萃取出,取出组织,7000 g离心10 min后取上清液,测量吸光度(A),并计算组织中的EB含量。
1.4.5 大鼠肺组织病理学观察剪取大鼠右肺下叶组织小块,浸入4%多聚甲醛溶液中固定,梯度乙醇脱水,常规石蜡包埋后切片(5 µm),脱蜡后苏木精-伊红(Hematoxylineosin,HE)染色,脱水在光镜下观察肺组织病理学变化。在DM 4000B光学显微镜(×200)下随机选取10个视野,进行肺组织病理损伤评分[9]。评分项目包括肺泡腔充血、中性粒细胞浸润、纤维蛋白渗出和肺泡间隔增宽,每项的评分按损伤程度分为0、1、2和3分,分别为无损伤、轻度损伤、中度和重度损伤,计算平均值。另外根据肺间质和肺泡的水肿程度,按照无、轻、中、重,分别计0、1、2和3分,对HE染色的切片进行肺水肿程度的评分[10],计算平均值。
1.4.6 ELISA方法检测肺组织中IL-6、IL-1β、TNF-α和ROS的含量使用大鼠IL-6、IL-1β、TNF-α和ROS酶联免疫分析试剂盒采用双抗体夹心ELISA法检测肺组织中细胞因子IL-6、IL-1β、TNF-α和ROS的含量,严格按照ELISA试剂盒说明书进行操作。
1.4.7 TUNEL观察大鼠肺组织凋亡大鼠肺组织石蜡切片经过梯度乙醇脱蜡,脱水后,吹干,PBS清洗3次,封闭液室温封闭1 h。以3%的H2O2阻断内源性过氧化物酶10 min后,PBS清洗2次。按照TUNEL试剂盒说明要求,进行TUNEL染色和二氨基联苯胺(DAB)染色,苏木精复染,透明、封片。光镜下观察,凋亡细胞核呈棕黄色,正常细胞核呈蓝色。采用ImageJ图像分析,每张切片显微镜下随机选取5个视野(200倍),计算凋亡指数(apoptosis index)。凋亡指数=阳性细胞数/总细胞数×100%。
1.4.8 Western blot方法测定大鼠肺组织中Pink1、Parkin、P62和LC3的表达,并计算LC3Ⅱ/LC3Ⅰ比值取新鲜右上肺组织块100 μg置于离心管内,加入1 mL的RIPA裂解液后研磨并离心,经上清液提取蛋白后,二喹啉甲酸(BCA)试剂盒测定蛋白浓度,将蛋白样本置于电泳仪中电泳,后经电转、脱脂奶粉溶液封闭,按说明书配制抗体工作液(Pink1、Parkin、P62和LC3抗体均按1∶2000稀释),一抗4 ℃摇床孵育过夜,相应二抗(1∶5000)室温孵育1 h,ECL化学发光成像系统检测信号强度大小。采用Image-Pro Plus 6.0软件分析条带光密度值,并与GAPDH内参吸光度的比值进行相对表达量的计算。
1.5 统计学方法采用GraphPad Prism 9软件进行统计分析。计量数据均符合正态分布,采用均数±标准差(x±s)表示。多组之间比较采用单因素方差分析,组间比较用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果 2.1 各组大鼠核心温度变化CON组和CON+Parkin组的核心温度保持在37~38 ℃。劳力性热射病大鼠核心温度急剧升高,达到43 ℃。脱离热环境后,EHS组大鼠核心体温逐渐下降,在100 min~150 min其间,其核心温度低于CON组大鼠。与EHS组相比,EHS+Parkin组大鼠核心温度降至正常体温后,保持稳定。见图 1。
|
| 与CON组相比,aP<0.05 图 1 各组大鼠核心温度的变化 Fig 1 The changes of core temperature in each group. |
|
|
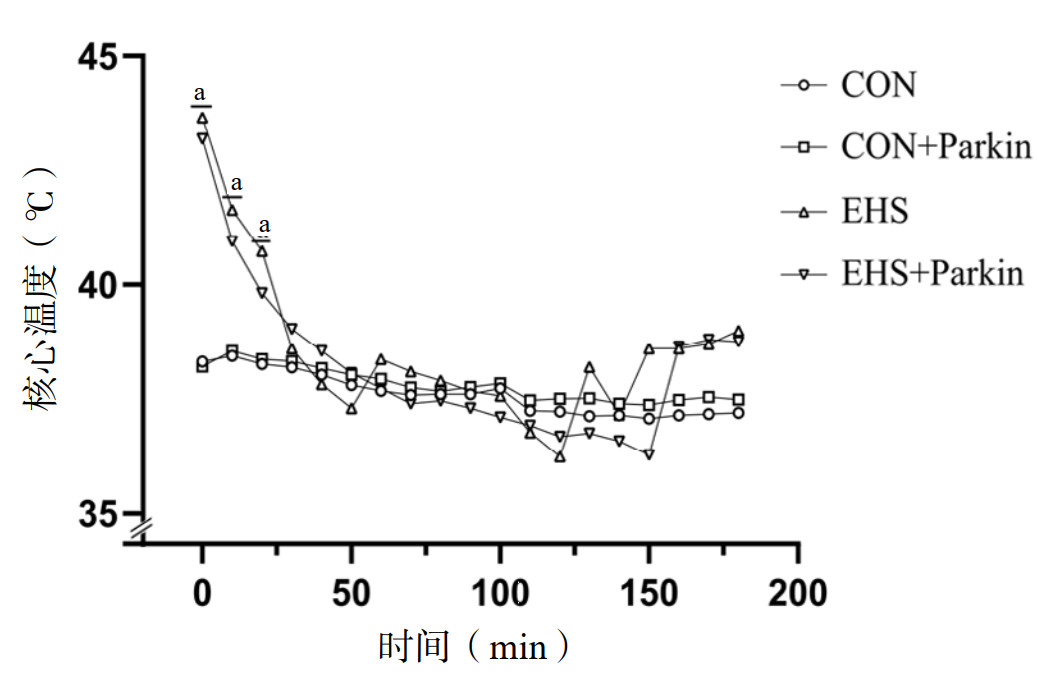
如图 2所示,EHS组大鼠1 h生存率约为87%(13/15),3 h生存率约为53%(8/15),5 h生存率约为33%(5/15)。与EHS组相比,EHS+Parkin组大鼠的生存率均显著升高(P<0.05)。CON组大鼠和CON+Parkin组大鼠生存率差异无统计学意义(P>0.05)。
|
| 与CON组相比,aP<0.05;与EHS组相比,bP<0.05 图 2 Parkin过表达提高热射病大鼠的生存率 Fig 2 The over-expression of Parkin increases the survival rate of EHS rats |
|
|
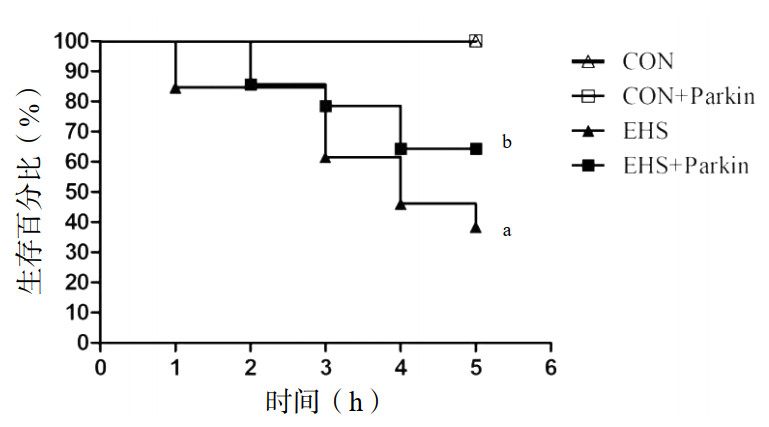
与CON组相比,EHS组大鼠肺系数和肺血管通透性均明显增加,差异有统计学意义(P<0.05)。而热射病Parkin过表达组大鼠肺系数和肺血管通透性较EHS组显著降低,差异有统计学意义(P<0.05)。CON组与CON+Parkin组相比较,大鼠肺系数和肺血管通透性均差异无统计学意义(P>0.05)。
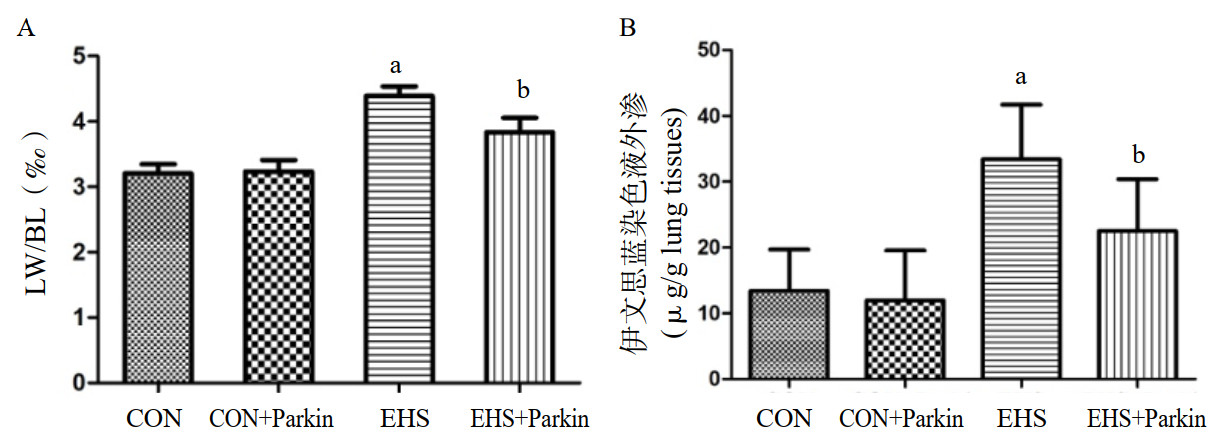
|
| A:各组大鼠肺系数变化;B:各组大鼠肺血管通透性变化;与CON组相比,aP<0.05;与EHS组相比,bP<0.05 图 3 Parkin过表达降低了热射病大鼠的肺系数和肺血管通透性 Fig 3 The over-expression of Parkin decreased the pulmonary index and vascular permeability of EHS rats |
|
|
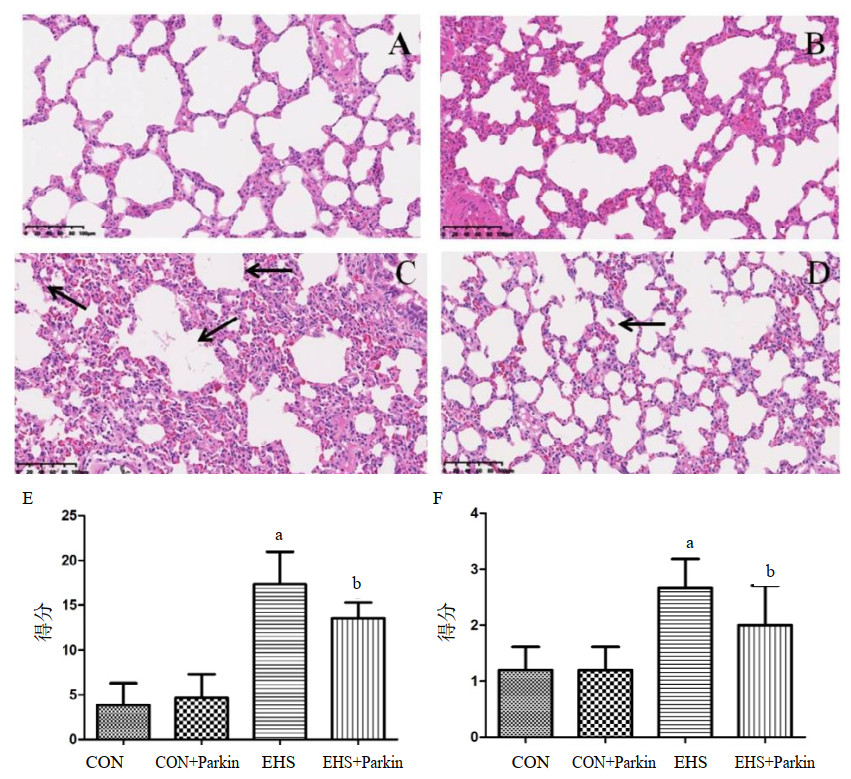
CON组和CON+Parkin组大鼠的肺组织结构清晰,肺泡壁光滑,且肺泡腔无液体渗出,见图 4A和图 4B;EHS组大鼠出现肺泡塌陷,肺泡腔出现大量的红细胞、炎症细胞和血浆样物质渗出,肺病理学评分和肺水肿评分明显增加(图 4C、图 4E和图 4F,P<0.05);和EHS组相比,EHS+Parkin组大鼠肺泡塌陷减少,炎症浸润程度低,肺泡内未见明显渗出物质,肺病理学评分和肺水肿评分较EHS组显著降低(P<0.05),见图 4D、图 4E和图 4F。
|
| A:CON组;B:CON+Parkin组;C:EHS组;D:EHS+Parkin组;箭头表示水肿;E:肺部损伤的组织学评分;F:肺部水肿的组织学评分;与CON组相比,aP<0.05;与EHS组相比,bP<0.05 图 4 Parkin过表达减轻EHS介导的大鼠肺组织病理改变 Fig 4 The Parkin over-expression rats resist the EHS-induced pathological changes of lung |
|
|
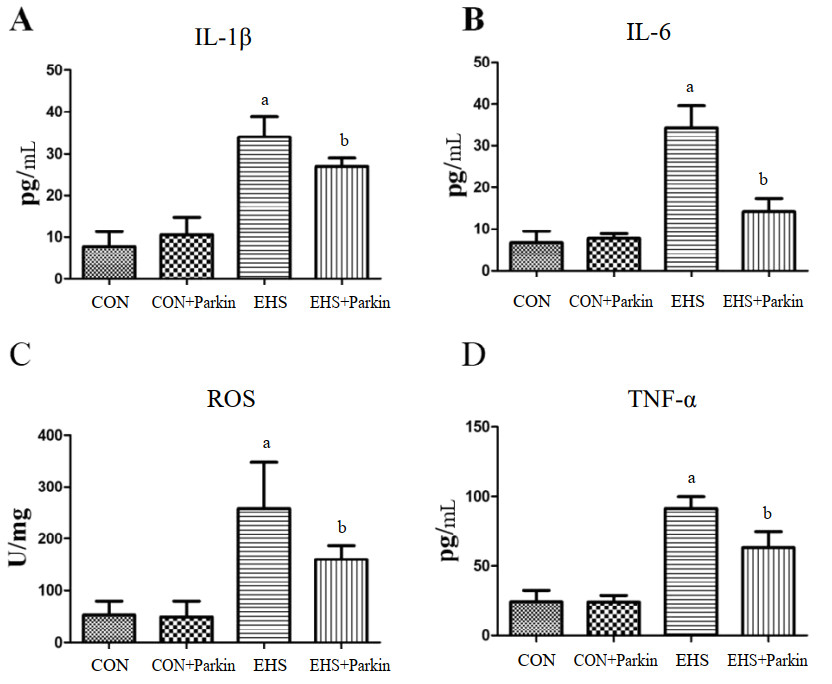
与CON组相比,EHS组大鼠肺组织中IL-6、IL-1β、TNF-α和ROS含量均显著增多(P<0.05);而EHS+Parkin组大鼠肺组织中上述细胞因子含量较EHS组均明显下降(P<0.05)。CON与CON+Parkin组相比较,上述细胞因子含量均差异无统计学意义(P>0.05),见图 5。
|
| A:大鼠肺组织中IL-1β水平变化;B:大鼠肺组织中IL-6水平变化;C:大鼠肺组织中ROS含量变化;D:大鼠肺组织中TNF-α水平变化;与CON组相比,aP<0.05;与EHS组相比,bP<0.05 图 5 Parkin过表达降低了热射病大鼠肺组织中IL-1β、IL-6、TNF-α和ROS等细胞因子的含量 Fig 5 The Parkin over-expression rats attenuated the EHS-induced increasing level of IL-1β、IL-6、TNF-αand ROS in the lung |
|
|
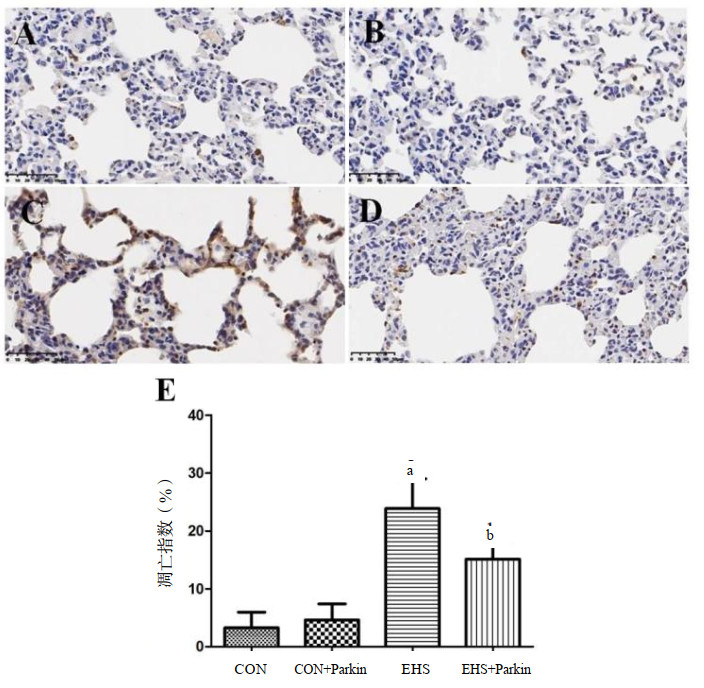
与CON相比,EHS组大鼠肺组织中的调亡细胞数量增加,凋亡指数升高(P<0.05);与EHS组比较,EHS+Parkin组大鼠肺组织中的凋亡细胞显著减少,凋亡指数明显降低(P<0.05)。CON与CON+Parkin组大鼠肺组织的凋亡指数差异无统计学意义,见图 6。
|
| A:CON组;B:CON+Parkin组;C:EHS组;D:EHS+Parkin组;棕色代表凋亡细胞。E:各组大鼠肺组织的凋亡指数;与CON组相比,aP<0.05;与EHS组相比,bP<0.05 图 6 Parkin过表达可以减少EHS大鼠肺组织细胞凋亡 Fig 6 Pulmonary apoptosis was attenuated to a greater extent in EHS+Parkin group rats |
|
|
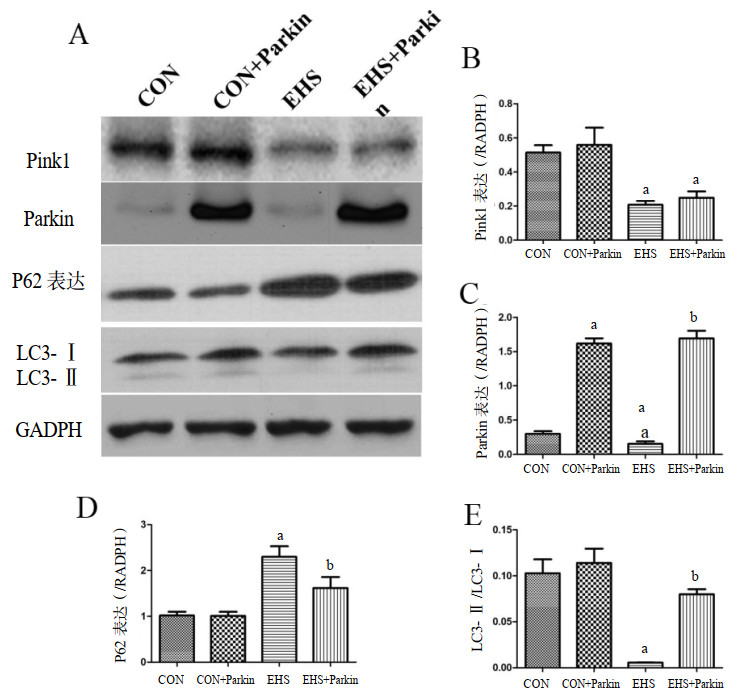
如图 7所示,与CON组相比,EHS组大鼠肺组织中Pink1和Parkin表达均减少(P<0.05),自噬水平标志物LC3-Ⅱ/LC3-Ⅰ比值降低(P<0.05),P62表达增加(P<0.05)。与EHS组相比,EHS+Parkin过表达组大鼠肺组织中Parkin的表达的增多,LC3-Ⅱ/LC3-Ⅰ比值均升高(P<0.05),P62表达减少(P<0.05),Pink1表达差异无统计学意义。CON+Parkin组和CON组相比,大鼠Parkin和自噬水平标志物LC3-Ⅱ/LC3-Ⅰ比值均升高(P<0.05),Pink1和P62表达差异无统计学意义。
|
| A:各组大鼠肺组织中Pink1、Parkin、P62和LC3的蛋白表达;B、C、D和E:Pink1、Parkin、P62和LC3-Ⅱ/LC3-Ⅰ比值的统计图;与CON组相比,aP<0.05;与EHS组相比,bP<0.05 图 7 Parkin过表达增加EHS大鼠肺组织中的自噬水平 Fig 7 Parkin over-expression rats exhibited the increasing autophagy level in their lung |
|
|
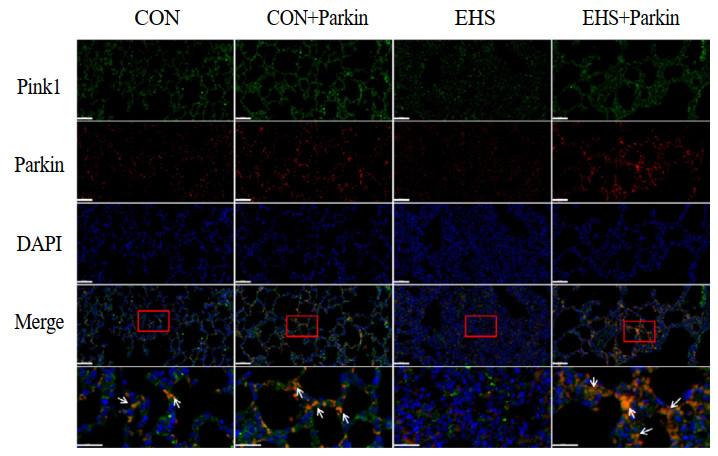
如图 8所示,免疫荧光结果显示,尾静脉注射携带Parkin基因腺相关病毒后,CON+Parkin组和EHS+Parkin组大鼠肺组织中Parkin荧光强度均显著增强(红色荧光)。与CON比较,EHS组大鼠肺组织中Pink1(绿色荧光)和Parkin(红色荧光)共定位荧光强度减弱(橙色荧光);而HS+Parkin组大鼠肺组织中Pink1(绿色荧光)与Parkin(红色荧光)共定位荧光强度较EHS组显著增强。CON+Parkin组与CON相比,肺组织中Pink1荧光强度(绿色荧光)无变化,Pink1(绿色荧光)与Parkin(红色荧光)共定位荧光强度(橙色荧光)略有增强。
|
| Pink1,绿色荧光;Parkin,红色荧光;橙色荧光:Pink1(绿色)和Parkin(红色)共染;bar=50μm 图 8 Parkin过表达增强了热射病大鼠肺组织中Pink1与Parkin的相互作用 Fig 8 Overexpression of Parkin enhances the interaction between Pink1 and Parkin in lung tissue of heat stroke rats |
|
|
HS是由热损伤因素作用于机体引起的致命性疾病,其病理生生理特点是多器官功能衰竭。其中高热诱发ALI或ARDS是其常见并发症之一[11]。本研究通过建立EHS大鼠模型发现,在高温高湿的环境中,进行高强度运动,大鼠核心温度急剧升高,达到HS诊断标准,且脱离热环境后,大鼠核心温度下降至正常体温以下,提示大鼠体内体温调节功能受损,符合HS特征。
热打击后,大鼠肺部发生明显病理改变,表现为进行性加重的间质血管显著扩张充血,大量肺泡腔出血,肺泡结构模糊不清,从而导致肺系数升高和肺血管通透性增加,肺内可见大量的凋亡细胞。这与既往研究结果相一致[12-13]。
HS致肺损伤机制尚不完全清楚。目前认为,直接热打击和继发的全身炎症反应是其病理生理基础。研究发现,HS所致ARDS时,肺组织中可检测到浓度明显升高的内毒素以及炎性细胞因子,同时炎性细胞浸润、肺泡腔巨噬细胞增多,表明HS患者肺部出现了明显的炎症反应。本研究同样发现,HS大鼠肺组织中IL-6、IL-1β、TNF-α的含量明显升高,证实热打击造成大鼠肺部发生炎症反应。此外,HS不仅引起组织局部发生炎症反应,还导致SIRS发生。一项HS动物研究发现,HS动物模型血液中IL-1β、IL-6、TNF-α等炎症因子的含量显著升高,其中IL-6在SIRS早期即出现显著的升高[14]。因此,HS状态下,机体免疫反应失调,免疫细胞、炎症因子通过级联放大反应,可诱发细胞因子风暴,导致更严重的器官和组织损伤。
氧化应激在HS导致的病理改变中有着重要作用。Liu等[2]通过高通量测序技术发现HS大鼠肺内有大量氧化应激基因高表达(如Aqp3、Cygb、SOD2、Hmox1等),抑制氧化应激反应可以减轻HS引起的肺炎症反应,改善肺功能。本研究发现,HS大鼠肺内活性氧簇(reactive oxygen species,ROS)的水平显著升高。
线粒体是ROS的主要来源之一,线粒体受损,氧化应激增强,产生ROS反过来又进一步加重线粒体损伤,形成恶性循环,致使ROS含量级联放大,从而导致“瀑布式”炎症反应,引起细胞发生凋亡、坏死,最终进展为脏器功能衰竭[15]。所以及时清除受损伤的线粒体对保护器官功能起到一定的积极作用[16]。
线粒体自噬是保持线粒体数量和质量平衡的一种重要调控机制,维持细胞内线粒体网络的动态平衡。线粒体自噬不完全或受到抑制可导致受损线粒体清除受阻,ROS产生增多,炎症反应增强,细胞凋亡增加,器官功能受损。反之,线粒体自噬增强可清除受损伤线粒体,减少ROS产生,降低氧化应激反应,减轻肺损伤[17-18]。Pink1/Parkin介导的线粒体自噬是线粒体自噬的经典通路之一。当受外部环境影响下,线粒体损伤导致内膜发生去极化,Pink1聚集于线粒体内膜上并通过自身磷酸化激活募集并结合Parkin分子,自噬体在LC3接头蛋白的引导下包裹受损的线粒体,线粒体自噬发生[19]。本研究发现,HS大鼠肺组织中自噬水平标志物LC3-Ⅱ/LC3-Ⅰ比值将低,P62的表达增高,调控线粒体自噬的Pink1和Parkin蛋白表达下降。上述结果表明HS引起大鼠肺组织中线粒体自噬水平降低。因此线粒体自噬受到抑制可能是HS引起肺炎症反应和细胞损伤的机制之一。
Pink1/Parkin介导的线粒体自噬可保护细胞免受不同刺激引起的损伤[20]。激活Pink1/Parkin途径对脓毒症引起的肺损伤、肾损伤、肝损伤都具有一定的保护作用[20-22]。笔者通过尾静脉注射携带有Parkin基因的腺相关病毒,使大鼠肺组织过表达Parkin蛋白。热应激后,发现过肺组织过表达Parkin分子的大鼠生存率明显提高,肺血管的通透性降低,肺组织病理改变减轻,细胞凋亡显著减少。肺组织中炎症因子IL-6、IL-1β、TNF-α水平下降,氧化应激产物ROS含量均明显减少。免疫印迹和免疫荧光结果显示,Parkin过表达使大鼠肺组织中Parkin表达显著增多,Pink1与Parkin相互作用增强,从而促使自噬蛋白LC3-Ⅱ/LC3-Ⅰ比值升高,P62表达减少。这些结果表明,Parkin过表达可以激活Pink1/Parkin信号通路,促进线粒体自噬来清除受损线粒体,保持线粒体功能的有效性和维持细胞稳态,从而减轻炎症反应和氧化应激过度激活,减轻细胞损伤,最终减轻HS大鼠急性肺损伤,改善HS大鼠预后。因此,激活Pink1/Parkin途径,增强线粒体自噬,对HS肺损伤具有保护作用。
综上所述,本研究证明EHS会损伤呼吸系统,引起肺损伤。Pink1/Parkin介导的线粒体自噬水平受到抑制是EHS导致肺损伤发生的机制之一,而激活Pink1/Parkin通路可以减轻EHS大鼠肺损伤。Pink1/Parkin通路只是影响线粒体自噬的通路之一。其他调控线粒体自噬的蛋白,比如Nip3样蛋白X和Fun14结构相关蛋白1受体和Bcl-2样蛋白13等是否参与HS肺损伤的发生仍需要进一步的探索。
利益冲突 所有作者声明无利益冲突
作者贡献声明 孙正中:实验操作、论文撰写;孙正中、江利亚、孟冉、马运亚:数据收集及整理;顾焱、张玉想、王佳兴:研究设计、统计学分析、论文修改、经费支持
| [1] | Belval LN, Casa DJ, Adams WM, et al. Consensus statement-prehospital care of exertional heat stroke[J]. Prehosp Emerg Care, 2018, 22(3): 392-397. DOI:10.1080/10903127.2017.1392666 |
| [2] | Liu ZY, Chen JT, Hu L, et al. Expression profiles of genes associated with inflammatory responses and oxidative stress in lung after heat stroke[J]. Biosci Rep, 2020, 40(6): BSR20192048. DOI:10.1042/BSR20192048 |
| [3] | Chen Y, Tong HS, Pan ZG, et al. Xuebijing injection attenuates pulmonary injury by reducing oxidative stress and proinflammatory damage in rats with heat stroke[J]. Exp Ther Med, 2017, 13(6): 3408-3416. DOI:10.3892/etm.2017.4444 |
| [4] | Wang L, Lu ZY, Zhao J, et al. Selective oxidative stress induces dual damage to telomeres and mitochondria in human T cells[J]. Aging Cell, 2021, 20(12): e13513. DOI:10.1111/acel.13513 |
| [5] | Kumar R, Reichert AS. Common principles and specific mechanisms of mitophagy from yeast to humans[J]. Int J Mol Sci, 2021, 22(9): 4363. DOI:10.3390/ijms22094363 |
| [6] | 李涛, 王香. 虎杖苷通过沉默信息调节因子2相关酶3上调PINK1-Parkin线粒体自噬减轻脓毒症小鼠急性肺损伤机制研究[J]. 创伤与急危重病医学, 2021, 9(4): 272-276. DOI:10.16048/j.issn.2095-5561.2021.04.06 |
| [7] | Wei J, Ni N, Meng WS, et al. Early urine proteome changes in the Walker-256 tail-vein injection rat model[J]. Sci Rep, 2019, 9(1): 13804. DOI:10.1038/s41598-019-50301-1 |
| [8] | Sendo T, Kataoka Y, Takeda Y, et al. Nitric oxide protects against contrast media-increased pulmonary vascular permeability in rats[J]. Invest Radiol, 2000, 35(8): 472-478. DOI:10.1097/00004424-200008000-00003 |
| [9] | Hong SB, Koh Y, Lee IC, et al. Induced hypothermia as a new approach to lung rest for the acutely injured lung[J]. Crit Care Med, 2005, 33(9): 2049-2055. DOI:10.1097/01.ccm.0000178186.37167.53 |
| [10] | Ma CF, Dong L, Li MJ, et al. Qidonghuoxue decoction ameliorates pulmonary edema in acute lung injury mice through the upregulation of epithelial sodium channel and aquaporin-1[J]. Evid Based Complement Alternat Med, 2020, 2020: 2492304. DOI:10.1155/2020/2492304 |
| [11] | 全军热射病防治专家组, 热射病急诊诊断与治疗专家共识组. 热射病急诊诊断与治疗专家共识(2021版)[J]. 中华急诊医学杂志, 2021, 30(11): 1290-1299. DOI:10.3760/cma.j.issn.1671-0282.2021.11.002 |
| [12] | 李佳佳, 张磊磊, 马娜, 等. 不同剂量姜黄素对干热环境热射病大鼠肺损伤的保护作用[J]. 中华急诊医学杂志, 2020, 29(2): 247-252. DOI:10.3760/cma.j.issn.1671-0282.2020.02.0026 |
| [13] | Lin CH, Tsai CC, Chen TH, et al. Oxytocin maintains lung histological and functional integrity to confer protection in heat stroke[J]. Sci Rep, 2019, 9(1): 18390. DOI:10.1038/s41598-019-54739-1 |
| [14] | Bouchama A, Roberts G, Al Mohanna F, et al. Inflammatory, hemostatic, and clinical changes in a baboon experimental model for heatstroke[J]. J Appl Physiol, 2005, 98(2): 697-705. DOI:10.1152/japplphysiol.00461.2004 |
| [15] | Montava-Garriga L, Ganley IG. Outstanding Questions in Mitophagy: what We Do and Do Not Know[J]. J Mol Biol, 2020, 432(1): 206-230. DOI:10.1016/j.jmb.2019.06.032 |
| [16] | Zhao Y, Huang SH, Liu J, et al. Mitophagy contributes to the pathogenesis of inflammatory diseases[J]. Inflammation, 2018, 41(5): 1590-1600. DOI:10.1007/s10753-018-0835-2 |
| [17] | Yen YT, Yang HR, Lo HC, et al. Enhancing autophagy with activated protein C and rapamycin protects against sepsis-induced acute lung injury[J]. Surgery, 2013, 153(5): 689-698. DOI:10.1016/j.surg.2012.11.021 |
| [18] | Xiao B, Goh JY, Xiao L, et al. Reactive oxygen species trigger Parkin/PINK1 pathway-dependent mitophagy by inducing mitochondrial recruitment of Parkin[J]. J Biol Chem, 2017, 292(40): 16697-16708. DOI:10.1074/jbc.M117.787739 |
| [19] | Onishi M, Yamano K, Sato M, et al. Molecular mechanisms and physiological functions of mitophagy[J]. EMBO J, 2021, 40(3): e104705. DOI:10.15252/embj.2020104705 |
| [20] | Chen HG, Lin HY, Dong BB, et al. Hydrogen alleviates cell damage and acute lung injury in sepsis via PINK1/Parkin-mediated mitophagy[J]. Inflamm Res, 2021, 70(8): 915-930. DOI:10.1007/s00011-021-01481-y |
| [21] | Lin QS, Li S, Jiang N, et al. PINK1-parkin pathway of mitophagy protects against contrast-induced acute kidney injury via decreasing mitochondrial ROS and NLRP3 inflammasome activation[J]. Redox Biol, 2019, 26: 101254. DOI:10.1016/j.redox.2019.101254 |
| [22] | Park JS, Choi HS, Yim SY, et al. Heme oxygenase-1 protects the liver from septic injury by modulating TLR4-mediated mitochondrial quality control in mice[J]. Shock, 2018, 50(2): 209-218. DOI:10.1097/SHK.0000000000001020 |
 2024, Vol. 33
2024, Vol. 33