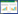2. 河南省人民医院CCU, 郑州 450003;
3. 河南省人民医院心内科, 郑州 450003
2. Coronary Care Unit, Henan Provincial People's Hospital, Zhengzhou 450003, China;
3. Department of Cardiology of Henan Provincial People's Hospital, Zhengzhou 450003, China
随着急性心肌梗死(acute myocardial infarction,AMI)救治技术的提高,AMI患者的病死率明显降低,但是心源性休克(cardic shock, CS)仍是导致AMI患者死亡的主要原因[1-3];即便是联合急诊经皮冠脉介入治疗(primary percutaneous coronary intervention, PPCI)、强化抗栓和血管活性药物的应用,AMICS的患者病死率仍然高达50%左右[4-5]。由于主动脉球囊反搏技术(intra-aortic balloon pump, IABP)的仅能辅助循环的局限性[6],静脉-动脉体外膜肺氧合(venoarterial-extracorporeal membrane oxygenation, VA-ECMO)立足于心肺的联合支持优势,单独或联合IABP作为AMICS患者危重时期的过渡的器械生命支持备受认可[7-9]。但VA-ECMO在AMICS患者救治中的价值仍存在争议,刊登在Lancet上的一项Meta分析[10]提出:对AMICS患者常规应用VA-ECMO并未提高30 d的生存率;且目前大规模多中心的随机对照研究[11]也尚未得出明确的结论。基于本院急诊中心应用VA-ECMO支持下AMICS患者PPCI的救治经验,提出如下假设:在对AMICS患者实施抢救过程中,是否是会因为社会问题或者技术问题相关的VA-ECMO支持的延迟置入导致了部分研究出现了阴性结果。故本研究将接受VA-ECMO支持下行PPCI的AMICS患者分为早期ECMO组和晚期ECMO组,且将无ECMO支持组作为对照,拟讨论及时启动VA-ECMO支持是否可提高AMICS接受PPCI患者短期及长期生存率。
1 资料与方法 1.1 研究对象本研究为前瞻性队列研究,本研究VA-ECMO组研究对象均来源于中国体外生命支持学会注册数据库(NCT04158479),纳入该数据库中2017年5月至2022年10月由河南省人民医院ECMO团队和心血管急诊介入团队救治的VA-ECMO支持下行PPCI的AMICS患者79例。另纳入与VA-ECMO组基线资料相匹配的同期就诊于本院的存在VA-ECMO的适应症但由于家属拒绝使用而未接受VA-ECMO支持的AMICS患者64例为无VA-ECMO支持的对照组。VA-ECMO组纳入标准:①年龄≥18岁;②患者均符合AMI全球新定义的诊断标准且符合PPCI的适应症[12];③符合CS的诊断标准且接受PPCI治疗;④符合VA-ECMO置入的适应症无禁忌证者。排除标准:①年龄 < 18岁或者≥90岁;②患者出现心搏骤停接受超过30 min以上的心肺复苏仍无生命迹象;③接诊时候明确有心脏器械并发症(如室间隔穿孔或者心脏破裂);④合并恶性肿瘤且生存期 < 1年;⑤伴有主动脉夹层、急性脑血管疾病脑或者严重的凝血功能障碍者;⑥出现难以逆转的多脏器功能衰竭或脑死亡者;⑦其他原因引起休克者。
所有纳入研究的患者家属均签署知情同意。本研究经河南省人民医院医学伦理委员会批准进行[批准号:(2020)伦审第(158)号]。
1.2 重要定义及分组标准心源性休克的定义:(1)收缩压低于90 mmHg(1 mmHg=0.133 kPa)大于30 min或者需要足量的血管活性药物使收缩压维持在90 mmHg以上(尽管有足够的液体复苏);(2)有休克的临床指征,包括肺淤血,器官末梢灌注受损(至少满足以下征象:精神状态差、发冷、指端皮肤湿冷、每小时尿量小于30 mL或者血乳酸含量大于2.0 mmol/L)[6]。确诊CS到ECMO启动工作的时间(CS-ECMO时间):即自诊断心源性休克到VA-ECMO顺利转机的时间间隔。围术期:本研究中特指患者自入院至完成PPCI手术48 h。早期VA-ECMO:自诊断为AMICS后大剂量应用血管活性药物或者IABP超过30 min,难以维持患者收缩压在90 mmHg,且外周氧饱和度进行性下降,即刻启动本院急诊中心ECMO团队顺利置入VA-ECMO且ECMO顺利转机;晚期VA-ECMO:符合上述VA-ECMO启动的标准,但由于转运、家属知情同意或设备等问题延迟启动ECMO团队导致CS-ECMO时间延长。
1.3 ECMO的置入及应用ECMO置入均由本院急诊中心成熟的ECMO团队成员操作,均采用静脉-动脉辅助模式。插管前10 min经静脉给予0.5 mg/kg肝素,ACT > 200 s开始置管。股动脉插管深度为插管侧孔后5~8 cm,股静脉插管深度为插管侧孔后30~40 cm。下肢血运不良时,安装侧路循环。VA-ECMO顺利转机后逐渐滴定调整流量,缓慢增加流量至3.0 L/min,评估循环、血管活性药物使用情况及超声主动脉瓣开放情况调整流量。PPCI后待血液动力学指标稳定,逐渐减少血管活性药物用量,并维持预设治疗目标。采用压力控制机械通气,根据右桡动脉的血气分析结果调整呼吸机和ECMO参数。患者意识恢复前采取浅低温(33~34℃)、甘油果糖及襻利尿剂,以减轻脑水肿。必要时补充浓缩红细胞、凝血因子和白蛋白,使血红蛋白达到120~140 g/L,血小板 > 75×109/L,白蛋白 > 30 g/L。
1.4 ECMO围术期管理ECMO机器开始转流时以较高流量灌注,维持平均动脉压在60 mmHg以上,混合静脉血氧饱和度SvO2≥65%,在保证灌注充足的前提下,逐渐下调血管活性药物。VA-ECMO辅助中期根据心肺恢复及血流动力学情况,可逐渐下调泵血流量至理想心输出量的50%左右。VA-ECMO辅助期间监测活化部分凝血活酶时间和D-二聚体,每4~6 h监测1次APTT,维持在40~60 s,D-二聚体保持无明显升高趋势。如流量降至理想心输出量的20%以下,使用小剂量/不使用正性肌力药物即可维持血流动力学稳定,血氧饱和度≥95%,超声心动图提示心脏左室及右室的各项参数达标且LVEF≥25%,即可考虑撤机。
1.5 临床数据采集收集患者的年龄、性别、BMI、吸烟、饮酒、既往病史、服药情况情况等基线资料;记录患者入院时血压、心率、左室射血分数(LVEF%)、乳酸、pro-BNP等指标;记录住院期间是否接受CRRT、IABP治疗及总住院天数;收集患者住院期间冠脉介入相关信息、VA-ECMO置入相关并发症、CS-ECMO时间、VA-ECMO转机时间、撤机情况等指标;追踪并随访患者围术期、院内及出院后1年的生存情况。出院后随访均有河南省人民医院心内科参与患者救治的两名医生完成1年内的随访。
1.6 临床终点及安全性指标主要终点事件:本研究的主要终点为1年内的全因死亡。次要终点事件:围手术期及院内病死率。安全性指标主要为围术期的并发症发生率。
1.7 统计学方法本研究采用SPSS 26.0及R 4.2.0进行统计学分析。计量资料服从正态分布的以均数±标准差(x±s)表示,不符合正态分布的以中位数(四分位数)[M(Q1, Q3)]表示,组间比较采用独立样本t检验或Mann-Whitney U检验进行比较。分类变量以例数(百分比)表示,组间比较采用卡方检验或Fisher精确概率法。应用多因素Logistic回归及Cox回归筛选影响院内及1年死亡的独立预测因素,采用Kaplan-Meier生存曲线对三组患者1年内生存情况进行对比分析,并进行Log-rank检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 临床基线资料比较共纳入143例符合纳入和排除标准的AMICS患者,除去失访患者和部分资料缺失患者,最终共76例接受VA-ECMO和60例无VA-ECMO支持的对照组AMICS患者资料纳入结果分析。136例AMICS患者中,男性90例(66.2%),年龄(60.69±13.14)岁。早期VA-ECMO组42例,晚期VA-ECMO组34例,无VA-ECMO组60例。三组间年龄、性别、基础疾病、有创呼吸机、CRRT及IABP使用情况等基线资料差异无统计学意义。但是与早期VA-ECMO组相比,晚期VA-ECMO组和无VA-ECMO支持组患者乳酸和NT-proBNP值均较高(均P < 0.05);与晚期VA-ECMO组相比,早期VA-ECMO从患者确诊AMICS到VA-ECMO正常转机工作的时间较短(P < 0.05)。见表 1。
| 项目 | 早期VA-ECMO (n =42) | 晚期VA-ECMO (n =34) | 无VA-ECMO (n =60) | t/χ2/Z值 | P值 |
| 年龄(岁) a | 59.07±11.90 | 59.41±10.97 | 63.57±13.31 | 2.086 | 0.128 |
| 男性[例(%)] | 31(73.8) | 24(70.6) | 35(58.3) | 3.038 | 0.219 |
| BMI(kg/m2) a | 25.67±2.57 | 24.70±2.23 | 25.75±2.28 | 2.385 | 0.096 |
| 吸烟[例(%)] | 26(61.9) | 22(64.7) | 38(63.3) | 0.064 | 0.969 |
| 饮酒史[例(%)] | 23(54.8) | 18(52.9) | 34(56.7) | 0.125 | 0.939 |
| 既往病史[例(%)] | |||||
| 高血压 | 22(52.4) | 17(50.0) | 30(50.0) | 0.066 | 0.968 |
| 糖尿病 | 11(26.2) | 7(20.6) | 10(16.7) | 1.371 | 0.504 |
| 脑血管病 | 4(9.5) | 5(14.7) | 8(13.3) | 0.529 | 0.767 |
| 冠心病 | 8(19.0) | 7(20.6) | 10(16.7) | 0.240 | 0.887 |
| 高脂血症 | 16(38.1) | 11(32.4) | 24(40.0) | 0.551 | 0.759 |
| 既往PCI史[例(%)] | 7(16.7) | 5(14.7) | 9(15.0) | 0.071 | 0.965 |
| 服药史[例(%)] | |||||
| 阿司匹林 | 9(21.4) | 7(20.6) | 15(25.0) | 0.304 | 0.859 |
| 他汀 | 8(19.0) | 6(17.6) | 13(21.7) | 0.245 | 0.885 |
| β-阻滞剂 | 9(21.4) | 6(17.6) | 14(23.3) | 0.419 | 0.811 |
| 硝酸酯类 | 6(14.3) | 3(8.8) | 4(6.7) | 1.687 | 0.430 |
| 收缩压(mmHg) a | 63.54±14.29 | 62.0±13.02 | 64.75±14.30 | 0.447 | 0.641 |
| 心率(次/min) a | 94.12±40.67 | 100.18±41.14 | 89.28±34.07 | 0.880 | 0.419 |
| LVEF(%)a | 29.50±6.07 | 29.06±6.11 | 30.03±5.062 | 0.337 | 0.715 |
| 室壁瘤[例(%)] | 2(4.8) | 2(5.9) | 3(5.0) | — | 1.000 |
| 乳酸(mmol/L) b | 3.45 (2.38, 5.65) | 7.85 (4.45, 10.10)c | 8.9 (7.90, 11.40)c | 47.287 | < 0.001d |
| NT-proBNP (pg/mL) b | 5980.0 (3375.0, 8962.5) | 1331.7 (7620.0, 18752.5)c | 16750.0 (10577.5, 19800.0)c | 43.933 | < 0.001d |
| CRRT[例(%)] | 5(11.9) | 4(11.8) | 9(15.0) | 0.291 | 0.864 |
| 有创呼吸机支持[例(%)] | 8(19.0) | 7(20.6) | 17(28.3) | 1.402 | 0.496 |
| IABP[例(%)] | 22(52.3) | 19(55.9) | 37(56.6) | 0.911 | 0.634 |
| 住院天数(d) b | 12(9.0, 17.0) | 16.0(4.0, 24.0) | 11.0(4.0, 15.0) | 1.206 | 0.547 |
| CS-ECMO(min) | 120.0 (77.0, 161.0) | 277.0 (241.0, 316.0) | — | 51.073 | < 0.001d |
| 注:a为x±s;b为M(Q1, Q3);与早期ECMO组比较,cP < 0.05,d为三组间比较差异有统计学意义;AMICS为急性心肌梗死合并心源性休克,ECMO为体外膜肺氧合,VA-ECMO为静脉-动脉体外膜肺氧合,IABP为主动脉球囊反搏,BMI为体重指数,LVEF(%)为左心室射血分数,CS-ECMO为确诊心源性休克到ECMO启动工作的时间;“—”为无数据 | |||||
本研究纳入分析的136例AMICS患者均在VA-ECMO前/后顺利完成PPCI,其相关冠脉造影及介入治疗结局见表 2所示。三组间IRA分布、PCI前后TIMI血流分级、病变血管个数及植入支架个数均差异无统计学意义;但早期VA-ECMO组门囊时间较晚期VA-ECMO组长(P < 0.05),且早期VA-ECMO组与晚期VA-ECMO组相比,置入VA-ECMO后行PPCI治疗的患者比例更高(P < 0.05)。见表 2。
| 项目 | 早期VA-ECMO(n =42) | 晚期VA-ECMO(n =36) | 无VA-ECMO(n =60) | χ2/Z值 | P值 |
| IRA[例(%)] | 4.041 | 0.671 | |||
| LM | 3 (7.1) | 5 (14.7) | 5 (8.3) | ||
| LAD | 23 (54.8) | 22 (64.7) | 36 (60.0) | ||
| RCA | 13 (31.0) | 6 (17.6) | 17 (28.3) | ||
| LCX | 3 (7.1) | 1 (2.9) | 2 (3.3) | ||
| 术前TIMI分级0/1[例(%)] | 34 (81.0) | 27 (79.4) | 52 (86.7) | 1.010 | 0.603 |
| 术后TIMI血流3级[例(%)] | 40 (95.3) | 31 (91.2) | 54 (90%) | 0.945 | 0.623 |
| 病变血管支数[例(%)] | 5.932 | 0.204 | |||
| 1 | 14 (33.3) | 6 (17.6) | 8 (30.0) | ||
| 2 | 17 (40.5) | 12 (35.3) | 16 (26.7) | ||
| 3 | 11 (26.2) | 16 (47.1) | 26 (43.3) | ||
| 置入支架数(枚)a | 2 (1, 4) | 3 (1, 4) | 2 (1, 3) | 2.806 | 0.246 |
| ECMO后PCI[例(%)] | 36 (81.8) | 8 (18.2)b | — | 29.806 | < 0.001 |
| D-to-B(min)a | 216.5 (148.8, 262.5) | 119.0 (67.50, 258.75) b | 145.0 (110.0, 227.5) | 8.263 | 0.016c |
| 注:a为M(Q1, Q3);与早期ECMO组比较,bP < 0.05,c为三组间比较差异有统计学意义;AMICS为急性心肌梗死合并心源性休克,ECMO为体外膜肺氧合,VA-ECMO为静脉-动脉体外膜肺氧合,IRA为梗死相关动脉,LM为左主干,LAD为左前降支,RCA为右冠状动脉,LCX为左回旋支,TIMI为心肌梗死溶栓试验,D-to-B为门囊时间;“—”为无数据 | |||||
早期VA-ECMO组VA-ECMO的撤机成功率明显高于晚期VA-ECMO组,且VA-ECMO支持时间较晚期VA-ECMO组明显缩短(P < 0.05);晚期VA-ECMO组菌血症及重度贫血的发生率较无VA-ECMO组高(P < 0.05);晚期VA-ECMO组急性肾损伤的发生率较早期VA-ECMO组高(P < 0.05);早期VA-ECMO支持组肺水肿的发生率明显低于无VA-ECMO支持组(P < 0.05),晚期VA-ECMO肺水肿的发生率虽然较无VA-ECMO低,但两者差异并无统计学意义。见表 3。
| 指标 | 早期VA-ECMO (n=42) | 晚期VA-ECMO (n=34) | 无VA-ECMO (n=60) | t/χ2/Z值 | P值 |
| ECMO初始流量(L/min) a | 2.68±0.21 | 2.66±0.19 | — | 0.329 | 0.743 |
| ECMO撤机成功率[例(%)] | 36 (85.7) | 20 (61.8) | — | 5.748 | 0.017d |
| ECMO支持时间(h) a | 78.07±32.89 | 104.918±56.24 | — | -2.595 | 0.011d |
| 并发症[例(%)] | |||||
| 重度贫血 | 5 (11.9) | 7 (20.6) | 2 (3.3)c | 7.168 | 0.028d |
| 消化道出血 | 3 (7.1) | 2 (5.9) | 2 (3.3) | 1.017 | 0.619 |
| 菌血症 | 4 (9.5) | 7 (20.5) | 2 (3.3)c | 7.474 | 0.024d |
| DIC | 2 (4.8) | 5 (14.7) | 4 (6.7) | 2.537 | 0.307 |
| 下肢缺血/血栓 | 7 (16.7) | 6 (17.6) | 11 (18.3) | 0.470 | 0.977 |
| 急性肾损伤 | 5 (11.9) | 13 (38.2)b | 14 (23.3) | 7.242 | 0.027d |
| 卒中 | 4 (9.5) | 6 (17.6) | 7 (11.7) | 1.202 | 0.548 |
| 肺水肿 | 3 (7.1) | 7 (20.6) | 16 (26.7)b | 6.154 | 0.045d |
| 再发心梗 | 3 (7.1) | 5 (14.7) | 6 (10.0) | 1.174 | 0.556 |
| 恶性心律失常 | 10 (23.8) | 11 (32.4) | 17 (28.3) | 0.689 | 0.708 |
| 心脏破裂 | 3 (7.1) | 4 (11.8) | 5 (8.3) | 0.531 | 0.767 |
| 注:a为x±s;b为与早期ECMO组比较,bP < 0.05;与晚期ECMO组比较,cP < 0.05;d为三组间比较存在统计学差异;MICS为急性心肌梗死合并心源性休克,ECMO为体外膜肺氧合,VA-ECMO为静脉-动脉体外膜肺氧合,DIC为弥漫性血管内凝血;“—”为无数据 | |||||
本院急诊中心自2018年以来,VA-ECMO支持下行PPCI救治AMICS患者例数逐年上涨(图 1A);且自确诊AMICS到VA-ECMO正常转机工作的时间(CS-ECMO)不管在早期VA-ECMO组还是晚期ECMO组均逐年缩短(图 1B);与2018年相比,2022年CS-ECMO总时间明显缩短且差异有统计学意义[388(282, 482) vs. 80(65, 221),P < 0.05]。见图 1。
|
| ECMO为体外膜肺氧合,VA-ECMO为静脉-动脉体外膜肺氧合,CS-ECMO为自确诊AMICS到植入VA-ECMO后VA-ECMO正常转机的时间 图 1 VA-ECMO本中心5年应用量及启动速度增长趋势 Fig 1 The rising tendency of using number and implanted speed in 5 years in our center |
|
|
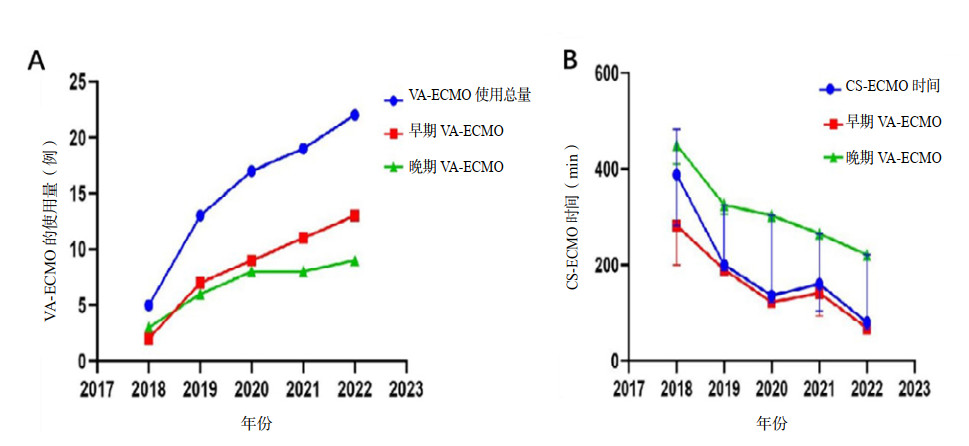
3组间不同时期病死率对比及院内与1年死亡预测因素分析如图所示(图 2、表 4),与早期VA-ECMO组相比,无VA-ECMO支持组围术期(4.8% vs. 28.3%,P=0.003)、院内(21.4% vs. 50.0%,P=0.003)及1年病死率(31.0% vs.61.7%,P=0.002)均明显升高;早期VA-ECMO组与晚期VA-ECMO组的围手术期及院内病死率差异无统计学意义,但晚期VA-ECMO组1年病死率明显增高(31.0% vs. 55.9%,P=0.029);而晚期VA-ECMO组和无VA-ECMO组相比,围手术期、院内及1年病死率虽较低,但差异均无统计学意义。多因素Logistic及Cox回归模型分析提示,校正年龄、EF%、NT-proBNP及D-to-B时间等干扰因素后,早期VA-ECMO仍是院内(OR=0.244,P=0.015)及1年(HR=0.308,P=0.001)内死亡的保护因素(表 4)。
|
| a组间相比,P < 0.01;b组间相比,P < 0.001;ns为组间相比无统计学差异 图 2 三组间不同时期病死率对比 Fig 2 Comparison of mortality in different periods among the 3 groups |
|
|
| Logistic | Cox | ||||||
| 项目 | OR | 95%CI | P值 | HR | 95%CI | P值 | |
| 早期VA-ECMO | 0.244 | 0.078~0.760 | 0.015a | 0.308 | 0.152~0.623 | 0.001a | |
| LVEF(%) | 0.925 | 0.858~0.996 | 0.04a | 0.929 | 0.890~0.971 | 0.001a | |
| 年龄(岁) | 1.076 | 1.037~1.116 | < 0.001a | 1.042 | 1.020~1.064 | < 0.001a | |
| NT-proBNP(ng/mL) | 1.021 | 0.986~1.057 | 0.241 | 1.002 | 1.001~1.031 | 0.039a | |
| D-to-B(min) | 1.004 | 1.000~1.008 | 0.082 | 1.002 | 1.000~1.005 | 0.076 | |
| 注:AMICS为急性心肌梗死合并心源性休克,VA-ECMO为静脉-动脉体外膜肺氧合,LVEF(%)为左心室射血分数,D-to-B为门囊时间;a为差异存在统计学意义 | |||||||
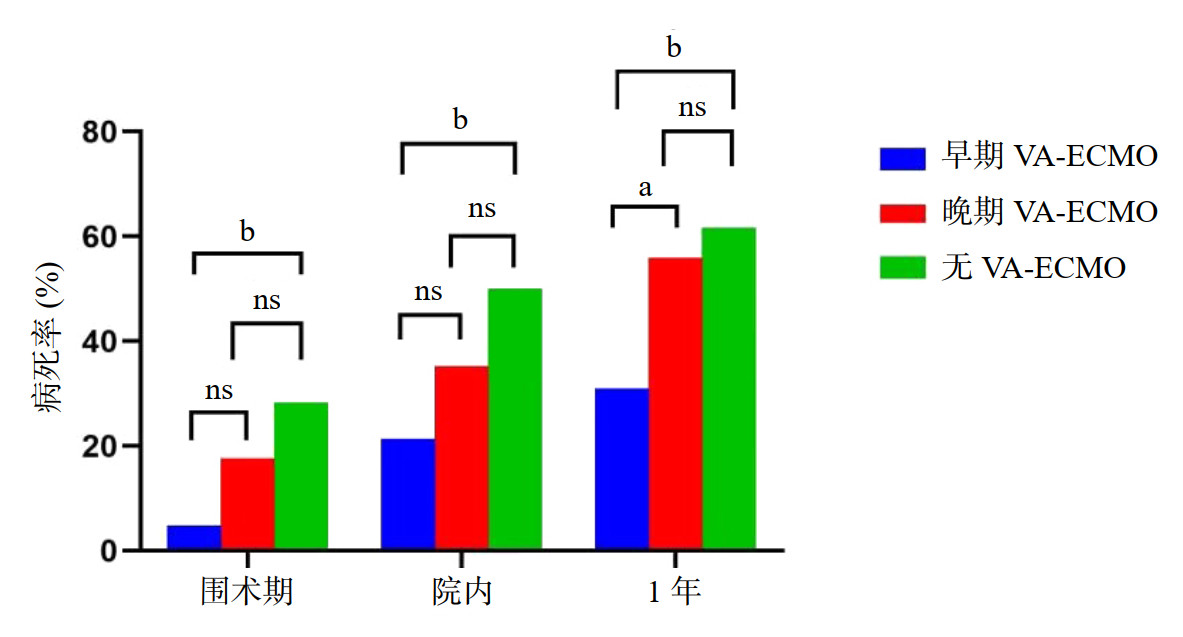
本研究中纳入的136例AMICS患者中,其中VA-ECMO支持下接受PPCI治疗患者76例,与无VA-ECMO组相比,VA-ECMO支持下的AMICS患者1年后生存率较高(57.9% vs. 38.3%, P=0.023);但早期VA-ECMO支持组1年生存率最高,且与无VA-ECMO组相比,晚期VA-ECMO组生存率虽有升高,但差异无统计学意义(图 2)。Kaplan-Merier生存曲线显示1年内生存率在期VA-ECMO组最高(P=0.002),但晚期VA-ECMO组与无VA-ECMO组间差异无统计学意义(P=0.224)(图 3)。
|
| AMICS为急性心肌梗死合并心源性休克,VA-ECMO为静脉-动脉体外膜肺氧合图 图 3 3组患者1年内预后的Kaplan-Meier生存曲线 Fig 3 Kaplan-Meier survival curve of patients in 3 groups in 1 year |
|
|
本研究结果提示,接受足量血管活性药物或IABP辅助治疗仍然存在低灌注状态的AMICS患者,及时早期启动VA-ECMO机械生命支持,较晚期VA-ECMO和无VA-ECMO支持患者围手术期、院内及1年内生存率均高;且与晚期VA-ECMO相比缩短了VA-ECMO的支持时间,提高了撤机成功率;晚期VA-ECMO支持与无VA-ECMO支持组相比,各时段生存率均无明显改善,且增加了菌血症和重度贫血的发生率。故早期启动VA-ECMO为病情随时可能进一步恶化的AMICS患者争取了救治时间且提供了安全保障。
PPCI技术的进步及普及大大的提高了AMI患者救治成功率,但是CS仍然是AMI患者死亡的首要原因。既往研究提示AMI患者发生CS的比例为4%~12%[13],且AMICS患者的住院病死率高达40%~60%[3-5],AMI合并CS多因多支血管病变造成的大面积梗死、持续低灌注状态导致的多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)或PCI后心肌缺血再灌注损伤、冠状动脉慢血流等因素。因此尽早纠正组织低灌注状态、维持血流动力学稳定是治疗AMICS的关键[4]。机械循环支持(mechanical circulatior supoport, MCS)为AMICS提过了“桥梁”式的循环和(或)呼吸支持,包括IABP、VA-ECMO和经皮微轴左心辅助装置(percutaneous microaxial left ventricular assist device, LVAD)。虽然大量临床研究表明,MCS的应用为AMICS的救治提供了时间和安全保证,对其获益与否的质疑仍然持续存在;IABP-SHOGK Ⅱ研究[11]是最具有说服力的评估IABP在AMICS中应用价值的研究,但结果却证实常规应用IABP并不能使患者获益,自此指南中对IABP在AMICS的推荐等级下降至IIb,有研究证实IABP的全球应用量自2011年起明显下降[6];2023年Almarzooq等[14]提出,经LVAD与其他替代治疗相比,并未使AMICS的患者获益;同年,Zeymer等[10]的Meta分析结果提出,VA-ECMO并未降低AMICS患者30 d的病死率。一时间,MCS在AMICS的应用价值再次掀起业内讨论的热潮。当然上述研究中也均提出,各中心纳入患者、MCS的应用时机、反应速度及社会文化差异,会导致各中心得出不同的研究结论。本院急诊中心作为中原较大的AMICS救治中心,拥有成熟的PPCI团队和ECMO救治团队,基于近年来VA-ECMO在本院急诊中心使用量逐渐递增的背景,拟进一步探讨VA-ECMO的应用时机对接受PPCI的AMICS患者的应用价值。
本研究纳入的136例VA-ECMO患者,根据有无VA-ECMO支持,及是否及时启动VA-ECMO支持分为早期VA-ECMO支持、晚期VA-ECMO支持和无VA-ECMO支持组,三组间的基线资料、疾病背景及入院基础生化检查并差异无统计学意义,说明三组间关于并发症、生存率的结果具有统计可比性;但是晚期VA-ECMO支持组和无VA-ECMO支持组患者的NT-proBNP和乳酸数值较高,与两组患者院内肺水肿发生率较高和延迟的呼吸支持相一致。
既往对VA-ECMO支持下AMICS生存情况的研究表明患者生存率在33%~66%不等[15-17],本研究结果提示76例接受VA-ECMO支持的患者中,1年病死率为42.7%,与先前的研究一致;若将之分为早期VA-ECMO组和晚期VA-ECMO组,则早期VA-ECMO组的病死率降低至31.0%,而晚期VA-ECMO组的病死率则高达55.9%,提示及时启动呼吸循环支持对AMICS患者救治的重要性;虽早期VA-ECMO组和晚期VA-ECMO组患者围术期和院内死亡的差异无统计学意义,但晚期VA-ECMO组与无VA-ECMO组相比,各阶段的病死率并无明显下降。由此可见,及时启动VA-ECMO使AMICS患者的长期获益更明显,这与Sheu等[15]的研究提示院内获益明显的结果并不一致。
关于早期VA-ECMO启动的定义,也存在一定的争议,比如以就诊至VA-ECMO的置入时间为或者PPCI前/后置入为标准;先于PPCI的早期VA-ECMO支持为冠脉血管重建提供了稳定的循环状态且为复杂的PCI手术提供足够时间支持;本研究中,有57.8%的患者在PPCI前置入并启动了VA-ECMO,其中早期VA-ECMO组为81.8%,晚期VA-ECMO组为18.2%,而笔者进一步的相关性分析提示PPCI和VA-ECMO的先后顺序并不是院内或者1年内生存情况的独立预测因素。而先前Pozzi等[18]的研究,90%的AMICS患者在完成PPCI后接受了VA-ECMO的置入,但是却以12%未成功PCI为代价;Muller等[19]的研究中,89.9%的AMI患者在PPCI后接受VA-ECMO支持,但ICU存活率仅为47.0%;而2018年,一项单中心研究结果提出,PPCI前置入VA-ECMO可以使STEMI患者明显获益[20]。由于各中心患者的综合管理流程和救治水平的差异,且PPCI前置入VA-ECMO是以牺牲“门-囊时间”为代价,如本研究中早期VA-ECMO组门囊时间明显延长,笔者并不能武断的以上述研究结果评判在PPCI前或者后置入VA-ECMO的优劣。而本研究以患者对临床初期的干预方式的反应定义早期VA-ECMO置入是符合临床实践的分组方式。
不可否认,VA-ECMO的应用会带来置入相关并发症,如急性肾衰竭、失血和下肢入路血管相关并发症等。Wu等[21]研究中发现急性肾衰竭的发生率为45.7%,此外,一项纳入4 608例接受VA-ECMO支持AMI患者的研究中表明,接受VA-ECMO支持的住院患者中血管并发症发生率为6.1%[22]。本研究纳入的76例VA-ECMO支持的患者中,急性肾功能损伤的发生率为23%,但是其中早期VA-ECMO支持组的发生率明显低于晚期VA-ECMO组,下肢血栓/缺血发生率为17.1%,且两组之间差异无统计学意义;且晚期VA-ECMO支持患者中重度贫血和菌血症的发生率明显高于无VA-ECMO支持的患者,而早期VA-ECMO组却与未植入VA-ECMO组差异无统计学意义。由此可见,在接受VA-ECMO支持的AMICS患者中,延迟VA-ECMO的使用明显增加了ECMO相关并发症的发生,却未在近期及远期生存率上获益。
本研究中患者中,自确诊AMICS到VA-ECMO工作时间均值为3.3 h,而早期VA-ECMO组仅为2 h,明显短于Pozzi等[18]2018年的报道,稍长于Huang等[20]的报道中PPCI前VA-ECMO组的患者,而先前的很多研究并未报道CS-ECMO的时间间隔,这可能是导致研究间存在差异的原因之一;且与晚期VA-ECMO组相比,早期VA-ECMO的置入明显缩短了VA-ECMO的工作时间、提高了撤机的成功率且降低了ECMO相关并发症的发生率;这也是早期VA-ECMO辅助AMICS患者生存率提高的主要原因。VA-ECMO的延迟置入及启动后顺利转机与多种因素有关,比如患者初次就诊医院的急救水平,是否拥有成熟的PPCI团队和ECMO团队直接影响了ECMO启动的时机,所以各中心关于VA-ECMO对AMICS救治的研究呈现出了不同的研究结果;另外更重要的因素为伦理和经济因素,虽然VA-ECMO的应用提高了部分患者的生存概率,但是仍然有不少的患者即便接受了VA-ECMO的支持,仍然难以存活,也就是Abrams等[23]提出的“bridge to nowhere”,且ECMO需要特殊的设备和专业的团队,需要较高的医疗花费,国外多项关于VA-ECMO用于心源性休克的救治成本分析研究[24-25],较常规的治疗,VA-ECMO支持的人均医疗花费提高了1~2万美元不等。故对于高龄患者的救治结局的不确定性和高额的医疗费用,可能是导致临床上VA-ECMO启动延迟的主要原因。乐观的是,本研究从本院急诊中心VA-ECMO在接受PPCI的AMICS患者中的应用趋势来看,5年来VA-ECMO的应用量稳定增长,这与国际趋势是一致的,且CS-ECMO的时间在各组均有明显缩短;这应该与近年来ECMO团队救治水平的提高和医务人员及患者家属群体的健康意识提高有关。
本研究通过评估难治性接受PPCI的AMICS患者VA-ECMO置入时机与临床结局之间的关系,补充了先前的研究,表明接受早期VA-ECMO支持的患者院内及1年生存情况均优于晚期VA-ECMO及无VA-ECMO支持组,且并发症的发生率并无明显增加,多因素回归结果提示即使是矫正了相关干扰因素,早期VA-ECMO支持仍是院内及1年内生存的保护因素。但是本研究的结论仍需要谨慎应用,因为对于早期置入的定义和患者评估差异,盲目冲动及早VA-ECMO置入也可能会延长门囊时间,增加不必要的并发症发生率及救治费。
本研究存在以下局限性:①本研究为单中心研究,样本量较小,女性患者偏少,无法准确代表研究人群总体;②本研究对早期VA-ECMO置入的定义不同于其他研究,可能导致研究结果的推广受到影响;③对出院患者的随访中除死亡以外的心血管不良事件未做分析。根据本研究的数据结果,后期拟开展多中心ECMO置入时机相关的前瞻性研究进一步明确此策略对AMICS患者的预后影响。
综上所述,AMI-CS患者早期及时应用VA-ECMO可降低患者围手术期病死率,提高院内及1年内的生存率,且并不明显增加严重并发症的发生率。
利益冲突 所有作者声明无利益冲突
作者贡献声明 秦历杰:实验设计、文章内容批评性审阅、ECMO置入团队协调和安全质控、研究经费的支持;楚英杰:参与实验设计、患者的纳入把控及急诊PCI手术质量安全控制;董淑娟:参与实验设计、数据的分析及急诊PCI手术质量安全控制;崔路乾及宋慧慧:参与急诊PCI手术、负责数据的收集和患者的随访;李静超:数据的统计分析、文章的撰写和修改;余海佳:文章的主要撰写、实验设计、统计分析、后期文章的修改和急诊PCI的手术质量安全控制
| [1] | Thiele H, Ohman EM, de Waha-Thiele S, et al. Management of cardiogenic shock complicating myocardial infarction: an update 2019[J]. Eur Heart J, 2019, 40(32): 2671-2683. DOI:10.1093/eurheartj/ehz363 |
| [2] | Thiele H, Akin I, Sandri M, et al. PCI strategies in patients with acute myocardial infarction and cardiogenic shock[J]. N Engl J Med, 2017, 377(25): 2419-2432. DOI:10.1056/NEJMoa1710261 |
| [3] | Damluji AA, Tehrani B, Sinha SS, et al. Position statement on vascular access safety for percutaneous devices in AMI complicated by cardiogenic shock[J]. JACC Cardiovasc Interv, 2022, 15(20): 2003-2019. DOI:10.1016/j.jcin.2022.08.041 |
| [4] | Thiele H, de Waha-Thiele S, Freund A, et al. Management of cardiogenic shock[J]. EuroIntervention, 2021, 17(6): 451-465. DOI:10.4244/EIJ-D-20-01296 |
| [5] | Goldberg RJ, Spencer FA, Gore JM, et al. Thirty-year trends (1975 to 2005) in the magnitude of, management of, and hospital death rates associated with cardiogenic shock in patients with acute myocardial infarction: a population-based perspective[J]. Circulation, 2009, 119(9): 1211-1219. DOI:10.1161/CIRCULATIONAHA.108.814947 |
| [6] | Parakh N. Intraaortic balloon support for myocardial infarction with cardiogenic shock[J]. Indian Heart J, 2012, 64(6): 617-618. DOI:10.1016/j.ihj.2012.10.009 |
| [7] | Guglin M, Zucker MJ, Bazan VM, et al. Venoarterial ECMO for adults: JACC scientific expert panel[J]. J Am Coll Cardiol, 2019, 73(6): 698-716. DOI:10.1016/j.jacc.2018.11.038 |
| [8] | 潘晨亮, 赵晶, 胡思雄, 等. 急性心肌梗死合并心原性休克患者应用VA-ECMO联合IABP的时机探索[J]. 中华心血管病杂志, 2023, 51(8): 851-858. DOI:10.3760/cma.j.cn112148-20230706-00396 |
| [9] | Rao P, Khalpey Z, Smith R, et al. Venoarterial extracorporeal membrane oxygenation for cardiogenic shock and cardiac arrest[J]. Circ Heart Fail, 2018, 11(9): e004905. DOI:10.1161/CIRCHEARTFAILURE.118.004905 |
| [10] | Zeymer U, Freund A, Hochadel M, et al. Venoarterial extracorporeal membrane oxygenation in patients with infarct-related cardiogenic shock: an individual patient data meta-analysis of randomised trials[J]. Lancet, 2023, 402(10410): 1338-1346. DOI:10.1016/S0140-6736(23)01607-0 |
| [11] | Banning AS, Sabaté M, Orban M, et al. Venoarterial extracorporeal membrane oxygenation or standard care in patients with cardiogenic shock complicating acute myocardial infarction: the multicentre, randomised EURO SHOCK trial[J]. EuroIntervention, 2023, 19(6): 482-492. DOI:10.4244/EIJ-D-23-00204 |
| [12] | Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018)[J]. Circulation, 2018, 138(20): e618-e651. DOI:10.1161/CIR.0000000000000617 |
| [13] | Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2018, 39(2): 119-177. DOI:10.1093/eurheartj/ehx393 |
| [14] | Almarzooq ZI, Song Y, Dahabreh IJ, et al. Comparative effectiveness of percutaneous microaxial left ventricular assist device vs intra-aortic balloon pump or No mechanical circulatory support in patients with cardiogenic shock[J]. JAMA Cardiol, 2023, 8(8): 744-754. DOI:10.1001/jamacardio.2023.1643 |
| [15] | Sheu JJ, Tsai TH, Lee FY, et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock[J]. Crit Care Med, 2010, 38(9): 1810-1817. DOI:10.1097/CCM.0b013e3181e8acf7 |
| [16] | Lee WC, Fang CY, Chen HC, et al. Associations with 30-day survival following extracorporeal membrane oxygenation in patients with acute ST segment elevation myocardial infarction and profound cardiogenic shock[J]. Heart Lung, 2016, 45(6): 532-537. DOI:10.1016/j.hrtlng.2016.08.006 |
| [17] | Chung SY, Tong MS, Sheu JJ, et al. Short-term and long-term prognostic outcomes of patients with ST-segment elevation myocardial infarction complicated by profound cardiogenic shock undergoing early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention[J]. Int J Cardiol, 2016, 223: 412-417. DOI:10.1016/j.ijcard.2016.08.068 |
| [18] | Pozzi M, Flagiello M, Armoiry X, et al. Extracorporeal life support in the multidisciplinary management of cardiogenic shock complicating acute myocardial infarction[J]. Catheter Cardiovasc Interv, 2020, 95(3): E71-E77. DOI:10.1002/ccd.28316 |
| [19] | Muller G, Flecher E, Lebreton G, et al. The ENCOURAGE mortality risk score and analysis of long-term outcomes after VA-ECMO for acute myocardial infarction with cardiogenic shock[J]. Intensive Care Med, 2016, 42(3): 370-378. DOI:10.1007/s00134-016-4223-9 |
| [20] | Huang CC, Hsu JC, Wu YW, et al. Implementation of extracorporeal membrane oxygenation before primary percutaneous coronary intervention may improve the survival of patients with ST-segment elevation myocardial infarction and refractory cardiogenic shock[J]. Int J Cardiol, 2018, 269: 45-50. DOI:10.1016/j.ijcard.2018.07.023 |
| [21] | Wu MY, Tseng YH, Chang YS, et al. Using extracorporeal membrane oxygenation to rescue acute myocardial infarction with cardiopulmonary collapse: the impact of early coronary revascularization[J]. Resuscitation, 2013, 84(7): 940-945. DOI:10.1016/j.resuscitation.2012.12.019 |
| [22] | Vallabhajosyula S, Bell MR, Sandhu GS, et al. Complications in patients with acute myocardial infarction supported with extracorporeal membrane oxygenation[J]. J Clin Med, 2020, 9(3): 839. DOI:10.3390/jcm9030839 |
| [23] | Abrams D, MacLaren G, Lorusso R, et al. Extracorporeal cardiopulmonary resuscitation in adults: evidence and implications[J]. Intensive Care Med, 2022, 48(1): 1-15. DOI:10.1007/s00134-021-06514-y |
| [24] | Jäämaa-Holmberg S, Salmela B, Suojaranta R, et al. Cost-utility of venoarterial extracorporeal membrane oxygenation in cardiogenic shock and cardiac arrest[J]. Eur Heart J Acute Cardiovasc Care, 2020, 9(4): 333-341. DOI:10.1177/2048872619900090 |
| [25] | Gravesteijn BY, Schluep M, Voormolen DC, et al. Cost-effectiveness of extracorporeal cardiopulmonary resuscitation after in-hospital cardiac arrest: a Markov decision model[J]. Resuscitation, 2019, 143: 150-157. DOI:10.1016/j.resuscitation.2019.08.024 |
 2024, Vol. 33
2024, Vol. 33