全球已发现的蛇类超过4 000种,其中一半以上是游蛇,毒蛇约占20%(800余种),其中眼镜蛇科400多种,蝰蛇科超380种[1],医学上有重要意义的毒蛇近250种[2]。蛇咬伤是重要的公共卫生问题,主要发生于赤道两侧温暖地区,东南亚、撒哈拉以南的非洲地区和南美洲等地最为多见,95%的蛇咬伤发生在发展中国家。全世界每年发生蛇咬伤450~540万例次,约20%是未排毒的“干咬”[3](即毒蛇咬合时没有释放毒素,不产生中毒症状和体征,或仅有轻微伤口表现);年蛇咬伤严重中毒者约180~270万,近40万毒蛇咬伤者发生不同程度的残疾[4-5]。造成8.1~13.8万人死亡,年人群病死率高达0.8/10万[6]。
中国是蛇类资源最丰富国家之一,全域均有蛇的分布,长江以南地区为主,已发现蛇类300多种,有毒蛇超过100种,其中眼镜蛇科和蝰科的剧毒蛇80多种,少数为游蛇科毒蛇[1],被世界卫生组织(WHO)列为医学上有重要意义的毒蛇共23种(含香港和台湾地区)[2]。据不完全统计,我国每年约发生25~28万例毒蛇咬伤,以50岁及以上人群为主,受伤部位主要是肢体,下肢高于上肢,每年4~10月多发,7~9月是蛇咬伤高峰[1]。各省区毒蛇谱有较大差异,不同地区的蛇咬伤救治水平参差不齐,仍有一定的致死致残率。本指南旨在提高公众对蛇咬伤的认知,进一步指导和规范临床蛇咬伤救治行为,提高蛇咬伤患者的存活率,降低致死致残率。
2 制定方法 2.1 检索策略本指南以循证医学为基本原则,针对蛇咬伤临床重要问题进行中/英文献检索,检索时间以最近10年为主(截至2023年12月31日),部分重要资料在此时间段之外。中文检索数据库为中国知网、维普和万方数据知识服务平台,主要通过关键词或题名中检索“蛇伤”、“蛇咬伤”、“毒蛇伤”、“毒蛇咬伤”、“蛇伤救治”、“蛇伤治疗”、“抗蛇毒”等;英文检索数据库主要是Pubmed、外文医学信息资源检索平台、Web of science、ScienceDirect、OVID。检索方法同中文检索,主要检索词为snake venom、venom、toxin、toxic、poisoning、snake bite、snakebite(s)、antivenom、anti snake、anti snake venom、antivenin、snakebite management、snakebite treatment等。
2.2 证据等级和推荐本指南参考GRADE证据评价系统,采用证据级别:A级为高质量证据,如随机对照试验或大样本Meta分析;B级为中等质量证据,如非随机对照试验、横断面研究、系统评价或临床病例系列等;C级为低质量证据,如专家意见或个案报告等。推荐级别:Ⅰ级为已证实和(或)一致认为是有益或有效,应当实施;Ⅱ级为证据有限或不一致,实施是适当或可行的;Ⅲ级为已证实或一致认为无益或有害,不建议或反对实施。
3 蛇与蛇毒 3.1 无毒蛇我国无毒蛇近200种,常见无毒蛇包括乌梢蛇、白条锦蛇、水蛇、三索锦蛇、赤链蛇、翠青蛇、黑眉锦蛇、滑鼠蛇、王锦蛇、玉斑锦蛇、草腹链蛇、灰鼠蛇、草花蛇、渔游蛇、中国小头蛇、环纹华游蛇和蟒蛇等。
3.2 毒蛇毒蛇种类繁多,临床上根据蛇毒对人体的毒性效应,分为神经毒、血液毒和细胞毒类蛇。每种毒蛇可同时含多种不同毒素,如眼镜王蛇主要含神经毒和血液毒素、蝮蛇以血液毒为主兼有神经毒素、尖吻蝮蛇为血液毒兼有细胞毒素、圆斑蝰蛇为血液毒兼有肾细胞毒素、海蛇主要是神经毒和肾细胞毒素等。常见毒蛇按主要毒素分类。
3.2.1 神经毒类蛇银环蛇、金环蛇、眼镜王蛇和海蛇等。
3.2.2 血液毒类蛇竹叶青蛇、蝮蛇、尖吻蝮蛇、蝰蛇、原矛头蝮蛇、红脖颈槽蛇和虎斑颈槽蛇等。
3.2.3 细胞毒类蛇中华眼镜蛇等。
3.3 蛇毒及作用机制蛇毒是自然界成分最为复杂的天然高效毒素混合物,毒液为淡黄或乳白色半透明黏稠液体,主要由蛋白(如酶、多肽和糖蛋白等)和非蛋白成分(如脂类、金属离子和生物胺等)组成,蛋白类占蛇毒干重的90%~95%[7-8]。每种毒蛇含20至100种以上不同毒素成分,且毒素种类存在种内和种间差异[9-10],并因地域、季节、蛇龄等的不同而异[11-12]。眼镜蛇科毒蛇的毒素以三指毒素和磷酯酶A2(PLA2)为主;蝰科毒蛇的毒素以蛇毒金属蛋白酶、PLA2和蛇毒丝氨酸蛋白酶为主[13]。蛇毒蛋白因作用位点的不同可产生多种毒性效应[9, 14-15],如PLA2主要作用于肌细胞的质膜和轴索膜中的各种受体[16];蛇毒金属蛋白酶作用靶点多,最显著的是IV型胶蛋白和凝血因子[17];蛇毒丝氨酸蛋白酶主要影响凝血因子[9];三指毒素作用于烟碱和毒蕈碱型乙酰胆碱受体、乙酰胆碱酯酶,阻断神经肌肉冲动传导等[18]。某些毒素本身表现为低毒性,当它与毒液中的其他毒素混合时,会放大彼此毒性或产生协同效应[19]。
3.3.1 血液系统损害常累及凝血瀑布和血小板[15],主要是蝰科、部分眼镜蛇科和游蛇科毒蛇的毒素。蛇毒Ⅴ因子活化剂、Ⅹ因子活化剂、凝血酶原激活剂和凝血酶样酶等产生促凝效应;Ⅸ/Ⅹ结合蛋白、蛋白C激活剂、凝血酶抑制剂和PLA2等表现为抗凝特性;纤维蛋白溶解酶和纤溶酶原激活剂等具纤维蛋白溶解活性;蛇毒金属蛋白酶、去整合素和C型凝集素会直接破坏血管壁[20]。蛇毒对血小板的效应主要是促进或抑制血小板聚集,如丝氨酸蛋白酶促进血小板聚集,去整合素和5-核苷酸酶抑制血小板聚集,PLA2、金属蛋白酶、C型凝集素样蛋白和L-氨基酸氧化酶的不同亚型分别产生抑制或促进血小板聚集效应[21]。蛇毒经淋巴管和毛细血管吸收,大分子经淋巴系统吸收,金属蛋白酶等酶类毒素对淋巴管本身有损害作用,导致淋巴管通透性增加,促进或加重局部水肿等[15]。
3.3.2 神经系统损害毒素作用于骨骼肌的神经-肌肉接头,毒素与运动神经末梢(突触前膜)和运动终板(突触后膜)的主要作用靶位是乙酰胆碱受体,产生弛缓性麻痹,见于绝大多数眼镜蛇科和少数蝰科毒蛇咬伤中毒。β银环蛇毒素、PLA2和树突毒素等作用于突触前膜;α银环蛇毒素、弱毒素、黑绿烙铁头毒素和PLA2等作用于突触后膜;乙酰胆碱酯酶作用于突触间隙[15]。大多数毒蛇仅含单一神经毒素,与突触前膜结合(如斯里兰卡圆斑蝰蛇、银环蛇和太攀蛇等)或与突触后膜结合(如眼镜王蛇、眼镜蛇);银环蛇毒液中含有α-银环蛇毒素、β-银环蛇毒素、κ-银环蛇毒素、γ-银环蛇毒素等,对突触前、后膜都有作用[1, 22]。多数毒素与神经肌肉受体结合的亲和力高,不易解离,尤其是突触前受体结合后临床恢复缓慢,但突触后神经毒素结合后可被抗蛇毒血清快速逆转[23, 24]。少数毒蛇的三指毒素、PLA2和孟加拉眼镜蛇的“弱毒素”等对自主神经系统有一定作用[15]。
3.3.3 细胞毒损害细胞毒是低分子量非酶促三指毒素家族的一类重要物质,广泛存在于眼镜蛇科和少数蝰科毒蛇的毒液中,中华眼镜蛇是亚洲眼镜蛇中细胞毒含量最多的,其细胞毒成分占毒素总量的70%左右[12]。细胞毒素通过影响细胞膜结构和膜结合蛋白、激活凋亡和坏死细胞死亡途径来介导毒性,多为非特异性效应,致使局部各种细胞、组织和皮肤损害等,也能通过神经元和心肌膜去极化,导致部分眼镜蛇中毒患者出现心力衰竭。
3.3.4 其他损害(1) 肾损害:部分毒蛇咬伤可引起急性肾损伤,以蝰科毒蛇多见,如圆斑蝰蛇、海蛇和响尾蛇的蛇毒酶(如PLA2、金属蛋白酶、透明质酸酶和丝氨酸蛋白酶等),可损伤肾小球、肾小管和肾血管细胞;个别非酶成分可直接致肾毒性[25]。(2)心血管损害:几乎所有毒蛇均有蛇毒PLA2,部分可与蛇毒钠尿肽、缓激肽增强肽、血管内皮细胞生长因子、蛇毒金属蛋白酶和丝氨酸蛋白酶协同作用诱发低血压;三指毒素通过阻断L型钙离子通道、与肾上腺素能和毒蕈碱受体相互作用,诱发低血压;蛇毒ATP酶、ADP酶和核苷酸酶催化ATP分解为ADP、AMP和腺苷,促进血管扩张、通透性增加和炎症效应,降低血压[26]。丝氨酸蛋白酶和金属蛋白酶可诱发出血和凝血障碍,产生蛇毒诱发的消耗性凝血病(VICC),导致有效血容量减少;某些蛇毒引起血管收缩、微血栓形成、微血管病性溶血性贫血和血小板降低,减少有效循环[27]。部分蛇毒可通过直接损伤心肌细胞膜、诱发心律失常、继发高凝状态诱发冠脉综合征、诱发冠脉痉挛、急性肾衰竭继发高钾血症和对蛇毒高敏反应产生促炎效应等,进而导致多种心血管损害效应等[26, 28]。
4 临床表现毒蛇咬伤的临床表现因蛇种或毒素种类和含量等不同而异,约20%(1.75%~50.0%)是“干咬”[3],重者产生严重中毒表现甚至致命,与毒蛇排毒量、被咬伤后至就诊的时间长短有显著关联[29]。临床主要表现为神经毒性三联征(双侧眼睑下垂、下行性麻痹、呼吸困难/急性呼吸衰竭)、血液毒性三联征(蛇毒诱发的消耗性凝血病、局部出血和全身性出血)和细胞毒性三联征(严重疼痛、进行性肿胀和组织损伤)。部分游蛇可产生不同程度的中毒[30],且为非前沟牙类游蛇咬伤,主要表现为轻度疼痛、牙痕或撕裂,局部轻微反应性水肿或少量出血,通常在24~36 h消退,少数有致命风险。
4.1 一般表现局部表现如牙痕,不同程度疼痛,出血,淋巴结肿大,淋巴管炎,局部肿胀,红斑,皮肤温度升高、水疱(出血性和非出血性)、瘀斑,后期可能发生局部感染、脓肿形成、气性坏疽和坏死等。部分患者出现非特异性全身表现,如恶心、呕吐、乏力、腹痛、头晕、头痛、发热、出汗或腹泻等。
4.2 神经表现银环蛇等神经毒类蛇主要引起弛缓性、下行性麻痹。逐渐影响颅神经支配的肌肉、颈屈肌以及延髓、呼吸、躯干和肢体的肌肉等。典型的下行性麻痹最先累及眼睑肌,表现为双侧上眼睑下垂,多在咬伤后数小时内出现;其次是外眼肌麻痹、复视、瞳孔散大固定,面瘫伴言语不清和张口困难;继之累及上颚、下颌、舌、喉,致咽部分泌物淤积、咽反射丧失;随后麻痹症状发展并继续下降到颈部肌肉和延髓肌肉,延髓肌肉受累导致吞咽困难,丧失气道保护功能,极易产生误吸或窒息;颈肌麻痹可表现为颈部柔软无力。呼吸肌受累则呼吸浅快,通气能力下降、腹部反常呼吸、动用辅助肌肉和出现紫绀,一旦出现严重呼吸困难很快会继发呼吸停止。蛇咬伤患者发生呼吸衰竭的时间差异较大,短者30 min,长者超过24 h,平均约6~12 h。四肢肌肉最后受累,近端肌肉先受影响,继而远端肌无力,严重者表现为四肢完全瘫痪状态,深部腱反射会减弱甚至消失。神经功能的恢复通常遵循肌肉受累的相反顺序,即远端肌力先恢复,继之近端肌力逐渐恢复,上睑下垂和眼肌麻痹最后才恢复[1, 27, 31]。
4.3 血液学表现竹叶青蛇、尖吻蝮蛇等血液毒类蛇主要为出凝血功能障碍,称为蛇毒诱发的消耗性凝血病(venom-inducedc onsumption coagulopathy, VICC),表现为伤口渗血甚或流血不止,皮肤出血点、瘀点、瘀斑、牙龈出血,呕血、黑便,咯血,血尿等,严重者发生脑等重要器官出血,甚至诱发低血容量性休克等[32]。
4.4 细胞毒表现主要是局部疼痛、肿胀,并由咬伤部位向周围扩展,出现水疱、皮肤坏死或感染、局部瘀斑等。当肿胀超过皮肤弹性极限时,即可诱发筋膜室综合征样表现,如疼痛、被动拉伸疼痛、感觉异常和肢端麻痹等,罕有皮肤苍白和无脉表现[33-34]。
4.5 其他表现心血管系统表现如心悸、低血压、休克、心律失常等;泌尿系统表现包括腰痛、血尿、血红蛋白尿、肌红蛋白尿、少尿/无尿等急性肾损伤或尿毒症特征;骨骼肌表现为全身疼痛、肌肉僵硬和压痛、张口困难等;内分泌系统可能出现全垂体功能减退、休克、血糖异常、继发性脱毛、性功能减退、闭经、睾丸萎缩或甲状腺功能减退等[35];喷毒眼镜蛇和中华眼镜蛇等的毒液喷入眼睛,会产生剧烈疼痛、无法睁眼、流泪、结膜充血发红、睑缘炎、眼睑痉挛和角膜糜烂等蛇毒相关性眼炎表现,延迟治疗或不治疗可能导致角膜混浊、前房积液和失明等[36]。
5 辅助检查 5.1 实验室检查血常规提示白细胞和中性粒细胞升高,核左移,早期多是应激所致。伴有较多出血或溶血者,可有红细胞减少,血红蛋白降低,部分蛇种咬伤易致血小板减少,VICC也可有血小板减少症。血尿、黑尿、少尿、无尿、蛋白尿或管型等提示伴有急性肾损伤;血管内溶血时有血红蛋白尿;肌损伤或溶解有肌红蛋白尿和高钾血症等。凝血-纤溶系统检查如国际标准化比率(INR)、凝血酶原时间(PT)、部分凝血活酶时间(APTT)、纤维蛋白原(Fbg)、D-二聚体(DD)、出血时间(BT)、凝血酶时间(TT)、抗凝血酶Ⅲ(AT-Ⅲ)和鱼精蛋白副凝(3P)试验等,结果异常提示血液毒类蛇咬伤。血栓弹力图(thromboelastography,TEG)可反映血液凝固动态变化或纤溶过程,包括血凝块形成和发展、血凝块回缩和溶解,从而提供血栓形成速度、强度和稳定性等血栓形成过程的信息,适用于血液毒类蛇咬伤后凝血功能障碍的评估,可作为凝血功能的辅助评估手段[37-39]。
常规做血液生化、肝肾功能、(心)肌酶谱等检查,评估内环境和重要器官功能。血气分析有助于发现和评价呼吸功能及酸碱异常;血乳酸可有效反应循环灌注和组织代谢等变化。20 min全血凝集试验是检测蛇咬伤后凝血功能障碍的一种高度特异性(特异度98%)和比较敏感(敏感度82%)的床旁试验[40],它简便易行,主要适用于偏远或简陋条件下且较长时间无实验室测定凝血功能者, 但3 h内阳性率低[41]。
推荐意见1:抗蛇毒治疗前应做重要器官的基本实验室检查,并酌情动态评估(B级证据,Ⅰ级推荐)。
5.2 影像学检查心电图检查有利于发现心脏受累情况,如心律失常、心肌缺血或梗死和高钾血症等改变。胸片或胸部CT可评估肺部受损情况,尤其肺水肿、肺出血和胸腔积液等。CT或MRI对判断内脏出血或其他结构性改变有用,如颅内出血或脑梗死、胸腹腔血肿等。B超适于探查浆膜腔积液、积血、心功能评估或其他疾病变化等。肌电图有助于评估神经肌肉病变,脑电图主要评估神经毒蛇咬伤后“脑死亡样改变”等。如有条件,可用红外热成像检查,直观评估咬伤局部炎症反应情况[42-43]。对确定或疑似蛇毒喷入眼睛的,应请眼科评估蛇毒相关性眼炎的眼损情况。
推荐意见2:建议对毒蛇咬伤患者做心肺等重要器官的基础影像学评估(B级证据,Ⅰ级推荐)。
6 诊断评估 6.1 蛇伤诊断蛇咬伤的诊断应根据病史、查体和实验室或影像结果,结合当地蛇咬伤流行病学特征综合评价确定。(1)病史:疑似或确定蛇咬伤史是最基本的诊断线索,主要询问咬伤部位、时间、地点、现场处理措施、目前感觉或症状、致伤蛇的特征,以及症状体征进展情况;尤应注意询问患者基础病用药(如抗凝或抗血小板药物)史和过敏史等。(2)查体:根据蛇咬伤牙痕及牙间距、伤口及伤周肿胀、水疱、出血或瘀斑、肤色或皮疹、区域淋巴结等局部表现,进行全身尤其是重要器官的体格检查。注意,对神经毒类蛇咬伤者,瞳孔对光反射、疼痛刺激或格拉斯哥评分可能无法准确反应临床情况。(3)实验室或影像检查结果。(4)蛇种确定:可根据目击致伤蛇的特征、目击者现场拍摄的致伤蛇照片或提供致伤蛇实物这些直接证据,或准备当地常见毒蛇的图片供伤者辨认,包括蛇体大小、长短或重量、色泽和体纹特征等;因光线、草丛环境等原因,很多时候患者无法直接目击或提供准确的致伤蛇信息,此时不必过分强调明确蛇的特征或蛇种,可根据中毒综合征综合判断和及时处理。
推荐意见3:毒蛇咬伤的诊断主要依赖临床中毒特征,避免过分强调致伤蛇种的确认(C级证据,Ⅱ级推荐)。
6.2 严重程度评估蛇咬伤的严重程度判断有多种方法,各种评估方法各有优劣,本指南推荐两种评估方法供临床参考。
6.2.1 临床严重度简易评估方法[1]此法简便易记、实用性强,适于急诊医师接诊和临床判断,但内容相对粗略。见表 1。
| 严重程度 | 临床表现 |
| 无中毒 | 仅有牙痕(“干”咬),无其他任何症状和体征 |
| 轻度 | 仅有伤口及周围局部表现,如疼痛、伤口出血、皮肤瘀血、非进行性肢体肿胀不超肘或膝关节,咬伤12 h无进展;局部感觉异常、麻木、神经性疼痛、肌肉痉挛、肌束震颤等 |
| 中度 | 肿胀进行性发展、远离伤口的地方出现紫癜或瘀斑未超过肢体一半;非致命性的全身症状或体征,如恶心、呕吐、呕血/黑便;轻微口周麻木感,轻度乏力感,呼吸肌无力产生呼吸困难或其他呼吸不适,语言障碍、复视、听觉或味觉异常、吞咽困难等;实验室结果轻微改变(< 正常高限值的2倍),凝血功能轻度异常但无全身出血表现 |
| 重度 | 局部症状如广泛肿胀、红斑或瘀斑快速进展超过大半肢体,或咬到头、颈或躯干;明显症状和体征,如乏力或进行性肌无力、视物模糊、上睑下垂、意识改变、心动过速、呼吸急促或窘迫、或需要人工通气支持,血流动力学不稳定如低血压或休克等,疑似或确定颅内或腹腔出血;实验室结果显著异常,如凝血功能严重障碍伴伤口以外的部位出血表现,血小板减少,肌酶显著异常(≥2倍正常高限值)等 |
| 部位 | 症状/体征 | 分值 |
| 肺部 | 无症状/体征 | 0 |
| 呼吸困难,轻度胸闷,轻度不适,呼吸20~25次/min | 1 | |
| 中度呼吸窘迫(呼吸困难,26~40次/min,动用辅助呼吸肌) | 2 | |
| 紫绀,空气不足感,严重呼吸急促或呼吸窘迫/衰竭 | 3 | |
| 心血管 | 无症状/体征 | 0 |
| 心率100~125次/min,心悸,全身乏力,良性心律失常或高血压 | 1 | |
| 心率126~175次/min或低血压(收缩压 < 100 mmHg) | 2 | |
| 心率 > 175次/min或低血压(收缩压 < 100 mmHg),恶性心律失常或心脏骤停 | 3 | |
| 局部创伤 | 无症状/体征(牙痕周围肿胀或红斑 < 2.5 cm) | 0 |
| 疼痛,咬伤部位肿胀或瘀斑范围 < 5.0~7.5 cm | 1 | |
| 疼痛,咬伤部位肿胀或瘀斑范围不超过半个肢体(7.5~50 cm) | 2 | |
| 疼痛,咬伤部位肿胀或瘀斑范围超过半个肢体(50~100 cm) | 3 | |
| 疼痛,肿胀或瘀斑超出肢体(距咬伤部位 > 100 cm) | 4 | |
| 胃肠道 | 无症状/体征 | 0 |
| 腹痛、里急后重或恶心 | 1 | |
| 呕吐或腹泻 | 2 | |
| 反复呕吐、腹泻、呕血或便血 | 3 | |
| 血液 | 无症状/体征 | 0 |
| 凝血参数轻度异常[PT < 20 s,APTT < 50 s,血小板(100~150)×109/L,纤维蛋白原100~150 mg/dL] | 1 | |
| 凝血参数明显异常[PT 20~50 s,APTT 50~75 s,血小板(50~100)×109/L,纤维蛋白原50~100 mg/dL] | 2 | |
| 凝血参数明显异常[PT 50~100 s, APTT 75~100 s,血小板(20~50)×109/L,纤维蛋白原 < 50 mg/dL] | 3 | |
| 凝血参数显著异常,伴有严重出血或自发性出血风险;PT或APTT测不出,血小板 < 20×109/L,纤维蛋白原测不出,其他实验室结果严重异常如静脉血凝固时间异常 | 4 | |
| 神经系统 | 无症状/体征 | 0 |
| 轻微不安或恐惧,头痛,乏力,头晕,寒冷或感觉异常 | 1 | |
| 中度不安或恐惧,头痛,乏力,头晕,寒冷,意识错乱或模糊,咬伤部位肌肉颤动或肌束震颤,上睑下垂和吞咽困难 | 2 | |
| 严重意识错乱、嗜睡、虚弱、瘫痪、抽搐、昏迷、精神障碍或全身肌束震颤 | 3 | |
| 肾脏系统 | 肌酐和尿量正常 | 0 |
| 肌酐是基线的1.5~1.9倍,或肌酐增加≥26.5 μmol/L,或尿量 < 0.5 mL/(kg•h)且持续 > 6 h | 1 | |
| 肌酐是基线的2~2.9倍,或尿量 < 0.5 mL/(kg•h)且持续 > 12 h | 2 | |
| 肌酐≥3倍基线,肌酐≥353.6 μmol/L,尿量 < 0.3 mL/(kg•h)且持续 > 24 h、或无尿≥12 h、或需要肾替代治疗 | 3 | |
| 注:纤维蛋白原数值应以本单位参考值划分;1 mmHg=0.133 kPa | ||
蛇咬伤严重程度评分[45](snakebite severity scale, SSS)是根据临床和实验室结果对蛇咬伤后的严重程度进行量化评分的方法,轻度0~3分,中度4~7分,重度≥8分。SSS分类项目多、内容详细、客观性好,已被大多数国家采纳,主要用于学术研究。但因稍复杂,可记忆性差,其设计初衷是作为研究工具而非临床评估工具,所以适于蛇伤事件人群研究,若用于患者的临床诊断,SSS对严重中毒的区分度较为有效,对轻中度的区分度较差[46];对某些症状和体征的特异性不强,因此可靠性欠佳。改良蛇咬伤严重程度评分在提高区分度的同时,纳入了肾脏损害指标,因此,评估更为全面,但该评分对神经毒类蛇咬伤的区分度仍然较差,如用于神经毒类蛇伤的评估,建议直接参考该评分表中神经系统评估分值来划分严重程度。见表 2。
6.3 严重中毒线索毒蛇咬伤的评估有明显时限性,如被咬伤至就诊时间短暂者,中毒程度相对较轻,随着时间延续,中毒可能渐趋严重。早期发生以下情况提示是严重中毒[47]:(1)致伤蛇是非常危险的蛇种或蛇体巨大。(2)牙间距过宽或有多处咬伤或被多条毒蛇咬伤。(3)早期局部肿胀快速进展和扩散。(4)早期发生淋巴结肿痛,提示蛇毒经淋巴系统扩散。(5)早期出现全身中毒症状,如低血压或休克、恶心、呕吐、腹泻、严重头痛、眼睑沉重感、昏睡、早期眼睑下垂或眼肌麻痹等。(6)早期出现自发性全身性出血。(7)被蛇咬伤后无尿。(8)早期发现血尿、褐色尿或黑色尿等。
6.4 诊断记录格式蛇咬伤诊断记录格式的统一,有利于各地规范诊断,便于临床资料收集、分析和电子化检索,易于促进学术交流。
6.4.1 无毒蛇伤(ICD:W59)对蛇种明确者,直接记录具体蛇种和咬伤部位;对蛇种不明确者,直接写无毒蛇和咬伤部位,如“蛇咬伤(水蛇,左脚后跟外侧)”或“蛇咬伤(无毒蛇,右脚后跟外侧)”。
6.4.2 毒蛇咬伤(ICD:T63)诊断要记录蛇种、咬伤部位和严重程度。对蛇种明确的毒蛇咬伤,直接记录具体蛇种,如“毒蛇咬伤(蝮蛇,右手食指,重度)”、毒蛇咬伤(眼镜蛇,右足后跟内侧,干咬)。对蛇种不明的毒蛇咬伤,按毒性类型(血液毒、神经毒或细胞毒类蛇)记录,如“毒蛇咬伤(血液毒类蛇,左手拇指,重度)。
推荐意见4:推荐按统一的蛇伤诊断格式书写病历记录,以便于开展数智赋能的真实世界研究。(A级证据,Ⅱ级推荐)。
6.5 鉴别诊断 6.5.1 毒蛇与无毒蛇咬伤由于蛇的种类繁多,被蛇咬伤后有时不易区别是否有毒。临床上主要依靠局部或全身症状、蛇的形态(如体形、头型、牙齿、色斑或体纹等)等综合鉴别。眼镜蛇科和蝰科全部是剧毒蛇,游蛇科的少数蛇种如红脖颈槽蛇和虎斑颈槽蛇也是剧毒蛇,其他游蛇多是低毒或微毒。
6.5.2 其他动物咬伤蛇咬伤依据目击咬伤史基本可以明确诊断,但部分蛇咬伤发生于夜间或光线不足的时段、在草丛或枯叶中无法看清致伤蛇,因此有必要与常见动物咬蜇伤相鉴别。一是蜈蚣蜇伤,有1~2枚蜇痕,蜇痕可呈楔状,无下颏牙痕,伤口及伤肢剧痛,可有局部炎性肿胀,严重者可伴组织坏死,多无全身症状或症状较轻。二是蝎子蜇伤,蝎子可有角化的大螯钳伤,有2枚伤痕,局部疼痛,多无红肿;如果是尾刺蜇伤,只有1枚刺痕,局部疼痛、肿胀和麻木,严重的可出现流泪、流涎等轻度神经症状。三是蜘蛛蜇伤,多是局部肿胀疼痛,严重的可产生局部小面积坏死,一般无全身症状。
7 蛇伤救治 7.1 现场急救目的是确保蛇咬伤患者生命安全和身体完整,延缓毒素吸收,预防并发症,尽快将患者运送到有救治条件的医疗机构,避免或减少对伤者带来额外伤害,不拖延时间影响急救,可参考蛇咬伤急救流程处理(图 1)。现场可采用以下急救方法[1, 48-50]。
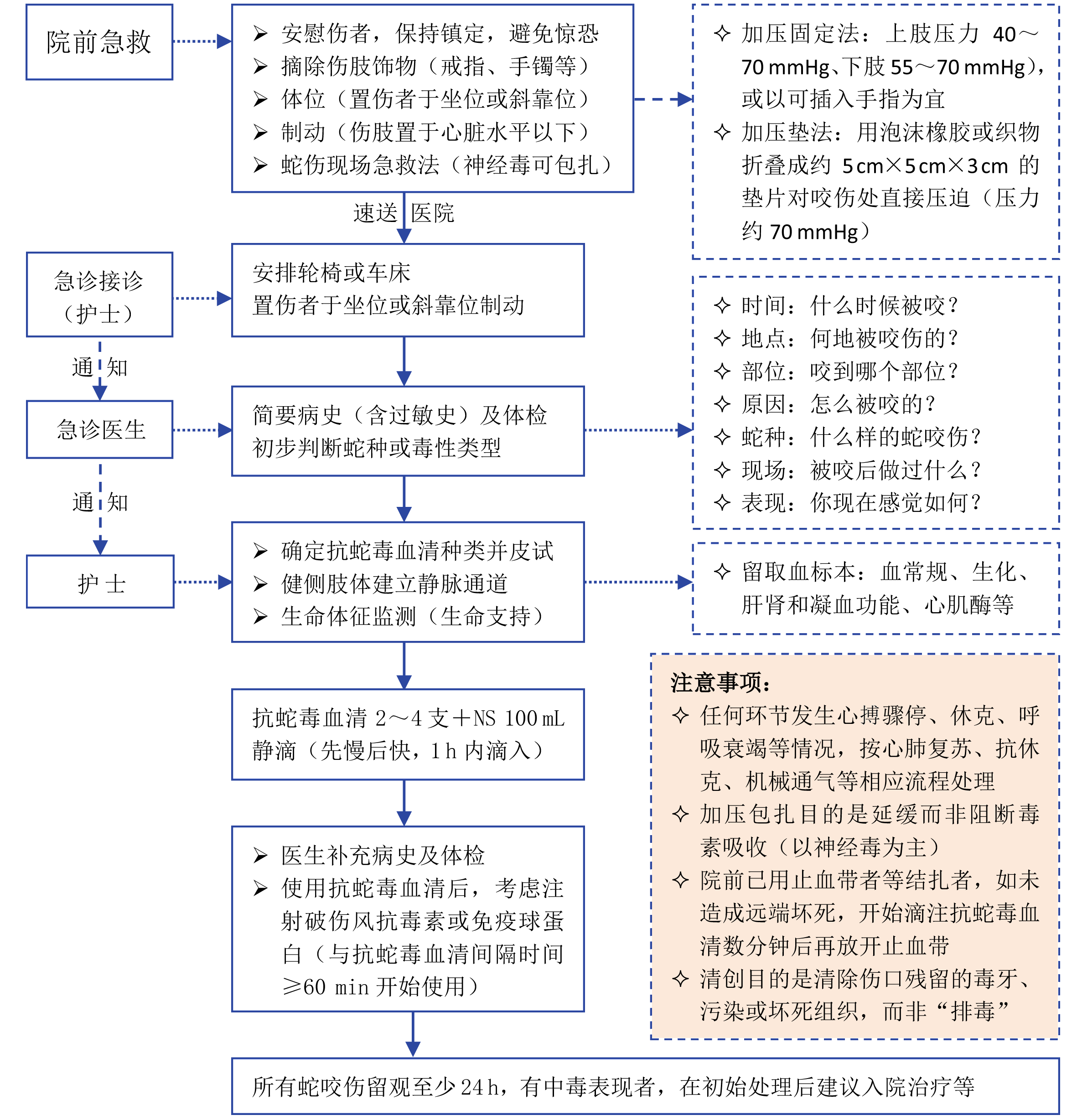
|
| 图 1 蛇咬伤急救流程图 |
|
|
立即远离发生咬伤的区域,遇有蛇咬住不放时,可用棍棒或其他工具促使其脱离,水中被蛇(如海蛇)咬伤者,立即将受伤者移送到岸边或船上,以免毒性发作致淹溺。
7.1.2 认蛇几乎无人能够认识所有蛇类,即便常见毒蛇,也可因地域、环境等因素产生不同程度的变异,给蛇的辨认带来困难。因此,尽量记住蛇的基本特征,如蛇的形态、头型、体纹和颜色等,或拍摄致伤蛇照片以备辨识。切勿企图捕杀致伤蛇,避免二次受伤。
7.1.3 镇定蛇伤后的紧张、恐慌等会加速血液循环,促进毒素吸收。尽量保持冷静,平复情绪,因为部分是“干咬”,且中毒症状需要一定时间才发生,及时救治是可痊愈的。
7.1.4 呼救尽快送去医院是被蛇咬伤后最有效的急救措施,应及时呼叫“120”或当地指定急救电话,快速送往就近医疗机构或有蛇伤救治能力的医院,切忌等到中毒症状发作再送医。
7.1.5 解压摘掉受伤肢体饰物,如戒指、手镯、手表、脚链、脱去紧身衣袖或裤子等,以免加重局部伤害,伤口可用清水简单冲洗。
7.1.6 制动活动有促进毒素吸收的风险,被毒蛇咬伤后应尽量全身性制动,尤其受伤肢体制动,可用夹板或就地取材固定伤肢以保持制动;伤者保持坐位或斜靠位,受伤部位或肢体处于相对低位(保持在心脏水平以下),以利减少回心血量,减缓毒素吸收或扩散。
7.1.7 包扎对蛇咬伤患者无绝对安全有效的包扎方法,绷带加压固定、加压垫或加压环有助于减缓毒素吸收,主要适于神经毒类蛇咬伤,也适合部分血液毒类蛇咬伤,谨慎用于中华眼镜蛇、尖吻蝮蛇等富含细胞毒的蛇咬伤,否则可能加重局部坏死。
7.1.8 止痛局部疼痛是蛇伤主要症状,大多无需止痛,严重者酌情给予乙酰氨基酚或阿片类止痛药适当镇痛。
7.1.9 复苏保持气道通畅。如患者恶心,有发生呕吐风险者,应将伤者置于侧卧位或恢复体位;如发生意识丧失、呼吸心跳停止,立即心肺复苏。
7.1.10 处置禁忌蛇咬伤急救应避免以下措施:裸手捡拾或触碰看似死亡的毒蛇、等待症状发作以确定是否中毒、用止血带结扎[51]、用刀去切割伤口(牙痕)、企图用嘴吸出毒素、用冰敷或将伤口浸入冰水中、饮酒止痛或喝咖啡饮料、用烧灼等方法处理伤口[47, 52-53]。
推荐意见5:现场仅做非创伤性急救,且不应延误送医时间,即“不伤害、不延误”(B级证据,Ⅱ级推荐)。
7.2 急诊抢救 7.2.1 优先措施生命体征的评估和维持是处理毒蛇咬伤的优先措施。首要是维持气道通畅,保持呼吸和氧合,稳定循环和血压、意识等。对有低血压或休克征象者,立即给予液体复苏(晶体液30mL/kg)以维持有效循环容量,必要时给予升压药确保有效灌注;神经毒类蛇咬伤患者极易发生呼吸功能不全、呼吸衰竭甚至呼吸停止,要给予心电监测、氧疗,密切监测呼吸和氧合情况,一旦血氧有下降趋势或呼吸窘迫,应尽早气管插管和机械通气等支持治疗。对无自主呼吸、意识丧失且无肢体反应等脑死亡样状态者,应在积极通气支持的同时,足量使用抗蛇毒血清,不应轻易放弃治疗;对急性肾损伤或肾衰竭者,在维持有效血容量、纠正凝血功能障碍和血小板减少症的基础上,考虑给予血液净化治疗等。
7.2.2 一般措施建立通畅的静脉通道(严重VICC者避免中心静脉或动脉穿刺),酌情给予乳酸林格氏液或生理盐水以维持有效容量平衡,抽送血常规(含血型)、生化、凝血功能、(心)肌酶和肝肾功能等检查,使用抗蛇毒血清前将伤者置于坐位或斜靠位、受伤肢体处于低垂位,监测尿量等。
7.2.3 留观建议所有无症状的毒蛇咬伤患者,至少留院观察24 h。
推荐意见6:生命支持是毒蛇咬伤救治的优先措施(B级证据,Ⅰ级推荐)。
7.3 抗蛇毒血清使用 7.3.1 使用原则抗蛇毒血清是毒蛇咬伤的基础性治疗药物,也是对抗蛇毒唯一安全有效的药物,其使用时机和剂量选择是毒蛇咬伤治疗过程中最重要、最关键的决策。由于毒蛇种类繁多,无法生产出针对每一种毒蛇的抗蛇毒血清,我国现有4种马免疫单特异性F(ab)2型抗蛇毒血清(抗眼镜蛇毒血清1 000 U/支,抗银环蛇毒血清10 000 U/支,抗蝮蛇毒血清6 000 U/支,抗五步蛇毒血清2 000 U/支),建议遵循“尽早足量、及时追加、同种专一、异种联合”四项基本原则使用。
推荐意见7:抗蛇毒血清是对抗蛇毒唯一安全有效的药物(A级证据,Ⅰ级推荐)。
推荐意见8:抗蛇毒血清遵循“尽早足量、及时追加、同种专一、异种联合”原则(B级证据,Ⅰ级推荐)。
7.3.2 适应证经典的使用指征包括:明确或疑似蛇咬伤伴有以下全身或局部中毒表现至少1项者[53]。⑴全身中毒表现,包括出凝血障碍,如咬伤部位之外的全身其他部位自发性出血、血小板降低、出血时间延长、纤维蛋白原降低,INR > 1.2,凝血酶原时间比正常高限高出4~5 s以上,血小板 < 10×109/L;神经系统中毒表现,如上睑下垂、外眼肌麻痹、瞳孔散大、肌无力或瘫痪、肌束震颤等;心血管表现,如低血压、休克、心律失常、异常心电图;急性肾损伤或肾衰竭表现,如少尿或无尿、BUN/Cr升高、黑尿或褐尿、其他血管内溶血证据、横纹肌溶解(肌痛或高钾血症)、血红蛋白尿或肌红蛋白尿等。⑵局部中毒表现,包括蛇咬伤48 h内局部肿胀超过咬伤肢体一半者;指、趾咬伤后肿胀者、出现广泛水疱;肿胀快速进展者(如手足咬伤几小时内肿胀超过手腕或踝关节者);咬伤后引流淋巴结肿痛;已知可引起局部坏死的蛇类蛇伤者,如中华眼镜蛇、尖吻蝮蛇、亚洲眼镜蛇等。
蛇咬伤是一种时间紧迫性的急症,抗蛇毒血清与蛇毒结合而发挥抗毒作用,启用时间早晚与预后直接相关,要努力缩短从毒蛇咬伤到开始使用抗蛇毒血清的时间[54-56],这样能逆转VICC、低血压、突触后神经毒性。早期用药可预防或限制突触前神经毒性、横纹肌溶解和局部组织坏死[13],延迟使用增加死亡风险[57]。抗蛇毒血清是解毒药,早期足量抗蛇毒血清可有效防止蛇毒的后续损害,且越早使用,毒蛇对组织造成的损害越小,预后越佳[58],只要确定或高度疑似毒蛇咬伤伴进行性中毒表现或实验室结果异常,即应立即给予抗蛇毒血清,不必等到典型中毒症状发作而浪费宝贵的早期用药时机。如抗蛇毒血清用量不足,组织中未被中和的毒素在咬伤后近200 h或更久仍可释放出来并可产生中毒表现[59-60],因此,如早期未能足量使用抗蛇毒血清,只要中毒性损害仍在持续,咬伤后几天甚至更长时间仍应考虑用药,毒蛇咬伤后17 d使用抗蛇毒血清仍然有效[61]。
推荐意见9:抗蛇毒血清启用时间早晚与预后直接相关,局部或全身进展性中毒表现就是使用抗蛇毒血清的可靠指征(B级证据,Ⅰ级推荐)。
7.3.3 禁忌证抗蛇毒血清使用没有绝对禁忌,尤其是严重中毒者。皮试是严重即时反应患者筛查的有效工具,首次使用抗蛇毒血清前应做皮试,皮试阴性的情况下才能用药,虽然抗蛇毒血清皮试不能准确预测过敏反应[47, 62],在得到多中心、大样本随机对照研究证据确认前,应遵照血清使用制度,用药前常规皮试。皮试阳性者,只有临床医生认为使用抗蛇毒血清带来的益处超过其风险时,方可考虑用药。对单纯皮试阳性者可考虑使用肾上腺素预处理。
使用抗蛇毒血清前给予小剂量(0.25 mg肌注)肾上腺素预处理,能安全有效地降低早期(1 h内)不良反应发生的风险,且至48 h仍有效[63-65],但无需常规做肾上腺素预处理。肾上腺素预处理对婴幼儿、孕妇、出现意识改变、毒蛇诱发消耗性凝血病伴脑膜刺激征或神经定位征者,有潜在不良反应风险[66],应谨慎使用。
推荐意见10:抗蛇毒血清对毒蛇咬伤无绝对禁忌(B级证据,Ⅱ级推荐)。
7.3.4 品种选择同种专一是指使用针对特定毒蛇的特异性抗蛇毒血清,如银环蛇、眼镜蛇、蝮蛇、五步蛇分别使用对应的抗蛇毒血清。每种毒蛇含有多种不同种类和含量的蛇毒成分,不同毒蛇之间有成分交叉和含量差异,每种蛇毒免疫动物产生的抗蛇毒血清中也含有针对不同毒素的多种抗体成分,不同品种的抗蛇毒血清其所含的特异性抗体各异,抗体成分也有交叉[10],因此,对无特异性抗蛇毒血清的毒蛇咬伤,应联合使用同类或相似毒性的抗蛇毒血清。如竹叶青蛇或原矛头蝮蛇咬伤优先使用抗五步蛇毒血清,次选抗蝮蛇毒血清或联合用药;蝰蛇咬伤使用抗五步蛇毒血清加抗蝮蛇毒血清;眼镜王蛇咬伤用抗银环蛇毒血清加抗眼镜蛇毒血清,且应先用足量抗银环蛇毒血清,因神经损害带来的风险远高于其他;金环蛇咬伤用抗银环蛇毒血清;海蛇用抗银环蛇毒血清联合抗眼镜蛇毒血清等。
对蛇种不明确的毒蛇咬伤,应以临床中毒表现作为选择依据,如神经毒类蛇咬伤使用抗银环蛇毒血清,血液毒类蛇咬伤选择抗五步蛇和(或)抗蝮蛇毒血清,细胞毒类蛇咬伤选用抗眼镜蛇毒血清和(或)抗五步蛇毒血清,不应过分强调“蛇种正确”而浪费宝贵的早期用药时间。
推荐意见11:抗蛇毒血清的使用取决于中毒表现,过分纠缠蛇种判断可能延误最佳给药时间(B级证据,Ⅱ级推荐)。
7.3.5 剂量选择尚无可以明确抗蛇毒血清理想剂量的临床研究,国内外没有统一标准,临床使用主要根据病情、指南或临床经验等决定。给药剂量应由临床医生根据蛇种、地区差异、严重程度、就诊时间不同而灵活把握。北美的方案是,初始剂量4~6支,对有致命性伤的病例,如休克或严重活动性出血,初始剂量增为8~12支,初始控制剂量的中位数是9支(四分位范围6~15支)[67-68]。我国是单价抗蛇毒血清,结合国内外抗蛇毒血清使用经验,初始剂量给予2~4支是合理有效的,根据中毒严重程度可酌情增量[15, 47]。适当增加初始给药剂量有利于快速充分地对抗血液中潜存的蛇毒,且与低初始剂量一样安全[69]。但应避免单剂过大剂量(> 5支),否则增加潜在不良反应风险[62]。
儿童被毒蛇咬伤后,所遭受的毒素负荷与成人相当,由于儿童体质跟成人不同,血液容量较成人更小,中毒后血液中的毒素浓度相较成人会更高,因此,首次可能需要相对更大的抗蛇毒血清剂量,以中和潜在的高毒素负荷。儿童抗蛇毒血清用量应与成人一致[33]。
孕妇毒蛇咬伤较为少见,但中毒后妊娠意外的发生风险增加,围产期病死率5.6%~20.0%(胎儿和新生儿各半),母体病死率0~5%[70-71]。抗蛇毒血清可对抗或减少毒素对母体的损害,进而降低对胎儿的影响[72],因此,抗蛇毒血清不是孕妇毒蛇咬伤的禁忌,但使用过程中需密切监测母胎变化,胎心监测至少8 h,有条件者可持续监测1周[73]。
推荐意见12:所有中毒患者,不分性别、年龄或体重,首次应给同等剂量的抗蛇毒血清(B级证据,Ⅰ级推荐)。
推荐意见13:酌情增加首次抗蛇毒血清剂量有助于快速达到初始控制,避免一次性超大剂量用药(B级证据,Ⅱ级推荐)。
7.3.6 用药途径静脉注入抗蛇毒血清可快速达到血液峰浓度,是抗蛇毒血清最为快速有效的用药途径。健侧肢体开通静脉通道更有利于抗蛇毒血清迅速进入血液循环,对严重凝血功能障碍者,应避免深静脉或动脉穿刺(待凝血障碍改善后方考虑穿刺)[74],以免产生严重出血。静脉推注时,应缓漫注入(≤2 mL/min);静脉滴注者,可将抗蛇毒血清加入100~250 mL生理盐水中1 h内滴入,先慢后快(初始10 min按25~50 mL/h,余量快速滴入)。对就诊时已做局部加压固定或结扎者,应在滴入抗蛇毒血清数分钟后再解除包扎,但局部肢/指有疑似坏死等不可逆损害表现者,应立即解压。抗蛇毒血清多是大分子免疫球蛋白,肌注吸收缓慢且生物利用度低[75],对VICC者有潜在诱发局部出血或血肿的风险[76],不宜肌注给药。
推荐意见14:抗蛇毒血清首选静脉给药,不推荐肌内注射给药(A级证据,Ⅰ级推荐)。
7.3.7 监测和追加大多数急性不良反应发生于开始使用抗蛇毒血清的1~2 h内。应密切监测不良反应,重点观察中毒症状、体征消长和实验室结果等,以利及时追加或调整用药。根据中毒严重程度,至少于首次使用抗蛇毒血清后第2、6、12、24小时监测中毒表现的消长情况,第6、12、24小时监测血常规、凝血功能、(心)肌酶等(血液毒)等[74]。使用充分中和剂量的抗蛇毒血清后,凝血功能障碍恢复的时间中位数是6 h[7, 23, 77]。因此,首剂抗蛇毒血清6 h后中毒症状持续不改善、凝血功能短暂恢复后再度加重、出血停止后1~2 h再发、首次用药1 h神经或心血管功能继续恶化等是追加给药的指征。
追加有两种方法,一是按需追加,即根据每6~8 h监测到的中毒进展情况追加,如无进展则无需追加;二是定时追加,即不论进展如何,每6~8 h追加一次(2支)抗蛇毒血清,连续3次后,依据中毒情况酌情追加。对致命性中毒,可考虑在首次用药后酌情缩短追加时间,如根据第2、4、6、12、24小时的监测情况,发现中毒进展即追加给药,24 h后再按需用药[36]。
推荐意见15:中毒症状持续或恶化是追加用药的指征,间隔时间约6~8 h,根据病情严重程度,酌情缩短或延长给药间隔时间(B级证据,Ⅱ级推荐)。
7.3.8 不良反应及处理抗蛇毒血清不良反应是异种蛋白的固有反应,其发生率差异巨大(2.9%~75.0%)[65, 78-79],我国不良反应发生率约4.9%[80]。皮试阴性无法预测潜在的过敏反应,因此,使用抗蛇毒血清前必须备好肾上腺素、氧气、气管插管等抢救药物和器械,建议首次使用抗蛇毒血清在有急救条件的场所进行。
抗蛇毒血清不良反应分为过敏反应、过敏原反应和血清病3种[81-82]。①过敏反应,表现为皮疹、荨麻疹、恶心呕吐、疼痛,甚至过敏性休克,常于用药后数分钟至几个小时内,大多数在1~2 h内发作,严重者发生低血压或哮喘等表现。②过敏原反应,多在用药1~2 h内产生,表现为畏寒、寒颤、发热、血管扩张和血压下降等,儿童可能诱发热性惊厥。③血清病,多在用药5~20 d(平均7 d)后产生,表现为发热、皮疹、恶心、呕吐、瘙痒、乏力、肌痛、关节肿痛、淋巴结肿大等。
不良反应的处置[47, 83-84]包括:立即停止使用抗蛇毒血清等药液,改用生理盐水500 mL快速注入(儿童10 mL/kg),维持充分血容量;置患者于卧位,保持气道通畅,高流量氧疗,必要时予气管插管和通气支持。肾上腺素是救治抗蛇毒血清过敏反应的一线药物,它对各种过敏症状均有效,心脏呼吸骤停者按心肺复苏流程抢救。轻者给予抗组胺药和糖皮质激素,合并气喘者吸入β-激动剂等。血清病的处理主要使用抗组胺药和糖皮质激素(疗程约5 d~2周);非甾体抗炎药可用于止痛治疗等。
推荐意见16:肾上腺素是抗蛇毒血清严重过敏反应的首选药物(A级证据,Ⅰ级推荐)。
7.4 外科处理 7.4.1 伤口处理毒蛇咬伤院前无需做伤口处理或仅需局部清水冲洗。毒蛇咬伤伤口清创目的是发现和清除可能残留的断牙、清理创面污染或感染灶以及清除局部坏死组织。绝大多数毒蛇咬伤的牙痕无需处理,如金环蛇、银环蛇、海蛇、竹叶青蛇等毒蛇咬伤无需创面处理或仅牙痕处生理盐水冲洗即可,仅极少数蛇种或患者可能需要清创,如中华眼镜蛇的细胞毒易致创面组织坏死和感染[85-87],其他毒蛇咬伤根据伤口感染或坏死情况决定是否清创,对单纯神经毒类蛇咬伤者无需局部切开[88]。切开清创必须在使用足量抗蛇毒血清后方可考虑,早期足量抗蛇毒血清可防止组织损伤、降低筋膜室内压等[89]。
蛇毒诱发的筋膜室综合征(snake venom-induced compartment syndrome, SVCS),多数是毒素直接注入肌肉组织所致,低龄儿童毒蛇咬伤、指或趾咬伤、伤口使用冰袋或冰敷、抗蛇毒血清用量不足或延迟使用是SVCS的危险因素[90],临床上仅少数患者发展为急性筋膜室综合征(acute compartment syndrome, ACS)。
伴有ACS的清醒患者大多仅表现疼痛和感觉异常;动脉缺血的表现如苍白、麻木和无脉等极少发生,或仅在严重ACS后期才会出现。因此,不能凭局部肿胀变硬、不成比例的疼痛和牵张痛等“软指征”确定为筋膜室综合征。SVCS切开减压的指征至少具备以下4条[1]:(1)凝血功能障碍得到纠正或显著改善;(2)临床符合ACS指征;(3)压差(ΔP =舒张压-筋膜室内压)≤30 mmHg(1 mmHg=0.133 kPa)或筋膜室绝对压力 > 40 mmHg;(4)有神经功能和(或)血管受损及血流受影响表现等。ΔP > 30 mmHg可作为SVCS的排除标准[91]。
使用足量抗蛇毒血清后仍存在SVCS且无法缓解者,切开减压是合理的[92],但不应预防性切开[89],因为切开会增加出血、神经血管或肌腱损伤及诱发感染的风险,甚至可能加重局部肌肉坏死、延长住院时间和增加住院费用;术后潜在引起伤口瘢痕形成、纤维化、手术意外致神经或血管损伤等,或导致伤者长期的身体功能、外观、疼痛或感觉障碍等不良影响[93-94]。
推荐意见17:外科干预应在尽早足量抗蛇毒血清治疗后方可考虑,推荐用于创面感染、坏死、残牙和SVCS等(B级证据,Ⅰ级推荐)。
7.4.2 负压创面疗法(negativepressure wound therapy,NPWT)又称真空负压治疗(VSD)或真空辅助伤口闭合(VAC),是给急慢性开放性创面或伤口提供低于大气压的密闭负压治疗系统。该系统由聚氨酯泡沫海绵、半闭塞屏障、液体收集系统和负压泵组成。NPWT通过促进组织的变形、细胞外炎症液的引流、伤口环境的稳定和微变形等机制,产生促进创面愈合的作用[95-96],用于糖尿病足溃疡、压疮、慢性创面和皮肤移植等急慢性创面的治疗,有较好效果[97-101]。但也有多项研究表明,NPWT并不优于标准治疗,甚至可能产生更多并发症[102-105],如中毒性休克综合征、感染、疼痛、出血、邻近组织缺血甚至血流动力学不稳定等[89]。
NPWT用于毒蛇咬伤创面的小样本临床研究显示,它能降低创面坏死、感染率和减轻水肿等作用[106-109],但存在潜在并发症风险。因此,NPWT用于毒蛇咬伤创面治疗的有效性和安全性仍需更多证据。现有证据条件下,可考虑用于足量抗蛇毒血清后的中华眼镜蛇等细胞毒类毒蛇咬伤的创面治疗,且使用时间不宜过长(< 7 d)。
推荐意见18:负压创面疗法可以考虑用于细胞毒类蛇伤患者的后期创面治疗(B级证据,Ⅱ推荐)。
7.5 止痛消肿 7.5.1 止痛及时缓解伤者的疼痛症状是蛇咬伤救治的重要对症措施。目前止痛主要有非甾体抗炎药(NSAIDs)和阿片类两种。NSAIDs可抑制血小板聚集,影响凝血功能,有增加血液毒类蛇咬伤患者的出血风险。乙酰氨基酚是乙酰苯胺类解热镇痛药,通过抑制中枢神经系统对前列腺素的合成、阻断痛觉神经末梢的冲动而产生镇痛作用[110],阿片类镇痛药主要通过作用于中枢神经组织内的阿片受体而产生强效镇痛作用,但过量或长时间使用有发生呼吸抑制、胃肠道反应和药物依赖等风险[110]。
7.5.2 消肿足量使用抗蛇毒血清后,给予体位引流,有利于促进肿胀部位组织间隙液体的快速回吸收,从而减轻局部压力、快速缓解肿胀,减轻肿胀相关性疼痛。可抬高肿胀的患肢至不低于胸骨角水平即可有效消肿[1, 111]。
7.5.3 水疱处理多种血液毒和细胞毒类蛇咬伤易产生局部张力性水疱或血疱,高张性大疱有发生破裂或撕裂、继发感染、延缓伤口愈合等风险。可用无菌注射器于水疱低垂位抽吸泡液,或作微切口,促进疱液流出,疱液释放后可用无菌纱布轻压迫包扎,避免再次产生水疱;对疑有感染的疱液,应送培养,以利于及时发现致病菌,及时有针对性地使用抗生素治疗[1]。
7.6 感染防治 7.6.1 抗生素使用毒蛇口腔菌群培养发现多种需氧和厌氧的革兰氏阳性或阴性病原微生物[112-113],毒蛇咬伤后伤口继发细菌感染的发生率10.3%~47.5%[114-116],远高于无毒蛇咬伤伤口[114],中华眼镜蛇咬伤创面感染率甚至可达80.9%[117],但蛇咬伤后无需常规预防感染,一旦感染,约68%伤口需要外科介入[117]。抗感染仅适于局部确定或疑似感染者(如脓肿形成、伤口分泌物增加或异味、蜂窝织炎或分泌物微生物培养阳性)、或局部组织坏死/坏疽等患者[13];明确感染者,应及时给予抗感染治疗,否则会诱发或加重局部组织坏死、全身性感染甚至脓毒症等[118]。高纤维蛋白原、丙氨酸转氨酶或C反应蛋白水平升高、中毒严重等患者的伤口感染风险增加[119]。常见病原菌如摩根菌、肠球菌属、脆弱类杆菌、大肠杆菌和金黄色葡萄球菌等。经验性抗感染可选阿莫西林/克拉维酸、氟喹诺酮类、头孢唑啉、第三代头孢菌素或氨基糖苷类等[120-122],或根据临床及药敏结果选择合适的抗菌药物。
7.6.2 破伤风预防破伤风是经皮肤(伤口)或黏膜侵入人体的破伤风梭菌所致,蛇咬伤(毒或无毒)咬伤虽很少发生破伤风,但因毒蛇牙痕相对较细,加之蛇类口腔中潜藏梭状菌的风险等,因此有发生破伤风风险[123-125]。鉴于破伤风的严重危害,毒蛇或无毒蛇咬伤,均应常规做破伤风预防。注意,破伤风抗毒素或免疫球蛋白有过敏风险,其使用应与抗蛇毒血清分开(通常在抗蛇毒血清后用药),二者间隔至少1 h,以避免过敏等不良反应重叠,用药后应注意严密观察不良反应。
推荐意见19:毒蛇咬伤无需常规抗感染治疗,有坏死、感染等征象者才需使用抗生素(A级证据,Ⅰ级推荐)。
推荐意见20:蛇咬伤后应常规做破伤风预防(B级证据,Ⅰ级推荐)。
7.7 糖皮质激素对炎症反应有抑制作用,通过直接收缩小血管、抑制血管扩张和液体渗出、抑制炎症细胞聚集和中性粒细胞释放氧自由基等效应,减轻或防止急性炎症期的炎性渗出、水肿和炎症细胞浸润等[110]。小样本研究显示,足量抗蛇毒血清辅用短期小剂量口服糖皮质激素有助于改善肿胀和疼痛[126];随机对照试验显示,糖皮质激素无法减轻肢体肿胀[127]。除非用于血清病或蛇毒相关性肾上腺功能不全,糖皮质激素不应作为毒蛇咬伤消肿的常规用药。
7.8 抗胆碱酯酶药神经毒素通过抑制突触前膜的乙酰胆碱释放、或与突触后膜乙酰胆碱受体结合产生肌麻痹效应。抗胆碱酯酶药如新斯的明或吡啶斯的明等,可抑制乙酰胆碱酯酶活性,减少突触间隙中乙酰胆碱的水解,发挥完全性拟胆碱效应,对骨骼肌产生兴奋作用,对部分神经毒素所致的肌麻痹有一定逆转功效[128-130],但对印度环蛇等突触前膜毒素效应无效[131]。新斯的明或吡啶斯的明0.02 mg/kg(儿童0.04 mg/kg)肌注,必要时1~3 h重复0.5~2.5 mg,24 h不超过10 mg;由于新斯的明有增加气道分泌物的风险,可在用药前静脉注射硫酸阿托品0.6mg(儿童50 μg/kg)[47]。此类药物不应延误抗蛇毒血清的使用和必要的气管插管等。
推荐意见21:抗胆碱酯酶药仅适于抗蛇毒血清疗效不佳的神经毒类蛇伤患者(B级证据,Ⅱ级推荐)。
7.9 其他治疗 7.9.1 血液制品蛇毒诱导的消耗性凝血病或凝血功能障碍是毒蛇咬伤后的严重反应之一,血制品使用的疗效备受争议。多中心随机对照试验表明,新鲜冰冻血浆作为抗蛇毒血清的辅助用药,可加速凝血功能的恢复,但未缩短留院时间,且早期(< 8 h)用药可能疗效不佳[132]。回顾性研究发现,新鲜冰冻血浆可能加快凝血功能恢复,减少出血和抗蛇毒血清用量[133];但针对蝰蛇咬伤的研究显示,新鲜冰冻血浆并未加快蝰蛇伤患者的凝血功能恢复[134];最近研究发现,新鲜冰冻血浆、冷沉淀并未改善凝血功能[135];对无出血的凝血障碍者无益[136]。因此,对伴VICC的毒蛇咬伤,不应常规使用新鲜冰冻血浆或冷沉淀等血制品,但对严重凝血功能障碍需紧急手术、有创操作、使用足量抗蛇毒血清仍无法改善或有活动性出血者,可考虑在足量抗蛇毒血清基础上作为辅助疗法使用。多种蛇毒酶类成分,可抑制或活化血小板,产生抗血小板或血小板聚集效应[137];使用足量抗蛇毒血清,可快速恢复血小板水平,对严重血小板减少伴出血、或需紧急手术者,可考虑输注血小板。
7.9.2 血液净化治疗如血浆置换通过分离并弃除血浆,从而清除血液中大分子物质,可能有助于清除大分子游离蛇毒[138],小样本临床观察显示能清除蛇毒[139],对蛇毒相关的血栓性微血管病等的疗效不确定[140-143]。
7.10 蛇毒相关性眼炎喷毒眼镜蛇、中华眼镜蛇、虎斑颈槽蛇(颈腺)等可喷射毒素,如毒素喷入眼睛,可产生严重疼痛、畏光、流泪、视物模糊等刺激症状,甚至发生角膜溃疡、继发眼内炎等[144]。现场需立即大量清水做低压冲洗,到医院后仍需用生理盐水或乳酸林格液等彻底冲洗,局部可用0.5%肾上腺素滴剂或4%利多卡因滴眼液等给予止痛;需眼科检查角膜损伤情况,可给予氯霉素、四环素或环丙沙星等抗生素滴眼液预防眼内或角膜混浊。原则上不必使用抗蛇毒血清,但早期即出现严重眼部损害或有毒素吸收表现者,应给予抗蛇毒血清。忌用糖皮质激素,因其有诱发单纯疱疹性角膜炎风险[47, 145]。
推荐意见22:蛇毒相关性眼炎需立即给予大量低压清水冲洗(B级证据,Ⅰ级推荐)。
7.11 中医药治疗祖国医学治疗毒蛇咬伤历史悠久,合理科学的使用中医药内服、外用以及针灸、刺络拔罐等方法,可以有效改善患者局部和全身中毒症状,提高治疗效果[146]。中医认为“蛇毒不泄,毒邪内结”是毒蛇咬伤的基本病机[147],将蛇伤分为风毒、火毒和风火毒3个证型,根据证型和具体临床表现,辨证运用清热解毒、祛风开窍、凉血止血、利尿泻下等方法治疗[148]。部分中成药蛇伤解毒制剂[149-150]组方成分中含有的生物碱、黄酮类、酚类等化合物,对PLA2、蛋白水解酶等酶类蛇毒成分有一定抑制效应,某些具有抗炎和抗氧化效果,利于消肿[1]。对蛇伤引起的溃疡,在足量抗蛇毒血清和局部清创的基础上,可配合使用提脓祛腐、生肌收口的药物[151]。中医药用于蝮蛇的大样本荟萃分析显示,它可改善局部症状和消肿,但结论可靠性有待高质量研究证实[152]。
7.12 蛇伤相关性心理障碍蛇伤患者的心理障碍发生率约8%~43%,主要是创伤后应激障碍综合征(post-traumatic stress disorder, PTSD)和抑郁,还可发生歇斯底里(或未指明的情感分离和转换障碍)、妄想症(或器质性妄想或精神分裂症样障碍)、社会心理障碍、幻觉、急性精神病、心因性惊厥、注意力不集中和攻击性行为等[153]。多数患者随着蛇伤的恢复而逐渐缓解,近1/3患者可持续1年以上,甚至长达数年[154-155]。心理干预是主要治疗方法,包括心理急救(如关怀、倾听或抚慰)、心理教育和认知行为疗法干预等[156-157],必要时给予抗抑郁药等心理药物治疗[158]。
8 蛇伤防范全球近58亿人面临遭遇毒蛇的风险,热带、亚热带地区多见[159],预防咬伤是最重要最实惠的方式。主要防范措施包括以下几点。
强化医疗健康体系,拓展重点地区蛇伤救治覆盖网络,提高和规范医疗机构蛇伤救治水平[160]。
加强科普宣传或培训,在社区尤其蛇出没较多的高危社区,进行蛇伤相关知识的宣传、培训或教育;科普知识进校园,教育学生有关蛇的生活和潜在伤害,避免近距离接触蛇类,宣传蛇伤急救知识等[160]。充分利用主流或社交媒体,以讲座、音视频等方式让更多公众了解蛇的生活习性和潜在伤害性,如蛇是变温动物,气温26~34℃是其最适宜的生活温度,其活动也最活跃,每年4~10月是活跃期;温度越低活动越少,气温持续低于15℃时,即开始准备冬眠;气温高至40℃以上,则不适于其生活,它会进入洞穴、石缝、树丛或枯树杂草下避暑。蛇类喜温,多昼出夜伏,如眼镜蛇和眼镜王蛇喜白昼活动(09:00~15:00),金环蛇/银环蛇多昼伏夜出(18:00~22:00),竹叶青蛇、蝮蛇、尖吻蝮蛇或原矛头蝮蛇常晨昏活动等,了解其活动规律,有利于避免蛇伤。
时常清洁环境,注意清理社区或房前屋后的枯叶杂草等,万一遭遇到蛇,应避而远之,绕道前行,不要激惹它。通常蛇的进攻距离约为其体长一半左右,平均0.30~0.60 m,注意少数毒蛇如中华眼镜蛇、喷毒眼镜蛇和颈槽蛇(颈腺)等会喷射毒素,距离可达1.0~2.5 m,且可多次喷毒[1]。
涉及草丛、树林或已知的蛇栖息地行走或工作时,需要穿长裤和靴子;搬动或清理乱木堆、枯枝枯叶或瓦砾等,应注意蛇潜藏;浅滩、沼泽、岸边、草丛中要注意蛇出没。对从事蛇类相关行业或野外工作者,上岗前做好蛇类知识培训,规范操作流程,配备防咬伤手套、靴子等防护用品等。野外露营时,注意避免在洞穴中或树荫下,选择开阔、干燥、无树枝或杂草的地方,帐篷应严密封闭,避免夜间蛇类钻入等。
蛇咬伤后,现场避免采用烧灼、切开、吸吮等急救措施,以防带来潜在伤害[13],应及时送到有蛇伤救治能力的医院处理。
执笔者:赖荣德(广州医科大学附属第一医院)、颜时姣(海南医科大学)、王世军(福建中医药大学附属人民医院)、杨树青(重庆大学附属中心医院/重庆市急救医疗中心)、严张仁(江西中医药大学附属医院)、兰频(温州医科大学附属第五医院/丽水市中心医院)、王永高(浙江中医药大学附属第一医院)、李琪(福建省立医院/福建省急救中心)、王威(广西医科大学第一附属医院)
参与指南制定专家(按姓名汉语拼音为序):宾文凯(南华大学附属南华医院)、陈松(万宁市人民医院)、陈粤明(湛江中心人民医院)、邓颖(哈尔滨医科大学附属第二医院)、丁玲新(重庆市南川区人民医院)、窦清理(深圳市宝安人民医院)、杜俊凯(西安交通大学第一附属医院)、范西真(安徽省立医院)、冯卢(四川省医学科学院•四川省人民医院)、郭庚(山西医科大学第一医院)、韩小彤(湖南省人民医院)、韩伟(青岛市市立医院)、何和与(乐东县人民医院)、何小军(中华急诊医学杂志)、贺献贵(望谟县人民医院)、黄亮(南昌大学第一附属医院)、季晓亮(湖州市中医院)、姜伟(德阳市人民医院)、赖荣德(广州医科大学附属第一医院)、兰频(丽水市中心医院)、李德忠(恩施土家族苗族自治州中心医院)、李琪(福建省立医院)、李强(重庆市江津区中医院)、李小民(连云港市第一人民医院)、李永武(厦门市第五医院)、梁庆(广州医科大学附属第一医院)、梁子敬(广州医科大学附属第一医院)、刘斌(南方医科大学珠江医院)、吕传柱(四川省医学科学院•四川省人民医院)、马岳峰(浙江大学医学院附属第二医院)、欧阳艳红(海南省人民医院)、潘险峰(联勤保障部队第920医院)、彭清生(宜春市中医院)、宋先权(重庆大学附属三峡医院)、苏畅(海南医科大学)、孙明伟(四川省医学科学院•四川省人民医院)、谭萍(湖南省人民医院)、唐忠志(解放军中部战区总医院)、汪友平(广州医科大学附属脑科医院)、王金龙(重庆大学附属涪陵医院)、王世军(福建中医药大学附属人民医院)、王威(广西医科大学第一附属医院)、王永高(浙江中医药大学附属第一医院)、吴建波(解放军南部战区海军第二医院)、吴铁军(浏阳市中医医院)、项涛(成都市第三人民医院)、徐爱华(浦城县蛇伤防治院)、徐平(自贡市第四人民医院)、许勇(铜仁市人民医院)、严张仁(江西中医药大学附属医院)、颜时姣(海南医科大学)、杨树青(重庆市急救医疗中心)、杨小平(隆回县人民医院)、杨学伟(重庆市南川区人民医院)、姚永坤(联勤保障部队第927医院)、于学忠(中国医学科学院北京协和医院)、余晓刚(宜昌市中心人民医院)、喻安永(遵义医科大学附属医院)、曾俊(四川省医学科学院•四川省人民医院)、张春阳(沈阳医学院附属中心医院)、张国彬(邵阳学院附属第一医院)、张国强(中日友好医院)、张剑锋(广西医科大学第一附属医院)、张磊冰(贵州省人民医院)、张茂(浙江大学医学院附属第二医院)、张斯龙(中华急诊医学杂志)、张文武(深圳市宝安区人民医院)、张新超(北京医院国家老年医学中心)、张炎安(福建省龙岩市第一医院)、赵晓东(解放军总医院第四医学中心)、周冬林(萍乡矿业集团有限责任公司总医院)、周宁(湛江中心人民医院)、周群辉(双牌县中医医院)、朱弘海(肇庆市第三人民医院)、朱华栋(中国医学科学院北京协和医院)
指南共识注册编号:PREPARE-2024CN948
利益冲突 所有作者声明无利益冲突
| [1] | 赖荣德. 蛇伤诊断治疗学[M]. 北京: 科学技术文献出版社, 2023. |
| [2] | WHO Expert Committee on Biological Standardization. Guidelines for the production, control and regulation of snake antivenom immunoglobulins[EB/OL]. (2017-06-12). https://www.who.int/publications/m/item/snake-antivenom-immunoglobulins-annex-5-trs-no-1004. |
| [3] | Pucca MB, Knudsen C, S Oliveira I, et al. Current knowledge on snake dry bites[J]. Toxins, 2020, 12(11): 668. DOI:10.3390/toxins12110668 |
| [4] | Warrell DA, Williams DJ. Clinical aspects of snakebite envenoming and its treatment in low-resource settings[J]. Lancet, 2023, 401(10385): 1382-1398. DOI:10.1016/S0140-6736(23)00002-8 |
| [5] | The Lancet. Snake-bite envenoming: a priority neglected tropical disease[J]. Lancet, 2017, 390(10089): 2. DOI:10.1016/S0140-6736(17)31751-8 |
| [6] | GBD Snakebite Envenomation Collaborators. Global mortality of snakebite envenoming between 1990 and 2019[J]. Nat Commun, 2022, 13(1): 6160. DOI:10.1038/s41467-022-33627-9 |
| [7] | Farrar J, Hotez PJ, Junghanss T, et al. Manson's tropical diseases[M]23rd. Elsevier Limited, 2014: 1103. |
| [8] | Sanhajariya S, Duffull SB, Isbister GK. Pharmacokinetics of snake venom[J]. Toxins, 2018, 10(2): 73. DOI:10.3390/toxins10020073 |
| [9] | Oliveira AL, Viegas MF, da Silva SL, et al. The chemistry of snake venom and its medicinal potential[J]. Nat Rev Chem, 2022, 6: 451-469. DOI:10.1038/s41570-022-00393-7 |
| [10] | Casewell NR, Jackson TNW, Laustsen AH, et al. Causes and consequences of snake venom variation[J]. Trends Pharmacol Sci, 2020, 41(8): 570-581. DOI:10.1016/j.tips.2020.05.006 |
| [11] | Brent J, Burkhart K, Dargan P, et al. Critical care toxicology: diagnosis and management of the critically poisoned patient[J]. Crit Care Toxicol Diagn Manag Crit Poisoned Patient, 2017: 1-3058. |
| [12] | Tan CH. Snake venomics: fundamentals, recent updates, and a look to the next decade[J]. Toxins, 2022, 14(4): 247. DOI:10.3390/toxins14040247 |
| [13] | Gutiérrez JM, Calvete JJ, Habib AG, et al. Snakebite envenoming[J]. Nat Rev Dis Primers, 2017, 3: 17063. DOI:10.1038/nrdp.2017.63 |
| [14] | Tasoulis T, Isbister GK. A current perspective on snake venom composition and constituent protein families[J]. Arch Toxicol, 2023, 97(1): 133-153. DOI:10.1007/s00204-022-03420-0 |
| [15] | Gopalakrishnakone P. Snake venom[M] Springer Science Business Media Dordrecht, 2017. |
| [16] | Murakami M, Sato H, Taketomi Y. Updating phospholipase A2 biology[J]. Biomolecules, 2020, 10(10): 1457. DOI:10.3390/biom10101457 |
| [17] | Olaoba OT, Karina Dos Santos P, Selistre-de-Araujo HS, et al. Snake Venom Metalloproteinases (SVMPs): a structure-function update[J]. Toxicon X, 2020, 7: 100052. DOI:10.1016/j.toxcx.2020.100052 |
| [18] | Kini RM, Doley R. Structure, function and evolution of three-finger toxins: mini proteins with multiple targets[J]. Toxicon, 2010, 56(6): 855-867. DOI:10.1016/j.toxicon.2010.07.010 |
| [19] | Bickler PE. Amplification of snake venom toxicity by endogenous signaling pathways[J]. Toxins, 2020, 12(2): 68. DOI:10.3390/toxins12020068 |
| [20] | Lu Q, Clemetson JM, Clemetson KJ. Snake venoms and hemostasis[J]. J Thromb Haemost, 2005, 3(8): 1791-1799. DOI:10.1111/j.1538-7836.2005.01358.x |
| [21] | White J. Snake venoms and coagulopathy[J]. Toxicon, 2005, 45(8): 951-967. DOI:10.1016/j.toxicon.2005.02.030 |
| [22] | Bickler PE, Abouyannis M, Bhalla A, et al. Neuromuscular weakness and paralysis produced by snakebite envenoming: mechanisms and proposed standards for clinical assessment[J]. Toxins, 2023, 15(1): 49. DOI:10.3390/toxins15010049 |
| [23] | Warrell DA. Snake bite[J]. Lancet, 2010, 375(9708): 77-88. DOI:10.1016/S0140-6736(09)61754-2 |
| [24] | Ranawaka UK, Lalloo DG, de Silva HJ. Neurotoxicity in snakebite: the limits of our knowledge[J]. PLoS Negl Trop Dis, 2013, 7(10): e2302. DOI:10.1371/journal.pntd.0002302 |
| [25] | Kumar M, Arcot Thanjan M, Gopalakrishnan N, et al. Snake envenomation-induced acute kidney injury: prognosis and long-term renal outcomes[J]. Postgrad Med J, 2022, 98(1158): 264-268. DOI:10.1136/postgradmedj-2020-139021 |
| [26] | Liblik K, Byun J, Saldarriaga C, et al. Snakebite envenomation and heart: systematic review[J]. Curr Probl Cardiol, 2022, 47(9): 100861. DOI:10.1016/j.cpcardiol.2021.100861 |
| [27] | Péterfi O, Boda F, Szabó Z, et al. Hypotensive snake venom components-a mini-review[J]. Molecules, 2019, 24(15): 2778. DOI:10.3390/molecules24152778 |
| [28] | Kini RM, Koh CY. Snake venom three-finger toxins and their potential in drug development targeting cardiovascular diseases[J]. Biochem Pharmacol, 2020, 181: 114105. DOI:10.1016/j.bcp.2020.114105 |
| [29] | Anonymous A. Joint trauma system clinical practice guideline: global snake envenomation management[J]. J Spec Oper Med, 2020, 20(2): 43-74. DOI:10.55460/ZFQW-DWGR |
| [30] | Weinstein SA, Warrell DA, Keyler DE. "Venomous bites" from "non-venomous" snakes[M]2nd. Elsevier Inc, 2022. |
| [31] | Silva A, Hodgson WC, Isbister GK. Antivenom for neuromuscular paralysis resulting from snake envenoming[J]. Toxins, 2017, 9(4): 143. DOI:10.3390/toxins9040143 |
| [32] | Suhita R, Begum I, Rashid M, et al. Systematic review and meta-analysis of global prevalence of neurotoxic and hemotoxic snakebite envenomation[J]. East Mediterr Health J, 2022, 28(12): 909-916. DOI:10.26719/emhj.22.090 |
| [33] | Seifert SA, Armitage JO, Sanchez EE. Snake envenomation[J]. N Engl J Med, 2022, 386(1): 68-78. DOI:10.1056/NEJMra2105228 |
| [34] | von Keudell AG, Weaver MJ, Appleton PT, et al. Diagnosis and treatment of acute extremity compartment syndrome[J]. Lancet, 2015, 386(10000): 1299-1310. DOI:10.1016/S0140-6736(15)00277-9 |
| [35] | Sarkar S, Sinha R, Chaudhury AR, et al. Snake bite associated with acute kidney injury[J]. Pediatr Nephrol, 2021, 36(12): 3829-3840. DOI:10.1007/s00467-020-04911-x |
| [36] | Chu ER, Weinstein SA, White J, et al. Venom ophthalmia caused by venoms of spitting elapid and other snakes: report of ten cases with review of epidemiology, clinical features, pathophysiology and management[J]. Toxicon, 2010, 56(3): 259-272. DOI:10.1016/j.toxicon.2010.02.023 |
| [37] | 急性出血性凝血功能障碍诊治专家共识组. 急性出血性凝血功能障碍诊治专家共识[J]. 中华急诊医学杂志, 2020, 29(6): 780-787. DOI:10.3760/cma.j.issn.1671-0282.2020.06.007 |
| [38] | Burton AG, Jandrey KE. Use of thromboelastography in clinical practice[J]. Vet Clin North Am Small Anim Pract, 2020, 50(6): 1397-1409. DOI:10.1016/j.cvsm.2020.08.001 |
| [39] | Leffers P, Ferreira J, Sollee D, et al. Thromboelastography in the management of snakebite-induced coagulopathy: a case series and literature review[J]. Blood Coagul Fibrinolysis, 2018, 29(7): 656-660. DOI:10.1097/MBC.0000000000000771 |
| [40] | Lamb T, Abouyannis M, de Oliveira SS, et al. The 20-minute whole blood clotting test (20WBCT) for snakebite coagulopathy-a systematic review and meta-analysis of diagnostic test accuracy[J]. PLoS Negl Trop Dis, 2021, 15(8): e0009657. DOI:10.1371/journal.pntd.0009657 |
| [41] | Tianyi FL, Hamza M, Abubakar SB, et al. Diagnostic characteristics of the 20-minute whole blood clotting test in detecting venom-induced consumptive coagulopathy following carpet viper envenoming[J]. PLoS Negl Trop Dis, 2023, 17(6): e0011442. DOI:10.1371/journal.pntd.0011442 |
| [42] | Medeiros CR, Brioschi ML, Souza SN, et al. Infrared thermography to diagnose and manage venomous animal bites and stings[J]. Rev Soc Bras Med Trop, 2017, 50(2): 260-264. DOI:10.1590/0037-8682-0390-2016 |
| [43] | Sabitha P, Bammigatti C, Deepanjali S, et al. Point-of-care infrared thermal imaging for differentiating venomous snakebites from non-venomous and dry bites[J]. PLoS Negl Trop Dis, 2021, 15(2): e0008580. DOI:10.1371/journal.pntd.0008580 |
| [44] | Carter RW, Gerardo CJ, Samuel SP, et al. The BRAVO clinical study protocol: oral varespladib for inhibition of secretory phospholipase A2 in the treatment of snakebite envenoming[J]. Toxins, 2022, 15(1): 22. DOI:10.3390/toxins15010022 |
| [45] | Dart RC, Hurlbut KM, Garcia R, et al. Validation of a severity score for the assessment of crotalid snakebite[J]. Ann Emerg Med, 1996, 27(3): 321-326. DOI:10.1016/s0196-0644(96)70267-6 |
| [46] | Nishioka SA. Limitations of the snakebite severity score[J]. Ann Emerg Med, 1996, 28(3): 371-372. DOI:10.1016/s0196-0644(96)70043-4 |
| [47] | World Health Organization regional office for south-east Asia, Guidelines for the Management of Snakebites[M/OL]2nd. (2016-08-19). https://www.who.int/publications/i/item/9789290225300. |
| [48] | Parker-Cote J, Meggs WJ. First aid and pre-hospital management of venomous snakebites[J]. Trop Med Infect Dis, 2018, 3(2): 45. DOI:10.3390/tropicalmed3020045 |
| [49] | Avau B, Borra V, Vandekerckhove P, et al. The treatment of snake bites in a first aid setting: a systematic review[J]. PLoS Negl Trop Dis, 2016, 10(10): e0005079. DOI:10.1371/journal.pntd.0005079 |
| [50] | World Health Organization. Control of Neglected Tropical Diseases[EB/OL]. [2024-4-30]. https://www.who.int/teams/control-of-neglected-tropical-diseases/snakebite-envenoming/treatment. |
| [51] | Yang Q, Gao YH, Fu WJ, et al. Impact of tourniquet use on severity of snakebite envenoming in Chongqing, China: a single-center retrospective study[J]. J Int Med Res, 2024, 52(1): 3000605231225540. DOI:10.1177/03000605231225540 |
| [52] | Yanamandra U, Yanamandra S. Traditional first aid in a case of snake bite: more harm than good[J]. BMJ Case Rep, 2014, 2014: bcr2013202891. DOI:10.1136/bcr-2013-202891 |
| [53] | Centers for Disease Control and Prevention. Venomous snake bites: symptoms & first aid[EB/OL]. (2021-06-28)[2024-04-30] https://www.cdc.gov/niosh/topics/snakes/symptoms.html. |
| [54] | Feitosa EL, Sampaio VS, Salinas JL, et al. Older age and time to medical assistance are associated with severity and mortality of snakebites in the Brazilian Amazon: a case-control study[J]. PLoS One, 2015, 10(7): e0132237. DOI:10.1371/journal.pone.0132237 |
| [55] | Isbister GK. Antivenom availability, delays and use in Australia[J]. Toxicon X, 2023, 17: 100145. DOI:10.1016/j.toxcx.2022.100145 |
| [56] | Johnston CI, Ryan NM, O'Leary MA, et al. Australian taipan (Oxyuranus spp.) envenoming: clinical effects and potential benefits of early antivenom therapy - Australian Snakebite Project (ASP-25)[J]. Clin Toxicol, 2017, 55(2): 115-122. DOI:10.1080/15563650.2016.1250903 |
| [57] | Habib AG, Abubakar SB. Factors affecting snakebite mortality in north-eastern Nigeria[J]. Int Health, 2011, 3(1): 50-55. DOI:10.1016/j.inhe.2010.08.001 |
| [58] | Jayaraman T, Dhanasinghu R, Kuppusamy S, et al. Bite-to-needle time - an extrapolative indicator of repercussion in patients with snakebite[J]. Indian J Crit Care Med, 2022, 26(11): 1175-1178. DOI:10.5005/jp-journals-10071-24344 |
| [59] | Seifert SA, Boyer LV. Recurrence phenomena after immunoglobulin therapy for snake envenomations: part 1. Pharmacokinetics and pharmacodynamics of immunoglobulin antivenoms and related antibodies[J]. Ann Emerg Med, 2001, 37(2): 189-195. DOI:10.1067/mem.2001.113135 |
| [60] | Seifert SA, Mascarenas DN, Fullerton L, et al. Unpredicted late-, new-onset thrombocytopenia and hypofibrinogenemia in Fab antivenom-treated rattlesnake envenomation[J]. Toxicon, 2020, 184: 55-56. DOI:10.1016/j.toxicon.2020.05.026 |
| [61] | 陈侨雪, 赖荣德, 梁子敬. 中华眼镜蛇咬伤中毒症状再次复发1例并文献复习[J]. 中国急救医学, 2022, 42(6): 511-513. DOI:10.3969/j.issn.1002-1949.2022.06.009 |
| [62] | Chuang PC, Chang KW, Cheng FJ, et al. Risk factors associated with snake antivenom reaction and the role of skin test[J]. Acta Trop, 2020, 203: 105293. DOI:10.1016/j.actatropica.2019.105293 |
| [63] | Premawardhena AP, de Silva CE, Fonseka MM, et al. Low dose subcutaneous adrenaline to prevent acute adverse reactions to antivenom serum in people bitten by snakes: randomised, placebo controlled trial[J]. BMJ, 1999, 318(7190): 1041-1043. DOI:10.1136/bmj.318.7190.1041 |
| [64] | Williams DJ, Jensen SD, Nimorakiotakis B, et al. Antivenom use, premedication and early adverse reactions in the management of snake bites in rural Papua New Guinea[J]. Toxicon, 2007, 49(6): 780-792. DOI:10.1016/j.toxicon.2006.11.026 |
| [65] | de Silva HA, Pathmeswaran A, Ranasinha CD, et al. Low-dose adrenaline, promethazine, and hydrocortisone in the prevention of acute adverse reactions to antivenom following snakebite: a randomised, double-blind, placebo-controlled trial[J]. PLoS Med, 2011, 8(5): e1000435. DOI:10.1371/journal.pmed.1000435 |
| [66] | Habib AG. Effect of pre-medication on early adverse reactions following antivenom use in snakebite: a systematic review and meta-analysis[J]. Drug Saf, 2011, 34(10): 869-880. DOI:10.2165/11592050-000000000-00000 |
| [67] | Lavonas EJ, Ruha AM, Banner W, et al. Unified treatment algorithm for the management of crotaline snakebite in the United States: results of an evidence-informed consensus workshop[J]. BMC Emerg Med, 2011, 11: 2. DOI:10.1186/1471-227X-11-2 |
| [68] | Corbett B, Clark RF. North American snake envenomation[J]. Emerg Med Clin North Am, 2017, 35(2): 339-354. DOI:10.1016/j.emc.2016.12.003 |
| [69] | Alirol E, Sharma SK, Ghimire A, et al. Dose of antivenom for the treatment of snakebite with neurotoxic envenoming: evidence from a randomised controlled trial in Nepal[J]. PLoS Negl Trop Dis, 2017, 11(5): e0005612. DOI:10.1371/journal.pntd.0005612 |
| [70] | Langley RL. Snakebite during pregnancy: a literature review[J]. Wilderness Environ Med, 2010, 21(1): 54-60. DOI:10.1016/j.wem.2009.12.025 |
| [71] | Nascimento TP, Vilhena Silva-Neto A, Baia-da-Silva DC, et al. Pregnancy outcomes after snakebite envenomations: a retrospective cohort in the Brazilian Amazonia[J]. PLoS Negl Trop Dis, 2022, 16(12): e0010963. DOI:10.1371/journal.pntd.0010963 |
| [72] | Palmeira P, Quinello C, Silveira-Lessa AL, et al. IgG placental transfer in healthy and pathological pregnancies[J]. Clin Dev Immunol, 2012, 2012: 985646. DOI:10.1155/2012/985646 |
| [73] | Mattison D, Halbert LA. Clinical pharmacology during pregnancy[M]2nd. Elsevier Inc, 2022: 392-394. |
| [74] | Ralph R, Faiz MA, Sharma SK, et al. Managing snakebite[J]. BMJ, 2022, 376: e057926. DOI:10.1136/bmj-2020-057926 |
| [75] | Pepin S, Lutsch C, Grandgeorge M, et al. Snake F(ab')2 antivenom from hyperimmunized horse: pharmacokinetics following intravenous and intramuscular administrations in rabbits[J]. Pharm Res, 1995, 12(10): 1470-1473. DOI:10.1023/a:1016279219619 |
| [76] | Gamulin E, Mateljak Lukačević S, Halassy B, et al. Snake antivenoms-toward better understanding of the administration route[J]. Toxins, 2023, 15(6): 398. DOI:10.3390/toxins15060398 |
| [77] | Brown AE, Brown L. Blood venom antigen levels after Malayan pit viper bite[J]. Trans R Soc Trop Med Hyg, 1987, 81(4): 548. DOI:10.1016/0035-9203(87)90401-9 |
| [78] | Sriapha C, Rittilert P, Vasaruchapong T, et al. Early adverse reactions to snake antivenom: poison center data analysis[J]. Toxins, 2022, 14(10): 694. DOI:10.3390/toxins14100694 |
| [79] | Giles T, Čačala SR, Wood D, et al. A retrospective study of antivenom-associated adverse reaction and anaphylaxis at Ngwelezana Hospital, South Africa[J]. Toxicon, 2022, 217: 1-4. DOI:10.1016/j.toxicon.2022.07.008 |
| [80] | Li QQ, Zeng LB, Deng HY, et al. Adverse reactions to four types of monovalent antivenom used in the treatment of snakebite envenoming in South China[J]. Toxicon, 2022, 219: 106935. DOI:10.1016/j.toxicon.2022.106935 |
| [81] | Morais V. Antivenom therapy: efficacy of premedication for the prevention of adverse reactions[J]. J Venom Anim Toxins Incl Trop Dis, 2018, 24: 7. DOI:10.1186/s40409-018-0144-0 |
| [82] | Mender MM, Bolton F, Berry C, et al. Antivenom: An immunotherapy for the treatment of snakebite envenoming in sub-Saharan Africa[J]. Adv Protein Chem Struct Biol, 2022, 129: 435-477. DOI:10.1016/bs.apcsb.2021.11.004 |
| [83] | Muraro A, Worm M, Alviani C, et al. EAACI guidelines: Anaphylaxis (2021 update)[J]. Allergy, 2022, 77(2): 357-377. DOI:10.1111/all.15032 |
| [84] | Li XT, Ma QB, Yin J, et al. A clinical practice guideline for the emergency management of anaphylaxis (2020)[J]. Front Pharmacol, 2022, 13: 845689. DOI:10.3389/fphar.2022.845689 |
| [85] | Hall EL. Role of surgical intervention in the management of crotaline snake envenomation[J]. Ann Emerg Med, 2001, 37(2): 175-180. DOI:10.1067/mem.2001.113373 |
| [86] | Laohawiriyakamol S, Sangkhathat S, Chiengkriwate P, et al. Surgery in management of snake envenomation in children[J]. World J Pediatr, 2011, 7(4): 361-364. DOI:10.1007/s12519-011-0282-8 |
| [87] | Russell JJ, Schoenbrunner A, Janis JE. Snake bite management: a scoping review of the literature[J]. Plast Reconstr Surg Glob Open, 2021, 9(4): e3506. DOI:10.1097/GOX.0000000000003506 |
| [88] | Mao YC, Liu PY, Chiang LC, et al. Clinical manifestations and treatments of Protobothrops mucrosquamatus bite and associated factors for wound necrosis and subsequent debridement and finger or toe amputation surgery[J]. Clin Toxicol, 2021, 59(1): 28-37. DOI:10.1080/15563650.2020.1762892 |
| [89] | Toschlog EA, Bauer CR, Hall EL, et al. Surgical considerations in the management of pit viper snake envenomation[J]. J Am Coll Surg, 2013, 217(4): 726-735. DOI:10.1016/j.jamcollsurg.2013.05.004 |
| [90] | Cumpston KL. Is there a role for fasciotomy in Crotalinaeenvenomations in North America?[J]. Clin Toxicol, 2011, 49(5): 351-365. DOI:10.3109/15563650.2011.597032 |
| [91] | Osborn CPM, Schmidt AH. Management of acute compartment syndrome[J]. J Am Acad Orthop Surg, 2020, 28(3): e108-e114. DOI:10.5435/JAAOS-D-19-00270 |
| [92] | Spyres MB, Maker G, Aldy K, et al. Compartment syndrome after crotalid envenomation in the United States: a review of the North American snakebite registry from 2013 to 2021 on behalf of the ToxIC snakebite study group[J]. Wilderness Environ Med, 2023, 34(3): 322-327. DOI:10.1016/j.wem.2023.05.007 |
| [93] | Tanen DA, Danish DC, Grice GA, et al. Fasciotomy worsens the amount of myonecrosis in a porcine model of crotaline envenomation[J]. Ann Emerg Med, 2004, 44(2): 99-104. DOI:10.1016/j.annemergmed.2004.01.009 |
| [94] | Darracq MA, Cantrell FL, Klauk B, et al. A chance to cut is not always a chance to cure- fasciotomy in the treatment of rattlesnake envenomation: a retrospective poison center study[J]. Toxicon, 2015, 101: 23-26. DOI:10.1016/j.toxicon.2015.04.014 |
| [95] | Normandin S, Safran T, Winocour S, et al. Negative pressure wound therapy: mechanism of action and clinical applications[J]. Semin Plast Surg, 2021, 35(3): 164-170. DOI:10.1055/s-0041-1731792 |
| [96] | Kim PJ, Attinger CE, Constantine T, et al. Negative pressure wound therapy with instillation: international consensus guidelines update[J]. Int Wound J, 2020, 17(1): 174-186. DOI:10.1111/iwj.13254 |
| [97] | Armstrong DG, Lavery LA, Consortium DFS. Negative pressure wound therapy after partial diabetic foot amputation: a multicentre, randomised controlled trial[J]. Lancet, 2005, 366(9498): 1704-1710. DOI:10.1016/S0140-6736(05)67695-7 |
| [98] | Huang Q, Wang JT, Gu HC, et al. Comparison of vacuum sealing drainage and traditional therapy for treatment of diabetic foot ulcers: a meta-analysis[J]. J Foot Ankle Surg, 2019, 58(5): 954-958. DOI:10.1053/j.jfas.2018.12.020 |
| [99] | Seidel D, Diedrich S, Herrle F, et al. Negative pressure wound therapy vs conventional wound treatment in subcutaneous abdominal wound healing impairment: the SAWHI randomized clinical trial[J]. JAMA Surg, 2020, 155(6): 469-478. DOI:10.1001/jamasurg.2020.0414 |
| [100] | Cai LY, Mei YF, Chen CH, et al. Comparison of vacuum sealing drainage and conventional drainage for postoperative drainage in closed calcaneal fracture: a randomized controlled trial[J]. Injury, 2022, 53(2): 777-783. DOI:10.1016/j.injury.2021.10.018 |
| [101] | Duan HJ, He YQ, Zhang HB, et al. Vacuum sealing drainage with instillation in the treatment of necrotising soft-tissue infection: a retrospective analysis[J]. J Wound Care, 2020, 29(9): 510-517. DOI:10.12968/jowc.2020.29.9.510 |
| [102] | Älgå A, Haweizy R, Bashaireh K, et al. Negative pressure wound therapy versus standard treatment in patients with acute conflict-related extremity wounds: a pragmatic, multisite, randomised controlled trial[J]. Lancet Glob Health, 2020, 8(3): e423-e429. DOI:10.1016/S2214-109X(19)30547-9 |
| [103] | Costa ML, Achten J, Bruce J, et al. Effect of negative pressure wound therapy vs standard wound management on 12-month disability among adults with severe open fracture of the lower limb: the WOLLF randomized clinical trial[J]. JAMA, 2018, 319(22): 2280-2288. DOI:10.1001/jama.2018.6452 |
| [104] | Costa ML, Achten J, Knight R, et al. Effect of incisional negative pressure wound therapy vs standard wound dressing on deep surgical site infection after surgery for lower limb fractures associated with major trauma: the WHIST randomized clinical trial[J]. JAMA, 2020, 323(6): 519-526. DOI:10.1001/jama.2020.0059 |
| [105] | Yuan KZ, Zhao B, Cooper T, et al. The management of degloving injuries of the limb with full thickness skin grafting using vacuum sealing drainage or traditional compression dressing: a comparative cohort study[J]. J Orthop Sci, 2019, 24(5): 881-887. DOI:10.1016/j.jos.2019.01.002 |
| [106] | Kim KJ, Min JH, Yoo I, et al. Negative pressure wound therapy for skin necrosis prevention after snakebite in the emergency department: a retrospective cohort study[J]. Medicine, 2021, 100(3): e24290. DOI:10.1097/MD.0000000000024290 |
| [107] | Zeng FJ, Chen C, Chen XY, et al. Small incisions combined with negative-pressure wound therapy for treatment of Protobothrops mucrosquamatus bite envenomation: a new treatment strategy[J]. Med Sci Monit, 2019, 25: 4495-4502. DOI:10.12659/MSM.913579 |
| [108] | Lu HY, Mao YC, Liu PY, et al. Clinical predictors of early surgical intervention in patients with venomous snakebites[J]. Eur J Med Res, 2023, 28(1): 131. DOI:10.1186/s40001-023-01101-x |
| [109] | 刘路培, 龙春萍, 黄高宗. 波动式负压封闭引流技术对中华眼镜蛇咬伤患者疗效的影响[J]. 中国医药, 2021, 16(3): 444-447. DOI:10.3760/j.issn.1673-4777.2021.03.030 |
| [110] | 国家药典委员会. 中华人民共和国药典临床用药须知-化学药和生物制品卷: 2015年版[M]. 北京: 中国医药科技出版社, 2017. |
| [111] | Walls RM, Rosen's emergency medicine: concepts and clinical practice[M]10th. Elsevier, Inc. 2023: 698. |
| [112] | Lam KK, Crow P, Ng KHL, et al. A cross-sectional survey of snake oral bacterial flora from Hong Kong, SAR, China[J]. Emerg Med J, 2011, 28(2): 107-114. DOI:10.1136/emj.2009.086694 |
| [113] | Shaikh IK, Dixit PP, Pawade BS, et al. Assessment of cultivable oral bacterial flora from important venomous snakes of India and their antibiotic susceptibilities[J]. Curr Microbiol, 2017, 74(11): 1278-1286. DOI:10.1007/s00284-017-1313-z |
| [114] | Smith LK, Vardanega J, Smith S, et al. The incidence of infection complicating snakebites in tropical Australia: implications for clinical management and antimicrobial prophylaxis[J]. J Trop Med, 2023, 2023: 5812766. DOI:10.1155/2023/5812766 |
| [115] | Soares Coriolano Coutinho JV, Fraga Guimarães T, Borges Valente B, et al. Epidemiology of secondary infection after snakebites in center-west Brazil[J]. PLoS Negl Trop Dis, 2023, 17(3): e0011167. DOI:10.1371/journal.pntd.0011167 |
| [116] | Bonilla-Aldana DK, Bonilla-Aldana JL, Ulloque-Badaracco JR, et al. Snakebite-associated infections: a systematic review and meta-analysis[J]. Am J Trop Med Hyg, 2024, 110(5): 874-886. DOI:10.4269/ajtmh.23-0278 |
| [117] | Mao YC, Liu PY, Chiang LC, et al. Naja atra snakebite in Taiwan[J]. Clin Toxicol, 2018, 56(4): 273-280. DOI:10.1080/15563650.2017.1366502 |
| [118] | Chuang PC, Lin WH, Chen YC, et al. Oral bacteria and their antibiotic susceptibilities in "Taiwanese" venomous snakes[J]. Microorganisms, 2022, 10(5): 951. DOI:10.3390/microorganisms10050951 |
| [119] | Sachett JAG, da Silva IM, Alves EC, et al. Poor efficacy of preemptive amoxicillin clavulanate for preventing secondary infection from Bothrops snakebites in the Brazilian Amazon: a randomized controlled clinical trial[J]. PLoS Negl Trop Dis, 2017, 11(7): e0005745. DOI:10.1371/journal.pntd.0005745 |
| [120] | Lin CC, Chen YC, Goh ZNL, et al. Wound infections of snakebites from the venomous Protobothrops mucrosquamatus and Viridovipera stejnegeri in Taiwan: bacteriology, antibiotic susceptibility, and predicting the need for antibiotics-a BITE study[J]. Toxins, 2020, 12(9): 575. DOI:10.3390/toxins12090575 |
| [121] | Yeh H, Gao SY, Lin CC. Wound infections from Taiwan cobra (Naja atra) bites: determining bacteriology, antibiotic susceptibility, and the use of antibiotics-a cobra BITE study[J]. Toxins, 2021, 13(3): 183. DOI:10.3390/toxins13030183 |
| [122] | Hu SP, Lou ZQ, Shen YC, et al. Bacteriological studies of venomous snakebite wounds in Hangzhou, southeast China[J]. Am J Trop Med Hyg, 2022, 107(4): 925-929. DOI:10.4269/ajtmh.21-1314 |
| [123] | Habib AG. Tetanus complicating snakebite in northern Nigeria: clinical presentation and public health implications[J]. Acta Trop, 2003, 85(1): 87-91. DOI:10.1016/s0001-706x(02)00234-6 |
| [124] | Usman SA, Taslim LO, Uduak OM, et al. Childhood tetanus complicating snakebite: a case report from a semi-urban area, northwestern Nigeria[J]. Cerrahpasa Med J, 2023, 47(2): 239-240. DOI:10.5152/cjm.2023.22103 |
| [125] | Vijaykumar G, Sreenivas K. Rare case of tetanus from snakebite wound[J]. Telangana lournal of IMA, 2022, 2(1): 40-41. DOI:10.52314/tjima.2022.v2i1.59 |
| [126] | Ghosh M, Acharyya A, Bhattacharya P, et al. Role of steroid on management of limb swelling and local pain in haematotoxic snake bite[J]. J Family Med Prim Care, 2022, 11(11): 7394-7397. DOI:10.4103/jfmpc.jfmpc_1371_22 |
| [127] | Nuchprayoon I, Pongpan C, Sripaiboonkij N. The role of prednisolone in reducing limb oedema in children bitten by green pit vipers: a randomized, controlled trial[J]. Ann Trop Med Parasitol, 2008, 102(7): 643-649. DOI:10.1179/136485908X311786 |
| [128] | Irshad VS, Godhiwala P, Kumar S, et al. Role of neostigmine in neurotoxic snake bite[J]. Jemds, 2021, 10(15): 1095-1097. DOI:10.14260/jemds/2021/234 |
| [129] | Lewin MR, Bickler P, Heier T, et al. Reversal of experimental paralysis in a human by intranasal neostigmine aerosol suggests a novel approach to the early treatment of neurotoxic envenomation[J]. Clin Case Rep, 2013, 1(1): 7-15. DOI:10.1002/ccr3.3 |
| [130] | Giri S, Taye SJ, Shyam R, et al. Recurrent neurotoxity in Naja kaouthia envenomation: a case report from Assam, India[J]. Toxicon, 2023, 222: 106990. DOI:10.1016/j.toxicon.2022.106990 |
| [131] | Anil A, Singh S, Bhalla A, et al. Role of neostigmine and polyvalent antivenom in Indian common krait (Bungarus caeruleus) bite[J]. J Infect Public Health, 2010, 3(2): 83-87. DOI:10.1016/j.jiph.2010.01.002 |
| [132] | Isbister GK, Buckley NA, Page CB, et al. A randomized controlled trial of fresh frozen plasma for treating venom-induced consumption coagulopathy in cases of Australian snakebite (ASP-18)[J]. J Thromb Haemost, 2013, 11(7): 1310-1318. DOI:10.1111/jth.12218 |
| [133] | Holla SK, Rao HA, Shenoy D, et al. The role of fresh frozen plasma in reducing the volume of anti-snake venom in snakebite envenomation[J]. Trop Doct, 2018, 48(2): 89-93. DOI:10.1177/0049475518756083 |
| [134] | Isbister GK, Jayamanne S, Mohamed F, et al. A randomized controlled trial of fresh frozen plasma for coagulopathy in Russell's viper (Daboia russelii) envenoming[J]. J Thromb Haemost, 2017, 15(4): 645-654. DOI:10.1111/jth.13628 |
| [135] | Zeng LB, Liang Q, Liang ZJ, et al. Effectiveness of clotting factor replacement therapy after antivenom treatment on coagulopathic envenomation following green pit viper bites: a retrospective observational study[J]. BMC Emerg Med, 2022, 22(1): 9. DOI:10.1186/s12873-022-00569-w |
| [136] | Jeon YJ, Kim JW, Park S, et al. Risk factor, monitoring, and treatment for snakebite induced coagulopathy: a multicenter retrospective study[J]. Acute Crit Care, 2019, 34(4): 269-275. DOI:10.4266/acc.2019.00591 |
| [137] | de Queiroz MR, de Sousa BB, da Cunha Pereira DF, et al. The role of platelets in hemostasis and the effects of snake venom toxins on platelet function[J]. Toxicon, 2017, 133: 33-47. DOI:10.1016/j.toxicon.2017.04.013 |
| [138] | 国家卫生健康委员会. 血液净化标准操作规程(2021版)[EB/OL]. (2021-11-08). http://www.nhc.gov.cn/yzygj/s7659/202111/6e25b8260b214c55886d6f0512c1e53f.shtml. |
| [139] | Zengin S, Yilmaz M, Al B, et al. Plasma exchange as a complementary approach to snake bite treatment: an academic emergency department's experiences[J]. Transfus Apher Sci, 2013, 49(3): 494-498. DOI:10.1016/j.transci.2013.03.006 |
| [140] | Noutsos T, Currie BJ, Lek RA, et al. Snakebite associated thrombotic microangiopathy: a systematic review of clinical features, outcomes, and evidence for interventions including plasmapheresis[J]. PLoS Negl Trop Dis, 2020, 14(12): e0008936. DOI:10.1371/journal.pntd.0008936 |
| [141] | Mohan G, Guduri PR, Shastry S. Role of therapeutic plasma exchange in snake bite associated thrombotic microangiopathy-a case report with review of literature[J]. J Clin Apher, 2019, 34(4): 507-509. DOI:10.1002/jca.21691 |
| [142] | Noutsos T, Currie BJ, Isoardi KZ, et al. Snakebite-associated thrombotic microangiopathy: an Australian prospective cohort study[ASP30[J]. Clin Toxicol, 2022, 60(2): 205-213. DOI:10.1080/15563650.2021.1948559 |
| [143] | Schwartz J, Winters JL, Padmanabhan A, et al. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the Writing Committee of the American Society for Apheresis: the sixth special issue[J]. J Clin Apher, 2013, 28(3): 145-284. DOI:10.1002/jca.21276 |
| [144] | Chang KC, Huang YK, Chen YW, et al. Venom ophthalmia and ocular complications caused by snake venom[J]. Toxins, 2020, 12(9): 576. DOI:10.3390/toxins12090576 |
| [145] | Fung HT, Lam KK, Wong OF, et al. Local antivenom treatment for ophthalmic injuries caused by a Naja atra[J]. J Med Toxicol, 2010, 6(2): 147-149. DOI:10.1007/s13181-010-0068-8 |
| [146] | 喻文球, 王万春, 刁军成, 等. 中医药干预综合疗法治疗蝮蛇咬伤300例临床观察[J]. 中医杂志, 2011, 52(12): 1019-1022. DOI:10.13288/j.11-2166/r.2011.12.009 |
| [147] | 余培南. 我国的蛇类概况[J]. 蛇志, 1999, 5(12): 46. |
| [148] | 王万春, 严张仁. 毒蛇咬伤中医诊疗方案专家共识(2016版)[J]. 中医杂志, 2017, 58(4): 357-360. DOI:10.13288/j.11-2166/r.2017.04.022 |
| [149] | 师为人. 福建蛇伤方药整理与研究回顾[J]. 福建中医药, 2023, 54(2) 36-39, 42. DOI:10.13260/j.cnki.jfjtcm.2023.02009 |
| [150] | 黄念, 吴国程, 杨延龙, 等. 中药治疗毒蛇咬伤研究进展[J]. 辽宁中医药大学学报, 2010, 12(12): 54-56. |
| [151] | 程馥平, 黄小宾, 张勇. 蛇伤性溃疡的治疗进展[J]. 中国中医药现代远程教育, 2016, 14(6): 143-145. DOI:10.3969/j.issn.1672-2779.2016.06.069 |
| [152] | 徐小港, 王钰, 徐义峰, 等. 中医药治疗蝮蛇咬伤临床疗效的Meta分析[J]. 蛇志, 2022, 34(4): 445-451. DOI:10.3969/j.issn.1001-5639.2022.04.001 |
| [153] | Bhaumik S, Kallakuri S, Kaur A, et al. Mental health conditions after snakebite: a scoping review[J]. BMJ Glob Health, 2020, 5(11): e004131. DOI:10.1136/bmjgh-2020-004131 |
| [154] | Waiddyanatha S, Silva A, Weerakoon K, et al. Long-term health effects perceived by snakebite patients in rural Sri Lanka: a cohort study[J]. PLoS Negl Trop Dis, 2022, 16(9): e0010723. DOI:10.1371/journal.pntd.0010723 |
| [155] | Waiddyanatha S, Silva A, Siribaddana S, et al. Long-term effects of snake envenoming[J]. Toxins, 2019, 11(4): 193. DOI:10.3390/toxins11040193 |
| [156] | North CS, Pfefferbaum B. Mental health response to community disasters: a systematic review[J]. JAMA, 2013, 310(5): 507-518. DOI:10.1001/jama.2013.107799 |
| [157] | Wijesinghe CA, Williams SS, Kasturiratne A, et al. A randomized controlled trial of a brief intervention for delayed psychological effects in snakebite victims[J]. PLoS Negl Trop Dis, 2015, 9(8): e0003989. DOI:10.1371/journal.pntd.0003989 |
| [158] | Maercker A, Cloitre M, Bachem R, et al. Complex post-traumatic stress disorder[J]. Lancet, 2022, 400(10345): 60-72. DOI:10.1016/S0140-6736(22)00821-2 |
| [159] | Minghui R, Malecela MN, Cooke E, et al. WHO's Snakebite Envenoming Strategy for prevention and control[J]. Lancet Glob Health, 2019(7): e837-e838. DOI:10.1016/S2214-109X(19)30225-6 |
| [160] | Iliyasu G, Tiamiyu AB, Daiyab FM, et al. Effect of distance and delay in access to care on outcome of snakebite in rural north-eastern Nigeria[J]. Rural Remote Health, 2015, 15(4): 3496. |
 2024, Vol. 33
2024, Vol. 33