暴发性心肌炎(Fulminant myocarditis, FM)是一种特殊类型的、严重的心脏炎症性疾病。作为一种急性弥漫性炎症性心肌疾病,其起病急骤,病情进展迅速,患者在短时间内出现血流动力学异常及严重心律失常,并可继发或伴有呼吸衰竭和肝肾功能衰竭,死亡风险极高[1]。根据2024年《中国成人暴发性心肌炎诊断和治疗指南》统计,在中国年龄 > 14岁的成年人中FM每年发病人数约为3~5万[2]。近年来,随着治疗措施的改进,FM的病死率从50%以上下降到5%以下。目前对于该疾病的发病机制的了解仍然有限,其快速恶化的特点导致难以在早期获得明确诊断,导致误诊率增高和延迟诊断。本文聚焦于FM在病因、病理生理机制、病理分类、临床表现、早期识别和诊断、治疗和预后上的最新研究现状,为改善FM患者的心功能提供新的视角和思路。
1 病因FM的确切病因及病理机制目前不明,但研究显示病原体引起的感染是促进FM的发展中主要因素,非感染因素包括过敏、自身免疫疾病和药物毒性等导致的FM呈逐年增加的趋势。
1.1 病原体感染病毒、细菌、螺旋体和真菌等病原体均可诱发感染,最常见的是病毒,包括肠道病毒(特别是柯萨奇B病毒)、腺病毒、巨细胞病毒、EB病毒、流感病毒等。一些通常感染非心脏器官的病毒,如人类免疫缺陷病毒也可诱发FM[3]。此外还发现人类聚乙二醇病毒(4%)、人类内源性逆转录病毒K(100%)诱导的FM[4-5],提示诱导FM发生的病毒其构成的复杂性。病毒感染诱发的FM可通过实时聚合酶链反应或原位杂交技术在心内膜心肌活检样本和血清中检测出病毒核酸的存在。除病毒外,细菌如结核分枝杆菌、脑膜炎奈瑟菌或原生动物如恶性疟原虫、弓形虫等均可诱发FM[6],在心脏功能迅速恶化的患者中应特别注意此类感染。
1.2 自身免疫性疾病自身免疫性疾病是诱导FM发生的重要因素。研究显示系统性红斑狼疮、风湿病、硬皮病和干燥综合征均可诱发FM[7-9]。通常情况下,心肌细胞上表达的程序性死亡配体-1(Programmed deathligand-1, PD-L1)与程序性死亡受体-1(Programmed death receptor-1, PD-1)结合后可抑制效应T细胞的活化,使得心脏免受特异性T细胞的攻击。然而自身免疫性疾病打破体内免疫稳态平衡,使得自身抗原暴露于免疫系统,并错误的激活心肌细胞毒性T细胞,主要为CD3+/CD8+T细胞以及巨噬细胞,以心肌细胞为目标,造成严重的心肌损害[10]。
1.3 药物毒性许多药物,特别是化疗药物和某些天然衍生物对心肌细胞存在毒性。例如,检查点抑制剂相关心肌梗死发生率逐渐增加,检查点抑制剂作为晚期恶性肿瘤治疗的主要手段之一,近年来研究发现其应用会诱导自身细胞毒性免疫细胞的形成,导致心脏中CD3+CD8+T细胞、巨噬细胞和中性粒细胞的积聚,攻击心肌细胞。由检查点抑制剂诱发心脏副作用发生率达25%,甚至更高。在化疗过程中的患者出现心脏功能恶化,应警惕FM[11-12]。
2 病理生理机制FM其心肌损伤和功能障碍的病理生理包括病毒的直接损伤和免疫反应及细胞因子引起的继发损伤。在新生儿中直接损伤更多见,而免疫源性损伤是成人的主要因素。
2.1 细胞因子风暴免疫反应失调在FM的发生发展中发挥关键作用。病原体感染通过刺激免疫反应,导致疾病迅速发展。在FM患者的心内膜活检样本中发现,坏死心肌组织中存在大量免疫细胞浸润[13],其中大多数浸润细胞是T淋巴细胞、巨噬细胞,B淋巴细胞少见。同样地,淋巴细胞心肌炎、嗜酸性粒细胞性心肌炎和巨细胞心肌炎是免疫紊乱的结果。不同的免疫细胞(例如中性粒细胞、单核细胞和淋巴细胞)分泌失调的细胞因子,介导FM早期阶段的免疫系统紊乱。病毒、细菌以及真菌等多种病原体可以触发细胞因子风暴[14]。细胞外病原体通过诱导细胞因子改变,与受体(如Toll样受体)结合发挥效应,刺激细胞内下游信号转导,调控胞内转录因子表达进而影响细胞反应[15]。如经典的炎症信号通路NF-κB、MAPK信号被激活进一步刺激细胞因子表达,影响心肌收缩和电转导信号,诱发FM[16]。
2.2 心肌收缩障碍FM患者常伴有血液循环受损和难治性心源性休克,需要机械循环支持。超声心动图检测到FM发展过程中的心肌收缩异常,包括大面积心室壁运动功能减退和室壁水肿[17]。一方面,细胞因子通过降低心肌收缩强度和速度,影响心肌功能[18];另一方面,病原体通过释放靶向肌酸蛋白的酶(如蛋白酶或胶原酶)诱导心肌损伤[19]。酶诱导的肌钙蛋白和抗肌萎缩蛋白等肌节蛋白的降解会直接破坏肌节的正常结构并导致心肌丝断裂,心肌将血液泵入循环的能力显著降低。此外,病原体已被证明可以激活不同的细胞死亡途径,包括细胞凋亡,坏死、焦亡、和坏死性凋亡诱导心肌坏死[20]。心肌细胞死亡的增加将进一步引发炎症反应和自身抗原的暴露,可能诱导自身免疫性心肌病的发生[21]。
2.3 心脏电活动异常和心律失常心律失常在FM中很常见,是预后不良的标志[22]。细胞因子风暴通过调节钙/钙调蛋白依赖性蛋白激酶α干扰钙信号转导,抑制心肌细胞收缩,导致心律失常。IL-1促进肌浆网释放钙,引起细胞内钙超载并加剧激发-收缩偶联过程。心肌细胞中钙信号通路的失调和免疫细胞的浸润是心律失常发展的重要因素。
3 病理分类对于FM进行病理分类有利于为疾病治疗及预后提供指导。细胞浸润是FM的主要病理改变,根据浸润细胞的类型,可将FM分为淋巴细胞性心肌炎、嗜酸性心肌炎和巨细胞性心肌炎(图 1)。淋巴细胞性心肌炎的苏木精伊红染色下显示为大量的淋巴细胞浸润,提示感染,尤其是病毒感染。嗜酸性粒细胞浸润提示过敏、寄生虫感染或伴有嗜酸性粒细胞增多和全身症状综合征(DRESS综合征)的药物反应;巨细胞的形成通常与自身免疫性疾病或结节病有关。病理学改变与心肌炎临床表现严重程度并不成严格对应关系。
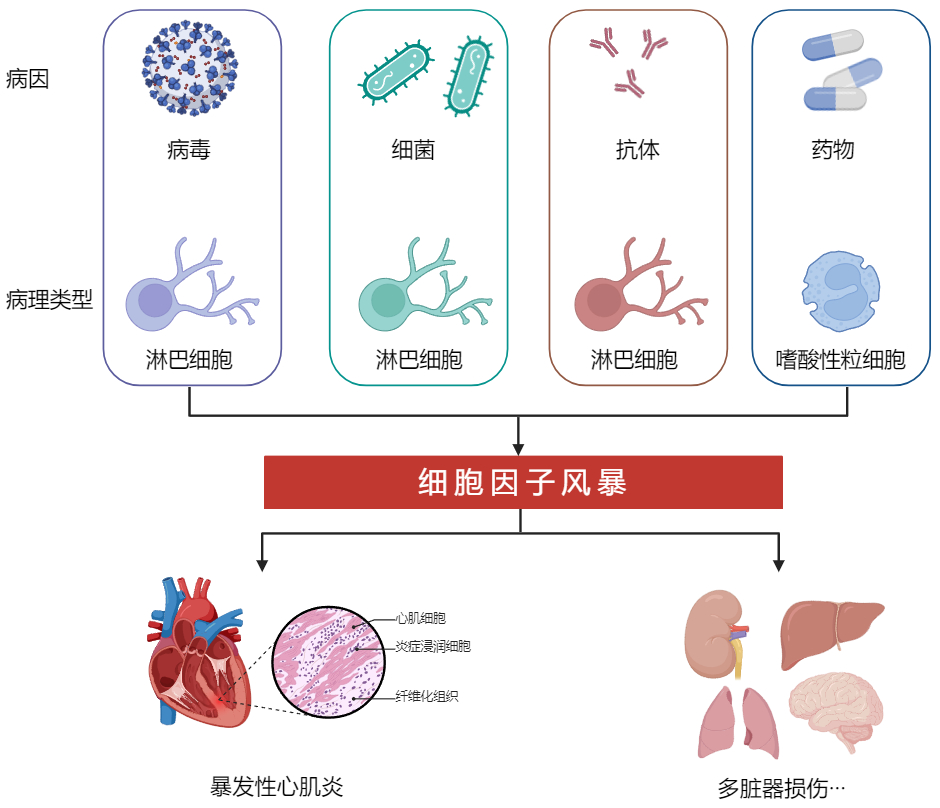
|
| 图 1 暴发性心肌炎的主要病因、病理类型和损伤部位 |
|
|
淋巴细胞性心肌炎的特征是存在单核细胞浸润和左心室功能障碍。作为一种心脏炎症性疾病,病毒感染是淋巴细胞性心肌炎最常见的原因,发生在30%~40%的患者中。临床可以表现为亚临床、亚急性、急性和暴发性形式[23-24]。及时诊断对于治疗至关重要,淋巴细胞性心肌炎的预后优于非特异性组织学发现或巨细胞心肌炎[25]。
3.2 嗜酸性心肌炎急性坏死性心肌炎作为罕见的嗜酸性心肌炎,好发于成人和16岁以下的青少年[26]。临床表现为暴发性心力衰竭或心脏骤停,心室血栓形成和动脉栓塞好发,病死率或移植率高达50%,症状平均持续时间为4 d[27]。最常见的原因是药物过敏,最常见的症状是新发的双心室心力衰竭,伴有快速的血流动力学恶化,需要使用强心剂或机械循环支持(mechanical circulatory support, MCS)。在少数病例中,会出现提示药物相关皮肤反应的皮疹。病理学上表现为嗜酸性粒细胞脱粒后,含有主要碱性蛋白的嗜酸性颗粒沉积在心肌组织上,心肌显示大面积嗜酸性心肌和大面积单核细胞浸润,炎症、心肌坏死和微血管血栓形成[28-29]。
3.3 巨细胞心肌炎心脏结节病是一种特殊的FM病理类型,十分罕见,其发病率与遗传背景密切相关,年轻人和中年人好发[30]。最常见的表现是急性心力衰竭,并发室性心律失常和进行性血流动力学恶化,少数会进展为特发性完全性心脏传导阻滞。多达25%的巨细胞心肌炎患者有其他自身免疫性疾病病史。巨细胞心肌炎的病理学标准是弥漫性或多灶性炎性浸润,由淋巴细胞和多核巨细胞组成,伴有肌细胞损伤[31]。
4 临床表现发病初期并无明显症状,很多患者仅有轻微发热、乏力、食欲明显减退、轻微腹泻等症状,这些症状可持续3~5 d甚至更长时间。FM的前驱症状难以与普通感冒区别开来,但其临床进展快,病情在前驱症状出现2周内迅速恶化,有的可在2或3 d内发生。此时患者可能因气喘、呼吸困难、胸闷或胸痛、心悸、头晕、极度乏力、食欲明显下降等症状就诊。部分患者可迅速出现血流动力学功能障碍和循环不稳定,表现为血压急剧下降,血管活性药物难以维持,需要机械循环支持,多器官衰竭多见。
5 早期识别与诊断FM的初步诊断主要基于患者观察到的临床症状,与普通病毒性心肌炎在组织学和病理学上并无显著差异,因此FM被认为是一种临床诊断,而非病理或病理生理诊断。一般认为,当急性心肌炎起病急、进展急剧,患者出现严重心力衰竭、低血压或心源性休克,必须使用正性肌力药物和血管活性药物或机械循环辅助装置才能维持或挽救生命的情况,可称为FM。发烧、心悸、喉咙痛、晕厥和心律失常等体征和症状可能是FM常见但非特异性的前驱体征[32]。诊断FM应满足以下标准:(1)2周内快速出现严重心力衰竭症状(EF%快速恶化或新发传导阻滞);(2)上呼吸道或胃肠道病毒感染的前驱症状;(3)血流动力学损害的快速发展,需要大剂量的正性肌力药物,如多巴胺、多巴酚丁胺,甚至MCS装置;(4)心血管磁共振成像(cardiovascular magnetic resonance, CMR)或心内膜心肌活检(endomyocardial biopsy, EMB)证实的心肌炎;(5)排除其他心脏疾病,特别是急性缺血性心肌病或冠状动脉疾病。一旦既往健康个体或非心脏病患者出现快速心力衰竭,需要充分考虑FM的可能性。当有FM疑似患者入院时,应进行常规检查,包括体格检查、血液生化、12导联心电图和紧急超声心动图[2]。体格检查可能有心力衰竭体征,包括血压下降、心率加快和心音明显减弱,通常伴有奔马律,伴或不伴呼吸急促。在有条件的情况下,应尽早从临床、病理和病因三个方面对于FM进行诊断。
5.1 心电图检查心电图对诊断FM具有高度敏感性,但非特异。因此,建议短期内重复进行心电图检查并比较差异。窦性心动过速是最常见的表现,如果心电图显示心律失常或心动过速伴窦性心律,左束支传导阻滞、QRS波幅降低、室性早搏和室性心动过速提示疾病进展[33]。肢体导联电压降低,特别是胸前导联电压降低,是心肌弥漫性严重损伤的征象。部分患者的心电图表现与典型的急性心肌梗死相似,如导联特异性弓形ST段抬高[34]。心电图变化瞬息万变,指南建议所有FM患者均应接受Holter监测[35]。
5.2 实验室检查常规血液检查可能显示中性粒细胞或淋巴细胞升高,提示存在感染,中性粒细胞持续降低提示预后不良。可采取病毒血清学检测,但检测阴性结果并不能排除病毒感染可能[36]。与通过活检获得的心内膜心肌组织进行的病毒基因组聚合酶链反应相比,常规病毒血清学检查的敏感性和特异性不足。宏基因组测序和靶基因测序可能有助于病原体的识别。
心肌损伤标志物,如心肌酶和肌钙蛋白I(cardiac troponin I, cTnI)或肌钙蛋白T(cardiac troponin T, cTnT),以及NT-ProBNP可进一步了解损伤和心功能不全,但急性冠脉疾病也可能引起上述指标升高。区分FM和急性冠状动脉疾病至关重要,其治疗方案完全不同,可考虑急诊血管造影进一步甄别。血清cTnI可成为心肌炎早期有用的诊断工具[37]。在386名患有心肌炎的队列中,所有386例患者(100%)均发现cTnI升高;385例患者(99%)的红细胞沉降率或C反应蛋白值异常。随访中,发生和未发生不良心脏事件患者的生物标志物升高水平相似。利钠肽通常会升高,可能有助于预后判断[38]。评估血清cTn、红细胞沉降率和C反应蛋白,可以协助心肌炎的诊断。然而,正常的红细胞沉降率和C反应蛋白水平并不能排除心肌炎。可溶性生长刺激表达基因2(Soluble suppression of tumorigenicity 2, sST2)用于鉴别FM和非暴发性心肌炎甚至比NT-ProBNP和cTnI更敏感[39]。
5.3 心内膜心肌活检EMB是诊断FM的金标准,有助于FM的病理分类。近年来,接受EMB诊断FM的患者比率有所增加。随着现代分子生物学技术的进步,如RT-PCR、ISH或NGS,EMB样本可能提供有关FM的关键信息。有经验的操作人员操作EMB的不良反应的发生率 < 2.5%[40]。EMB相关并发症大多不致命,包括三尖瓣反流、短暂性右束支传导阻滞和短暂性心律失常;危及生命的并发症包括心室穿孔和相关的心包填塞。心脏的炎症浸润可能不均匀,因此EMB可能会产生假阴性结果。采集4~5个甚至更多的EMB样本,可以减少采样误差和假阴性结果。具有典型GCM特征的患者,例如伴有室性心律失常的暴发性心力衰竭和对指南指导的医疗治疗缺乏反应,应该进行EMB。特征性巨细胞在前驱症状出现后1至2周后出现,因此在疾病最初几天获得的活检样本可能类似于没有巨细胞的坏死性嗜酸性心肌炎,呈现假阴性。GCM可能类似于心脏结节病,但没有非干酪性肉芽肿或大量纤维化。嗜酸性粒细胞浸润的程度各不相同,但通常比心脏结节病的程度要重。
5.4 超声心动图超声心动图采集快速、便携,是大多数FM病例的首选检查,有助于快速处理多项鉴别诊断(包括心包疾病)并评估心脏和瓣膜功能和形态。及早使用超声心动图对于明确诊断和确定心血管损害的严重程度至关重要。除了显示心脏功能障碍及其并发症(如血栓)外,左心室舒张末期内径正常,但心肌水肿导致的室壁增厚和心包积液对于FM具有提示意义[41-42]。心室扩张程度较大提示慢性损伤,而左心室较小可能提示FM[43]。组织多普勒成像和应变成像可以用于检测收缩和舒张功能的敏感指标,但缺乏诊断特异性。超声心动图不仅用于诊断和监测,部分超声心动图参数可用于描述恢复情况[44]。与急性心肌炎患者相比,能够存活到恢复期的FM患者的收缩功能恢复程度更高。在儿童中,较小的LV尺寸和较大的LV厚度预后较好。与所有类型的心力衰竭一样,右心室功能障碍和持续性舒张功能障碍提示预后不良。值得注意的是,超声心动图的结果可能因FM患者的心脏功能状态而异,建议重复和密切监测。
5.5 心脏磁共振成像无法获得EMB或疑似FM患者的情况不稳定,钆造影增强CMR是一种替代选择。CMR在显示心肌水肿和纤维化方面,包括细胞内和间质水肿、充血、毛细血管渗漏,甚至坏死和随后的组织纤维化,能够提供与心肌炎组织病理水平一致的优势[45-46]。早期钆增强是充血和毛细血管渗漏的征兆,晚期钆增强是坏死和纤维化的征兆[47]。此外,CMR可以提供有关心脏功能和心脏形态的数据,区分心室壁和血室并精确评估心脏功能。使用CMR诊断心肌炎时,LakeLouise标准是接受最为广泛的标准[47]。
5.6 增强心脏计算机断层扫描计算机断层扫描(computed tomography, CT)通常用于评估冠状动脉疾病是否是心肌功能障碍的原因。大部分FM患者的CT影像心影不大或稍大,也可因左心功能不全出现肺淤血或肺水肿表现。增强心脏计算机断层扫描因需要注射造影剂,临床上谨慎使用。
5.7 其他使用漂浮导管监测右心房、右心室、肺动脉及肺毛细血管楔压,或采用脉搏指数连续心输出量监测压力,有创血流动力学监测有助于判断患者病情及治疗反应。冠状动脉造影可快速鉴别急性心肌梗死和以急性胸痛起病的FM患者,需要注意的是造影剂对心脏收缩有抑制作用,故应慎用。
6 治疗FM作为一种进展迅速的严重疾病,患者对于对常规血管活性药物治疗以及标准心力衰竭、难治性心力衰竭和心源性休克治疗反应不佳。然而,MCS设备的改进使FM患者的治疗成功率从不到20%提高到40%~70%[48]。
针对细胞因子炎症风暴、免疫系统紊乱、过度刺激以及趋化因子谱系紊乱在FM中的重要作用,最新指南提出“以生命支持为基础的综合治疗方案”(图 2)。方案强调一旦怀疑为FM,应尽快进行积极的综合治疗,包括严格卧床休息,监测血流动力学、心电活动、血氧饱和度,给予营养支持和药物治疗,包括抗炎、抗病毒、大剂量糖皮质激素和静脉注射免疫球蛋白进行免疫调节,必要时应用血浆或血液净化和生命支持技术(包括IABP、ECMO、辅助机械通气,必要时植入临时起搏器)。当治疗失败时可以考虑进行心脏移植[2, 49]。
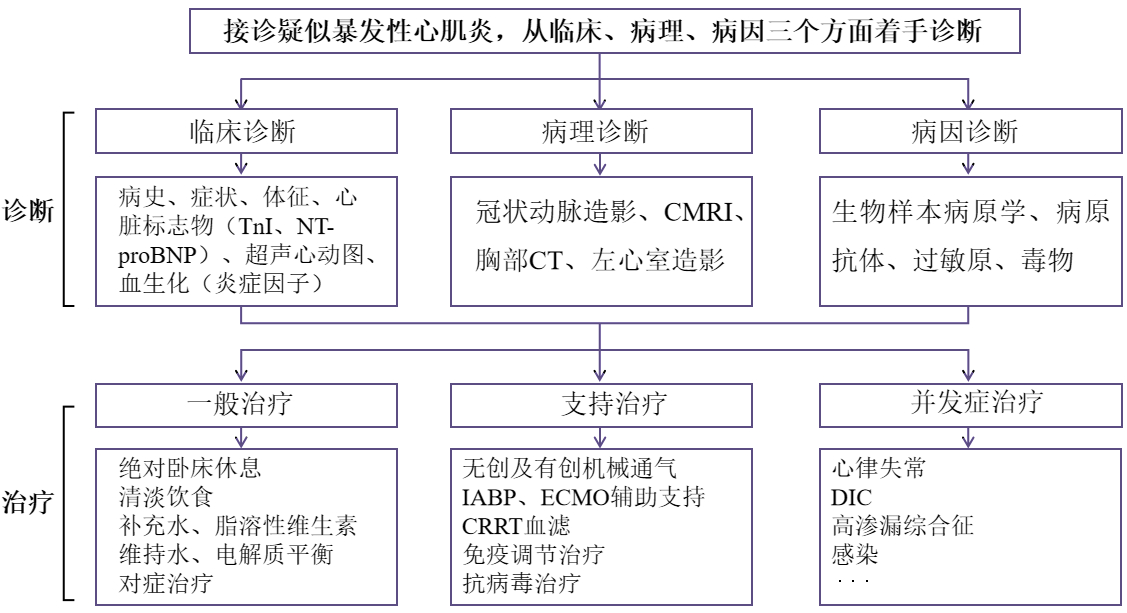
|
| 图 2 暴发性心肌炎诊治流程 |
|
|
免疫调节和MCS的结合是治疗方案的核心。所有FM患者均应给予免疫调节治疗,应用大剂量糖皮质激素和静脉注射免疫球蛋白[50]。目前指南推荐甲泼尼龙3~8 mg/kg,qd,连续使用3~5 d。尽管目前尚缺少大规模多中心临床研究的明确结果,但大量临床实践证明免疫调节治疗有助于阻断发病、减轻炎症、改善临床症状、挽救濒死心肌,改善预后。糖皮质激素的应用仍存在争议,最佳给药时机仍不清楚。据报道,在急性病毒性心肌炎的动物模型中,不同时间点使用糖皮质激素治疗小鼠,小鼠的病死率不同。糖皮质激素应在第二期即所谓的免疫损伤期使用,第一期使用时病毒正在复制,心肌损伤严重,糖皮质激素可能会增加病毒的复制[51]。静脉注射免疫球蛋白不仅为机体提供被动免疫,帮助清除病毒;另一方面,它可以调节抗原呈递细胞和Treg细胞的功能,防止细胞免疫过度反应,减少细胞毒性T细胞对心肌的攻击,减少细胞因子的合成,减轻心肌损伤,改善左心室功能,避免严重心律失常和死亡[4, 52]。指南推荐免疫球蛋白的使用总量在2 g/kg,具体用量根据临床实际动态调整。
另一个重要方面是抗病毒治疗,尽管各种病因都可能导致心肌炎的发生,但病毒感染仍然被认为是最主要的诱因。所有FM患者应尽早接受抗病毒治疗。证据表明,对于H1N1病毒性心肌炎患者,早期使用抗病毒药物比晚期使用药物可以降低病死率并获得更好的预后[53]。奥司他韦、帕拉米韦等药物通过抑制流感神经氨酸酶,阻止病毒从细胞中释放,从而抑制病毒的复制和传播;鸟苷酸类似物(如阿昔洛韦)可干扰和抑制病毒DNA的合成[54]。
FM患者应积极接受一般治疗和生命支持治疗(针对呼吸衰竭、休克、左心衰、心律失常的治疗[55]。体外膜肺氧合(ECMO)是一种有效的FM治疗技术,可为患者提供心肺支持以及维持生命的充足气体交换或灌注[56]。
7 预后评估关于FM的预后,目前仍存在较大争议。2000年的McCarthy团队发表的一项单中心研究数据显示FM的预后优于急性(非FM)心肌炎[57]。观点认为FM虽然在急性期表现相当严重,但成功度过这一阶段的患者预后良好,是FM与急性心肌炎之间最重要的区别。然而,2018年Ammirati团队发表的一项研究揭示经EMB证实并分为三个亚型的FM患者在60 d和长期随访中的表现均比非FM更差,其中FM患者的60 d病死率为28%,而非FM患者为1.8%(P=0.0001),长期随访(7年)显示FM患者的病死率为47.7%,而非FM患者的病死率为10.4%(P < 0.001)[58-59]。普遍认为,病原体相关免疫反应和免疫稳态紊乱对FM的长期预后有显著影响。尽管FM患者出院时心脏功能可能正常或轻微受损,免疫系统紊乱、残余炎症和自身免疫耐受性的变化会持续影响预后并影响心脏重塑[17]。对FM患者进行1年随访时,超过20%的患者出现心力衰竭、心律失常或心脏扩大,而急性心肌炎患者的不到10%。细胞因子风暴释放的细胞因子会影响心脏重塑过程[50]。例如,转化生长因子β(TGF-β)是一种在FM急性期上调的促纤维化细胞因子,诱导过度纤维化,纤维化和瘢痕组织为心律失常的发生进一步提供了结构基础。对于影响FM长期病理生理变化的确切机制仍然未知,需要进一步的研究。
8 未来研究方向与展望FM是一种未被充分诊断的综合征,其病因复杂,大多数炎症性FM病例都使用高剂量类固醇治疗,了解导致特定自身免疫反应的生物学机制将有助于更精确地治疗这些可能致命的综合征。FM的主要特征包括快速进展性心力衰竭和心源性休克,以及心电不稳定,包括猝死。早期评估和管理对于区分FM与其他形式的急性循环功能障碍非常重要,为疾病的明确诊断和心肌恢复争取时间。MCS的开始时间仍然存在争议,VA-ECMO是目前最常用并推荐的选择。FM的初始治疗方案以药物为中心,随着机械支持系统的出现,开始转变为由利用MCS系统联合免疫调节的“基于生命的支持的综合治疗”的方案,显著降低了病死率,侧面证实这一方案的正确性。在短期的MCS支持治疗后续,心脏移植和心室辅助设置的植入治疗选择变得愈发重要,未来可能出现新一代的改进的循环支持系统,为FM患者提供更好的短期以及长期选择。根据实际情况建立包含多学科的FM救治的快速反应团队,EMB的早期识别,有利于为FM患者提供最佳康复机会,康复患者的最佳治疗方案仍有待阐明。
利益冲突 所有作者声明无利益冲突
| [1] | Saraiya N, Singh S, Corpuz M. Fatal influenza myocarditis with incessant ventricular tachycardia[J]. BMJ Case Rep, 2019, 12(7): e228201. DOI:10.1136/bcr-2018-228201 |
| [2] | Wang DW, Li S, Jiang JG, et al. Chinese society of cardiology expert consensus statement on the diagnosis and treatment of adult fulminant myocarditis[J]. Sci China Life Sci, 2019, 62(2): 187-202. DOI:10.1007/s11427-018-9385-3 |
| [3] | Brucato A, Colombo T, Bonacina E, et al. Fulminant myocarditis during HIV seroconversion: recovery with temporary left ventricular mechanical assistance[J]. Ital Heart J, 2004, 5(3): 228-231. |
| [4] | Maisch B, Alter P. Treatment options in myocarditis and inflammatory cardiomyopathy: focus on i.?v. immunoglobulins[J]. Herz, 2018, 43(5): 423-430. DOI:10.1007/s00059-018-4719-x |
| [5] | Hage-Sleiman M, Derre N, Verdet C, et al. Meningococcal purpura fulminans and severe myocarditis with clinical meningitis but no meningeal inflammation: a case report[J]. BMC Infect Dis, 2019, 19(1): 252. DOI:10.1186/s12879-019-3866-x |
| [6] | Avsar S, Oz A, Çınar T, et al. Acute fulminant eosinophilic myocarditis due to Giardia lamblia infection presented with cardiogenic shock in a young patient[J]. Anatol J Cardiol, 2019, 21(4): 234-235. DOI:10.14744/AnatolJCardiol.2019.48742 |
| [7] | Leung MCH, Harper RW, Boxall J. Extracorporeal membrane oxygenation in fulminant myocarditis complicating systemic lupus erythematosus[J]. Med J Aust, 2002, 176(8): 374-375. DOI:10.5694/j.1326-5377.2002.tb04458.x |
| [8] | Lin CY, Hsu CY, Huang PH. Rapid resolution of severe myocardial dysfunction in a patient with rheumatoid arthritis by intravenous immunoglobulin and steroid treatment[J]. Acta Cardiol Sin, 2014, 30(6): 570-573. DOI:10.6515/acs20131102a |
| [9] | Watanabe T, Takahashi Y, Hirabayashi K, et al. Acute fulminant myocarditis in a patient with primary Sjögren's syndrome[J]. Scand J Rheumatol, 2019, 48(2): 164-165. DOI:10.1080/03009742.2018.1514068 |
| [10] | Ginsberg F, Parrillo JE. Fulminant myocarditis[J]. Crit Care Clin, 2013, 29(3): 465-483. DOI:10.1016/j.ccc.2013.03.004 |
| [11] | Tajiri K, Aonuma K, Sekine I. Immune checkpoint inhibitor-related myocarditis[J]. Jpn J Clin Oncol, 2018, 48(1): 7-12. DOI:10.1093/jjco/hyx154 |
| [12] | Wang DY, Salem JE, Cohen JV, et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis[J]. JAMA Oncol, 2018, 4(12): 1721-1728. DOI:10.1001/jamaoncol.2018.3923 |
| [13] | Ikarashi K, Uto K, Kawamura S, et al. An autopsy case of giant cell myocarditis showing shared pathology in the myocardium and skeletal muscles[J]. Cardiovasc Pathol, 2019, 42: 10-14. DOI:10.1016/j.carpath.2019.05.003 |
| [14] | Cavalli G, Pappalardo F, Mangieri A, et al. Treating life-threatening myocarditis by blocking interleukin-1[J]. Crit Care Med, 2016, 44(8): e751-e754. DOI:10.1097/CCM.0000000000001654 |
| [15] | Kurdi M, Zgheib C, Booz GW. Recent developments on the crosstalk between STAT3 and inflammation in heart function and disease[J]. Front Immunol, 2018, 9: 3029. DOI:10.3389/fimmu.2018.03029 |
| [16] | Huang CH, Zhang Y, Qi HL, et al. Myc is involved in Genistein protecting against LPS-induced myocarditis in vitro through mediating MAPK/JNK signaling pathway[J]. Biosci Rep, 2020, 40(6): BSR20194472. DOI:10.1042/BSR20194472 |
| [17] | Zuo HJ, Li R, Ma F, et al. Temporal echocardiography findings in patients with fulminant myocarditis: beyond ejection fraction decline[J]. Front Med, 2020, 14(3): 284-292. DOI:10.1007/s11684-019-0713-9 |
| [18] | Kazanski V, Mitrokhin VM, Mladenov MI, et al. Cytokine effects on mechano-induced electrical activity in atrial myocardium[J]. Immunol Invest, 2017, 46(1): 22-37. DOI:10.1080/08820139.2016.1208220 |
| [19] | Jenke A, Schur R, Röger C, et al. Adiponectin attenuates profibrotic extracellular matrix remodeling following cardiac injury by up-regulating matrix metalloproteinase 9 expression in mice[J]. Physiol Rep, 2017, 5(24): e13523. DOI:10.14814/phy2.13523 |
| [20] | Ogawa S, Suzuki M, Ochi H, et al. The clinical potential of impella 5.0 support in the treatment of recurrent fulminant viral myocarditis with profound cardiogenic shock[J]. Intern Med, 2019, 58(10): 1459-1462. DOI:10.2169/internalmedicine.1866-18 |
| [21] | Arumugam R, Yalaka B, Massilamany C, et al. An evidence for surface expression of an immunogenic epitope of sarcoplasmic/endoplasmic reticulum calcium-ATPase2a on antigen-presenting cells from naive mice in the mediation of autoimmune myocarditis[J]. Immunobiology, 2020, 225(2): 151896. DOI:10.1016/j.imbio.2019.12.005 |
| [22] | Sawamura A, Okumura T, Ito M, et al. Prognostic value of electrocardiography in patients with fulminant myocarditis supported by percutaneous venoarterial extracorporeal membrane oxygenation - analysis from the CHANGE PUMP study[J]. Circ J, 2018, 82(8): 2089-2095. DOI:10.1253/circj.CJ-18-0136 |
| [24] | Trachtenberg BH, Hare JM. Inflammatory cardiomyopathic syndromes[J]. Circ Res, 2017, 121(7): 803-818. DOI:10.1161/CIRCRESAHA.117.310221 |
| [25] | Sinagra G, Porcari A, Gentile P, et al. Viral presence-guided immunomodulation in lymphocytic myocarditis: an update[J]. Eur J Heart Fail, 2021, 23(2): 211-216. DOI:10.1002/ejhf.1969 |
| [26] | Brambatti M, Matassini MV, Adler ED, et al. Eosinophilic myocarditis: characteristics, treatment, and outcomes[J]. J Am Coll Cardiol, 2017, 70(19): 2363-2375. DOI:10.1016/j.jacc.2017.09.023 |
| [27] | Zhong ZZ, Yang ZC, Peng YM, et al. Diagnosis and treatment of eosinophilic myocarditis[J]. J Transl Autoimmun, 2021, 4: 100118. DOI:10.1016/j.jtauto.2021.100118 |
| [28] | Piccirillo F, Mastroberardino S, Nafisio V, et al. Eosinophilic myocarditis: from bench to bedside[J]. Biomedicines, 2024, 12(3): 656. DOI:10.3390/biomedicines12030656 |
| [29] | Almusawi H, daSilva-deAbreu A, Zerpa T, et al. Elusive diagnosis of eosinophilic myocarditis: a case series[J]. Curr Probl Cardiol, 2021, 46(10): 100849. DOI:10.1016/j.cpcardiol.2021.100849 |
| [30] | Kusano KF, Satomi K. Diagnosis and treatment of cardiac sarcoidosis[J]. Heart, 2016, 102(3): 184-190. DOI:10.1136/heartjnl-2015-307877 |
| [31] | Bang V, Ganatra S, Shah SP, et al. Management of patients with giant cell myocarditis: JACC review topic of the week[J]. J Am Coll Cardiol, 2021, 77(8): 1122-1134. DOI:10.1016/j.jacc.2020.11.074 |
| [32] | Wang ZC, Wang YW, Lin HY, et al. Early characteristics of fulminant myocarditis vs non-fulminant myocarditis: a meta-analysis[J]. Medicine, 2019, 98(8): e14697. DOI:10.1097/MD.0000000000014697 |
| [33] | Dai MY, Yan YC, Wang LY, et al. Characteristics of electrocardiogram findings in fulminant myocarditis[J]. J Cardiovasc Dev Dis, 2023, 10(7): 280. DOI:10.3390/jcdd10070280 |
| [34] | Bhasin D, Deshpande AA, Gupta A, et al. Fulminant myocarditis mimicking extensive anterior wall myocardial infarction[J]. Acta Cardiol, 2021, 76(9): 1036-1038. DOI:10.1080/00015385.2020.1864927 |
| [35] | Yang D, Dai Q, Wu H, et al. The diagnostic capability of electrocardiography on the cardiogenic shock in the patients with acute myocarditis[J]. BMC Cardiovasc Disord, 2020, 20(1): 502. DOI:10.1186/s12872-020-01796-4 |
| [36] | Mahfoud F, Gärtner B, Kindermann M, et al. Virus serology in patients with suspected myocarditis: utility or futility?[J]. Eur Heart J, 2011, 32(7): 897-903. DOI:10.1093/eurheartj/ehq493 |
| [37] | Liu C, Wang ZQ, Chen KQ, et al. The absolute and relative changes in high-sensitivity cardiac troponin I are associated with the in-hospital mortality of patients with fulminant myocarditis[J]. BMC Cardiovasc Disord, 2021, 21(1): 571. DOI:10.1186/s12872-021-02386-8 |
| [38] | Yu SR, Zhang CY, Xiong WJ, et al. An hypothesis: disproportion between cardiac troponin and B-type natriuretic peptide levels-a high risk and poor prognostic biomarker in patients with fulminant myocarditis?[J]. Heart Lung Circ, 2021, 30(6): 837-842. DOI:10.1016/j.hlc.2020.12.012 |
| [39] | Wang J, He MY, Li HH, et al. Soluble ST2 is a sensitive and specific biomarker for fulminant myocarditis[J]. J Am Heart Assoc, 2022, 11(7): e024417. DOI:10.1161/JAHA.121.024417 |
| [40] | Dominguez F, Kühl U, Pieske B, et al. Update on myocarditis and inflammatory cardiomyopathy: reemergence of endomyocardial biopsy[J]. Rev Esp Cardiol, 2016, 69(2): 178-187. DOI:10.1016/j.rec.2015.10.015 |
| [41] | Skouri HN, Dec GW, Friedrich MG, et al. Noninvasive imaging in myocarditis[J]. J Am Coll Cardiol, 2006, 48(10): 2085-2093. DOI:10.1016/j.jacc.2006.08.017 |
| [42] | Shillcutt SK, Thomas WR, Sullivan JN, et al. Fulminant myocarditis: the role of perioperative echocardiography[J]. Anesth Analg, 2015, 120(2): 296-299. DOI:10.1213/ANE.0000000000000508 |
| [43] | Ammirati E, Cipriani M, Lilliu M, et al. Survival and left ventricular function changes in fulminant versus nonfulminant acute myocarditis[J]. Circulation, 2017, 136(6): 529-545. DOI:10.1161/CIRCULATIONAHA.117.026386 |
| [44] | Escher F, Kasner M, Kühl U, et al. New echocardiographic findings correlate with intramyocardial inflammation in endomyocardial biopsies of patients with acute myocarditis and inflammatory cardiomyopathy[J]. Mediators Inflamm, 2013, 2013: 875420. DOI:10.1155/2013/875420 |
| [45] | Friedrich MG, Sechtem U, Schulz-Menger J, et al. Cardiovascular magnetic resonance in myocarditis: a JACC White Paper[J]. J Am Coll Cardiol, 2009, 53(17): 1475-1487. DOI:10.1016/j.jacc.2009.02.007 |
| [46] | Wheen P, Armstrong R, Daly CA. Recent advances in T1 and T2 mapping in the assessment of fulminant myocarditis by cardiac magnetic resonance[J]. Curr Cardiol Rep, 2020, 22(7): 47. DOI:10.1007/s11886-020-01295-0 |
| [47] | Ferreira VM, Schulz-Menger J, Holmvang G, et al. Cardiovascular magnetic resonance in NonischemicMyocardial inflammation: expert recommendations[J]. J Am Coll Cardiol, 2018, 72(24): 3158-3176. DOI:10.1016/j.jacc.2018.09.072 |
| [48] | Kociol RD, Cooper LT, Fang JC, et al. Recognition and initial management of fulminant myocarditis: a scientific statement from the American heart association[J]. Circulation, 2020, 141(6): e69-e92. DOI:10.1161/CIR.0000000000000745 |
| [49] | Edin ML, Zeldin DC. An improved protocol for the treatment of fulminant myocarditis[J]. Sci China Life Sci, 2019, 62(3): 433-434. DOI:10.1007/s11427-019-9507-x |
| [50] | Hang WJ, Chen C, Seubert JM, et al. Fulminant myocarditis: a comprehensive review from etiology to treatments and outcomes[J]. Signal Transduct Target Ther, 2020, 5(1): 287. DOI:10.1038/s41392-020-00360-y |
| [51] | Ammirati E, Veronese G, Bottiroli M, et al. Update on acute myocarditis[J]. Trends Cardiovasc Med, 2021, 31(6): 370-379. DOI:10.1016/j.tcm.2020.05.008 |
| [52] | Axelrod ML, Meijers WC, Screever EM, et al. T cells specific for α-myosin drive immunotherapy-related myocarditis[J]. Nature, 2022, 611(7937): 818-826. DOI:10.1038/s41586-022-05432-3 |
| [53] | Lobo ML, Taguchi Â, Gaspar HA, et al. Fulminant myocarditis associated with the H1N1 influenza virus: case report and literature review[J]. Rev Bras Ter Intensiva, 2014, 26(3): 321-326. DOI:10.5935/0103-507x.20140046 |
| [54] | Dennert R, Velthuis S, Westermann D, et al. Parvovirus-B19-associated fulminant myocarditis successfully treated with immunosuppressive and antiviral therapy[J]. Antivir Ther, 2010, 15(4): 681-685. DOI:10.3851/IMP1563 |
| [55] | Bassawon R, Shum-Tim D. Extracorporeal life support in fulminant myocarditis: on the side or in the centre?[J]. Eur J Cardiothorac Surg, 2021, 60(5): 1193-1194. DOI:10.1093/ejcts/ezab272 |
| [56] | Zhang XH, Wang SL, Jia J, et al. The use of extracorporeal membrane oxygenation in the treatment of fulminant myocarditis: current progress and clinical outcomes[J]. Microvasc Res, 2021, 137: 104190. DOI:10.1016/j.mvr.2021.104190 |
| [57] | McCarthy RE 3rd, Boehmer JP, Hruban RH, et al. Long-term outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis[J]. N Engl J Med, 2000, 342(10): 690-695. DOI:10.1056/NEJM200003093421003 |
| [58] | Ammirati E, Veronese G, Brambatti M, et al. Fulminant versus acute nonfulminant myocarditis in patients with LeftVentricular SystolicDysfunction[J]. J Am Coll Cardiol, 2019, 74(3): 299-311. DOI:10.1016/j.jacc.2019.04.063 |
| [59] | Ammirati E, Cipriani M, Moro C, et al. Clinical presentation and outcome in a contemporary cohort of patients with acute myocarditis: multicenter Lombardy registry[J]. Circulation, 2018, 138(11): 1088-1099. DOI:10.1161/CIRCULATIONAHA.118.035319 |
 2024, Vol. 33
2024, Vol. 33