2. 武汉大学空间全生命周期健康国际研究中心(ISLE),武汉 430072;
3. 武汉大学资源与环境科学学院,武汉 430072;
4. 湖北省荆州市中心医院重症医学科,荆州 434020;
5. 武汉大学公共卫生学院,武汉 430072
2. International Institute of Spatial Lifecourse Health (ISLE), Wuhan University, Wuhan, 430072, China;
3. School of Resource and Environmental Sciences, Wuhan University, Wuhan, 430072, China;
4. Department of Intensive Care Unit (ICU), Jingzhou Central Hospital, the Second Clinical Medical College, Yangtze University, Jingzhou, 434020, China;
5. School of Public Health, Wuhan University, Wuhan, 430072, China
对人体健康有危害的空气污染物主要包括空气动力学直径 < 2.5 μm(PM2.5)和 < 10 μm(PM10)的颗粒物、二氧化氮(NO2)、二氧化硫(SO2)、臭氧(O3)和一氧化碳(CO)。这些空气污染物每年造成约400万人死亡,在全球死亡风险因素排行中位列第四[1]。空气污染物与多种疾病的发生发展有关,以心血管系统、呼吸系统疾病、癌症最为关注[2-4]。
目前大多数发现空气污染负面健康效应的研究基于自然人群或健康体检人群开展,很少有机会在急危重症患者中进行深入研究[5-6]。近年来有研究报道急诊入院人数和病死率的增加与空气污染物暴露有关,特别是在老年人、有慢性基础疾病等脆弱人群中,这一相关性尤为明显[5-7],但研究污染物暴露时间仅为入院前3 d[7]。另外,有研究空气污染物对血细胞计数比值的影响[8],以及血细胞计数比值对死亡风险的影响[9-10],但是极少有研究探索血细胞计数比值在空气污染物和危重患者死亡风险之间关联中是否发挥潜在的中介效应。
本研究旨在探究空气污染物暴露与入住ICU的危重患者28 d死亡风险之间的关联,并评估血细胞计数比值[中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)、单核细胞/淋巴细胞比值(MLR)]在空气污染物暴露与死亡风险关联中潜在的中介效应。
1 资料与方法 1.1 研究对象本研究数据来自于湖北省人民医院/武汉大学人民医院, 荆州中心医院重症监护室。每位患者的常年居住地址分布在湖北省各地市县。为避免新冠肺炎疫情(2019年11月至2020年5月)对研究结果造成的偏倚,在疫情前后各选择一年时间:2018年8月至2019年8月和2021年5月至2022年5月,纳入武汉大学人民医院和荆州中心医院重症监护室收治的年龄≥18岁患者为研究对象,收集电子病历资料,包括:(1)一般资料:性别、年龄、婚姻、吸烟史、饮酒史、住院天数和病因;(2)收集患者入科后24 h内实验室检查指标,包括白细胞计数、中性粒细胞计数、淋巴细胞计数、单核细胞计数、血小板计数,分别计算NLR、PLR和MLR。所有指标均取24 h内最低值;(3)记录入科时SOFA(sequential organ failure assessment)评分。
排除标准:(1)个人基本信息或病历数据不完整;(2)ICU住院时间<12 h或>60 d;(3)意外死亡,例如高处坠落,车祸伤,自杀自伤自残等;(4)围手术期患者。
本研究经武汉大学人民医院临床研究伦理委员会批准(WDRY2023-K067),完全符合赫尔辛基宣言。共纳入4 047例入住ICU的危重患者,根据排除标准排除275例,最终纳入3 772例患者进行研究。ICU院内死亡及出院后28 d的全因死亡通常被认为是危重患者最合适和最有意义的终点,并在临床试验中广泛使用[11-13]。因此,住院期间或出院28 d内的死亡用作本研究的主要终点事件。
1.2 空气污染物暴露值根据每位患者的居住地址和入院日期,评估各患者入院前空气污染物暴露(包括PM2.5、PM10、NO2、SO2、O3和CO)的平均水平。空气污染物日均浓度是基于地面观测、多源遥感卫星、气象变量、土地覆盖、污染排放、人口和地形地表数据,通过两阶段机器学习模型,结合合成少数过采样技术和基于树模型的间隙填充方法,以1 km的空间分辨率进行估算[14]。最终计算患者住院时间前2个月平均浓度作为此次研究中空气污染物暴露的平均水平。
1.3 统计学方法本研究所有统计分析均使用R(版本号4.3.0)。均以双侧P < 0.05为有统计学意义。本研究调查地区空气污染物浓度近似服从正态分布,血细胞比值[中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)、单核细胞/淋巴细胞比值(MLR)]由于其偏态分布,进行对数转换,以均数±标准差(x±s)进行统计描述。
患者的特征以分类变量的数量(n)和百分比(%)、计量资料用均数±标准差(x±s)。χ2检验(针对分类变量)和Z检验(针对连续变量)检验患者特征的显著性。广义线性回归模型用于估计单个空气污染物暴露与死亡风险之间的关联,以比值比(OR)和95%置信区间(CI)表示。然后以单个空气污染物暴露为亚组,检验患者的疾病特征(年龄、性别、吸烟、饮酒、住院天数和SOFA评分)对患者28 d死亡这一主要结局指标的效应量和可信区间。通过Z检验检查亚组间差异的统计学意义。模型调整的协变量包括性别(男性、女性)、年龄(< 65岁、≥65岁)、婚姻状况(已婚、未婚)、吸烟(是否吸烟)、饮酒(是否饮酒)、住院天数(≤6 d、>6 d, 按照中位数区分),SOFA评分(≤3分、>3分, 按照中位数区分)。
使用R软件的中介包(Bruce R)进行中介分析。直接效应代表空气污染物暴露和死亡风险之间的关联;间接效应即评估中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)、单核细胞/淋巴细胞比值(MLR)在空气污染物暴露与死亡风险关联中是否是中介变量。采用偏差校正Bootstrap方法进行自助抽样以检验中介效应的可靠性,Bootstrap次数设置为1 000次,如果Bootstrap 95%的置信区间不包含0,则说明参数估计值显著;反之,则说明参数估计值不显著。中介比例表示间接效应占总效用的百分比。
2 结果 2.1 入组患者基本情况所有患者临床基线特征见表 1。在纳入研究的3 772例患者中约55.5%的患者(2 092例)年龄≥ 65岁,64.7%(2 440例)为男性,92.2%(3 479例)已婚。总病死率为40.0%(1 509/3 772)。约28.6% 的患者(1 078例)有长期吸烟习惯,19.4%(732例)有大量饮酒习惯,约48.2%的患者(1 818例)SOFA评分>3分。
| 变量 | 总体(n=3 772) | 存活组(n=2 263) | 死亡组(n=1 509) | P值a |
| 年龄[岁, n (%)] | <0.001 | |||
| <65 | 1 680 (44.5) | 1 086 (48.0) | 594 (39.4) | |
| ≥65 | 2 092 (55.5) | 1 177 (52.0) | 915 (60.6) | |
| 性别[n (%)] | 0.73 | |||
| 男 | 2 440 (64.7) | 1 459 (64.5) | 981 (65.0) | |
| 女 | 1 332 (35.3) | 804 (35.5) | 528 (35.0) | |
| 婚姻[n (%)] | 0.73 | |||
| 未婚 | 293 (7.8) | 173 (7.6) | 120 (8.0) | |
| 已婚 | 3 479 (92.2) | 2 090 (92.4) | 1 389 (92.0) | |
| 吸烟[n (%)] | 0.29 | |||
| 是 | 1 078 (28.6) | 661 (29.2) | 417 (27.6) | |
| 否 | 2 694 (71.4) | 1 602 (70.8) | 1 092 (72.4) | |
| 饮酒[n (%)] | 0.92 | |||
| 是 | 732 (19.4) | 438 (19.4) | 294 (19.5) | |
| 否 | 3 040 (80.6) | 1 825 (80.6) | 1 215 (80.5) | |
| 住院天数[d, n (%)] | <0.001 | |||
| <6 | 1 870 (49.6) | 964 (42.6) | 906 (60.0) | |
| ≥6 | 1 902 (50.4) | 1 299 (57.4) | 603 (40.0) | |
| SOFA评分[n (%)] | <0.001 | |||
| ≤3 | 1 954(51.8) | 1 467(64.8) | 487(32.3) | |
| >3 | 1 818(48.2) | 798(35.2) | 1 020(67.7) | |
| NLR(x±s) | 0.9±0.4 | 0.8±0.4 | 1.0±0.5 | <0.001 |
| PLR(x±s) | 2.2±0.4 | 2.2±0.4 | 2.2±0.4 | 0.079 |
| MLR(x±s) | -0.2±0.4 | -0.3±0.3 | -0.2±0.4 | <0.001 |
| 空气污染物(μg/m3, x±s) | ||||
| PM2.5 | 40.5±17.6 | 39.9±17.4 | 41.4±17.8 | 0.015 |
| PM10 | 65.1±20.5 | 64.6±20.5 | 65.7±20.4 | 0.050 |
| NO2 | 31.6±15.2 | 31.1±14.9 | 32.5±15.7 | 0.013 |
| SO2 | 8.6±2.0 | 8.6±1.9 | 8.8±2.1 | 0.009 |
| O3 | 59.9±18.4 | 60.5±18.2 | 59.0±18.8 | 0.024 |
| CO | 0.9±0.2 | 0.8±0.1 | 0.9±0.2 | 0.007 |
| 注:CO:一氧化碳;NO2:二氧化氮;O3:臭氧;PM2.5:空气动力学直径 < 2.5 μm颗粒物;PM10:空气动力学直径 < 10 μm的颗粒物;SO2:二氧化硫; NLR: 中性粒细胞/淋巴细胞比值; PLR: 血小板/淋巴细胞比值; MLR: 单核细胞/淋巴细胞比值;本研究调查地区空气污染物浓度近似服从正态分布;入组患者血细胞比值[中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)、单核细胞/淋巴细胞比值(MLR)]由于其偏态分布,进行对数转换以均数±标准差(x±s)进行统计描述;aP值:通过分类变量χ2检验或连续变量Z检验检查存活组和死亡组之间每个变量差异的统计学意义 | ||||
根据每位患者的常年居住地址(图 1)和入院日期,以患者住院时间前2个月平均浓度作为此次研究中空气污染物暴露的平均水平。它们分别是PM2.5(40.5±17.6)μg/m3,PM10 (65.1±20.5)μg/m3,NO2 (31.6±15.2)μg/m3、SO2 (8.6±2.0)μg/m3、O3 (59.9±18.4)μg/m3和CO (0.9±0.2)μg/m3。死亡组PM2.5、NO2、SO2和CO平均暴露水平高于存活组[PM2.5:(41.4±17.8)μg/m3 vs.(39.9±17.4)μg/m3,P=0.015;NO2:(32.5±15.7)μg/m3 vs.(31.1±14.9)μg/m3,P=0.013;SO2:(8.8±2.1)μg/m3 vs.(8.6±1.9)μg/m3,P=0.009,CO:(0.9±0.2)μg/m3 vs.(0.8±0.1)μg/m3,P=0.007]。死亡组O3暴露水平低于存活组[(59.0±18.8)μg/m3 vs. (60.5±18.2)μg/m3,P=0.024]。PM10的暴露水平在存活组与死亡组之间差异无统计学意义[PM10:(64.6±20.5)μg/m3 vs. (65.7±20.4)μg/m3, P=0.050]。
|
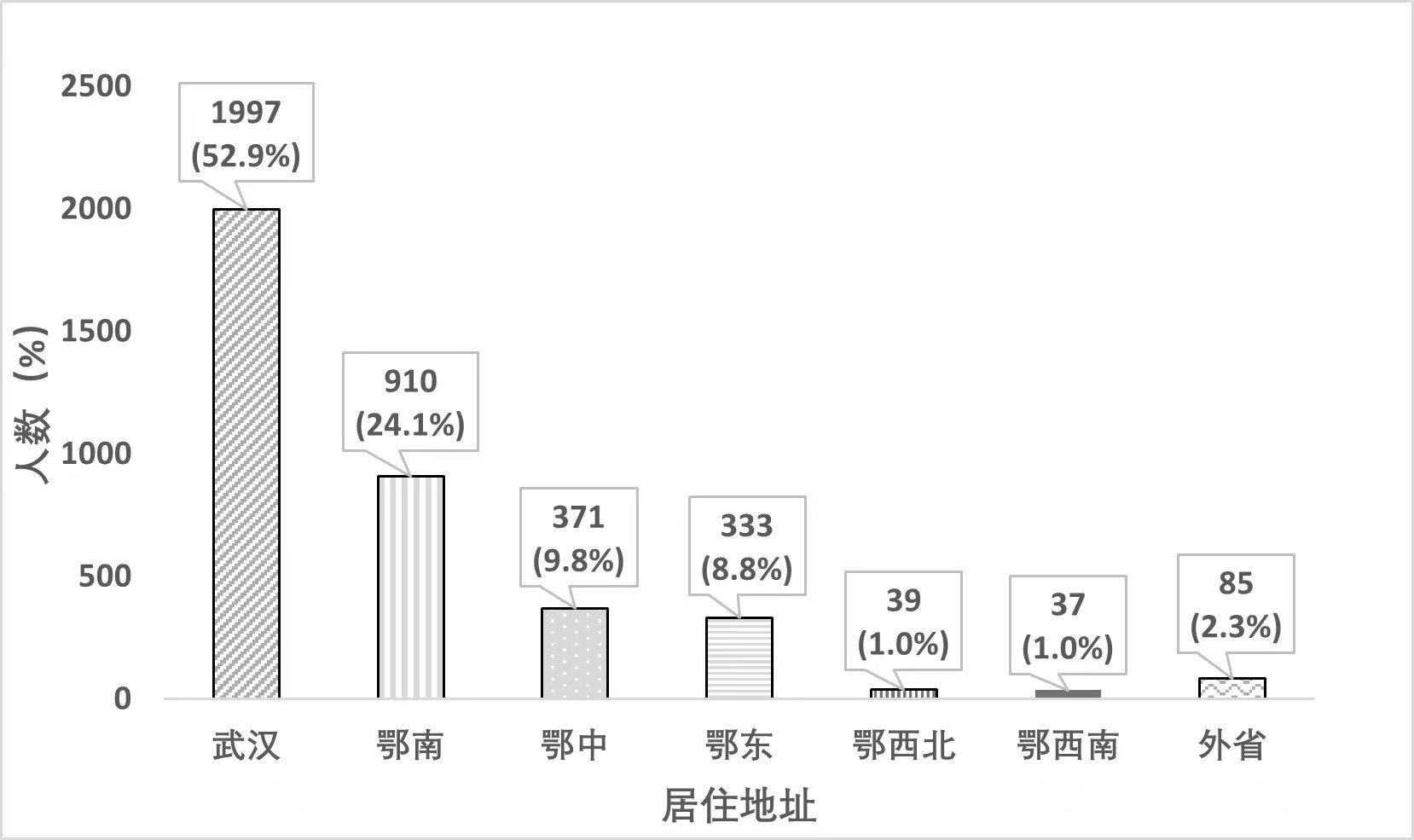
| 鄂南主要包括荆州、咸宁地区;鄂中,即江汉平原,主要包括仙桃、潜江、孝感、荆门、随州、天门等地区;鄂东主要包括黄石、黄冈等地区;鄂西北主要指襄阳、十堰等地区;鄂西南主要指恩施、宜昌等地区 图 1 入组患者的居住地址分布情况 Fig 1 Distribution of residential addresses of enrolled patients |
|
|
存活组与死亡组比较,在年龄,平均住院天数,SOFA评分方面差异有统计学意义(P < 0.001)。与死亡组比较,存活组年龄<65岁者居多,住院天数>6 d较多,SOFA评分≤3分居多。死亡组NLR和MLR的对数转换值显著高于存活组[NLR:(1.0±0.5)vs.(0.8±0.4),P < 0.001;MLR:(-0.2±0.4)vs.(-0.3±0.3),P< 0.001]。
2.2 空气污染物暴露与ICU患者28 d全因死亡之间的关联基于空气污染物与死亡风险之间的关联,进行多变量广义线性回归分析,结果如表 2所示。在未校正的模型中,PM2.5(OR=1.005,95%CI=1.001~1.009), NO2(OR=1.006,95%CI=1.002~1.010),SO2(OR=1.051, 95%CI=1.017~1.086)、O3(OR=0.995,95%CI=0.992~0.999)和CO(OR=1.868,95%CI=1.229~2.838)的暴露与ICU患者28 d全因死亡风险相关联。
| 变量 | 初始模型 | 模型1 | 模型2 | 模型3 |
| PM2.5 | 1.005b (1.001~1.009) | 1.004a (1.001~1.008) | 1.005a (0.999~1.008) | 1.004a (1.000~1.008) |
| PM10 | 1.003(0.999~1.006) | 1.002 (0.999~1.005) | 1.002 (0.999~1.005) | 1.003(0.999~1.006) |
| NO2 | 1.006b (1.002~1.010) | 1.004 (0.999~1.009) | 1.004 (0.999~1.009) | 1.011c (1.006~1.015) |
| SO2 | 1.051b (1.017~1.086) | 1.049b (1.015~1.085) | 1.050b(1.016~1.086) | 1.030(0.994~1.067) |
| O3 | 0.995a (0.992~0.999) | 0.996a (0.993~0.999) | 0.996a (0.993~1.000) | 0.995b(0.991~0.999) |
| CO | 1.868b (1.229~2.838) | 1.605a (1.049~2.454) | 1.641a (1.072~2.511) | 2.257c (1.428~3.568) |
| 注:模型1:根据年龄和性别进行调整;模型2:在模型1的基础上额外调整婚姻、吸烟和饮酒;模型3:在模型2的基础上额外调整住院天数和SOFA评分。aP< 0.05; bP< 0.005; cP< 0.001 | ||||
在对所有协变量,包括年龄、性别、婚姻、吸烟、饮酒、住院天数和SOFA评分进行调整后,结果提示空气污染物(PM2.5、NO2、CO)与死亡风险之间具有显著正向关联。具体而言,每增加1 μg/m3 PM2.5,ICU患者的28 d全因死亡风险会增加0.4%(OR=1.004,95%CI =1.000~1.008);每增加1 μg/m3 NO2,ICU患者的28 d全因死亡风险就会增加1.1%(OR=1.011,95%CI=1.006~1.015);每增加1μg/m3 CO,ICU患者的28 d全因死亡风险增加125.7%(OR=2.257,95%CI= 1.428~3.568)。O3的暴露与ICU患者28 d全因死亡风险之间具有显著负向关联(OR=0.995,95%CI=0.991~0.999)。
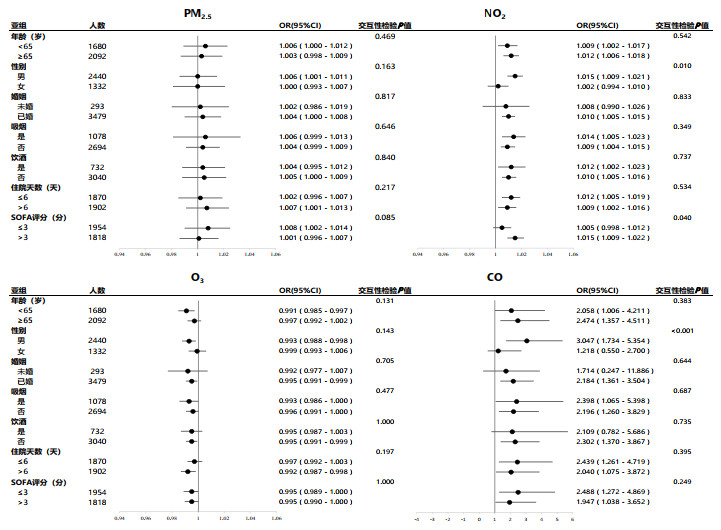
2.3 空气污染物暴露与ICU患者28 d全因死亡风险关联的亚组分析在明确了空气污染物PM2.5、NO2、CO暴露与ICU患者28 d全因死亡风险显著正向关联,O3暴露与死亡风险显著负向关联之后,笔者进行了亚组分析。图 2显示了患者的疾病特征(年龄、性别、吸烟、饮酒、住院天数和SOFA评分)对患者28 d死亡这一主要结局指标的效应量和可信区间。
|
| OR:空气污染物浓度每增加1 μg/m3,死亡风险增加的比值比;CI:置信区间;森林图中的横向线段>1是ICU患者28 d死亡的危险因素,<1是ICU患者28 d死亡的保护因素 图 2 PM2.5、NO2、O3和CO暴露与ICU患者28 d全因死亡风险关联亚组分析 Fig 2 Subgroup analysis of the association between air pollutant exposure (PM2.5, NO2, O3, and CO)and 28-day all-cause mortality risk in ICU patients |
|
|
研究结果显示,在NO2暴露组(OR=1.015,95%CI=1.009~1.021,交互性检验P=0.010)和CO暴露组(OR=3.047,95%CI=1.734~5.354,交互性检验P<0.001),男性是ICU患者28 d死亡的危险因素。另外,SOFA评分>3是NO2(OR=1.015,95%CI=1.009~1.022,交互性检验P=0.040)暴露与ICU患者28 d全因死亡的危险因素。
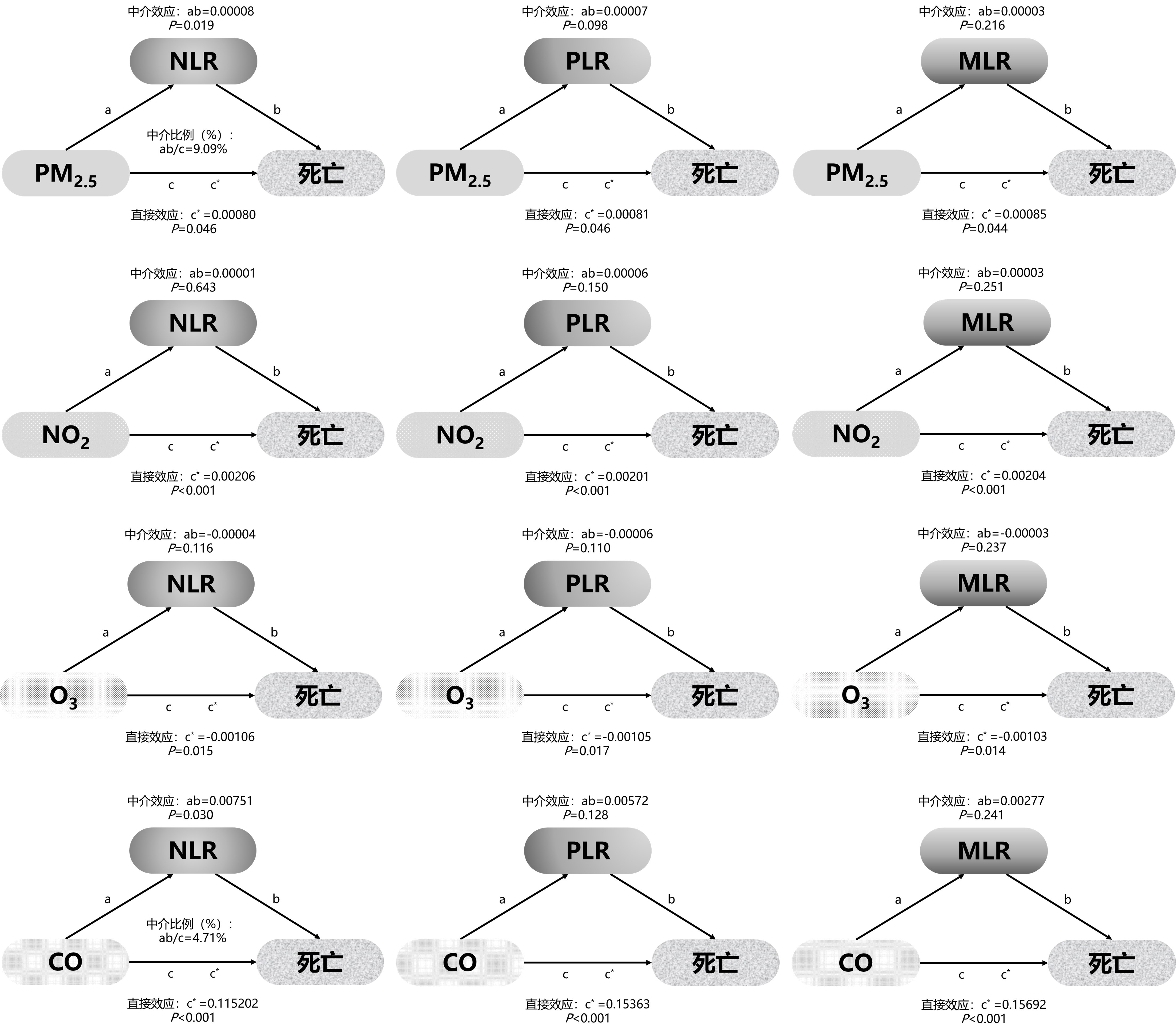
2.4 血细胞比值的中介效应分析图 3显示了中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)、单核细胞/淋巴细胞比值(MLR)在空气污染物(PM2.5、NO2、O3、CO)暴露与ICU患者28 d全因死亡风险之间关联的中介效应。研究结果提示,PM2.5、NO2、O3和CO对ICU患者28 d全因死亡风险的直接效应均显著。NLR显著介导了PM2.5、CO暴露与ICU患者28 d死亡风险的关联,分别解释了9.09%、4.71%的相关性。
|
| 图 3 中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)、单核细胞/淋巴细胞比值(MLR)在空气污染物暴露与ICU患者28 d全因死亡关联中的中介分析路径图 Fig 3 Mediation analysis pathway diagram illustrating the role of neutrophil/ lymphocyte ratio (NLR), platelet/lymphocyte ratio (PLR), and monocyte/lymphocyte ratio (MLR) in the association between air pollutant exposure and 28-day all-cause mortality in ICU patients |
|
|
本研究结果表明,(1)校正年龄、性别、吸烟史、饮酒史、住院天数、SOFA评分等混杂因素后,空气污染物(PM2.5、NO2和CO)的暴露与ICU患者28 d全因死亡风险显著正相关,O3的暴露与ICU患者28 d全因死亡风险呈负相关。(2)此外,男性是NO2和CO暴露与ICU患者28 d全因死亡的危险因素,SOFA评分>3是NO2暴露与ICU患者28 d全因死亡的危险因素。(3)中介分析显示,中性粒细胞/淋巴细胞比值(NLR)介导了PM2.5、CO暴露与ICU患者28 d死亡风险的关联,分别解释了9.09%、4.27%的相关性。
依据世界卫生组织修订并发布的《全球空气质量指导值(2021)》文件,人群暴露于PM2.5、PM10、O3、NO2、SO2、CO等六种主要空气污染物导致健康风险的最低浓度值AQG分别是PM2.5 (15 μg/m3),PM10(45 μg/m3),O3(100 μg/m3),NO2(25 μg/m3),SO2(40 μg/m3)、CO(4 mg/m3)[15]。根据本课题组的数据统计,湖北省2018—2022年空气污染物暴露的平均水平分别是PM2.5 (40.5±17.6)μg/m3,PM10 (65.1±20.5)μg/m3,O3 (59.9±18.4)μg/m3,NO2(31.6±15.2)μg/m3、SO2 (8.6±2.0)μg/m3和CO (0.9±0.2)μg/m3。近十年来,我国政府通过开展《大气污染防治行动计划》(2012-2017年)和《打赢蓝天保卫战三年行动计划》(2018-2020年)等一系列大气污染防治措施,空气质量得到了显著改善[16-18], 但是湖北省PM2.5、PM10、NO2暴露的平均水平仍然显著高于世界卫生组织制定的最低标准。
目前有关空气污染物暴露与全因死亡风险关联的研究主要集中在PM2.5,越来越多的证据提示研究者需要评估其他空气污染物,包括PM10、NO2、SO2、O3、CO与死亡风险之间的关联[3,19-20]。本课题组最终纳入3 772例入住ICU并长期居住在湖北省各个地市县的患者,评估患者住院前2个月6种主要空气污染物暴露的平均水平,调查PM2.5、PM10、NO2、SO2、O3和CO暴露与ICU患者28 d全因死亡之间的关联。本研究结果显示空气污染物PM2.5、NO2和CO浓度增加会导致ICU患者28 d全因病死率上升,这一研究结果与国内外发表的空气污染致总死亡负担的大型研究队列总体是一致的[21-23]。一项基于近9万名≥40岁中国男性的前瞻性队列研究发现,PM2.5浓度每增加10 μg/m3,全因病死率风险增加9%[21]。来自西方国家1974—2009年工业迅速发展年代的大型研究队列数据提示,PM2.5每增加10 μg/m3,全因病死率增加14%[22]。
另外,笔者在单个空气污染物模型分析中观察到O3与ICU患者死亡风险之间呈现负向相关。这一结果在既往已经发表的研究中是有争议的,O3暴露在单个空气污染物模型、双污染物模型中表现出不同的效应[24-25]。可能的解释是,空气中NO、NO2与臭氧O3可相互转化,浓度呈负向关联[26-27]。O3与PM10的浓度也是负相关,因为颗粒物PM10可以吸收太阳辐射,减少O3的生成[28]。因此,O3的效应受其他空气污染物的影响。
值得一提的是,本研究结果显示,在PM2.5当前暴露平均值(40.5±17.6)μg/m3,NO2当前暴露平均值(31.6±15.2)μg/m3显著劣于世卫组织制定的空气质量标准时,可以观察到PM2.5、NO2暴露水平与ICU患者28 d全因死亡的关联;CO (0.9±0.2)μg/m3当前暴露平均值显著优于世卫组织制定的空气质量标准时,仍然可以观察到CO暴露水平与ICU患者28 d全因死亡风险的关联。说明: (1)低水平的空气污染物暴露也与ICU患者28 d全因死亡风险之间呈现正向关联。近期,多中心研究“低水平空气污染的影响: 欧洲研究”(ELAPSE)分析了长期暴露于低污染水平PM2.5、NO2、CO和暖季O3与非意外病死率(包括心血管、呼吸系统和肺癌)之间的关系[25]。所有证据提示在低于欧盟、美国环境保护署和世卫组织空气质量标准的浓度下,大多数空气污染物(除O3之外)仍然呈现浓度-反应函数关系,斜率最陡的在低暴露水平而不是高暴露水平,提示空气污染物暴露可能没有最低阈值[25]。(2)本研究人群是入住ICU的危重患者。他们的特点是高龄,基础疾病较多,有多个器官功能不全和免疫功能低下,对外界危险因素的抵抗能力极为薄弱。关于空气污染与这类脆弱人群的结局极少被研究。有理由估计空气污染物暴露对危重患者死亡风险的影响是不容小觑的。因此,未来需要在更大样本的危重患者中进行更细致的研究。
本研究进一步探讨了中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)、单核细胞/淋巴细胞比值(MLR)在空气污染物暴露与ICU患者死亡风险关联中的中介效应。目前的研究只关注空气污染物对中性粒细胞、血小板或淋巴细胞的单独影响,很少有研究关注空气污染物与PLR、NLR、MLR这些血细胞比值的关联。本研究结果提示PM2.5、CO暴露与NLR呈正相关,提示PM2.5、CO高水平暴露与中性粒细胞计数增加和(或)淋巴计数相对减少呈正相关。NLR介导了PM2.5、CO暴露与危重患者28 d死亡风险的关联,分别解释了9.09%、4.71%的相关性。这些研究线索促使我们提出血细胞比值在空气污染物与ICU患者死亡风险之间的关联中可能存在中介效应。
本研究存在一定局限性。首先,空气污染包括室内和室外空气污染。室内空气污染主要来源于燃料燃烧和建筑材料释放等; 室外空气污染主要来源于工业生产过程和交通运输过程的排放,因此室外和室内空气污染物的主要组分和浓度是不一样的,在我国伤残调整寿命年(DALYs)中的危险因素排序也有所区别(分别是第4位,第5位),但本研究并没有严格区分室内空气污染和室外空气污染[16]。其次,空气污染物是各种固体颗粒物和气体污染物的混合物。6种主要的空气污染物通常是共存的,并且它们之间可能存在相关性[26-27]。因此,将六种主要空气污染物作为一个整体来考虑更为合理。目前本研究集中在单个污染物导致的死亡风险研究,后续笔者将尝试更先进的统计模型,如加权分位数和(WQS)或贝叶斯核机(BKMR)回归模型,以探讨多种空气污染物的联合作用[27]。
综上所述,本研究证实PM2.5、NO2和CO与ICU患者28 d全因死亡风险呈显著正相关,而O3与死亡风险呈负相关。男性是NO2和CO暴露与ICU患者全因死亡的危险因素,SOFA评分>3分是NO2暴露与ICU患者全因死亡的危险因素。中性粒细胞/淋巴细胞比值(NLR)在PM2.5、CO暴露与ICU患者死亡风险的关联中发挥中介效应。值得关注的是即使低水平的空气污染仍然与ICU患者的死亡风险有正向关联。本研究为持续降低大气污染物水平,保护危重患者等脆弱群体的健康带来有益的证据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张聪:临床数据收集整理、论文撰写;李辰:环境数据收集整理、统计学分析;贾鹏、吕菁君:研究设计、论文修改。吕菁君和金平对每个医疗中心临床数据的真实性和有效性负责。所有作者都对文章做出了贡献,并同意提交的版本
| [1] | Cohen AJ, Brauer M, Burnett R, et al. Estimates and 25-year trends of the global burden of disease attributable to ambient air pollution: an analysis of data from the Global Burden of Diseases Study 2015[J]. Lancet, 2017, 389(10082): 1907-1918. DOI:10.1016/S0140-6736(17)30505-6 |
| [2] | Sin DD, Doiron D, Agusti A, et al. Air pollution and COPD: gold 2023 committee report[J]. Eur Respir J, 2023, 61(5): 2202469. DOI:10.1183/13993003.02469-2022 |
| [3] | Groves CP, Butland BK, Atkinson RW, et al. Intensive care admissions and outcomes associated with short-term exposure to ambient air pollution: a time series analysis[J]. Intensive Care Med, 2020, 46(6): 1213-1221. DOI:10.1007/s00134-020-06052-z |
| [4] | Rajagopalan S, Al-Kindi SG, Brook RD. Air pollution and cardiovascular disease: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2018, 72(17): 2054-2070. DOI:10.1016/j.jacc.2018.07.099 |
| [5] | Liu C, Chen RJ, Sera F, et al. Ambient particulate air pollution and daily mortality in 652 cities[J]. N Engl J Med, 2019, 381(8): 705-715. DOI:10.1056/NEJMoa1817364 |
| [6] | Chen C, Warrington JA, Dominici F, et al. Temporal variation in association between short-term exposure to fine particulate matter and hospitalisations in older adults in the USA: a long-term time-series analysis of the US Medicare dataset[J]. Lancet Planet Health, 2021, 5(8): e534-e541. DOI:10.1016/S2542-5196(21)00168-6 |
| [7] | Mills IC, Atkinson RW, Anderson HR, et al. Distinguishing the associations between daily mortality and hospital admissions and nitrogen dioxide from those of particulate matter: a systematic review and meta-analysis[J]. BMJ Open, 2016, 6(7): e010751. DOI:10.1136/bmjopen-2015-010751 |
| [8] | Qiu WH, He H, Wang B, et al. Short-term impacts of air pollution on the platelet-lymphocyte ratio and neutrophil-lymphocyte ratio among urban adults in China[J]. J Environ Sci, 2023, 125: 101-111. DOI:10.1016/j.jes.2021.10.022 |
| [9] | 宋小静, 高伟波, 朱继红. 中性粒/淋巴细胞比率、血小板/淋巴细胞比率联合BISAP评分对于重症高三酰甘油血症性胰腺炎早期预测分析[J]. 中华急诊医学杂志, 2022, 31(9): 1193-1199. DOI:10.3760/cma.j.issn.1671-0282.2022.09.007 |
| [10] | 陈晨松, 方俊杰, 陈乾峰, 等. 早期血小板计数动态变化对脓毒症患者预后的预测价值[J]. 中华急诊医学杂志, 2022, 31(5): 665-671. DOI:10.3760/cma.j.issn.1671-0282.2022.05.017 |
| [11] | Lin J, Ke L, Li W. Trajectories of protein intake and 28-day mortality in critically ill patients: secondary analysis of A cluster-randomized controlled trial[J]. Clin Nutr ESPEN, 2023, 54: 484. DOI:10.1016/j.clnesp.2022.09.084 |
| [12] | Pardo E, Lescot T, Preiser JC, et al. Association between early nutrition support and 28-day mortality in critically ill patients: the FRANS prospective nutrition cohort study[J]. Crit Care, 2023, 27(1): 7. DOI:10.1186/s13054-022-04298-1 |
| [13] | Mukhopadhyay A, Henry J, Ong V, et al. Association of modified NUTRIC score with 28-day mortality in critically ill patients[J]. Clin Nutr, 2017, 36(4): 1143-1148. DOI:10.1016/j.clnu.2016.08.004 |
| [14] | Geng GN, Xiao QY, Liu SG, et al. Tracking air pollution in China: near real-time PM2.5 retrievals from multisource data fusion[J]. Environ Sci Technol, 2021, 55(17): 12106-12115. DOI:10.1021/acs.est.1c01863 |
| [15] | WHO. WHO global air quality guidelines[EB/OL]. (2021-09-22)[2023-02-15]. https://www.who.int/news-room/questions-and-answers/item/who-global-air-quality-guidelines. |
| [16] | 余林玲, 龙品品, 陈卫红, 等. 我国室内外空气污染所致主要慢性疾病的死亡和疾病负担研究进展[J]. 中华流行病学杂志, 2023, 44(5): 699-704. DOI:10.3760/cma.j.cn112338-20230215-00078 |
| [17] | Yin P, Brauer M, Cohen AJ, et al. The effect of air pollution on deaths, disease burden, and life expectancy across China and its provinces, 1990-2017: an analysis for the Global Burden of Disease Study 2017[J]. Lancet Planet Health, 2020, 4(9): e386-e398. DOI:10.1016/S2542-5196(20)30161-3 |
| [18] | Liu J, Han YQ, Tang X, et al. Estimating adult mortality attributable to PM2.5 exposure in China with assimilated PM2.5 concentrations based on a ground monitoring network[J]. Sci Total Environ, 2016, 568: 1253-1262. DOI:10.1016/j.scitotenv.2016.05.165 |
| [19] | Yang SJ, Liang X, Dou QY, et al. Ethnic disparities in the association between ambient air pollution and risk for cardiometabolic abnormalities in China[J]. Sci Total Environ, 2022, 838(Pt 1): 155940. DOI:10.1016/j.scitotenv.2022.155940 |
| [20] | Zanobetti A, Schwartz J. The effect of fine and coarse particulate air pollution on mortality: a national analysis[J]. Environ Health Perspect, 2009, 117(6): 898-903. DOI:10.1289/ehp.0800108 |
| [21] | Yin P, Brauer M, Cohen A, et al. Long-term fine particulate matter exposure and nonaccidental and cause-specific mortality in a large national cohort of Chinese men[J]. Environ Health Perspect, 2017, 125(11): 117002. DOI:10.1289/EHP1673 |
| [22] | Lepeule J, Laden F, Dockery D, et al. Chronic exposure to fine particles and mortality: an extended follow-up of the Harvard Six Cities study from 1974 to 2009[J]. Environ Health Perspect, 2012, 120(7): 965-970. DOI:10.1289/ehp.1104660 |
| [23] | Beelen R, Raaschou-Nielsen O, Stafoggia M, et al. Effects of long-term exposure to air pollution on natural-cause mortality: an analysis of 22 European cohorts within the multicentre ESCAPE project[J]. Lancet, 2014, 383(9919): 785-795. DOI:10.1016/S0140-6736(13)62158-3 |
| [24] | Liu C, Chen RJ, Sera F, et al. Interactive effects of ambient fine particulate matter and ozone on daily mortality in 372 cities: two stage time series analysis[J]. BMJ, 2023, 383: e075203. DOI:10.1136/bmj-2023-075203 |
| [25] | Stafoggia M, Oftedal B, Chen J, et al. Long-term exposure to low ambient air pollution concentrations and mortality among 28 million people: results from seven large European cohorts within the ELAPSE project[J]. Lancet Planet Health, 2022, 6(1): e9-e18. DOI:10.1016/S2542-5196(21)00277-1 |
| [26] | Fu YW, Zhang WL, Li Y, et al. Association and interaction of O3 and NO2 with emergency room visits for respiratory diseases in Beijing, China: a time-series study[J]. BMC Public Health, 2022, 22(1): 2265. DOI:10.1186/s12889-022-14473-2 |
| [27] | Zhang JJ, Wei YJ, Fang ZF. Ozone pollution: a major health hazard worldwide[J]. Front Immunol, 2019, 10: 2518. DOI:10.3389/fimmu.2019.02518 |
| [28] | Yu LL, Liu W, Wang X, et al. A review of practical statistical methods used in epidemiological studies to estimate the health effects of multi-pollutant mixture[J]. Environ Pollut, 2022, 306: 119356. DOI:10.1016/j.envpol.2022.119356 |
 2024, Vol. 33
2024, Vol. 33




