近年来,导管相关性血流感染(catheter-related blood stream infection, CRBSI)的发生率有所下降,但仍然较高,尤其是ICU患者的发病率和死亡率最高[1-2]。CRBSI患者缺乏特征性的临床表现,一般以发热为首要表现,插管部位的红肿痛及化脓表现有较高的特异性,其他临床表现包括血流动力学的不稳定、导管功能障碍以及突发脓毒血症等[3]。患者一旦发生CRBSI,不但延长住院时间,增加医疗费用,同时也增加了临床治疗难度,从而对患者的预后转归产生不利影响[4-5]。因此,近年来如何降低CRBSI的感染率,是临床医生积极研究的课题[6-9]。然而,对于急诊失血性休克患者发生CRBSI的研究报道较少,急诊失血性休克患者病情紧急,没有足够的时间对其做全面病情评估,置管者忙于抢救患者而疏于严格的无菌操作规范,急性失血相关穿刺体征不明显(穿刺者需多次穿刺才能成功,穿刺处损伤较重),同时没有时间对患者进行有效的备皮(例如在腹股沟处),这些都有可能增加失血性休克深静脉置管患者导管相关性感染的发生率。另外,急诊失血性休克患者导管相关性感染病原菌特点也值得临床关注。本研究选取在本院确诊急诊失血性休克且行中心静脉置管的患者,对导致患者发生导管相关性感染的危险因素及致病菌情况进行分析,旨在明确急诊失血性休克中心静脉置管患者发生CRBSI的危险因素及病原菌分布情况,为其治疗及预防提供充足、可靠的依据。
1 资料与方法 1.1 研究对象选取2016年6月至2022年6月在上海第一人民医院就诊的急诊失血性休克患者(急诊创伤和急性消化道出血),均在本院抢救室行中心静脉置管,且符合纳入标准。
失血性休克诊断标准:(1)收缩压 < 90 mmHg(1 mmHg=0.133 kPa)或者较基础水平下降30%以上或者脉压 < 30 mmHg;(2)有意识障碍,如烦躁、表情淡漠或者意识模糊、昏迷;(3)四肢湿冷或者皮肤花斑、黏膜苍白或发绀;(4)脉搏 > 100次/min或者不能触及。凡符合第一以及后三项中的任何一项者即可诊断失血性休克。
CRBSI诊断判定标准[10]:外周血和导管尖端分离出同样致病菌,且导管尖端培养阳性早于外周血阳性2 h,且患者有感染表现,即可诊断为CRBSI;中心静脉导管拔除后48 h内发热缓解且无任何其他感染源,虽然实验室培养阴性的患者被定义为“疑似”CRBSI。
纳入标准:(1)在本院抢救室行中心静脉置管且符合失血性休克诊断标准的患者;(2)患者的年龄≥20岁;(3)留置导管48 h以上者;(4)同一患者有多次诊断,只选取第一次;(5)临床病历资料齐全的患者。排除标准:(1)合并心、肺、肝、肾等器官器质性病变的患者;(2)行深静脉置管前1个月内使用免疫抑制药或抗菌药物的患者;(3)住院期间死亡、转院或中途放弃治疗的患者;(4)中心静脉导管置管前48 h有发热或寒战等感染症状的患者。
分组方式:根据是否发生CRBSI分为感染组和无感染组。
本研究方案已获上海市第一人民医院伦理委员会批准[院伦快(2023)184号]。
1.2 研究方法通过医院的病案查询系统检索回顾性分析失血性休克临床病例资料(检索关键词:消化道出血/多发伤/失血性休克/骨折),两人负责录入表格,一人负责审核。相关资料的具体内容包括患者的性别、年龄、置管的位置、失血量、休克病因、体质量指数(body mass index, BMI)、急性生理功能和慢性健康情况Ⅱ评分(acute physiology and chronic health evaluation Ⅱ score, APACHE Ⅱ评分)、中心静脉导管留置的时间、是否应用广谱抗生素、是否超声引导下穿刺及相关血液化验指标等方面;病原菌检出和药敏试验结果、抗菌药物使用情况(通过患者病史记录、医嘱单、护理单及检查报告单等获取以上信息,其中失血量根据患者入抢救室时记录的主诉、体格检查特征、血压、心率等进行评估计算)。
所有导管均常规进行细菌培养,同时进行外周血培养。对导管穿刺部位周围皮肤消毒后,拔出导管,用无菌剪刀剪断近端4~5 cm,置于无菌容器中,室温下15 min内送微生物实验室。导管尖端采用半定量培养技术进行培养。用BactecTMFX4血培养仪(美国Becton Dickinso公司)进行血培养,病原鉴定采用phoenix 100全自动细菌鉴定药敏系统(美国Becton Dickinson公司)。
1.3 统计学方法采用SPSS 21.0软件对数据进行分析。计数资料以百分数表示,采用χ2检验,符合方差齐性和正态分布的计量资料以均数±标准差(x±s)表示,采用t检验。采用多因素Logistic回归分析中心静脉CRBSI的危险因素。P < 0.05为差异有统计学意义。
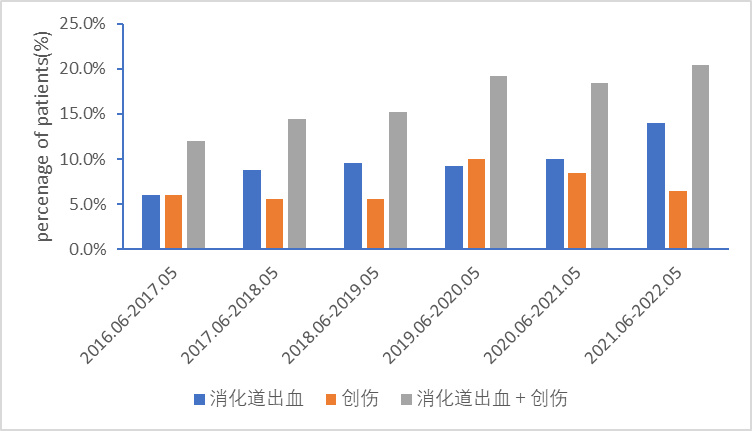
2 结果 2.1 患者的感染率及相关情况2016年6月至2022年6月在本院就诊符合纳入标准的急诊失血性休克患者共249例,仅收集急诊创伤和急性消化道出血患者,由急诊创伤和急性消化道出血引起的急诊失血性休克患者的就诊量是逐年上升的(图 1)。
|
| 图 1 本院急诊失血性休克患者在近六年发生情况 Fig 1 Occurrence of patients with emergency hemorrhagic shock in the hospital in the past six years |
|
|
两组基线资料的比较,感染组患者性别、休克病因、BMI、相关血液化验指标与非感染组比较差异无统计学意义(均P < 0.05);比较两组患者的年龄、中心静脉置管位置、失血量、APACHE Ⅱ评分、中心静脉导管留置的时间、应用广谱抗生素、超声引导下穿刺差异有统计学意义(均P < 0.05)。见表 1。
| 指标 | 感染组(n=54) | 无感染组(n=195) | 统计值 | P值 |
| 性别a | 0.576 | 0.448 | ||
| 男 | 31(57.41) | 123(63.08) | ||
| 女 | 23(42.59) | 72(36.92) | ||
| 年龄(岁)a | 5.974 | 0.015 | ||
| < 60岁 | 36(66.67) | 160(82.05) | ||
| ≥60岁 | 18(33.33) | 35(17.95) | ||
| 休克病因a | 0.482 | 0.488 | ||
| 消化道出血 | 29(53.70) | 115(58.97) | ||
| 创伤 | 25(46.30) | 80(41.03) | ||
| 失血量a | 5.441 | 0.020 | ||
| < 1500mL | 32(59.26) | 147(75.38) | ||
| ≥1500 mL | 22(40.74) | 48(24.62) | ||
| BMI (kg/m2)b | 21.73±3.84 | 22.40±3.65 | 0.896 | 0.462 |
| APACHE Ⅱ评分b | 20.04±3.22 | 15.40±3.01 | 9.566 | < 0.001 |
| 导管留置时间(d)a | 6.709 | 0.009 | ||
| < 14 | 32(59.26) | 150(76.92) | ||
| ≥14 | 22(40.74) | 45(23.08) | ||
| 应用广谱抗生素a | 5.585 | 0.018 | ||
| 是 | 17(31.48) | 33(16.92) | ||
| 否 | 37(68.52) | 162(83.08) | ||
| 置管位置a | 5.035 | 0.025 | ||
| 颈内或锁骨下静脉 | 35(64.81) | 155(79.49) | ||
| 股静脉 | 19(35.19) | 40(20.51) | ||
| 超声引导下穿刺a | 5.860 | 0.015 | ||
| 是 | 7(12.96) | 57(29.23) | ||
| 否 | 47(87.04) | 138(70.77) | ||
| 血红蛋白(g/L)b | 83.9±16.6 | 84.0±14.6 | -0.024 | 0.981 |
| 血小板(×109/L)b | 100.4±21.2 | 104.6±22.8 | -0.787 | 0.434 |
| D-二聚体(μg/mL)b | 1.25±0.61 | 1.10±0.52 | 1.170 | 0.246 |
| 钙离子(mmol/L)b | 1.86±0.28 | 1.90±0.27 | -0.515 | 0.608 |
| 纤维蛋白原(g/L)b | 1.13±0.32 | 1.16±0.34 | -0.462 | 0.646 |
| 注:BMI为体质量指数,APACHE Ⅱ评分为急性生理功能和慢性健康情况Ⅱ评分,a为例(%),b为x±s | ||||
以中心静脉CRBSI为因变量(赋值:感染=1,无感染=0),以年龄、中心静脉置管的位置、失血量、APACHE Ⅱ评分、中心静脉导管留置的时间、应用广谱抗生素、是否超声引导下穿刺为自变量。多因素Logistic回归分析结果发现,年龄、中心静脉置管的位置、APACHE Ⅱ评分、中心静脉导管留置的时间、应用广谱抗生素、超声引导下穿刺为失血性休克患者中心静脉CRBSI的危险因素。见表 2。
| 指标 | β | S.E | Wald χ2 | P值 | OR值 | 95%CI |
| 年龄 | 1.387 | 0.349 | 8.354 | 0.022 | 2.016 | 1.109~12.438 |
| 置管位置 | 1.391 | 0.360 | 9.172 | 0.018 | 2.671 | 1.110~13.544 |
| 中心静脉导管留置时间 | 1.447 | 0.430 | 12.320 | 0.007 | 4.503 | 1.116~19.228 |
| 超声引导下穿刺 | -0.893 | 0.332 | 8.811 | 0.009 | 0.307 | 0.114~0.925 |
| 失血量 | 1.214 | 0.207 | 2.570 | 0.069 | 1.124 | 0.912~3.103 |
| APACHE Ⅱ评分 | 2.844 | 0.410 | 14.875 | 0.000 | 3.066 | 2.150~10.396 |
| 应用广谱抗生素 | 2.302 | 0.495 | 5.032 | 0.024 | 1.542 | 1.304~3.974 |
| 注:APACHE Ⅱ评分为急性生理功能和慢性健康情况Ⅱ评分 | ||||||
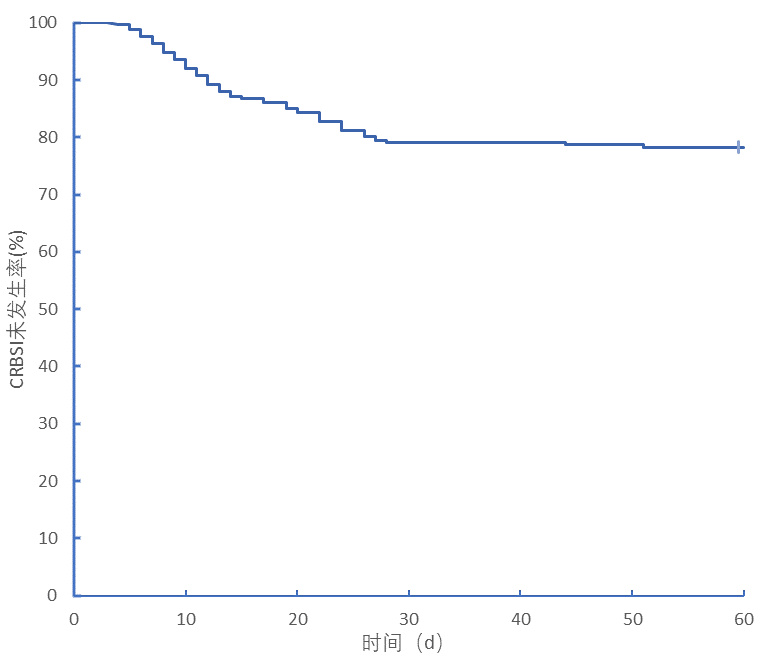
CRBSI患者的Kaplan-Meier生存曲线,中心静脉置入后7 d内发生导管相关血流的感染率为3.6%,14 d的发生导管相关血流的感染率为12.9%,28 d为20.9%(图 2)。
|
| 图 2 CRBSI患者的Kaplan-Meier生存曲线分析 Fig 2 Kaplan-Meier survival curve analysis of CRBSI patients |
|
|
检出病原菌以表皮葡萄球菌最多(占44.4%);其次是大肠埃希菌(占24.1%)及真菌(占11.1%),见表 3。
| 病原菌 | 株数 | 构成比(%) |
| G-杆菌 | ||
| 大肠埃希菌 | 13 | 24.1 |
| 肺炎克雷伯菌 | 4 | 7.4 |
| 其他 | 2 | 3.7 |
| G+球菌 | ||
| 表皮葡萄球菌 | 24 | 44.4 |
| 金黄色葡萄球菌 | 3 | 5.6 |
| 屎肠球菌 | 2 | 3.7 |
| 真菌 | 6 | 11.1 |
革兰阳性球菌对万古霉素的耐药率最低为3.4%,其次是四环素为34.5%,对阿莫西林的耐药率最高100%。革兰阴性杆菌对阿米卡星及头孢曲松的耐药率相对较高,均是94.7%。见表 4、5。
| 抗菌药物 | 株数 | 耐药率(%) |
| 阿莫西林 | 29 | 100.0 |
| 氨苄西林 | 27 | 93.1 |
| 头孢噻肟 | 24 | 82.8 |
| 克林霉素 | 11 | 37.9 |
| 红霉素 | 23 | 79.3 |
| 亚胺培南 | 19 | 65.5 |
| 庆大霉素 | 18 | 62.1 |
| 利福平 | 14 | 48.3 |
| 四环素 | 10 | 34.5 |
| 万古霉素 | 1 | 3.4 |
| 抗菌药物 | 株数 | 耐药率(%) |
| 阿米卡星 | 18 | 94.7 |
| 氨曲南 | 13 | 68.4 |
| 氨苄西林 | 15 | 78.9 |
| 头孢他啶 | 17 | 89.5 |
| 头孢曲松 | 18 | 94.7 |
| 头孢噻肟 | 14 | 73.7 |
| 环丙沙星 | 11 | 57.9 |
| 亚胺培南 | 8 | 42.1 |
| 哌拉西林 | 15 | 78.9 |
| 磺胺甲噁唑/甲氧苄啶 | 13 | 68.4 |
| 妥布霉素 | 10 | 52.2 |
根据患者的病原学检测及药敏结果为患者采用合适的抗菌药物治疗,抗菌药物使用时间为(8.1±1.3)d,所有患者的感染被控制,临床症状消失,细菌培养结果均阴性,最终治愈出院。
3 讨论失血性休克患者病情危急病死率高[11-12],快速诊断及治疗是关键,首先需接受大量、快速的输血、补液,中心静脉置管是必不可少的操作之一,其具有导管弹性好,保留时间长及操作简单等特点,借助超声引导,可以显著提高穿刺成功率并且能够减少相关损伤,已经广泛应用于对休克、心衰、脱水及血容量不足等患者的临床抢救工作中[13]。但深静脉置管技术作为一种有创操作技术,其CRBSI发生率较高[14]。
本研究的入选人群为来本院就诊的失血性休克患者,主要包括消化道出血和创伤性休克患者,病情紧急。由图 1可知,来本院就诊的失血性休克患者近六年总体是逐年上升的,特别是消化道出血患者,虽然这仅仅体现了本院失血性休克的发生情况。本研究中,CRBSI发病54例,感染率约为21.7%,明显高于Bisanti等[15]报道的13%(在ICU中发生CRBSI),一定程度上说明在急诊失血性休克患者的CRBSI发生率更高。多因素Logistic回归分析结果显示,年龄、中心静脉置管的位置、APACHE Ⅱ评分、中心静脉导管留置的时间、应用广谱抗生素、超声引导下穿刺是CRBSI发生的独立危险因素。年龄的增加、更高的APACHE Ⅱ评分所导致的患者抵抗力降低,免疫细胞数量的下降,可能是患者发生静脉置管感染的重要原因[7]。
随着导管留置时间的增加,血液中的血清蛋白以及纤维蛋白等物质极易沉积在导管表面,上述沉积物属于病原菌的理想培养基,发挥保护病原菌被免疫细胞以及抗菌药物杀灭的作用,从而促使大量的病原菌释放入血,最终使感染发生。本研究多因素Logistic回归分析中导管留置时间的OR为4.503,由图 2可知中心静脉置入后7 d内发生导管相关血流的感染率为3.6%,14 d的发生导管相关血流的感染率为12.9%,28 d为20.9%,说明导管相关血流感染多发生于留置导管后7~30 d内。Polderman和Girbes[16]与Pitiriga等[17]的研究也说明了导管留置时间是导管相关感染的独立危险因素,所以在条件允许的情况下应尽早拔出中心静脉导管。
本研究提示,使用抗菌药亦是失血性休克患者发生CRBSI重要的危险因素(OR=1.542),应用广谱抗生素极易导致耐药菌株的产生,继而增加感染的概率。Rinke等[18]研究显示,患者抗菌药物治疗史被确定为CRBSI的危险因素,由于用药时机、药物选择、使用持续时间的不合理性,导致一些呈细菌定植状态的患者可能最终转变为感染状况。美国疾病控制与预防中心和美国医院感染控制实践顾问委员会于2017年6月发布的CRBSI预防控制指南中也明确提出:血管内导管置管前或置管中,不要为了预防导管细菌定植或CRBSI而常规全身预防性使用抗菌药物[10]。
关于超声在中心静脉置管中的作用,有报道认为超声引导中心静脉置管可降低CRBSI的发生率[19-20]。而Khera等[21]认为超声引导中心静脉置管与CRBSI无关。Buetti等[22]认为不当的超声操作会增加导管相关感染的发生率。本研究发现超声引导下的中心静脉置管导管感染率低于非超声引导下置管的发生率。只要严格无菌操作,超声引导可以降低导管血流感染的发生率,可能主要是因为超声下穿刺成功率更高,减少了穿刺次数,减少了组织损伤,从而降低了导管感染的概率。
本研究还发现中心静脉置管位置不同,导管感染概率也不同,颈内静脉或锁骨下静脉通路与股静脉通路相比导管感染发生率低,与Bisanti等[15]及Heidenreich等[23]研究结果类似。而Parienti等[24]研究认为虽然锁骨下静脉通路感染率较低,但是其发生气胸可能性较大,故颈静脉通路在无明显禁忌证的情况下可作为置管的首选部位。
本研究中,54例发生CRBSI的患者送检样本中均培养出致病菌株,其主要致病菌为革兰阳性菌(占53.7%),这与相关研究[25-27]结果类似。此外,药敏结果显示,革兰阳性球菌对万古霉素的敏感度最高,San-Juan等[28]研究认为万古霉素应继续作为革兰阳性导管相关血流感染的首选治疗方法,特别是在对万古霉素敏感性降低的菌株流行率较低的医院中心,同时药敏显示阿莫西林的耐药率最高,其次是氨苄西林,因此在临床根据患者的药敏结果选择抗菌药物。革兰阴性杆菌对亚胺培南的敏感度最高,其次是妥布霉素,但对阿米卡星及头孢曲松的耐药率相对较高,这对指导临床经验性用药有一定的参考价值。
目前的指南建议抗生素治疗至少7~14 d,最近的数据表明,在去除中心静脉导管后,对导管感染的发生,合适的抗生素治疗7 d或更短时间可能与较长的疗程具有相同的有效性[29-30],本研究中抗菌药物使用时间为(8.1±1.3)d,所有患者的感染被控制,临床症状消失,细菌培养结果均阴性。Zhong等[31]认为在CRBSI的情况下,早期中心静脉导管再置入是安全的。对于仍然需要中心静脉导管进行持续治疗的患者,不应推迟更换新的中心静脉导管。
本研究为回顾性分析,有一定局限之处,无法统计穿刺前是否外科洗手、穿刺针数、穿刺者工作年限等。本研究为单中心研究,病例数相对偏少,在一定程度上可能存在部分差异。本团队将来会进一步扩大样本量及进行前瞻性研究,为失血性休克患者预防发生CRBSI提供更加充足可靠的依据。
综上所述,失血性休克深静脉置管患者导管相关性感染的发生率仍然较高,革兰阳性菌为主要致病菌,其与患者的年龄、置管的位置、导管的留置时间、APACHE Ⅱ评分、应用广谱抗生素以及是否在超声引导下穿刺有关。为降低失血性休克深静脉置管患者导管相关性感染的发生率,根据失血性休克患者中心静脉CRBSI的危险因素,制定干预措施,临床工作中医师应加强对失血性休克患者的病情评估,尽量选取颈内静脉或锁骨下静脉进行穿刺,尽可能在超声引导下进行穿刺,尽早拔除留置的深静脉导管,少用或者不用广谱抗生素,应用抗生素时应根据细菌血培养结果合理应用抗生素。
利益冲突 所有作者声明无利益冲突
作者贡献声明 朱建平:负责数据收集、论文设计与撰写;许严新、吴绍宏:参与数据收集、分析及论文的修改;王飞瑶、张伟星:参与论文的设计及数据收集分析;王瑞兰:参与选题与设计、论文指导和修正
| [1] | Verberk JDM, van der Kooi TII, Kampstra NA, et al. Healthcare-associated infections in Dutch hospitals during the COVID-19 pandemic[J]. Antimicrob Resist Infect Control, 2023, 12(1): 2. DOI:10.1186/s13756-022-01201-z |
| [2] | Badia-Cebada L, Peñafiel J, Saliba P, et al. Trends in the epidemiology of catheter-related bloodstream infections; towards a paradigm shift, Spain, 2007 to 2019[J]. Euro Surveill, 2022, 27(19): 2100610. DOI:10.2807/1560-7917.ES.2022.27.19.2100610 |
| [3] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [4] | Nelson RE, Hyun D, Jezek A, et al. Mortality, length of stay, and healthcare costs associated with multidrug-resistant bacterial infections among elderly hospitalized patients in the United States[J]. Clin Infect Dis, 2022, 74(6): 1070-1080. DOI:10.1093/cid/ciab696 |
| [5] | Forrester JD, Maggio PM, Tennakoon L. Cost of health care-associated infections in the United States[J]. J Patient Saf, 2022, 18(2): e477-e479. DOI:10.1097/PTS.0000000000000845 |
| [6] | Eturajulu RC, Ng KH, Tan MP, et al. Quality improvement report: safety program for prevention of central line-associated bloodstream infections[J]. Radiographics, 2022, 42(7): E216-E223. DOI:10.1148/rg.220035 |
| [7] | Rickard CM, Marsh NM, Larsen EN, et al. Effect of infusion set replacement intervals on catheter-related bloodstream infections (RSVP): a randomised, controlled, equivalence (central venous access device)-non-inferiority (peripheral arterial catheter) trial[J]. Lancet, 2021, 397(10283): 1447-1458. DOI:10.1016/S0140-6736(21)00351-2 |
| [8] | Kotwal S, Cass A, Coggan S, et al. Multifaceted intervention to reduce haemodialysis catheter related bloodstream infections: REDUCCTION stepped wedge, cluster randomised trial[J]. BMJ, 2022, 377: e069634. DOI:10.1136/bmj-2021-069634 |
| [9] | Lin MR, Chang PJ, Hsu PC, et al. Comparison of efficacy of 2% chlorhexidine gluconate-alcohol and 10% povidone-iodine-alcohol against catheter-related bloodstream infections and bacterial colonization at central venous catheter insertion sites: a prospective, single-center, open-label, crossover study[J]. J Clin Med, 2022, 11(8): 2242. DOI:10.3390/jcm11082242 |
| [10] | Mermel LA, Allon M, Bouza E, et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2009, 49(1): 1-45. DOI:10.1086/599376 |
| [11] | Gauss T, Richards JE, Tortù C, et al. Association of early norepinephrine administration with 24-hour mortality among patients with blunt trauma and hemorrhagic shock[J]. JAMA Netw Open, 2022, 5(10): e2234258. DOI:10.1001/jamanetworkopen.2022.34258 |
| [12] | 陈翔宇, 刘红升, 向强, 等. 创伤失血性休克中国急诊专家共识(2023)[J]. 中国急救医学, 2023, 43(11): 841-854. DOI:10.3969/j.issn.1002-1949.2023.11.001 |
| [13] | Kirkegaard E, Lind PC, Dolmer H, et al. Supraclavicular ultrasonographic real-time guidance of peripherally inserted central catheters - A feasibility study[J]. Acta Anaesthesiol Scand, 2021, 65(5): 688-694. DOI:10.1111/aas.13782 |
| [14] | Smit JM, Exterkate L, van Tienhoven AJ, et al. Incidence, risk factors, and outcome of suspected central venous catheter-related infections in critically ill covid-19 patients: a multicenter retrospective cohort study[J]. Shock, 2022, 58(5): 358-365. DOI:10.1097/SHK.0000000000001994 |
| [15] | Bisanti A, Giammatteo V, Bello G, et al. Usefulness of differential time to positivity between catheter and peripheral blood cultures for diagnosing catheter-related bloodstream infection: data analysis from routine clinical practice in the intensive care unit[J]. J Crit Care, 2023, 75: 154259. DOI:10.1016/j.jcrc.2023.154259 |
| [16] | Polderman K, Girbes A. Central venous catheter use[J]. Intensive Care Med, 2002, 28(1): 18-28. DOI:10.1007/s00134-001-1156-7 |
| [17] | Pitiriga V, Bakalis J, Kampos E, et al. Duration of central venous catheter placement and central line-associated bloodstream infections after the adoption of prevention bundles: a two-year retrospective study[J]. Antimicrob Resist Infect Control, 2022, 11(1): 96. DOI:10.1186/s13756-022-01131-w |
| [18] | Rinke ML, Heo M, Saiman LS, et al. Pediatric ambulatory central line-associated bloodstream infections[J]. Pediatrics, 2021, 147(1): e20200524. DOI:10.1542/peds.2020-0524 |
| [19] | Timsit JF, Baleine J, Bernard L, et al. Expert consensus-based clinical practice guidelines management of intravascular catheters in the intensive care unit[J]. Ann Intensive Care, 2020, 10(1): 118. DOI:10.1186/s13613-020-00713-4 |
| [20] | 范晓莉, 陈庆丽. 超声引导下PICC置管对肾移植患者DVT形成和导管相关性血流感染的影响[J]. 医学影像学杂志, 2022, 32(12): 2214-2217. |
| [21] | Khera S, Kumar A, Parikh B, et al. Safety and outcome of ultrasound-guided tunneled central venous catheter in children with cancers from low middle-income country: a prospective study[J]. Pediatr Blood Cancer, 2023, 70(1): e30029. DOI:10.1002/pbc.30029 |
| [22] | Buetti N, Mimoz O, Mermel L, et al. Ultrasound guidance and risk for central venous catheter-related infections in the intensive care unit: a post hoc analysis of individual data of 3 multicenter randomized trials[J]. Clin Infect Dis, 2021, 73(5): e1054-e1061. DOI:10.1093/cid/ciaa1817 |
| [23] | Heidenreich D, Hansen E, Kreil S, et al. The insertion site is the main risk factor for central venous catheter-related complications in patients with hematologic malignancies[J]. Am J Hematol, 2022, 97(3): 303-310. DOI:10.1002/ajh.26445 |
| [24] | Parienti JJ, Mongardon N, Mégarbane B, et al. Intravascular complications of central venous catheterization by insertion site[J]. N Engl J Med, 2015, 373(13): 1220-1229. DOI:10.1056/NEJMoa1500964 |
| [25] | Calò F, Retamar P, Pérez-Crespo PMM, et al. Catheter-related bloodstream infections: predictive factors for Gram-negative bacteria aetiology and 30 day mortality in a multicentre prospective cohort[J]. J Antimicrob Chemother, 2020, 75(10): 3056-3061. DOI:10.1093/jac/dkaa262 |
| [26] | San-Juan R, Ruiz-Ruigómez M, Aguado JM. How to manage central venous catheter-related bloodstream infections due to Gram-negative bacilli?[J]. Curr Opin Infect Dis, 2022, 35(6): 583-588. DOI:10.1097/QCO.0000000000000855 |
| [27] | Ripa M, Morata L, Rodríguez-Núñez O, et al. Short-term peripheral venous catheter-related bloodstream infections: evidence for increasing prevalence of gram-negative microorganisms from a 25-year prospective observational study[J]. Antimicrob Agents Chemother, 2018, 62(11): e00892-e00818. DOI:10.1128/AAC.00892-18 |
| [28] | San-Juan R, Viedma E, Chaves F, et al. High MICs for vancomycin and daptomycin and complicated catheter-related bloodstream infections with methicillin-sensitive Staphylococcus aureus[J]. Emerg Infect Dis, 2016, 22(6): 1057-1066. DOI:10.3201/eid2206.151709 |
| [29] | Ruiz-Ruigómez M, Aguado JM. Duration of antibiotic therapy in central venous catheter-related bloodstream infection due to Gram-negative bacilli[J]. Curr Opin Infect Dis, 2021, 34(6): 681-685. DOI:10.1097/QCO.0000000000000763 |
| [30] | Muff S, Tabah A, Que YA, et al. Short-Course Versus Long-Course Systemic Antibiotic Treatment for Uncomplicated Intravascular Catheter-Related Bloodstream Infections due to Gram-Negative Bacteria, Enterococci or Coagulase-Negative Staphylococci: a Systematic Review[J]. Infect Dis Ther, 2021, 10(3): 1591-1605. DOI:10.1007/s40121-021-00464-0 |
| [31] | Zhong YY, Deng LH, Zhou LM, et al. Association of immediate reinsertion of new catheters with subsequent mortality among patients with suspected catheter infection: a cohort study[J]. Ann Intensive Care, 2022, 12(1): 38. DOI:10.1186/s13613-022-01014-8 |
 2024, Vol. 33
2024, Vol. 33




