2. 河南省急诊与创伤工程研究中心,郑州 450052;
3. 河南省急诊与创伤研究医学重点实验室,郑州 450052;
4. 郑州大学第一附属医院心血管内科,郑州 450052
2. Henan Provincial Emergency and Trauma Engineering Research Center, Zhengzhou 450052, China;
3. Henan Key Laboratory of Emergency Medicine and Trauma Research, Zhengzhou 450052, China;
4. Department of Cardiology, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
心肌肥厚是心脏对血管紧张素Ⅱ(angiotensin Ⅱ, Ang Ⅱ)、内皮素-1等因素刺激引起心肌做功代偿性增加的一种适应性反应,但长期持续的刺激会引起心脏结构改变,导致心室重塑、心力衰竭甚至猝死[1]。心肌肥厚的标志物包括心房利钠肽(atrial natriuretic peptide, ANP)、脑利钠肽(brain natriuretic peptide, BNP)、β-肌球蛋白重链(β-myosin heavy chain, β-MHC)等[2]。尽管心肌肥厚已有一个多世纪的探索和研究,其具体发病机制仍知之甚少,缺乏有效的药物来预防。心肌肥厚中信号通路的作用日益受到关注,包括丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、钙调神经磷酸酶/活化T细胞核因子、磷脂酰肌醇3激酶/蛋白激酶B(Phosphatidylinositol-3-kinase/Protein kinase B, PI3K/Akt)、AMP活化蛋白激酶、核因子-κB(nuclear factor-κB, NF-κB)和其他信号传导途径[3]。研究表明,Akt通路参与了Ang Ⅱ诱导的心肌肥厚进展[4-5]。
异钩藤碱(isorhynchophylline, IRN)是从传统中药藤本植物中提取的一种四环羟吲哚生物碱[6]。研究发现,IRN对多种器官损伤具有保护作用[7]。在小鼠的阿尔茨海默病模型中用IRN治疗可显著缓解记忆和学习障碍[8]。IRN可以抑制大鼠肺动脉平滑肌细胞增殖并抑制野百合碱诱导的肺血管重塑[9]。在自发性高血压大鼠动物模型中,IRN可以通过调节下丘脑的昼夜节律和神经递质代谢治疗高血压[10-11]。Zheng等[12]研究发现,IRN可以通过减轻氧化应激和线粒体损伤来改善百草枯诱导的急性肾损伤。Zhou等[13]研究发现,IRN在LPS诱导的小鼠肺泡巨噬细胞中发挥抗炎和抗氧化活性。这些结果表明IRN在多种疾病中具有保护作用,但是IRN对心肌肥厚的作用及作用机制尚不清楚。因此,本研究建立了Ang Ⅱ诱导的H9c2心肌细胞肥大模型,以探讨IRN对心肌细胞肥大的作用及具体作用机制。
1 材料与方法 1.1 细胞培养大鼠H9c2心肌细胞从中国科学院细胞库获得(中国,上海)。IRN(纯度≥96%)由广西中医药研究所提供(中国,南宁)。将IRN溶解在ddH2O中,并以20 μmol/L的浓度储存,然后用0.2 μm过滤器(Pall,1140503)进行过滤。
细胞在Dulbecco改良的Eagle培养基(DMEM)/F12 1∶1培养基(GIBCO,C11995)中培养,添加10%胎牛血清(GIBCO,10099)、青霉素(100 U/ml;GIBCO,11213)和链霉素(100 mg/mL;GIBCO,15140),在37 ℃、含5% CO2的加湿培养箱中培养(SANYO 18M)。将细胞以1×106/孔的密度接种于6孔培养板中,并以5.0×103/孔的密度接种于96孔培养板中,然后培养24 h。细胞饥饿处理12 h,在Ang Ⅱ(1 μmol/L)[14-15](A9525,Sigma,美国)之后向培养基中添加不同浓度的IRN(0、5、10、25、50 μmol/L)。6孔板中的细胞用于蛋白质和mRNA提取,96孔板中的细胞用于测量细胞表面积。
1.2 细胞表面积测量将H9c2细胞接种在96孔板中的无菌玻璃盖玻片上。细胞在PBS中用0.1%Triton X-100固定和渗透。盖玻片用PBS清洗3次,室温下用5%牛血清白蛋白(BSA)在含有0.1%Triton X-100的Tris缓冲盐水(TBS)中封闭1 h。细胞在1%山羊血清(ab7481, Abcam, 美国)中以1∶100的稀释度用抗肌节肌动蛋白抗体(ab11008, Abcam, USA)染色。用TBS冲洗后,将细胞与Alexa Fluor 488山羊抗鼠IgG(A11001,Invitrogen,美国)孵育。最后,使用含有DAPI的SlowFade Gold Antifade试剂(S36939,Invitrogen,美国)进行复染。使用定量数字图像分析系统(Image Pro Plus,版本6.0)测量单个细胞。每个孔至少测量50个细胞,每个实验独立重复三次。
1.3 实时定量PCR根据制造商的说明,使用TRIzol试剂(D9108A, Takara Biotechnology, 日本)从H9c2细胞中提取总RNA。使用RNA-PCR试剂盒(RR036A, Takara Biotechnology, 日本)反转录总RNA(1 μg),所得cDNA用作PCR模板。根据制造商的说明,使用ABI PRISM 7900序列检测系统(Applied Biosystem, 美国)通过实时PCR测定mRNA水平。PCR反应混合物中含有SYBR GreenⅠ(RR420A, 4Takara Biotechnology, 日本),cDNA和引物。使用比较Ct方法公式2-ΔΔCt计算相对基因表达水平(目标量,标准化为内源性控制基因)。
PCR结果使用双重标准化曲线来量化,使用GAPDH的mRNA表达进行校准。所用引物序列见表 1。
| mRNA | 正向引物 | 反向引物 |
| ANP | ATACAGTGCGGTGTCCAACA | AGCCCTCAGTTTGCTTTTCA |
| BNP | TTGGGCAGAAGATAGACCGGAT | GGTCTTCCTAAAACAACCTCA |
| β-MHC | AACCTGTCCAAGTTCCGCAAGGTG | GAGCTGGGTAGCACAAGAGCTACT |
| GAPDH | TTGCCATCAACGACCCCTTC | TTGTCATGGATGACCTTGGC |
| 注:序列顺序为5’ → 3’ | ||
从不同组的H9c2细胞中提取蛋白质,并用BCA蛋白质测定试剂盒(23227, Thermo, 美国)测定蛋白质浓度。在变性和SDS-PAGE电泳后,分离的蛋白质转移到硝化纤维素膜上。然后用5%脱脂牛奶在TBS(10 mmol/L Tris-HCl,150 mmol/L NaCl,pH 7.6)中封闭3 h。在4 ℃下与不同的一级抗体在TBS中孵育过夜后,将膜与过氧化物酶结合的二级抗体在TBS中室温下孵育2 h。用Bio-rad成像系统检测特异性条带。将总细胞裂解液的蛋白表达水平以GAPDH蛋白标准化。
1.5 统计学方法实验数据采用SPSS 25.0软件进行统计分析。正态分布的计量资料以均数±标准差(x±s)表示,两组间差异采用独立样本t检验比较分析。以P < 0.05为差异有统计学意义。
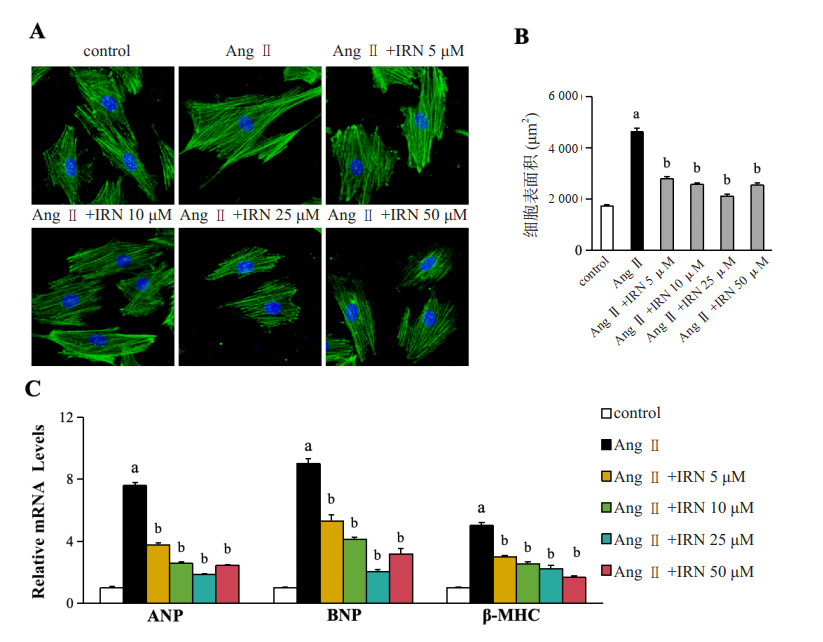
2 结果 2.1 IRN对H9c2心肌细胞肥大的抑制作用暴露于Ang Ⅱ(1 μmol/L)的H9c2细胞通过肌节肌动蛋白染色测定以评估肥大生长。如图 1A所示,Ang Ⅱ可以使细胞表面积显著增加(P < 0.05),IRN(5、10、25、50 μmol/L)预处理可抑制细胞表面积的增加(均P < 0.05),尤其是在浓度为25 μmol/L时(P < 0.01,图 1B)。ANP、BNP和β-MHC是心肌肥厚的标志物。如图 1C所示,IRN被证实能够显著抑制Ang Ⅱ诱导的ANP、BNP和β-MHC mRNA激活(均P < 0.05),尤其是在25 μmol/L的浓度下(P < 0.01,图 1C)。这些结果表明IRN在Ang Ⅱ诱导的H9c2细胞肥大中起保护作用。
|
| A为在0、5、10、25、50 μM IRN存在下用1 μM Ang Ⅱ处理24 h的H9c2细胞的代表性图像;B为各组间细胞表面积变化的定量比较;C为各组间ANP、BNP和β-MHC mRNA的定量比较;Ang Ⅱ组与control组比较,aP < 0.05;Ang Ⅱ+IRN组与Ang Ⅱ组比较,bP < 0.05 图 1 IRN抑制Ang Ⅱ诱导的H9c2细胞表面积增加 Fig 1 IRN inhibits Ang Ⅱ-induced increase in H9c2 cell surface area |
|
|
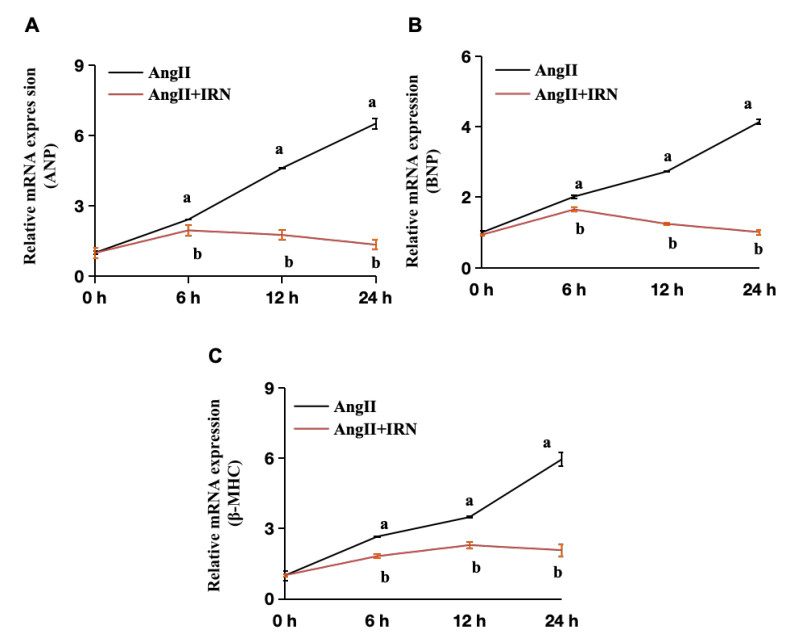
为了研究抑制的最有效时间,H9c2细胞与Ang Ⅱ(1 μmol/L)和IRN(25 μmol/L)在不同时间(0 h、6 h、12 h、24 h)共同孵育。IRN对Ang Ⅱ诱导的ANP、BNP和β-MHC mRNA表达表现出时间依赖性抑制(P < 0.05,图 2)。这些结果表明IRN在体外抑制心肌肥厚有时间依赖性。
|
| Ang Ⅱ诱导ANP、BNP和β-MHC mRNA表达的上调可以时间依赖性的被IRN(25 μM)抑制,作用时间越长,抑制效果越明显;Ang Ⅱ组不同时间点与0 h比较,aP < 0.05;Ang Ⅱ+IRN组与Ang Ⅱ组相同时间点比较,bP < 0.05 图 2 IRN对ANP、BNP和β-MHC mRNA表达抑制作用的时间依赖性 Fig 2 Time dependence of the inhibitory effect of IRN on ANP, BNP and β-MHC mRNA expression |
|
|
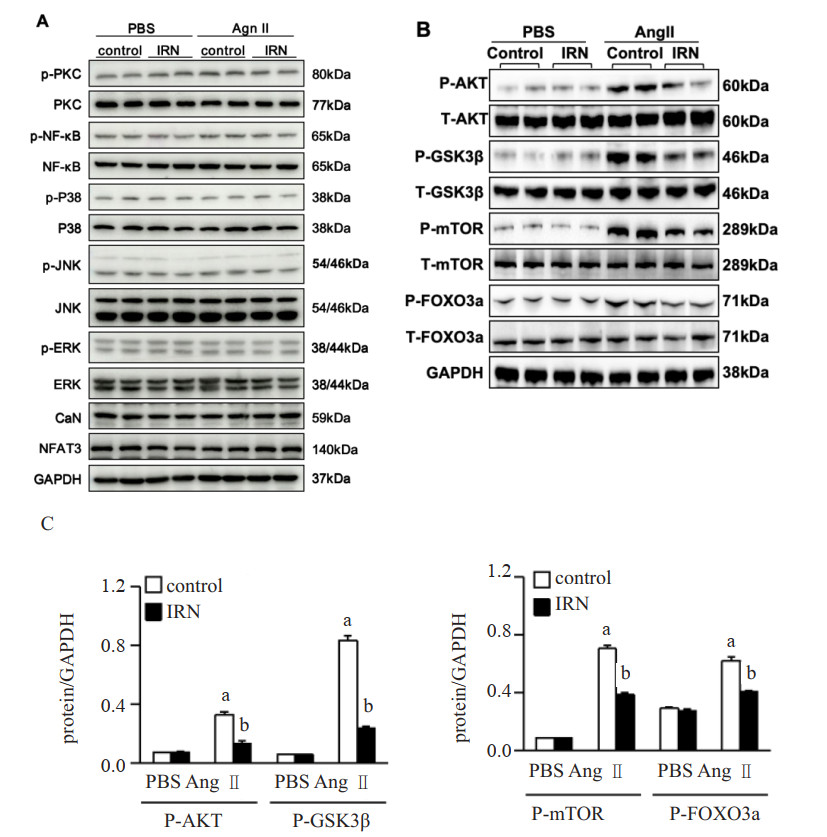
为了研究Ang Ⅱ对信号通路的激活作用,在本研究的实验模型中,用Ang Ⅱ及IRN干预H9c2细胞对其内在机制进行探讨。本研究检测MAPK、CaN/NFAT、Akt、PKC、NF-κB信号通路的磷酸化水平,只有Akt信号通路发生变化(图 3A、3B)。如图 3B、3C所示,Ang Ⅱ引起Akt、糖原合成酶激酶3β(Glycogen synthase kinase 3β, GSK3β)、雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、FOXO3a的磷酸化水平升高。IRN阻断Ang Ⅱ诱导的Akt信号通路磷酸化。
|
| A为Ang Ⅱ诱导的H9c2细胞中MAPK、CaN/NFAT、Akt、PKC、NF-κB信号通路的磷酸化水平未发生变化;B为Ang Ⅱ诱导的H9c2细胞中Akt/GSK3β/mTOR、FOXO3a的磷酸化水平;C为IRN可以逆转Ang Ⅱ诱导的H9c2细胞中Akt/GSK3β/mTOR、FOXO3a磷酸化水平的升高;Ang Ⅱ组与control组比较,aP < 0.05;Ang Ⅱ+IRN组与Ang Ⅱ组比较,bP < 0.05 图 3 IRN对Ang Ⅱ激活的Akt通路磷酸化的影响 Fig 3 Effect of IRN on phosphorylation of the Ang II-activated Akt pathway |
|
|
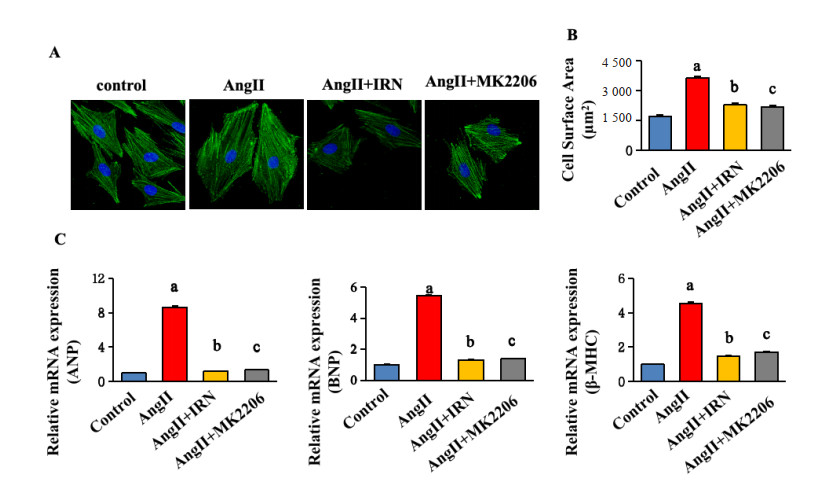
为了进一步证实IRN靶蛋白在Ang Ⅱ诱导的心肌肥大中的调节作用,本研究用Ang Ⅱ、IRN(25 µmol/L)和Akt抑制剂MK2206持续干预H9c2细胞24 h。如图 4结果显示,Ang Ⅱ显著增加细胞表面积及ANP、BNP和β-MHC mRNA表达(均P < 0.05),MK2206和IRN(25 μmol/L)预处理可抑制其表达(P < 0.05)。这些结果表明IRN抑制Ang Ⅱ诱导的心肌肥大在很大程度上与Akt信号通路的调节有关。
|
| A为在IRN或MK2206存在下用25 μM Ang Ⅱ处理24 h的H9c2细胞的代表性图像;B为作用24 h后定量细胞表面积变化;C为Ang Ⅱ诱导的ANP、BNP和β-MHC mRNA表达的上调可以被IRN(25 μM)和MK2206阻断;Ang Ⅱ组与control组比较,aP < 0.05;Ang Ⅱ+IRN组与Ang Ⅱ组比较,bP < 0.05;Ang Ⅱ+MK2206组与Ang Ⅱ组比较,cP < 0.05 图 4 Akt抑制剂(MK2206)减轻Ang Ⅱ诱导的H9c2细胞肥大 Fig 4 Akt inhibitor (MK2206) attenuates Ang Ⅱ-induced hypertrophy in H9c2 cells |
|
|
病理性心肌肥厚是由多种刺激物和多种分子参与的信号通路,最终导致心律失常、心力衰竭甚至猝死[1, 16]。Ang Ⅱ是肾素-血管紧张素系统中一种重要的心肌肥大刺激因子,其诱导心肌细胞肥大的信号通路非常复杂[16]。Akt是一种丝氨酸/苏氨酸蛋白激酶,它是细胞内重要的信号转导途径。激活的Akt有广泛的生物学效应,包括抗心肌细胞凋亡、促细胞生存等[17-18]。Akt信号通路被激活后调节两种重要的下游靶点:GSK3β和mTOR[19-20]。一项研究表明,车前子甙通过抑制Akt/GSK3β信号通路对异丙肾上腺素诱导的心肌肥大具有显著的保护作用[21]。Liao等[22]发现油酸可抑制心肌细胞肥大,其机制可能与Akt/mTOR/FOXO3a信号通路有关。FOXO3a作为一种转录因子参与糖尿病心肌病的心脏重塑[23]。这些研究表明,Akt/mTOR/FOXO3a信号通路在心肌肥厚和心脏重塑中起着重要作用。IRN是一种四环羟吲哚生物碱。IRN对多种疾病,包括心血管系统疾病具有保护作用。
在本研究中,应用Ang Ⅱ诱导的H9c2细胞作为心肌肥大的细胞模型来探讨IRN的作用。Ang Ⅱ可以使H9c2细胞表面积显著增加,并引起心肌肥大标志物ANP、BNP和β-MHC的mRNA显著激活。本研究发现用IRN预处理可以逆转Ang Ⅱ诱导的H9c2心肌细胞肥大,在研究中通过IRN减少心肌细胞表面积和ANP、BNP及β-MHC的mRNA表达来证实。证明了IRN对心肌细胞肥大的保护作用。为了探索IRN减轻Ang Ⅱ诱导的H9c2细胞肥大的作用机制,本研究检测了MAPK、CaN/NFAT、Akt、PKC、NF-κB信号通路的磷酸化水平,只有Akt信号通路磷酸化发生了变化。本研究发现在预先给与Akt抑制剂MK2206之后,Ang Ⅱ诱导的ANP、BNP和β-MHC mRNA表达的上调被阻断,与IRN预处理达到了同样的效果。这些结果提示IRN调节Ang Ⅱ诱导的心肌细胞肥大是通过Akt信号通路发挥作用的。本研究在细胞水平上首次证实了IRN在Ang Ⅱ诱导的心肌细胞肥大中的保护作用。此外,发现IRN抑制Ang Ⅱ诱导的心肌细胞肥大是通过抑制Akt的下游靶点GSK3β、mTOR、FOXO3a实现的。但是,本研究不确定IRN是否也通过其他途径对心肌细胞肥大起到保护作用。本研究仅在细胞水平上对IRN抑制Ang Ⅱ诱导的心肌肥大进行了评价,缺乏临床试验的可行性。
综上所述,IRN可以减轻Ang Ⅱ诱导的心肌细胞肥大,其机制可能是通过激活Akt信号通路实现的。
利益冲突 所有作者声明无利益冲突
作者贡献声明 谷玉雷、刘怡、朱志强:参与实验操作、设计、文章撰写;裴辉、姜毓敏、谢佳丰:参与文章撰写、内容修改;毛宇径、张晓凡:负责数据采集、统计分析、图表与图片制作;高路、肖莉丽:文章内容修改、审阅以及后期文章处理,获取经费与技术支持
| [1] | Inoue N, Watanabe M, Ishido N, et al. Involvement of genes encoding apoptosis regulatory factors (FAS, FASL, TRAIL, BCL2, TNFR1 and TNFR2) in the pathogenesis of autoimmune thyroid diseases[J]. Hum Immunol, 2016, 77(10): 944-951. DOI:10.1016/j.humimm.2016.07.232 |
| [2] | Nakamura M, Sadoshima J. Mechanisms of physiological and pathological cardiac hypertrophy[J]. Nat Rev Cardiol, 2018, 15(7): 387-407. DOI:10.1038/s41569-018-0007-y |
| [3] | Takano APC, Senger N, Barreto-Chaves MLM. The endocrinological component and signaling pathways associated to cardiac hypertrophy[J]. Mol Cell Endocrinol, 2020, 518: 110972. DOI:10.1016/j.mce.2020.110972 |
| [4] | Wang XF, Chen LL, Zhao XY, et al. A cathelicidin-related antimicrobial peptide suppresses cardiac hypertrophy induced by pressure overload by regulating IGFR1/PI3K/AKT and TLR9/AMPKα[J]. Cell Death Dis, 2020, 11(2): 96. DOI:10.1038/s41419-020-2296-4 |
| [5] | Ba LN, Gao JQ, Chen YP, et al. Allicin attenuates pathological cardiac hypertrophy by inhibiting autophagy via activation of PI3K/Akt/mTOR and MAPK/ERK/mTOR signaling pathways[J]. Phytomedicine, 2019, 58: 152765. DOI:10.1016/j.phymed.2018.11.025 |
| [6] | Lee H, Baek SH, Lee JH, et al. Isorhynchophylline, a potent plant alkaloid, induces apoptotic and anti-metastatic effects in human hepatocellular carcinoma cells through the modulation of diverse cell signaling cascades[J]. Int J Mol Sci, 2017, 18(5): 1095. DOI:10.3390/ijms18051095 |
| [7] | Zhang YT, Cui YQ, Dai S, et al. Isorhynchophylline enhances Nrf2 and inhibits MAPK pathway in cardiac hypertrophy[J]. Naunyn Schmiedebergs Arch Pharmacol, 2020, 393(2): 203-212. DOI:10.1007/s00210-019-01716-0 |
| [8] | Li HQ, Ip SP, Zheng GQ, et al. Isorhynchophylline alleviates learning and memory impairments induced by aluminum chloride in mice[J]. Chin Med, 2018, 13(1): 29. DOI:10.1186/s13020-018-0187-8 |
| [9] | Guo HP, Zhang X, Cui YQ, et al. Isorhynchophylline protects against pulmonary arterial hypertension and suppresses PASMCs proliferation[J]. Biochem Biophys Res Commun, 2014, 450(1): 729-734. DOI:10.1016/j.bbrc.2014.06.044 |
| [10] | Wang DY, Sun MJ, Liu YC, et al. Isorhynchophylline regulates the circadian rhythm of the hypothalamus in spontaneously hypertensive rats to treat hypertension[J]. Curr Pharm Des, 2023, 29(2): 139-148. DOI:10.2174/1381612829666221222115134 |
| [11] | Li Y, Yu RX, Zhang D, et al. Deciphering the mechanism of the anti-hypertensive effect of isorhynchophylline by targeting neurotransmitters metabolism of hypothalamus in spontaneously hypertensive rats[J]. ACS Chem Neurosci, 2020, 11(11): 1563-1572. DOI:10.1021/acschemneuro.9b00699 |
| [12] | Zheng Q, Zhang Y, Zhao Z, et al. Isorhynchophylline ameliorates paraquat-induced acute kidney injury by attenuating oxidative stress and mitochondrial damage via regulating toll-interacting expression[J]. Toxicol Appl Pharmacol, 2021, 420: 115521. DOI:10.1016/j.taap.2021.115521 |
| [13] | Zhou Z, Su YH, Fa XN. Isorhynchophylline exerts anti-inflammatory and anti-oxidative activities in LPS-stimulated murine alveolar macrophages[J]. Life Sci, 2019, 223: 137-145. DOI:10.1016/j.lfs.2019.03.017 |
| [14] | Ye S, Luo W, Khan ZA, et al. Celastrol attenuates angiotensin Ⅱ-induced cardiac remodeling by targeting STAT3[J]. Circ Res, 2020, 126(8): 1007-1023. DOI:10.1161/circresaha.119.315861 |
| [15] | Hu L, Wei JR, Zhang Y, et al. ANGPTL8 is a negative regulator in pathological cardiac hypertrophy[J]. Cell Death Dis, 2022, 13(7): 621. DOI:10.1038/s41419-022-05029-8 |
| [16] | Bhullar SK, Dhalla NS. Angiotensin Ⅱ-induced signal transduction mechanisms for cardiac hypertrophy[J]. Cells, 2022, 11(21): 3336. DOI:10.3390/cells11213336 |
| [17] | 吴彬, 曹亚红, 李锐. 加巴喷丁通过PI3K-AKT信号通路减轻大鼠心肌缺血-再灌注损伤[J]. 中华急诊医学杂志, 2022, 31(3): 344-348. DOI:10.3760/cma.j.issn.1671-0282.2022.03.015 |
| [18] | 王赟, 张宗泽, 张婧婧, 等. 氢吗啡酮后处理经PI3K/Akt通路减轻大鼠心肌缺血-再灌注细胞凋亡[J]. 中华急诊医学杂志, 2021, 30(11): 1329-1333. DOI:10.3760/cma.j.issn.1671-0282.2021.11.009 |
| [19] | Zhang GS, Wang Q, Wang WW, et al. Tempol protects against acute renal injury by regulating PI3K/akt/mTOR and GSK3β signaling cascades and afferent arteriolar activity[J]. Kidney Blood Press Res, 2018, 43(3): 904-913. DOI:10.1159/000490338 |
| [20] | Zi CN, Zhang CL, Yang YL, et al. Penehyclidine hydrochloride protects against anoxia/reoxygenation injury in cardiomyocytes through ATP-sensitive potassium channels, and the Akt/GSK-3β and Akt/mTOR signaling pathways[J]. Cell Biol Int, 2020, 44(6): 1353-1362. DOI:10.1002/cbin.11329 |
| [21] | Shang LL, Pin L, Zhu SS, et al. Plantamajoside attenuates isoproterenol-induced cardiac hypertrophy associated with the HDAC2 and AKT/GSK-3β signaling pathway[J]. Chem Biol Interact, 2019, 307: 21-28. DOI:10.1016/j.cbi.2019.04.024 |
| [22] | Liao HH, Zhang N, Feng H, et al. Oleanolic acid alleviated pressure overload-induced cardiac remodeling[J]. Mol Cell Biochem, 2015, 409(1/2): 145-154. DOI:10.1007/s11010-015-2520-1 |
| [23] | Peng ML, Fu Y, Wu CW, et al. Signaling Pathways Related to Oxidative Stress in Diabetic Cardiomyopathy[J]. Front Endocrinol (Lausanne), 2022, 13: 907757. DOI:10.3389/fendo.2022.907757 |
 2024, Vol. 33
2024, Vol. 33




