2. 徐州医科大学研究生院/急救与救援医学系,徐州 221002;
3. 江苏省卫生应急研究所,徐州 221002;
4. 南京医科大学附属江宁医院急诊科,南京 211100
2. Graduate School/Department of Emergency and Rescue Medicine, Xuzhou Medical University, Xuzhou 221002, China;
3. Jiangsu Provincial Institute of Health Emergency Response, Xuzhou 221002, China;
4. Department of Emergency, Jiangning Hospital, Nanjing Medical University, Nanjing 211100, China
创伤后应激障碍(post-traumatic stress disorder, PTSD)是指个体暴露于创伤事件后延迟出现和持续存在的精神障碍[1]。既往研究发现轻度创伤性脑损伤(traumatic brain injury, TBI)后PTSD发生率较高[2],但有关多发伤合并TBI的研究较少,且新近研究发现,TBI后早期存在着急性脑糖代谢紊乱[3],并与TBI后远期神经功能预后相关[4]。由于多发伤患者多处于应激状态下,使得血糖升高且血糖波动增大[5],而血糖发生波动是否与多发伤后PTSD的发生有关,目前尚未见文献报道。因此,本研究旨在探讨急性多发伤后早期血糖波动对PTSD发病的影响,为急性多发伤早期通过血糖波动预警PTSD的发生提供依据。
1 资料与方法 1.1 研究对象本研究为病例对照研究。以2022年3月至2023年3月徐州医科大学附属医院收治的急性多发伤患者为研究对象。根据是否合并TBI以及PTSD检查量表(the PTSD checklist for DSM-5, PCL-5)得分是否≥38分进行分组[6]。
纳入标准:(1)创伤后≤24 h、首诊于本院急诊科并入住ICU者,同意加入本研究并签署知情同意书;(2)年龄在18周岁以上;(3)创伤后1个月,情绪稳定、能够理解且配合回答问题,有效完成问卷者;(4)无基础资料缺失。
排除标准:(1)妊娠期及哺乳期妇女;(2)既往糖尿病史或住院期间糖化血红蛋白≥7%者;(3)既往存在甲亢、甲减等内分泌疾病;(4)既往存在严重的肝肾疾病、血液病、恶性肿瘤等疾病;(5)既往存在精神疾病史或精神药物服用史;(6)严重脑损伤(严重脑外伤、大量脑出血、大面积脑梗死、重度颅内感染)造成认知受损者;(7)有物质滥用病史,如吸毒、酒精依赖等;(8)接受过心理治疗或心理培训者;(9)无法理解、不能配合、拒绝完成相关病史询问及量表。
退出或剔除标准:(1)依从性差,未按照规定方案完成相关血液生化检查;(2)影像学资料缺失者;(3)随访期间出现病情加重甚至死亡等情况无法继续参与者;(4)中途要求退出本研究者;⑤电话随访过程中失访者。
本研究符合医学伦理学标准,经徐州医科大学附属医院医学伦理委员会批准(审批号:XYFY2023-KL079-01)。本研究已在中国临床试验注册中心注册(注册号:ChiCTR2300073211)并在国家医学研究中心备案。
1.2 观察指标 1.2.1 人口统计学资料记录患者性别、年龄、职业、受教育程度、高血压史、心脏疾病史、手术外伤史、吸烟饮酒史、体重指数等资料。
1.2.2 临床资料记录手术方式、特殊物理降温及机械通气使用情况、ICU住院天数及总住院天数等。
1.2.3 短期血糖波动指标收集(1)应激性高血糖(stress-induced hyperglycemia, SIH):应激状态下空腹血糖 > 6.9 mmol/L或随机血糖 > 11.1 mmol/L[7];(2)病程中血糖的最大值(the maximum value of blood glucose, BGmax)、最小值(the minimum value of blood glucose, BGmin);(3)短期血糖变异性(glycemic variability,GV)指标:入院后72 h内动态血糖值(每2~6 h监测1次血糖,每天至少4次),计算72 h血糖变异系数(glucose coefficient of variation, Glu-CV),计算公式为:72 h血糖标准差除以72 h血糖平均值[8]。
1.2.4 创伤严重程度评估评估患者创伤后24 h内完成损伤严重度评分(injury severity score, ISS)、急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluation,APACHE Ⅱ)及格拉斯哥昏迷评分(Glasgow coma score, GCS)。采用赫尔辛基CT评分量表收集合并TBI患者的影像资料[9]。
1.2.5 PTSD相关症状维度划分依据DSM-5诊断标准,PCL被重新修订为包括20个问题,划分为四个症候群[6],包括(1)再体验(reexperiencing, R);(2)回避症状(avoidance, A);(3)负性认知和情绪改变(negative alterations in cognitions and mood, NACM);(4)警觉性增高(hyperarousal, H)。创伤后1个月,应用PCL-5量表评估PTSD症状,将总得分≥38分患者诊断为PTSD。
1.2.6 创伤后功能恢复情况创伤后1个月,应用简易智能精神状态检查量表(minimum mental state examination, MMSE)、匹兹堡睡眠质量指数(Pittsburgh sleep quality index, PSQI)以及格拉斯哥结局评分(Glasgow outcome score, GOS),评估患者认知功能恢复情况、睡眠质量及神经功能预后状态。
1.3 统计学方法应用SPSS 23.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差(x ± s)表示,组间比较采用独立样本t检验;非正态分布计量资料以中位数(四分位数)[M(Q1,Q3)]表示,组间比较采用Wilcoxon Mann Whitney U检验及Kruskal-Wallis检验;计数资料以例数(%)表示,组间比较采用χ2检验分析;事后比较应用Bonferroni法进行分析。应用单因素以及多因素二元Logistic回归分析探讨PTSD发生的影响因素。相关变量与PCL-5量表得分之间相关性应用Spearman相关性分析;绘制受试者工作特征(receiver operating characteristic, ROC)曲线分析相关变量对PTSD发病的预测价值。以P < 0.05为差异有统计学意义。
2 结果 2.1 TBI组与非TBI组患者一般临床资料及量表得分比较研究入组、排除及分组流程见图 1。本研究共纳入159例急性多发伤患者,其中94例合并有TBI;致伤原因见表 1。TBI组患者年龄、PTSD发生率、ISS评分、APACHEⅡ评分、PCL-5量表总得分及H症状得分、NACM得分高于非TBI组;而GCS评分、GOS得分以及MMSE量表得分低于非TBI组,差异均有统计学意义(均P < 0.05)。其余指标差异无统计学意义。见表 1。
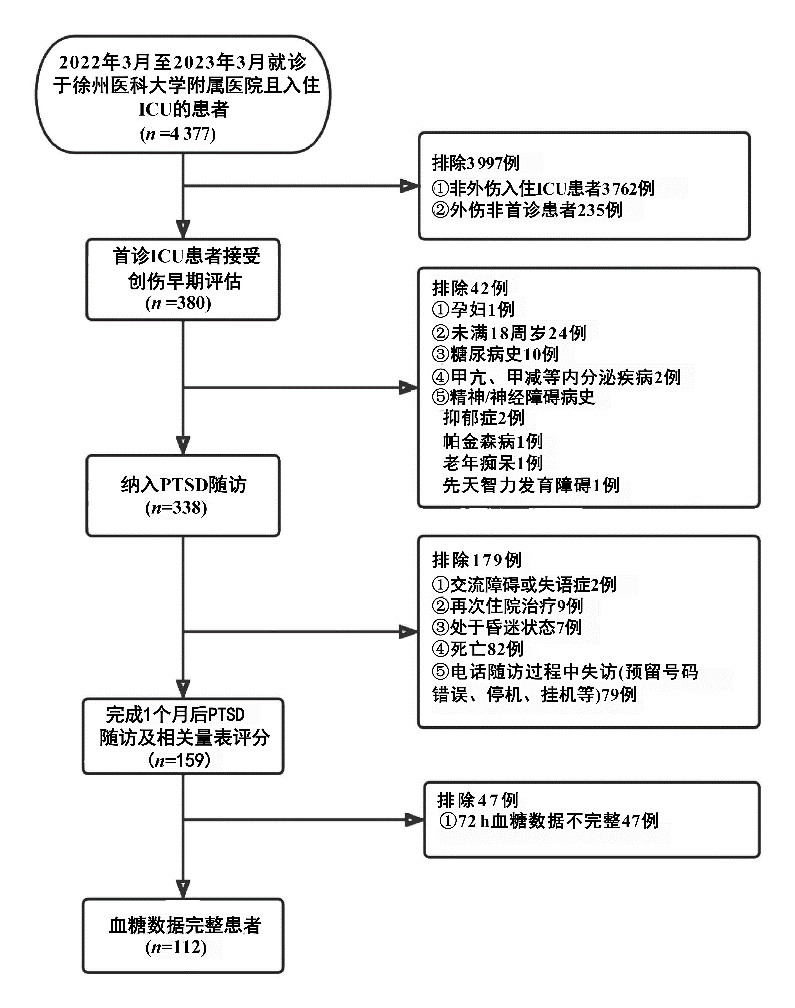
|
| 图 1 研究入组、排除及分组流程 Fig 1 Flow diagram of enrollment、exclusion and grouping |
|
|
| 指标 | TBI组(n=94) | 非TBI组(n=65) | t/Z/χ2值 | P值 |
| 一般情况 | ||||
| 年龄(岁)a | 57.24±1.34 | 51.91±1.72 | 2.473 | 0.014 |
| BMI(kg/m2)b | 24.82(22.60,22.85) | 24.60(22.56,25.95) | 1.119 | 0.263 |
| 女性c | 33(35.1) | 17(26.2) | 1.429 | 0.232 |
| 既往史c | ||||
| 高血压史 | 24(25.5) | 15(23.1) | 0.125 | 0.724 |
| 心脏病史 | 7(7.4) | 4(6.2) | 0.000 | 1.000 |
| 既往手术史 | 28(29.8) | 13(20.0) | 1.924 | 0.165 |
| 吸烟史 | 8(8.5) | 9(13.8) | 1.146 | 0.284 |
| 酗酒史 | 10(10.6) | 5(7.7) | 0.390 | 0.532 |
| 学历c | 2.891 | 0.576 | ||
| 文盲 | 7(7.4) | 3(4.6) | ||
| 小学 | 13(13.8) | 12(18.5) | ||
| 初中 | 56(59.6) | 34(52.3) | ||
| 高中 | 12(12.8) | 8(12.3) | ||
| 大专及本科以上 | 6(6.4) | 8(12.3) | ||
| 致伤原因c | - | - | ||
| 车祸伤 | 64(68.1) | 26(40.0) | ||
| 高处坠落伤 | 15(16.0) | 17(26.2) | ||
| 重物砸伤 | 1(1.1) | 12(18.5) | ||
| 爆炸伤 | 1(1.1) | 0(0.0) | ||
| 其他(绞伤、刀割伤等) | 13(13.8) | 10(15.4) | ||
| 创伤至入住ICU时间(h)b | 8(5,14) | 8(5,13) | 0.309 | 0.757 |
| ISS评分b | 18(17,26) | 17(14,19) | 4.406 | < 0.001 |
| APACHE Ⅱ评分b | 12.0(8.0,16.0) | 5.0(3.0,7.5) | 6.209 | < 0.001 |
| GCS评分b | 7.5(5.0,13.0) | 15.0(14.5,15.0) | 8.611 | < 0.001 |
| PTSDc | 35(37.2) | 14(21.5) | 4.440 | 0.035 |
| PCL-5评分b | 33.0(25.0,42.2) | 26.0(20.0,36.0) | 3.243 | 0.001 |
| R评分 | 6.0(5.0,9.0) | 5.0(5.0,9.0) | 1.069 | 0.285 |
| A评分 | 2.0(2.0,4.0) | 2.0(2.0,4.0) | 0.540 | 0.589 |
| NACM评分 | 14.0(8.0,17.0) | 9.0(7.0,13.0) | 3.534 | < 0.001 |
| H评分 | 10.0(7.0,14.2) | 7.0(6.0,12.0) | 2.989 | 0.003 |
| MMSE评分b | 26.5(23.0,29.0) | 29.0(26.0,30.0) | 3.325 | 0.001 |
| PSQI评分b | 6(4.0,9.0) | 4(2.0,9.5) | 1.651 | 0.099 |
| GOS评分b | 4(3,5) | 5(4,5) | 3.017 | 0.003 |
| 注:BMI为体重指数,ISS评分为损伤程度评分,APACHEⅡ为急性生理与慢性健康评分Ⅱ,GCS为入院时格拉斯哥昏迷量表评分,R为再体验症状,A为回避症状,NACM为负性认知和情绪改变,H为警觉性增高,MMSE为简易智能精神状态检查量表,PSQI为匹兹堡睡眠质量指数,GOS为格拉斯哥结局评分;a为x ± s,b为M(Q1,Q3),c为(例,%) | ||||
TBI组合并PTSD患者的赫尔辛基CT评分、硬膜下血肿、脑出血、脑室出血的占比高于未合并PTSD组患者,差异均有统计学意义(均P < 0.05)。见表 2。
| 指标 | TBI组 | Z/χ2值 | P值 | |
| PTSD组(n=35) | 非PTSD组(n=59) | |||
| 颅脑损伤类型a | ||||
| 硬膜下血肿 | 30(85.7) | 35(59.3) | 7.173 | 0.007 |
| 硬膜外血肿 | 6(17.1) | 16(27.1) | 1.220 | 0.269 |
| 脑挫伤 | 28(80.0) | 42(71.2) | 0.898 | 0.343 |
| 脑出血 | 27(77.1) | 21(35.6) | 15.177 | < 0.001 |
| 脑室出血 | 13(37.1) | 6(10.2) | 9.911 | 0.002 |
| 创伤性蛛网膜下出血 | 30(85.7) | 44(74.6) | 1.627 | 0.202 |
| 手术方式a | ||||
| 去骨瓣减压术 | 0(0) | 5(8.5) | 1.676 | 0.195 |
| 颅内血肿清除术 | 13(37.1) | 21(35.6) | 0.023 | 0.880 |
| 赫尔基辛CT评分b | 5.0(4.0,7.0) | 2.0(1.0,3.0) | 7.831 | < 0.001 |
| 注:a为(例,%),b为M(Q1,Q3) | ||||
TBI组SIH发生率、高血糖发生率、初次血糖值、BGmax以及72 h Glu-CV高于非TBI组,而BGmin低于非TBI组,差异均有统计学意义(P < 0.05)。见表 3。
| 指标 | TBI组(n=94) | 非TBI组(n=65) | Z/χ2值 | P值 |
| 特殊物理降温a | 15(16.0) | 17(26.2) | 2.485 | 0.115 |
| 应用机械通气a | 45(47.9) | 35(53.8) | 0.549 | 0.459 |
| 机械通气时间b | 0(0,5) | 1(0,3) | 0.019 | 0.985 |
| ICU天数(d)b | 6(3,11) | 7(4,10) | 0.179 | 0.858 |
| 住院天数(d)b | 19.5(14.8,32.0) | 18.0(13.0,24.5) | 1.794 | 0.073 |
| SIHa | 24(25.5) | 1(1.5) | 16.695 | < 0.001 |
| 低血糖a | 8(8.5) | 1(1.5) | 2.314 | 0.128 |
| 高血糖a | 66(70.2) | 17(26.2) | 29.896 | < 0.001 |
| 初次血糖(mmol/L)b | 8.00(7.12,10.05) | 6.40(5.70,7.62) | 6.744 | < 0.001 |
| BGmax(mmol/L)b | 11.15(9.73,15.40) | 8.00(6.60,10.35) | 6.745 | < 0.001 |
| BGmin(mmol/L)b | 5.20(4.49,5.73) | 6.30(5.46,7.55) | 6.750 | < 0.001 |
| 72 h Glu-CV bc | 18.10(13.34,24.95) | 15.30(9.86,23.02) | 2.085 | 0.037 |
| 注:SIH为应激性高血糖;BGmin为病程中血糖最小值,BGmax为病程中血糖最大值,72 h Glu-CV为72 h内血糖变异系数;a为(例,%),b为M(Q1,Q3),c为排除了47例创伤后72 h内血糖数据不完整者,TIB组94例,非TIB组65例 | ||||
TBI和非TBI两个亚组中并发PTSD患者的SIH发生率、低血糖发生率、高血糖发生率、初次血糖值、BGmax以及72h Glu-CV高于无PTSD组患者,而BGmin则低于非PTSD组患者,差异均有统计学意义(均P < 0.05)。TBI并发PTSD组SIH发生比例高于非TBI并发PTSD组;TBI无PTSD组高血糖发生率、初次血糖值、BGmax高于非TBI无PTSD组,而BGmin低于非TBI无PTSD组,差异有统计学意义(均P < 0.05)。见表 4。
| 指标 | TBI组 | 非TBI组 | Z/χ2值 | P值 | |||
| PTSD组 | 非PTSD组 | PTSD组 | 非PTSD组 | ||||
| n=159 | n=35 | n=59 | n=14 | n=51 | |||
| 特殊物理降温a | 8(22.9) | 7(11.9) | 3(21.4) | 14(27.5) | 4.583 | 0.205 | |
| 应用机械通气a | 21(60.0) | 24(40.7) | 9(64.3) | 26(51.0) | 4.607 | 0.203 | |
| 机械通气时间(d)b | 1(0,5) | 0(0,5) | 2(0,4) | 1(0,3) | 1.874 | 0.599 | |
| ICU天数(d)b | 8(3,18) | 6(3,9) | 6(4,11) | 7(4,10) | 1.305 | 0.728 | |
| 住院天数(d)b | 25.0(16,32) | 18.0(14,29) | 23.5(13,32) | 18.0(12,23) | 7.643 | 0.054 | |
| SIH a | 22(62.9)d, e | 2(3.4) | 1(7.1) | 0(0.0) | 67.493 | < 0.001 | |
| 低血糖a | 8(22.9)d | 0(0.0) | 1(7.1) | 0(0.0) | 24.338 | < 0.001 | |
| 高血糖a | 35(100.0)d | 31(52.5)f | 14(100.0)g | 3(5.9) | 88.722 | < 0.001 | |
| 初次血糖(mmol/L)b | 10.8(9.3,12.2)d | 7.4(6.9,7.9)f | 8.8(8.6,9.0)g | 6.1(5.6,6.6) | 122.285 | < 0.001 | |
| BGmax(mmol/L)b | 17.4(14.2,20.4)d | 10.2(9.4,10.9)f | 12.5(11.9,13.2)g | 7.2(6.5,8.4) | 121.805 | < 0.001 | |
| BGmin(mmol/L)b | 4.4(4.0,4.7) | 5.6(5.3,5.9)g | 4.9(4.8,5.0) | 6.6(6.2,8.0)f, g | 121.811 | < 0.001 | |
| n=112c | n=24 | n=45 | n=11 | n=32 | |||
| 72 h Glu-CV b | 25.8(18.7,32.4)d | 15.9(11.5,19.3) | 25.8(15.8,28.1)g | 12.6(8.7,16.5) | 39.997 | < 0.001 | |
| 注:SIH为应激性高血糖,BGmin为病程中血糖最小值,BGmax为病程中血糖最大值,72 h Glu-CV为72 h内血糖变异系数;a为(例,%),b为M(Q1,Q3);c为112例为排除了47例创伤后72 h内血糖数据不完整者;d为TBI并发PTSD组与TBI无PTSD组进行组间比较;e为TBI并发PTSD组与非TBI并发PTSD组进行组间比较;f为TBI无PTSD组与非TBI无PTSD组进行组间比较;g为非TBI并发PTSD组与非TBI无PTSD组进行组间比较 | |||||||
单因素Logistic回归分析示,ISS评分、赫尔辛基CT评分、SIH、BGmax、BGmin以及72 h Glu-CV是急性多发伤患者发生PTSD的危险因素(P < 0.05)。将上述危险因素纳入多因素Logistic回归分析表明,72 h Glu-CV(OR=1.333,95%CI: 1.028~1.727)是急性多发伤后发生PTSD的独立危险因素(P < 0.05)。见表 5。
| 指标 | 单因素分析 | 多因素分析 | |||||
| OR值 | 95% CI | P值 | OR值 | 95% CI | P值 | ||
| ISS评分 | 1.130 | 1.052~1.213 | 0.001 | 1.365 | 0.952~1.958 | 0.091 | |
| 赫尔辛基CT评分 | 1.781 | 1.411~2.249 | < 0.001 | 0.496 | 0.206~1.193 | 0.117 | |
| SIH | 0.014 | 0.002~0.112 | < 0.001 | 0.001 | 0.001~3.989 | 0.083 | |
| BGmin | 0.002 | 0.001~0.034 | < 0.001 | 0.001 | 0.001~48.222 | 0.156 | |
| BGmax | 3.333 | 1.943~5.718 | < 0.001 | 1.621 | 0.122~21.579 | 0.714 | |
| 72 h Glu-CV | 1.262 | 1.154~1.381 | < 0.001 | 1.333 | 1.028~1.727 | 0.030 | |
| 注:数据为排除47例创伤后72 h内血糖数据不完整者后的112例患者数据;ISS评分为损伤程度评分,SIH为应激性高血糖,BGmin为病程中血糖最小值,BGmax为病程中血糖最大值,72 h Glu-CV为72 h内血糖变异系数 | |||||||
Spearman相关性分析显示72 h Glu-CV与PCL-5量表得分呈正相关(r=0.54,P < 0.001)。见图 2。
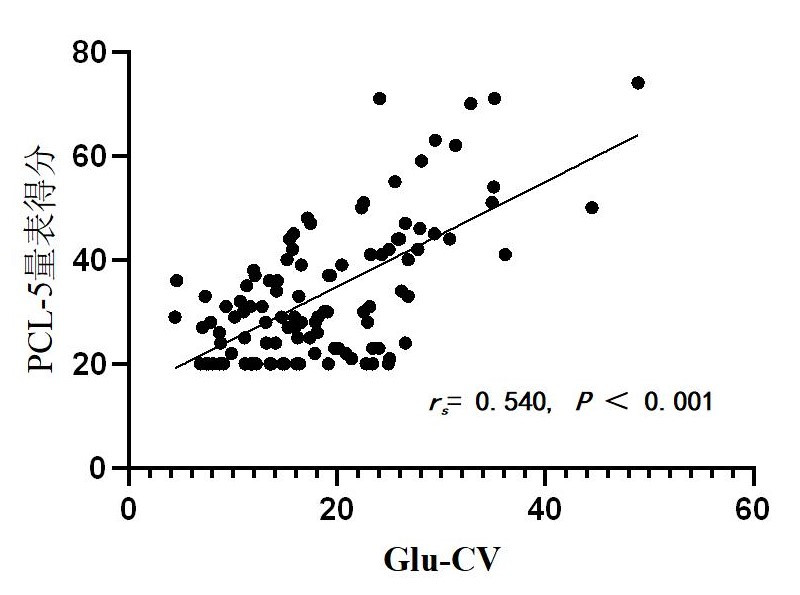
|
| 图 2 72 h Glu-CV与PCL-5量表得分相关分析 Fig 2 Correlation analysis between 72 h Glu-CV and PCL-5 score |
|
|
应用ROC曲线评估72 h Glu-CV对性创伤后PTSD发病预测价值,曲线下面积为0.861(95%CI: 0.789~0.933,P < 0.001)。当72 h Glu-CV截断值取24.06对PTSD发病具有预测价值,敏感度为62.9%,特异度为93.5%。见图 3。
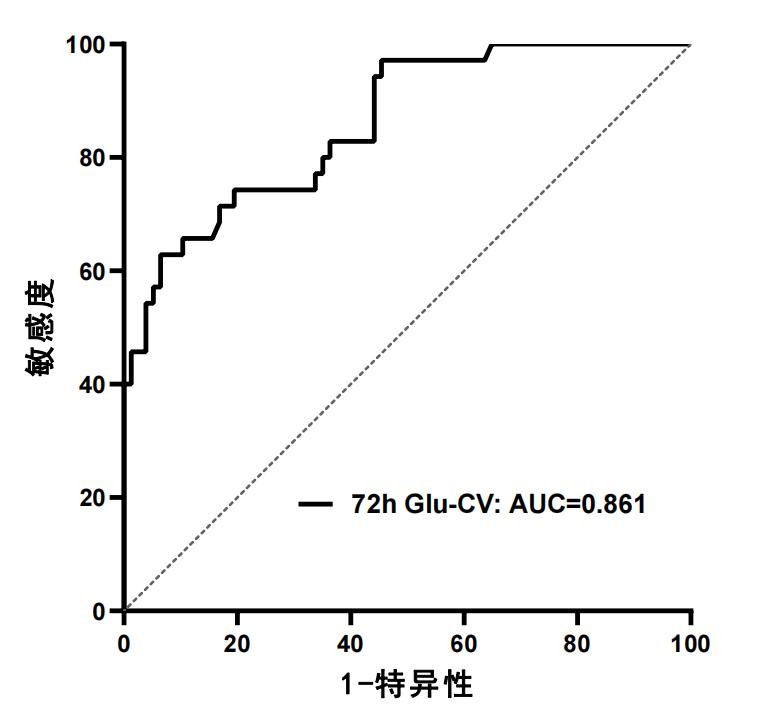
|
| 图 3 72 h Glu-CV对PTSD发病预测价值的ROC曲线 Fig 3 ROC curves of 72 h Glu-CV on the predictive value of PTSD |
|
|
多发伤具有损伤机制复杂、伤情重、病情变化快、生理紊乱严重等特点[10],给患者躯体和心理都造成了不同程度的影响。本研究中159例急性多发伤患者中49例出现了PTSD(30.8%),提示临床上急性多发伤患者中PTSD发病率较高,需要引起临床医师重视。
本研究中,存在TBI的多发伤患者PTSD发生率高于非TBI组,且主要表现为警觉性增高与负性认知情绪,同时TBI患者PTSD的发生与颅脑损伤类型(硬膜下血肿、脑出血、脑室出血)有关,而与术式、临床治疗措施(如应用特殊物理降温、机械通气等)无关,提示TBI本身可因脑组织不同程度受损影响患者长期神经功能预后[11-13]。本研究显示TBI组SIH、高血糖发生率、血糖波动幅度均高于非TBI组,尤其在合并PTSD时差异有统计学意义,提示TBI后存在急性脑糖代谢紊乱,由于TBI后病灶区脑血流量减少以及葡萄糖转运蛋白功能和表达下调,血浆中葡萄糖通过血脑屏障转运至脑组织中葡萄糖减少[14],脑组织微血管缺血以及线粒体功能障碍,使得大脑总体葡萄糖利用率降低、受损区葡萄糖磷酸化水平降低以及无氧糖酵解的增加[15],从而影响远期神经功能预后,导致PTSD的发生。本研究还发现TBI组72 h Glu-CV高于非TBI组,同时PTSD组72 h Glu-CV高于非PTSD组;进一步研究发现,72 h Glu-CV是急性创伤后发生PTSD的独立危险因素,且72 h Glu-CV与PTSD严重程度相关。其机制可能为TBI本身与创伤后应激反应可能存在着双向关联[16],TBI可使受损脑功能区应激反应失调而加重应激反应,而HPA轴和ANS过度反应则会增加神经系统炎症、氧化应激、神经内分泌紊乱,包括血糖调节失衡[17-18],导致血糖波动与血糖变异性增大,进而使细胞代谢中活性氧的产生与抗氧化防御机制失衡而造成氧化应激以及炎症因子释放增加[19-20],使得脑神经功能进一步受损,最终导致PTSD的发生。因此,短期GV增大可能成为急性创伤后发生PTSD的危险因素。
本研究应用ROC曲线评估72 h Glu-CV对PTSD发生预测价值,当72 h Glu-CV截断值取24.06时,敏感度为62.9%,特异度为93.5%,提示72 h Glu-CV > 24.06,发生PTSD的可能性极大,其阳性价值更高。
综上所述,合并TBI的急性多发伤患者更易出现早期血糖波动以及发生PTSD,短期GV增加是急性创伤后发生PTSD的独立危险因素。因此,积极探寻影响血糖波动的因素并予以及时干预,以维持血糖稳定对防治PTSD有重要意义。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王京京:统计学分析、论文撰写;蒋文佳、李彦泽:数据收集及整理;薛婷、叶英、许铁、燕宪亮:分析数据、指导撰写;花嵘:研究设计、论文修改
| [1] | Bisson JI, Cosgrove S, Lewis C, et al. Post-traumatic stress disorder[J]. BMJ, 2015: h6161. DOI:10.1136/bmj.h6161 |
| [2] | Stein MB, Jain S, Giacino JT, et al. Risk of posttraumatic stress disorder and major depression in civilian patients after mild traumatic brain injury: a TRACK-TBI study[J]. JAMA Psychiatry, 2019, 76(3): 249-258. DOI:10.1001/jamapsychiatry.2018.4288 |
| [3] | Hermanides J, Hong YT, Trivedi M, et al. Metabolic derangements are associated with impaired glucose delivery following traumatic brain injury[J]. Brain, 2021, 144(11): 3492-3504. DOI:10.1093/brain/awab255 |
| [4] | Iljazi A, Ashina H, Al-Khazali HM, et al. Post-traumatic stress disorder after traumatic brain injury-a systematic review and meta-analysis[J]. Neurol Sci, 2020, 41(10): 2737-2746. DOI:10.1007/s10072-020-04458-7 |
| [5] | 赵晓东, 孟海东, 姚咏明. 创伤后胰岛素抵抗与血糖控制治疗[J]. 中国危重病急救医学, 2006(12): 766-768. DOI:10.3760/j.issn:1003-0603.2006.12.023 |
| [6] | Blevins CA, Weathers FW, Davis MT, et al. The posttraumatic stress disorder checklist for DSM-5 (PCL-5): development and initial psychometric evaluation[J]. J Trauma Stress, 2015, 28(6): 489-498. DOI:10.1002/jts.22059 |
| [7] | Dungan KM, Braithwaite SS, Preiser JC. Stress hyperglycaemia[J]. Lancet, 2009, 373(9677): 1798-1807. DOI:10.1016/S0140-6736(09)60553-5 |
| [8] | Ravi R, Balasubramaniam V, Kuppusamy G, et al. Current concepts and clinical importance of glycemic variability[J]. Diabetes Metab Syndr, 2021, 15(2): 627-636. DOI:10.1016/j.dsx.2021.03.004 |
| [9] | Raj R, Siironen J, Skrifvars MB, et al. Predicting outcome in traumatic brain injury: development of a novel computerized tomography classification system (Helsinki computerized tomography score)[J]. Neurosurgery, 2014, 75(6): 632-646. DOI:10.1227/NEU.0000000000000533 |
| [10] | 白丽爽, 王兴义, 杨立山. 多发伤患者预后列线图模型的构建和研究[J]. 中华急诊医学杂志, 2023, 32(4): 540-545. DOI:10.3760/cma.j.issn.1671-0282.2023.04.017 |
| [11] | McCrea MA, Giacino JT, Barber J, et al. Functional outcomes over the first year after moderate to severe traumatic brain injury in the prospective, longitudinal TRACK-TBI study[J]. JAMA Neurol, 2021, 78(8): 982-992. DOI:10.1001/jamaneurol.2021.2043 |
| [12] | Kowalski RG, Hammond FM, Weintraub AH, et al. Recovery of consciousness and functional outcome in moderate and severe traumatic brain injury[J]. JAMA Neurol, 2021, 78(5): 548-557. DOI:10.1001/jamaneurol.2021.0084 |
| [13] | Nelson LD, Temkin NR, Barber J, et al. Functional recovery, symptoms, and quality of life 1 to 5 years after traumatic brain injury[J]. JAMA Netw Open, 2023, 6(3): e233660. DOI:10.1001/jamanetworkopen.2023.3660 |
| [14] | Koepsell H. Glucose transporters in brain in health and disease[J]. Pflugers Arch, 2020, 472(9): 1299-1343. DOI:10.1007/s00424-020-02441-x |
| [15] | Veenith TV, Carter EL, Geeraerts T, et al. Pathophysiologic mechanisms of cerebral ischemia and diffusion hypoxia in traumatic brain injury[J]. JAMA Neurol, 2016, 73(5): 542-550. DOI:10.1001/jamaneurol.2016.0091 |
| [16] | Brand J, McDonald SJ, Gawryluk JR, et al. Stress and traumatic brain injury: an inherent bi-directional relationship with temporal and synergistic complexities[J]. Neurosci Biobehav Rev, 2023, 151: 105242. DOI:10.1016/j.neubiorev.2023.105242 |
| [17] | 徐杨, 周健, 姚海军, 等. 颅脑创伤早期动态监测血糖对判断预后的作用[J]. 中华急诊医学杂志, 2009, 18(5): 516-518. DOI:10.3760/cma.j.issn.1671-0282.2009.05.019 |
| [18] | Watt C, Sanchez-Rangel E, Hwang JJ. Glycemic variability and CNS inflammation: reviewing the connection[J]. Nutrients, 2020, 12(12): 3906. DOI:10.3390/nu12123906 |
| [19] | 张诗荧, 栗卓, 丁洪光, 等. 应激性高血糖与脓毒症相关性脑病的关系[J]. 中华急诊医学杂志, 2023, 32(8): 1070-1076. DOI:10.3760/cma.j.issn.1671-0282.2023.08.011 |
| [20] | Papachristoforou E, Lambadiari V, Maratou E, et al. Association of glycemic indices (hyperglycemia, glucose variability, and hypoglycemia) with oxidative stress and diabetic complications[J]. J Diabetes Res, 2020, 2020: 7489795. DOI:10.1155/2020/7489795 |
 2024, Vol. 33
2024, Vol. 33




